醛酮的加成反应
- 格式:ppt
- 大小:5.45 MB
- 文档页数:112

醛酮知识要点—邢其毅基础有机化学醛酮是有机化合物中常见的一类官能团,具有广泛的应用和重要的地位。
在邢其毅基础有机化学中,我们需要掌握醛酮的结构与性质、合成方法以及相关反应等知识要点。
本文将从这几个方面进行详细的阐述。
一、醛酮的结构与性质:醛酮是一类含有羰基的化合物,其中醛代表羰基的碳原子上连接有至少一个氢原子,而酮代表羰基的碳原子上连接有两个有机基团。
醛酮的羰基碳原子上还可以有其他取代基,这使得醛酮的结构多样性较高。
醛酮的羰基碳原子具有亲电性,因此容易受到亲核试剂的攻击。
此外,醛酮的羰基碳原子还可以通过质子转移反应,参与有机合成中的重要步骤。
二、醛酮的合成方法:1. 醛酮的氧化还原反应:醛酮可以通过将醛或酮经过氧化还原反应来合成。
例如,醛可以被氧化成相应的羧酸,然后再还原成醛酮。
此外,酮也可以通过还原成醇,然后再氧化成醛酮。
2. 反应的亲核试剂攻击:醛酮的羰基碳原子可以被亲核试剂攻击,形成加成产物,然后通过质子转移反应生成醛酮。
常见的亲核试剂包括水、醇、胺等。
3. 氰化反应:醛酮可以和氰化物反应生成氰醇盐,然后再发生质子转移反应生成醛酮。
这是一种常用的合成醛酮的方法。
三、醛酮的相关反应:1. 氧化反应:醛酮可以被氧化成相应的羧酸。
常用的氧化剂包括KMnO4、CrO3等。
2. 质子转移反应:醛酮的羰基碳原子上的氢可以通过质子转移反应发生变化,生成醇或羧酸。
3. 加成反应:醛酮的羰基碳原子可以被亲核试剂攻击,形成加成产物。
例如,水的加成反应生成醇,胺的加成反应生成亚胺等。
4. 消除反应:醛酮的羰基碳原子与邻位或相邻的碳原子发生消除反应,生成不饱和化合物。
四、醛酮在有机合成中的应用:醛酮是有机合成中常用的中间体,广泛应用于各个领域。
例如,在药物合成中,醛酮作为重要的中间体参与多步合成反应,构建复杂的有机结构。
此外,醛酮的还原反应也可以用于合成醇化合物。
结论:醛酮作为基础有机化学中的重要内容,掌握其结构与性质、合成方法以及相关反应是我们在有机化学学习中的基础要点。


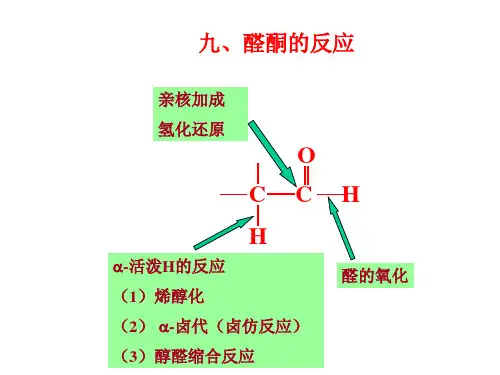
原创——醛、酮化学反应归纳醛、酮化学反应归纳一、与RMgX加成甲醛产生一级醇,其他的醛生成二级醇。
酮生成三级醇。
羰基两旁的基团太大时,酮不能正常地反应。
会发生烯醇化反应或还原反应:烯醇化反应:还原反应:当格式试剂反应结果不好时,用烷基锂反应可以得到较好的结果。
Cram规则一:大基团L与R呈重叠型,两个较小的基团在羰基两旁呈邻交叉型,与格式试剂(包括氢化铝锂等)反应时,试剂从羰基旁空间位阻较小的基团S一边接近分子,故(i)是主要产物,(ii)为副产物。
R与L处于重叠型为最有利的反应时的构象。
二、与HCN反应(碱性条件下)生成的,—羟基腈可用于制备,—羟基酸,羟基酸可进一步失水变为,,,—不饱和酸(如有机玻璃)。
氢氧根可以增加氰离子的浓度,但碱性不能太强。
该反应符合Cram规则一。
Cram规则二:当醛、酮的,—C上有—OH,—NHR时,由于它们能与羰基氧形成氢键,反应物主要为重叠型构象,发生亲核加成反应时,亲核试剂主要从S基团的一侧进攻。
Strecker(斯瑞克)反应:羰基化合物与氯化铵、氰化钠生成,—氨基腈、再水解制备,—氨基酸的反应三、与炔化物的反应四、与含氮亲核试剂的加成A、与NH或RNH反应(与一级胺生成亚胺,又称西弗碱)(弱酸性条件) 32亚胺在稀酸中水解,可得原羰基化合物与胺:故该反应可用来保护羰基。
B、与RNH反应(生成烯胺) 2要使反应完全,需将水除去。
在稀酸水溶液中烯胺可水解得到羰基化合物与二级胺。
可发生氮烷基化与碳烷基化反应。
C、与氨衍生物的反应a.与羟胺的反应(生成肟)肟与亚硝基化合物发生互变异构。
亚硝基化合物与酮肟的互变异构:亚硝基化合物与醛肟的互变异构:亚硝基化合物在没有,氢时是稳定的,有,氢时有利于平衡肟。
肟的Z构型一般不稳定。
Beckmann(贝克曼)重排反应:酮肟在酸性催化剂中重排生成酰胺的反应催化剂:HSO、多聚磷酸、PCl、PhSOCl(苯磺酰氯)、SOCl (亚硫酰氯)24532 反应特点:离去与迁移基团处于反式;基团的离去与迁移是同步的;迁移基团在迁移前后构型不变。



醛酮与羰基化合物的反应与应用醛酮是有机化合物中常见的功能团,在有机合成中具有重要的地位。
它们与羰基化合物的反应多种多样,这些反应不仅在有机合成中起着重要的作用,还在药物合成、天然产物合成、材料科学等领域发挥着关键的作用。
本文将重点探讨醛酮与羰基化合物的反应及其应用。
一、氧化反应醛酮可与醇或氨发生氧化反应,生成酸或酮类化合物。
例如,醛酮和氧气反应,可以得到相应的羧酸化合物。
这种反应在化学分析、环境保护等方面有重要的应用。
同时,醛酮还能与二氧化硫反应,生成硫醇。
二、还原反应醛酮可以通过还原反应,转化为相应的醇。
这种反应常用于合成糖类化合物。
例如,将醛酮与氢气和催化剂反应,可以得到对应的醇。
此外,醛酮还能与金属化合物(如铝、锂等)反应,生成金属醇ates。
三、加成反应醛酮与亲电试剂(如醇、胺等)发生加成反应,生成相应的酯、醚、胺等化合物。
这种反应常用于有机合成中。
例如,将醛酮与酰胺反应,可以得到相应的酮类化合物。
此外,醛酮与硫酸铵反应,可以得到硫酸盐。
四、羟醛互变异构反应醛酮可以与胺或醇发生羟醛互变异构反应,生成相应的酮或醛。
这种反应在天然产物合成和药物合成中具有重要的应用价值。
例如,将醛酮与胺反应,可以得到相应的亚胺。
同时,醛酮还可以与醇反应,生成相应的假酮。
五、甲酸反应醛酮与甲酸酐反应,生成相应的甲酸酯。
此类反应常用于有机合成的重要反应之一。
例如,将醛酮与甲酸酐反应,可以得到相应的甲酸酯。
同时,醛酮还可以与酸酐反应,生成相应的酮类化合物。
六、羧酸反应醛酮与羧酸反应,生成相应的酯类化合物。
此类反应在有机合成中有广泛的应用。
例如,将醛酮与甲酸反应,可以得到相应的甲酸酯。
同时,醛酮还可以与酰胺反应,生成相应的酰胺类化合物。
七、Michael加成反应醛酮与α,β-不饱和羰基化合物发生Michael加成反应,生成相应的加成产物。
这种反应对于药物合成中环的构建具有重要的意义。
例如,将醛酮与丙烯酸酯反应,可以得到相应的加成产物。
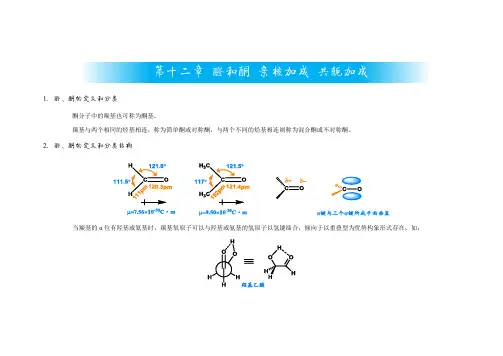
1. 醛、酮的定义和分类酮分子中的羰基也可称为酮基。
羰基与两个相同的烃基相连,称为简单酮或对称酮,与两个不同的烃基相连则称为混合酮或不对称酮。
2. 醛、酮的定义和分类结构当羰基的α位有羟基或氨基时,羰基氧原子可以与羟基或氨基的氢原子以氢键缔合,倾向于以重叠型为优势构象形式存在,如:第十二章 醛和酮 亲核加成 共轭加成3.醛、酮的物理性质由于羰基的偶极矩增加了分子间的吸引力,因此醛、酮的沸点比相应相对分子质量的烷烃高,但比醇低。
醛酮的氧原子可以与水形成氢键,因此低级醛酮能与水混溶(甲醛易溶于水,丙酮能与水以任意比例互溶,乙醛的溶解度为16g(100g H2O)-1)。
脂肪族醛酮相对密度小于1,芳香族醛酮相对密度大于1。
4.醛、酮的反应(1)羰基的亲核加成由于电子效应和空间位阻的原因,醛比酮表现的更活泼。
1)和含碳亲核试剂的加成①与有机金属化合物的加成此反应仅限于酮的烃基和格氏试剂的烃基都不太大,即空间位阻不很突出。
否则将发生两种“不正常”的反应:烯醇化反应及酮被还原。
烷基锂体积较小,因此当格氏试剂反应结果不好时,有时可以用烷基锂进行反应,会得到较好的结果,因此,格氏试剂与烷基锂可以相互补充。
当羰基与一个手性中心相连时,它与格氏试剂(也包括氢化铝锂等试剂)反应就是一个手性诱导反应。
亲核加成反应遵循Cram规则一,即:亲核试剂从空间位阻较小的一边进攻羰基碳原子。
为什么R与L取重叠型构象?因为这些试剂与羰基发生加成反应时,它们的金属部分须与羰基氧络合,因此羰基氧原子一端位阻增大,α碳上最大基团(L)与羰基处于反式,故R与L取重叠型构象为最有利于反应的构象。
②与HCN的加成丙酮与氢氰酸在氢氧化钠的水溶液中反应,生成丙酮羟腈,然后和甲醇在硫酸的作用下,即发生失水及腈的醇解反应,氰基变成甲氧酰基(-COOCH3):工业上就是利用这个反应步骤合成有机玻璃的。
碱性条件能加速该反应,这是由于氢氰酸是弱酸,其离解很少,[CN-]浓度很低,当加入NaOH时,碱与H+ 结合促使离解平衡右移,使亲核性的增大,但是碱性不能太强,因为最后还需要H+才能完成反应。

醛酮的化学性质实验报告醛酮是一类含有醛基(-CHO)和酮基(-CO-)的有机化合物,具有许多重要的化学性质。
本实验旨在通过对醛酮的一系列实验,探究其化学性质及相关反应特点。
首先,我们进行了醛酮的还原反应实验。
将醛酮与还原剂进行反应,观察到醛酮被还原为对应的醇。
这一实验结果表明,醛酮具有较强的还原性,能够被还原剂还原为醇。
接着,我们进行了醛酮的氧化反应实验。
将醛酮与氧化剂进行反应,观察到醛酮被氧化为对应的羧酸。
这一实验结果表明,醛酮具有一定的氧化性,能够被氧化剂氧化为羧酸。
通过这两组实验,我们验证了醛酮的还原性和氧化性。
接下来,我们进行了醛酮的加成反应实验。
将醛酮与含有双键的化合物进行加成反应,观察到醛酮与双键发生加成反应生成相应的醇。
这一实验结果表明,醛酮具有一定的加成反应能力,能够与含有双键的化合物发生加成反应。
此外,我们还进行了醛酮的缩合反应实验。
将两个分子的醛酮进行缩合反应,观察到生成了α,β-不饱和酮。
这一实验结果表明,醛酮具有一定的缩合反应能力,能够与其他分子的醛酮进行缩合反应生成不饱和酮。
最后,我们进行了醛酮的亲核加成反应实验。
将醛酮与亲核试剂进行反应,观察到醛酮与亲核试剂发生加成反应生成相应的加合物。
这一实验结果表明,醛酮具有一定的亲核加成反应能力,能够与亲核试剂发生加成反应。
通过这一系列实验,我们全面了解了醛酮的化学性质及相关反应特点。
综上所述,醛酮作为一类重要的有机化合物,具有较强的还原性、氧化性、加成反应能力和亲核加成反应能力。
对醛酮的化学性质进行深入研究,有助于我们更好地理解有机化合物的特性及其在化学反应中的应用。
希望本实验报告能为相关研究提供一定的参考价值。
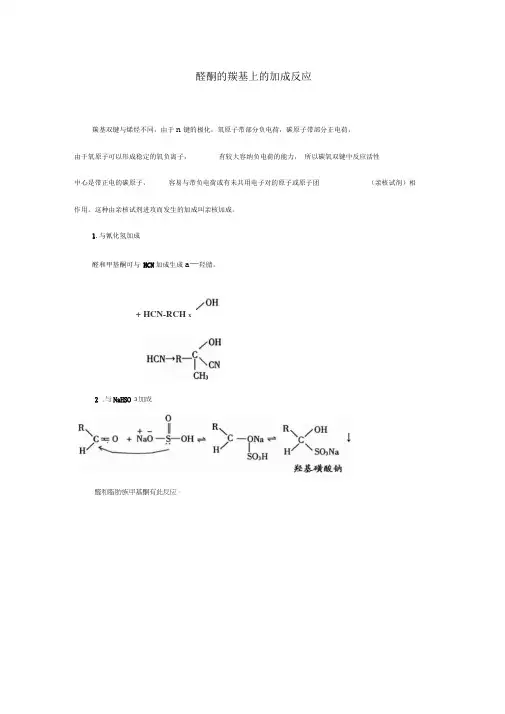
醛酮的羰基上的加成反应羰基双键与烯烃不同,由于n键的极化,氧原子带部分负电荷,碳原子带部分正电荷,由于氧原子可以形成稳定的氧负离子,有较大容纳负电荷的能力,所以碳氧双键中反应活性中心是带正电的碳原子,容易与带负电荷或有未共用电子对的原子或原子团(亲核试剂)相作用。
这种由亲核试剂进攻而发生的加成叫亲核加成。
1.与氰化氢加成醛和甲基酮可与HCN加成生成a—羟腈。
+ HCN-RCH x2 .与NaHSO 3加成醛和脂肪族甲基酮有此反应。
这一反应是典型的可逆反应,所以NaHSO 3溶液是饱和的,而且需过量。
此反应常用于分离提纯醛酮。
RCHO+ NaQ+ SOi+ HiO R\ /OH:C H/X SOsNaRCHO+ NU2SO1+ H20 碳原子数小于8以下的环酮也有此反应。
3.与格氏试剂反应4 •与醇的加成⑴•醛与醇的反应干 HCt R \ /°H wh Z ™RCHO + fVOH {无水) ------ (涪泼):唁A :C(穗定)H /、OfV H /、0卍半缩醛 第醛等物质的量的醇与醛反应产物叫半缩醛, 半缩醛很活泼,通常可再和1mol 醇生成缩醛, 缩醛较稳定可分离出来。
缩醛在稀酸中加热可水解成原来的醛。
R\ /°R R\、C +HQ 皿;C = 0+2R ,0HH /、0R' H /有机合成中常利用此性质保护醛基。
⑵.酮在同样条件下可生成缩酮。
有些酮反应较难,可用二元醇反应,可生成环状缩酮。
5 .与氨的衍生物反应 NO JNHiNH -N0?醛酮与格氏试剂反应是合成醇的重要方法之一。
\ \ /R 0+ RMgX-+ X C Z Z X QMgX HiOH*从上式可看出,甲醛得 1 °ROH ,醛生成2 °ROH ,酮生成3 °ROH 。
例女口0+ 匸—CHj\ 诙/ 无水乙塔氨的衍生物如羟氨(NH2OH )、肼(NH2NH2)、2, 4 —二硝基苯肼()均为弱亲核试剂,可与醛酮羰基反应。

一、实验目的1. 了解醛酮的物理性质和化学性质。
2. 掌握醛酮的鉴定方法。
3. 通过实验加深对醛酮化学性质的理解。
二、实验原理醛酮是一类含有羰基的有机化合物,其化学性质主要表现为羰基的反应。
醛酮的化学性质主要包括氧化反应、加成反应、缩合反应等。
本实验主要研究了醛酮的氧化反应、加成反应和缩合反应。
三、实验仪器与试剂1. 仪器:锥形瓶、试管、滴管、酒精灯、铁架台、烧杯、石棉网等。
2. 试剂:乙醛、丙酮、氢氧化钠溶液、重铬酸钾溶液、硫酸铜溶液、碘化钾溶液、氢氧化钠溶液、淀粉溶液、银氨溶液、斐林试剂等。
四、实验步骤1. 醛酮的氧化反应(1)取两支试管,分别加入少量乙醛和丙酮。
(2)向两支试管中分别加入少量重铬酸钾溶液。
(3)将两支试管置于酒精灯上加热,观察颜色变化。
2. 醛酮的加成反应(1)取两支试管,分别加入少量乙醛和丙酮。
(2)向两支试管中分别加入少量硫酸铜溶液。
(3)向两支试管中分别加入少量碘化钾溶液。
(4)观察两支试管中的颜色变化。
3. 醛酮的缩合反应(1)取两支试管,分别加入少量乙醛和丙酮。
(2)向两支试管中分别加入少量氢氧化钠溶液。
(3)将两支试管置于酒精灯上加热,观察颜色变化。
五、实验现象与结果1. 醛酮的氧化反应乙醛加热后,溶液由橙色变为绿色;丙酮加热后,溶液无明显变化。
2. 醛酮的加成反应乙醛与硫酸铜、碘化钾反应后,溶液由蓝色变为绿色;丙酮与硫酸铜、碘化钾反应后,溶液无明显变化。
3. 醛酮的缩合反应乙醛与氢氧化钠加热后,溶液由无色变为蓝色;丙酮与氢氧化钠加热后,溶液无明显变化。
六、实验结论1. 醛类化合物容易被氧化,而酮类化合物不易被氧化。
2. 醛酮可以与硫酸铜、碘化钾发生加成反应。
3. 醛酮可以与氢氧化钠发生缩合反应。
七、实验讨论1. 实验过程中,乙醛与丙酮的氧化反应、加成反应和缩合反应现象明显,说明醛酮具有明显的化学性质。
2. 在实验过程中,需要注意加热的温度和时间,以免影响实验结果。
关于醛、酮亲核加成反应的几点教学体会[权威资料] 关于醛、酮亲核加成反应的几点教学体会[摘要]本文从羰基的结构特点入手,通过醛、酮的几个亲核加成反应实例,介绍了与醛、酮进行亲核加成的常用试剂、亲核加成反应机理,通过结构分析和理论分析判断不同反应物的反应活性等,揭示了醛、酮亲核加成反应本质。
[关键词]羰基;醛、酮;化学性质;活性J523 A 1009-914X(2015)08-0017-02醛、酮是一类重要的有机化合物。
其结构上的特点,决定了醛、酮具有非常活泼的化学性质。
其中,羰基的亲核加成是醛、酮最重要的化学性质之一。
一、有机化合物化学性质的判断和分析,应从官能团结构特征入手。
醛、酮的官能团都含有羰基。
其结构特点如下:1、羰基中含有不饱和键,化学性质活泼,可发生加成反应。
2、C原子采用sp2杂化轨道与O原子未杂化的2p原子轨道成键,形成平面结构。
3、羰基中的C=O是极性双键。
由于O原子的大电负性,使得体系电子云强烈偏向O原子(δ-),同时使得C原子带部分正电荷(δ+)。
4、Oδ- 比O原子稳定;由于C原子的价电子构型为2s22p2,既不易得电子,也不易失电子,所以Cδ+ 使得C原子很不稳定,容易受到带异性电荷的亲核试剂进攻,引起亲核加成反应。
二、常见的亲核试剂有:NaOH、NaCN、RO-Na+(醇钠或醇钾)、NH3、H2O等。
其中的亲核部分分别是:OH-、CN-、RO-(烷氧基负离子)、NH3(:N原子)、H2O(:O: 原子)。
三、醛、酮与HCN(NaCN)的亲核加成根据电子效应,写出该反应的产物并不难。
但笔者认为,重要的并不是结论,而是培养学生的分析判断、推导结论和进一步思考的能力。
大学教育要教给学生知识,更要教给学生方法。
对于上述反应,应启发学生做如下思考:1、反应为什么可逆,HCN是弱酸(Ka 量级为10-10),其解离出的CN-(亲核试剂)浓度过低,使得反应很快达到平衡。
2、如何改进这种可逆性,要使反应进行得较为彻底,可以考虑使用更强的亲核试剂:NaCN,即在HCN体系中加入NaOH。
醛酮的化学性质——羰基上的加成
羰基双键与烯烃不同,由于π键的极化,氧原子带部分负电荷,碳原子带部分正电荷,由于氧原子可以形成稳定的氧负离子,有较大容纳负电荷的能力,所以碳氧双键中反应活性中心是带正电的碳原子,容易与带负电荷或有未共用电子对的原子或原子团(亲核试剂)相作用。
这种由亲核试剂进攻而发生的加成叫亲核加成。
1.与氰化氢加成
醛和甲基酮可与HCN加成生成α—羟腈。
2.与NaHSO3加成
醛和脂肪族甲基酮有此反应。
这一反应是典型的可逆反应,所以NaHSO3溶液是饱和的,而且需过量。
此反应常用于分离提纯醛酮。
碳原子数小于8以下的环酮也有此反应。
3.与格氏试剂反应
醛酮与格氏试剂反应是合成醇的重要方法之一。
化学反应中的醛酮反应醛酮反应是一类重要的有机化学反应,指的是醛与酮之间进行氧化还原反应,生成相应的醇和酸酐的过程。
该反应在有机合成、医药化学等领域具有广泛的应用。
本文将介绍醛酮反应的机理、分类以及其在实际应用中的一些例子。
一、醛酮反应的机理醛酮反应通常是通过氧化还原的方式进行,其中醛或酮被氧化为酸酐或醇。
该反应是在酸性或碱性条件下进行的。
在酸性条件下,醛酮反应首先发生质子化,形成醇醛离子或酮离子。
接着,醇醛离子或酮离子会接受电子,生成相应的酸酐或醇产物。
在碱性条件下,醛酮反应开始于亲核试剂的加成。
亲核试剂攻击醛或酮中的部分正电荷,形成一个中间体。
然后,中间体经历质子化或负离子迁移等步骤,最终生成酸酐或醇产物。
二、醛酮反应的分类根据反应条件和产物类型的不同,醛酮反应可以分为多种类型,如氧化、还原、氧气插入和杂原子插入等。
下面将介绍其中的几种典型反应。
1. 氧化反应氧化反应是指醛或酮被氧化为酸酐的反应。
常见的氧化剂有氧气、过氧化氢、高锰酸钾等。
例如,乙醛可以通过氧气氧化为乙酸的反应:CH3CHO + O2 -> CH3COOH2. 还原反应还原反应是指醛或酮被还原为醇的反应。
典型的还原剂有金属钠、锂铝烷等。
例如,丙酮可以通过锂铝烷还原为异丙醇的反应:(CH3)2CO + LiAlH4 -> (CH3)2CHOH3. 氧气插入反应氧气插入反应是指氧气直接参与醛酮反应,生成酸酐的反应。
例如,甲醛可以通过氧气插入反应生成甲酸的反应:CH3CHO + 1/2 O2 -> CH3COOH4. 杂原子插入反应杂原子插入反应是指醛酮反应中,醛或酮分子中的氧原子被其他原子或基团所取代的反应。
例如,乙醛可以经过羟胺的插入反应生成乙酰肼:CH3CHO + H2NNH2 -> CH3C(NHNH2)O三、醛酮反应的应用举例醛酮反应在有机合成和医药化学中具有广泛的应用。
下面介绍两个具有代表性的例子。