人甲状腺过氧化物酶抗体 (TPOAb)测定试剂盒(磁微粒化学发光免疫分析法)产品技术要求大成
- 格式:docx
- 大小:15.10 KB
- 文档页数:4

抗甲状腺球蛋白抗体(TG-Ab)测定试剂盒(化学发光免疫分析法)适用范围:本试剂盒用于体外定量测定人血清中抗甲状腺球蛋白抗体(TG-Ab)的含量。
1.1 包装规格96人份/盒。
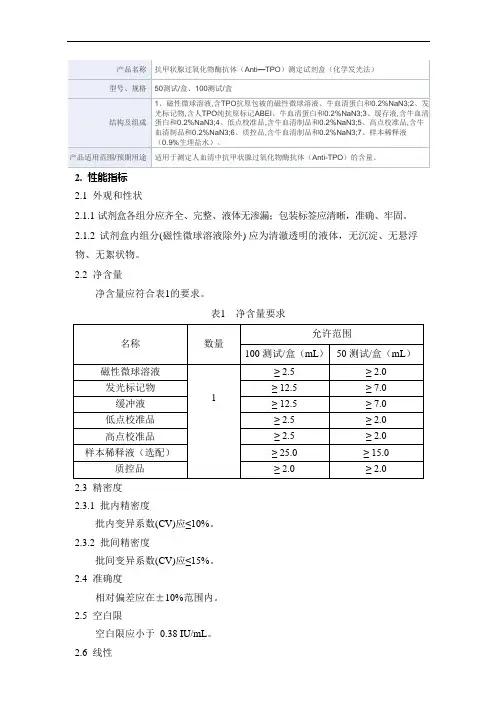
1.2 主要组成成分主要组成成分见表1。
表1注:校准品靶值批特异、具体浓度详见标签。
2.1 物理性能试剂盒的各液体组分应澄明,无沉淀或絮状物。
包被抗体微孔板的铝箔袋,应无破损现象。
2.2 准确度试剂盒内校准品与相应浓度的中国食品药品检定研究院的标准品(编号150556)同时进行分析测定,用Log(x)-Log(y)模型拟合,要求两条剂量-反应曲线不显著偏离平行(t检验);以中国食品药品检定研究院的标准品为对照品,试剂盒内校准品的实测值与标示值的效价比应在0.900~1.100之间。
2.3 剂量-反应曲线的线性在企业线性范围内[120,2400]IU/ml,剂量-反应曲线的相关系数应(r)应不低于0.9900。
2.4 重复性重复性(CV%)应不高于10.0%.2.5 批间差2.5.1 批间差批间差(CV%)应不高于15.0%。
2.5.2 批内瓶间差校准品各浓度点(除零外)批内瓶间差(CV%)应不高于15.0%。
2.6 空白检测限试剂盒的空白检测限应不高于100IU/mL。
2.7 特异性表2交叉反应2.8 溯源性根据GB/T 21415-2008的有关规定,提供所用校准品的来源、赋值过程及测量不确定度等内容,溯源至中国食品药品检定研究院提供的标准品(编号:150556)。
2.9 稳定性2℃~8℃保存,有效期12个月,效期后2个月内分别检测2.1~2.4、2.6项,其结果应符合各项要求。

化学发光免疫类体外诊断试剂(盒)产品技术审评规范(2017版)本规范旨在指导注册申请人对化学发光免疫类体外诊断试剂(盒)产品注册申报资料的准备及撰写,同时也为技术审评部门对注册申报资料的技术审评提供参考。
本规范是对化学发光免疫类体外诊断试剂(盒)产品的一般要求,申请人应依据具体产品的特性对注册申报资料的内容进行充实和细化,并依据产品特性确定其中的具体内容是否适用。
本规范是对申请人和审查人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,如果有能够满足相关法规要求的其他方法,也可以采用,但需要提供详细的研究资料和验证资料。
应在遵循相关法规的前提下使用本规范。
本规范是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本规范相关内容也将进行适时调整。
一、适用范围本规范适用于利用化学发光免疫分析技术对被测物质进行定量检测的第二类体外诊断试剂(包括以微孔板、管、磁颗粒、微珠和塑料珠等为载体的酶促及非酶促化学发光免疫分析测定试剂)的注册技术审查。
依据《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第5号,以下简称《办法》)、《食品药品监管总局关于印发体外诊断试剂分类子目录的通知》(食药监械管〔2013〕242号)化学发光免疫类体外诊断试剂(盒)产品分类代号为6840。
二、注册申报资料要求(一)综述资料综述资料主要包括产品预期用途、临床意义、产品描述、有关生物安全性的说明、研究结果的总结评价以及同类产品上市情况介绍等内容,应符合《办法》和《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》(国家食品药品监督管理总局公告2014年第44号)的相关要求。
(二)主要原材料研究资料(如需提供)主要原材料(例如各种天然抗原、重组抗原、单克隆抗体、多克隆抗体以及多肽类、激素类等生物原科,辣根过氧化物酶、碱性磷酸酶等标记用酶、磁微粒及其他主要原料)的选择、制备、质量标准及实验验证研究资料;校准品、质控品的原料选择、制备、赋值过程及试验资料;校准品的溯源性文件,包括具体溯源链、实验方法、数据及统计分析等详细资料。

化学发光免疫类体外诊断试剂(盒)产品技术审评规范(2017 版)本规范旨在指导注册申请人对化学发光免疫类体外诊断试剂(盒)产品注册申报资料的准备及撰写,同时也为技术审评部门对注册申报资料的技术审评提供参考。
本规范是对化学发光免疫类体外诊断试剂(盒)产品的一般要求,申请人应依据具体产品的特性对注册申报资料的内容进行充实和细化,并依据产品特性确定其中的具体内容是否适用。
本规范是对申请人和审查人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,如果有能够满足相关法规要求的其他方法,也可以采用,但需要提供详细的研究资料和验证资料。
应在遵循相关法规的前提下使用本规范。
本规范是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本规范相关内容也将进行适时调整。
一、适用范围本规范适用于利用化学发光免疫分析技术对被测物质进行定量检测的第二类体外诊断试剂(包括以微孔板、管、磁颗粒、微珠和塑料珠等为载体的酶促及非酶促化学发光免疫分析测定试剂)的注册技术审查。
依据《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第 5 号,以下简称《办法》)、《食品药品监管总局关于印发体外诊断试剂分类子目录的通知》(食药监械管〔2013〕242 号)化学发光免疫类体外诊断试剂(盒)产品分类代号为 6840。
二、注册申报资料要求(一)综述资料综述资料主要包括产品预期用途、临床意义、产品描述、有关生物安全性的说明、研究结果的总结评价以及同类产品上市情况介绍等内容,应符合《办法》和《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》(国家食品药品监督管理总局公告 2014 年第44 号)的相关要求。
(二)主要原材料研究资料(如需提供)主要原材料(例如各种天然抗原、重组抗原、单克隆抗体、多克隆抗体以及多肽类、激素类等生物原科,辣根过氧化物酶、碱性磷酸酶等标记用酶、磁微粒及其他主要原料)的选择、制备、质量标准及实验验证研究资料;校准品、质控品的原料选择、制备、赋值过程及试验资料;校准品的溯源性文件,包括具体溯源链、实验方法、数据及统计分析等详细资料。

抗甲状腺过氧化物酶抗体测定试剂注册技术审查指导原则(2022年)本指导原则是在现行法规、标准体系及当前认知水平下制定的,随着法规、标准体系的不断完善和科学技术的不断发展,本指导原则相关内容也将适时进行调整。
一、适用范围从方法学考虑,在本文中抗甲状腺过氧化物酶抗体测定试剂盒是指采用化学发光免疫分析技术,利用全自动、半自动化学发光免疫分析仪,对人血清或血浆等样本中抗甲状腺过氧化物酶抗体的含量进行体外定量分析的试剂。
化学发光免疫分析法主要有直接化学发光、电化学发光、酶促间接化学发光等。
根据《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第5号)和《食品药品监管总局关于印发体外诊断试剂分类子目录的通知》(食药监械管〔2022〕242号),抗甲状腺过氧化物酶抗体测定试剂盒的管理类别为二类,分类代码为6840。
本指导原则适用于进行首次注册申报和相关许可事项变更的产品。
本指导原则不适用于:(一)单独申请注册的抗甲状腺过氧化物酶抗体校准品和质控品。
(二)化学发光免疫分析法原理之外的其他抗甲状腺过氧化物酶抗体测定试剂盒。
Anti-TPO抗体主要以IgG类为主,该抗体主要见于自身免疫性甲状腺病,如桥本甲状腺炎(阳性率85%~100%)、Graves病(阳性率65%)、原发性黏液性水肿患者;也见于其他器官特异性自身免疫病,如1型糖尿病(阳性率14%)、Addison病(阳性率31%)、恶性贫血(阳性率55%)及产后甲状腺炎(阳性率15%)等。
目前认为,Anti-TPO抗体为人类自身免疫性甲状腺炎较理想的标志抗体,阳性结果可用于自身免疫性甲状腺疾病的辅助诊断。
1.主要生产工艺介绍,可以流程图方式表示,并简要说明主要生产工艺的确定依据。
2.产品反应原理介绍。
3.抗原/抗体包被工艺研究:申请人应考虑如包被缓冲液及添加量、浓度、时间、温度等指标对产品性能的影响,通过试验确定上述指标的最佳组合。
4.体系反应条件确定:申请人应考虑反应模式、反应时间、反应温度、洗涤次数等条件对产品性能的影响,通过试验确定上述条件的最佳组合。
2.性能指标
2.1外观和性状
2.1.1试剂盒各组分应齐全、完整、液体无渗漏;包装标签应清晰,准确、牢固。
2.1.2试剂盒内组分(磁性微球溶液除外) 应为清澈透明的液体,无沉淀、无悬浮物、无絮状物。
2.2净含量
净含量应符合表1的要求。
表1 净含量要求
2.3精密度
2.3.1批内精密度
批内变异系数(CV)应≤10%。
2.3.2批间精密度
批间变异系数(CV)应≤15%。
2.4准确度
相对偏差应在±10%范围内。
2.5空白限
空白限应小于0.38 IU/mL。
2.6线性
在(15.0-1000)IU/mL浓度范围内,线性相关性系数(r)绝对值应大于0.9800。
2.7质控品准确度
测量结果在质控范围内(可接受区间)。
2.8质控品均一性
瓶间重复性CV%应≤10%。
1 / 1。

tpo检测标准TPo检测标准是指在医学领域中对TPO(甲状腺过氧化物酶)进行检测的标准化要求和流程。
甲状腺过氧化物酶是一种重要的酶,它在甲状腺功能异常时往往会发生变化,因此检测TPO水平可以帮助医生判断甲状腺疾病的病情和治疗方案。
在TPo检测标准中,通常会规定采血时间、采血方法、采血部位等具体要求。
一般情况下,医生会建议在早上空腹时进行TPO的检测,因为这时的血液中TPO的浓度最为稳定,可以更准确地反映患者的甲状腺功能情况。
采血时需要选择静脉血,通常会在患者的手臂内侧或手背处进行采血,确保采血部位干净,避免感染的发生。
此外,TPo检测标准还会规定实验室检测方法和结果解读的标准。
在实验室检测方面,一般会采用化学发光免疫分析法(CLIA)或酶联免疫吸附法(ELISA)来测定血清中的TPO水平,这些方法在检测TPO方面具有高灵敏度和准确性。
检测结果一般以国际单位(IU/mL)或者是浓度(ng/mL)的形式呈现,医生会根据检测结果来判断患者的甲状腺功能是否正常。
在TPo检测标准中,还会对检测结果的解读给出具体的参考范围。
一般情况下,TPO的正常范围在0-34 IU/mL之间,超过这个范围可能意味着甲状腺功能异常,如甲状腺炎、自身免疫性甲状腺疾病等。
医生会根据检测结果和患者的临床症状综合判断,制定合理的治疗方案。
总的来说,TPo检测标准是为了保证对甲状腺功能的检测结果准确性和一致性,有助于医生及时发现患者的甲状腺疾病,为疾病的诊断和治疗提供科学依据。
患者在进行TPO检测时,应该遵守相关的检测标准和流程,以确保检测结果的准确性,及时发现并治疗甲状腺疾病,维护身体健康。

tpo指标
甲功五项中的tpo应为TPOAb,其全称为抗甲状腺过氧化物酶抗体,正常值通常为小于60 IU/ml或阴性,不同实验室的参考范围可能存在略微差异。
TPOAb正常成年人的参考值为小于60 IU/ml,因为各个医院检测试剂不同,参考值略有差异。
部分医院正常范围内为阴性,阳性则为异常。
TPOAb异常,多见于甲状腺疾病,如桥本甲状腺炎、甲状腺功能亢进(包括桥本甲状腺炎甲亢期)、原发性甲状腺功能低下症等。
除此之外,少部分亚急性甲状腺炎、甲状腺癌患者也可能升高。
但是,TPOAb升高不能确诊疾病类型,需要结合其他检查,如甲状腺功能、甲状腺彩超、甲状腺穿刺活检等,进一步诊断。
当发现TPOAb升高或有不适症状时,建议及时就医,由专业医生结合个人情况进行诊治,以免延误病情。
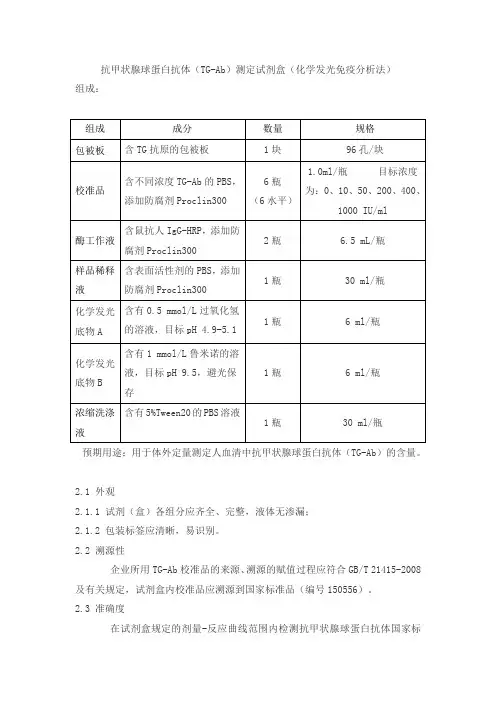
抗甲状腺球蛋白抗体(TG-Ab)测定试剂盒(化学发光免疫分析法)组成:预期用途:用于体外定量测定人血清中抗甲状腺球蛋白抗体(TG-Ab)的含量。
2.1 外观2.1.1 试剂(盒)各组分应齐全、完整,液体无渗漏;2.1.2 包装标签应清晰,易识别。
2.2 溯源性企业所用TG-Ab校准品的来源、溯源的赋值过程应符合GB/T 21415-2008及有关规定,试剂盒内校准品应溯源到国家标准品(编号150556)。
2.3 准确度在试剂盒规定的剂量-反应曲线范围内检测抗甲状腺球蛋白抗体国家标准品,其测量结果的相对偏差应在±10%范围内。
2.4 特异性测定浓度不低于400IU/ml的抗甲状腺过氧化物酶(TPO)样本、浓度不低于1000ng/ml的IgG样本,其测定结果应不大于10IU/ml。
检测企业阴性质控品N3-N5,其测定结果应不大于10IU/ml。
2.5 空白限空白限应不大于10IU/ml。
2.6 线性线性区间在[10,1000]IU/ml,在试剂盒检测的线性范围内,试剂盒的相关系数(r)应不低于0.9900。
2.7 精密度2.7.1 批内精密度用试剂盒检测企业重复性质控品TG-Ab-LP(50±10IU/ml)和TG-Ab-HP (300±60IU/ml),各重复检测10次,其变异系数(CV)应不大于10.0%。
2.7.2 批间精密度用3个批号试剂盒检测企业重复性质控品TG-Ab-LP(50±10IU/ml)和TG-Ab-HP(300±60IU/ml),重复检测10次,3个批号试剂盒之间的批间变异系数(CV)应不大于15.0%。
2.8 稳定性效期稳定性:检测过效期试剂盒,其结果应符合2.3~2.7.1项要求。

不同化学发光检测系统测定抗甲状腺过氧化物酶抗体的比较研究张淑艳;杨永昌;刘杰【摘要】目的对Roche Cobase E601和SIEMENS Centaur XP两种化学发光检测系统测定抗甲状腺过氧化物酶抗体(TPOAb)结果的可比性和相关性进行评价.方法使用上述两种发光检测系统测定94例患者血清中的TPOAb浓度,对两组数据进行比较,并对相关性进行分析.结果两种发光检测系统的批内、批间精密度较好,差异无统计学意义;SIEMENS Centaur XP检测系统阳性率大于Roche Cobase E601检测系统的阳性率,结果比较差异有统计学意义(P<0.05);两检测系统对TPOAb的检测结果总符合率为75.6%,两检测系统检测结果呈正相关(r=0.866,P<0.01).结论建议对TPOAb检测建立标准化的参考系统,现有的检测系统应与标准化的参考系统进行比对.%Objective To assess the comparability and correlation of Roche Cobase E601 and SIEMENS Centaur XP chemiluminescence detection systems for the determination of thyroid peroxidase antibody (TPOAb) level.Methods The serum concentration of TPOAb in 94 patients was measured by two different detection system mentioned above.We then compared the abnormal rate of the two groups of data, and did the correlation analysis.Results No significant difference was observed between the within-run and between-run precision of two detection systems′ test results;The positive rate of Roche Cobase E601 was significantly higher than that of SIEMENS Centaur XP (P<0.05).The coincidence of the detection results of TPOAb between two systems was 75.6%, and there was a positive correlation between them (r=0.866,P<0.01).Conclusion Our study results suggested to establish a standardized reference system for TPOAb detection, with which the existing detection system could be compared.【期刊名称】《标记免疫分析与临床》【年(卷),期】2017(024)005【总页数】3页(P581-583)【关键词】化学发光检测系统;抗甲状腺过氧化物酶抗体;方法学比较【作者】张淑艳;杨永昌;刘杰【作者单位】陆军总医院检验科,北京 100700;陆军总医院检验科,北京 100700;陆军总医院检验科,北京 100700【正文语种】中文甲状腺特异性过氧化物酶(TPO)存在于甲状腺细胞的微粒体上,并在顶端细胞表面表达,TPO是甲状腺微粒体的主要抗原成分[1]。

抗甲状腺过氧化物酶抗体定量测定·每一试剂盒做一次重新定标:·根据要求进行标定:如质控结果超出范围时。
7 质控PreciControl抗-TPO1和抗-TPO2以及其它合适的质控品。
各浓度区域的质控至少每24工作时、每个试剂盒或每一次定标后测定一次。
质控间隔期应适用于实验室的具体要求。
检测值应落在确定的范围内,如出现质控值落在范围以外,应采取校正措施。
8试剂准备及稳定期M:链霉亲和素包被的微粒(透明瓶盖),1瓶,6.5ml。
粒子浓度0.72g/ml,生物素结合能力: 470ng生物素/mg粒子。
含防腐剂。
R1:Ru(bpy)32+标记的羊抗TPO抗体(灰盖),1瓶,10ml。
浓度1.0mg/l,TRIS缓冲液0.1mol/l,pH7.2。
含防腐剂。
R2:生物素化的TPO重组抗原(黑盖),1瓶,10ml。
浓度0.15mg/l,TRIS缓冲液0.03mol/l,pH7.0。
含防腐剂。
Cal1:羊抗TPO定标液1(白盖),1瓶,1.3ml。
浓度约35 IU/ml,人血清基质。
含防腐剂。
Cal2:羊抗TPO定标液2(白盖),1瓶,1.3ml。
浓度约350IU/ml,人血清基质。
含防腐剂。
PC ATPO1 PreciControl 人抗TPO质控品1,(黑盖),1瓶,1.0ml。
浓度约20IU/ml,人血清基质。
含防腐剂。
PC ATPO2 PreciControl 人抗TPO质控品2,(黑盖),1瓶,1.0ml。
浓度约100IU/ml,人血清基质。
含防腐剂。
未打开的试剂盒:2-8℃至效期末。
开封后,2-8度6周;放E170/e601和Elecsys2010/e411上2周。
9实验程序按Roche Modular E170/e601 ECL2010/e411标准操作流程严格进行。
10抗干扰能力该方法不受黄疸(胆红素<66mg/dl)、溶血(血红蛋白<1.5g/dl)、脂血(脂质<2100mg/dl)和生物素<60ng/ml等干扰。

促甲状腺激素测定试剂盒产品技术要求北京美联泰科促甲状腺激素测定试剂盒(磁微粒化学发光法)是一种用来检测人体内促甲状腺激素水平的试剂盒。
在促甲状腺激素测定的过程中,该试剂盒采用磁微粒化学发光法,通过特定的试剂盒,可以快速、准确地检测出人体内促甲状腺激素的浓度。
根据国家相关标准和技术要求,促甲状腺激素测定试剂盒(磁微粒化学发光法)的产品技术要求包括以下几个方面:
1.试剂盒的稳定性要求:试剂盒必须具有较长的保存期限,并且在保存期间,其性能稳定性应能满足测量的需要。
2.试剂盒的灵敏度和特异性要求:试剂盒使用的抗体必须具有较高的灵敏性,能够检测出较低浓度的促甲状腺激素。
此外,试剂盒还应具有较高的特异性,确保只能检测出促甲状腺激素,而不受其他物质的干扰。
3.试剂盒的精确度和准确性要求:试剂盒的使用应具有较高的精确度和准确性,确保能够得到可靠的测量结果。
同时,试剂盒的成本控制也是一个考虑因素。
4.试剂盒的操作简便性要求:试剂盒的操作应简便易行,不需要复杂的专业技能,便于广泛应用于临床实验室。
5.试剂盒的安全性要求:试剂盒必须符合相关的安全标准和规定,确保操作人员的安全。
6.试剂盒的报告范围和结果解释要求:试剂盒显示的测量结果应具有合理的报告范围,且结果能够清楚地解释,并与实际情况相符。
除了上述技术要求外,促甲状腺激素测定试剂盒(磁微粒化学发光法)还需要符合国家食品药品监督管理部门的相关注册要求,包括质量控制要
求和生产工艺要求等。
同时,还需要进行相关的临床验证和评估,以确保
其在实际应用中的可靠性和准确性。
甲状腺过氧化物酶抗体高说明什么
上海武警浦东甲状腺科是一所集医、教、研为一体的综合性医院。
医院位于上海市浦东新区云台路265号,地铁直达交通便利。
作为一所公立部队医院,医院目前已成为国家级高层次的医教研中心之一,在国内外均享有较高声誉。
医院始终以坚持人民军队为人民服务为建院理念,以“科技兴医,质量建院”为宗旨,打造诚信医院作为部队医院义不容辞的责任
注册号国食药监械(准)字2006第3401171号产品名称抗甲状腺过氧化物酶抗体定量检测试剂盒(化学发光法) 产品标准YZB/国0280-2006《抗甲状腺过氧化物酶抗体定量检测试剂盒(化学发光法)》产品性能结构及组成本产品由包被板、质控品、酶结合物、标准品、样品稀释液、发光底物A、发光底物B、固体洗液、封口膜、说明书等组成。
产品适用范围该产品用于人血清中甲状腺过氧化物酶抗体含量的检测,用于自身免疫性甲状腺疾病的诊断,特别对于桥本甲状腺炎的诊断具有重大意义,并且对鉴别亚急性甲状腺炎,甲状腺肿瘤等疾病提供了重要依据,帮助医生排除干扰因素,减少误诊率。
促甲状腺激素受体抗体磁微粒化学发光法的建立和初步临床应用评估徐海娈;马冰;靳增明;赵艳芳;张世杰【期刊名称】《检验医学》【年(卷),期】2024(39)1【摘要】目的建立检测人血清促甲状腺激素受体抗体(TRAb)的磁微粒化学发光法,并进行初步临床应用评估。
方法采用竞争法原理,建立基于异硫氰酸荧光素(FITC)-抗FITC系统的检测血清TRAb的磁微粒化学发光法,并对方法的空白限、检出限、线性区间、精密度、抗干扰能力进行评估。
采用受试者工作特征(ROC)曲线评估该方法的临床诊断效能。
比较磁微粒化学发光法与电化学发光法和促甲状腺激素受体刺激性抗体(TSI)化学发光法的一致性。
了解郑州地区健康成人血清TRAb的分布情况。
结果建立的磁微粒化学发光法的空白限为0.3 IU·L^(-1),检出限为0.7 IU·L^(-1),线性区间为1.0~50.0 IU·L^(-1);低、中、高水平样本的重复性分别为5.36%、2.54%和2.12%,中间精密度分别为8.13%、3.92%和3.50%。
胆红素≤250 mg·L^(-1)、血红蛋白(Hb)≤1.0 g·L^(-1)、三酰甘油(TG)≤10.0 g·L^(-1)、FITC-Na≤500 ng·mL^(-1)对磁微粒化学发光法检测TRAb无干扰,甲状腺球蛋白抗体(TgAb)、甲状腺过氧化物酶抗体(TPOAb)、促甲状腺激素(TSH)、促黄体生成素(LH)、卵泡刺激素(FSH)和人绒毛膜促性腺激素(hCG)对磁微粒化学发光法检测TRAb无交叉反应。
ROC曲线分析结果显示,磁微粒化学发光法检测TRAb诊断毒性弥漫性甲状腺肿(GD)的曲线下面积为0.998,最佳临界值为1.92 IU·L^(-1),敏感性为99.07%,特异性为95.00%。
磁微粒化学发光法与电化学发光法具有良好的相关性(r2=0.941,P<0.0001),2种方法的偏差为0.090IU·L^(-1),总符合率为96.24%,一致性好(kappa=0.925);与TSI化学发光法的相关性一般(r2=0.671,P<0.000 1),2种方法的偏差为-2.613 IU·L^(-1),总符合率为88.15%,一致性较好(kappa=0.763)。
抗甲状腺过氧化物酶(TPO)抗体测定试剂盒(磁微粒化学发光法)适用范围:本试剂盒用于体外定量检测人血清中抗甲状腺过氧化物酶(TPO)抗体的含量。
1.1 规格100人份/盒、500人份/盒。
1.2主要组成成分2.1 外观试剂盒各组分应齐全、完整,液体无渗漏;各液体组分应澄明,无沉淀或絮状物。
2.2 溯源性根据GB/T 21415-2008的有关规定,提供所用校准品的来源、赋值过程及测量不确定度等内容,溯源至中国食品药品检定研究院提供的标准品(编号:150557)。
2.3 准确度用中国食品药品检定研究院提供的抗甲状腺过氧化物酶抗体标准品(编号:150557)配制的样本进行检测,其测量结果的相对偏差应在±10%范围内。
2.4 线性在线性范围[10,400]IU/mL内,相关系数应(r)应不低于0.9900。
2.5 重复性分别检测高值和低值两个样本,重复性(CV%)应不高于10.0%。
2.6 批间差在三个不同批次产品之间,样本测定结果的变异系数(CV%)应不高于15.0%。
2.7 检出限检出限应不高于10IU/mL。
2.8 特异性表12.9 质控品赋值有效性测定高值、低值浓度质控品,其结果均应在质控范围内。
2.10 稳定性稳定性可选用以下其中一种方法进行验证:2.10.1 2℃~8℃储存,有效期12个月,效期后分别检测2.3、2.4、2.5、2.7、2.8、2.9项,其结果应符合各项要求。
2.10.2 取有效期内的试剂盒在37℃放置7天,分别检测2.3、2.4、2.5、2.7、2.8、2.9项,其结果应符合各项要求。
人甲状腺过氧化物酶抗体(TPOAb)测定试剂盒(磁微粒化学发光免疫分析法)适用范围:用于体外定量测定人血清中的人甲状腺过氧化物酶抗体的含量。
1.1包装规格
规格W:W1:25人份/盒;W2:50人份/盒;W3:2×50人份/盒;W4:4×50人份/盒。
规格L:L1:25人份/盒;L2:50人份/盒;L3:100人份/盒;L4:2×100人份/盒。
1.2 产品主要组成成分
校准品和质控品浓度具有批特异性,具体浓度见标签。
2.1 外观
试剂盒中的组分应澄清,应无沉淀和絮状物。
磁分离试剂摇匀后,应为均匀悬浊液,无明显凝集。
校准品和质控品均为澄清无沉淀液体。
2.2空白限
应不大于5IU/mL。
2.3准确度
用国家标准品(编号:150557)进行检测,其相对偏差应在±15%范围内。
2.4 线性
在[5,500]IU/mL测量范围内,相关系数R≥0.9900。
2.5 重复性
用高低两个浓度的样本,各重复检测10次,变异系数CV应不大于10%。
2.6 批间差
用三个批号试剂盒检测同一样本,则三个批号试剂盒之间的变异系数CV应不大于15%。
2.7特异性
2.7.1含浓度不低于5000ng/mL人免疫球蛋白G(人IgG)的零浓度TPOAB样本,测值应不高于5IU/mL。
2.8稳定性
试剂盒在2℃~8℃的贮存条件下保存至有效期(12个月)后,结果应符合2.1-2.5项的要求。
2.9校准品溯源性
根据GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》及有关规定提供校准品的来源、赋值过程及测量不确定度等内容,该校准品可溯源至国家标准品(编号:150557)。