钴镍的氢氧化物性质
- 格式:ppt
- 大小:755.50 KB
- 文档页数:74


镍钴氢氧化物的制备及其电化学性能安露露㊀米㊀杰∗(太原理工大学ꎬ煤科学与技术国家重点实验室㊀太原030024)摘㊀要㊀采用化学共沉淀法成功制备了片状镍钴氢氧化物ꎬ并探究了不同镍钴物质的量比对样品形貌及电化学性能的影响ꎮ通过X射线衍射(XRD)㊁扫描电子显微镜(SEM)㊁X射线光电子能谱仪(XPS)及比表面积孔径分析仪(BET)对样品的结构㊁形貌进行了表征ꎬ并利用循环伏安法㊁恒电流充放电法等对其电化学性能进行了分析ꎮ结果表明ꎬn(Ni)ʒn(Co)=4ʒ1的样品直接用作电极材料时ꎬ具有最好的电化学性能:在0 5A/g的电流密度下拥有1852F/g的高比容量ꎻ电流密度增大20倍时ꎬ仍拥有1330F/g的高比容量ꎮ以镍钴氢氧化物为正极ꎬ活性炭为负极组装的非对称式超级电容器在346W/kg的功率密度下ꎬ能量密度达52Wh/kgꎬ在循环10000圈之后电容保持率为92%ꎮ优异的电化学性能表明ꎬ片状镍钴氢氧化物是很有应用潜力的电极材料之一ꎮ关键词㊀镍钴氢氧化物ꎻ超级电容器ꎻ循环稳定性中图分类号:O646ꎻTB31㊀㊀㊀㊀㊀文献标识码:A㊀㊀㊀㊀㊀文章编号:1000 ̄0518(2020)05 ̄0579 ̄08DOI:10.11944/j.issn.1000 ̄0518.2020.05.1903152019 ̄11 ̄25收稿ꎬ2020 ̄01 ̄17修回ꎬ2020 ̄03 ̄11接受山西省重大科技专项(MC2015 ̄04)资助通讯联系人:米杰ꎬ教授ꎻTel:0351 ̄6018080ꎻE ̄mail:mijie111@163.comꎻ研究方向:电化学超级电容器因具有高的功率密度ꎬ长的循环寿命和较快的充放电速率等优势ꎬ已广泛应用于混合动力汽车ꎬ可穿戴电子设备等[1 ̄2]ꎮ然而ꎬ较低的能量密度仍是超级电容器面临的一个重大挑战[3]ꎮ因此ꎬ开发高能量密度ꎬ高比容量及循环性能良好的电极材料势在必行ꎮ现如今ꎬ过渡金属氧化物ꎬ氢氧化物电极材料因拥有高的比容量引起了极大关注[4 ̄5]ꎮ其中ꎬNi(OH)2在理论上具有高的比容量ꎬ约3750F/g[6]ꎻ而Co(OH)2比Ni(OH)2具有更好的导电性ꎮ为得到导电性更好ꎬ比容量更高的双金属氢氧化物ꎬ将钴掺入到氢氧化镍中得到镍钴氢氧化物ꎮ且双金属氢氧化物具有优异的离子交换能力ꎬ丰富的氧化还原反应及可调的化学组成等优势[7 ̄9]ꎮ这些优势使得镍钴双金属氢氧化物成为极具发展潜力的电极材料ꎮ当前ꎬ为提高镍钴氢氧化物的比容量ꎬ科研人员采用不同的方法进行了制备ꎮKulkarni等[10]采用电沉积法制备了Co1-xNixLDHs薄膜ꎬ作为电极材料时具有1213F/g的比容量ꎬ在循环了10000圈之后ꎬ容量保持率为77%ꎮ苟建霞等[4]通过溶剂热法制备了花状镍钴氢氧化物ꎬ在1A/g的电流密度下其比容量能达到1698F/gꎮ但是镍钴氢氧化物的电化学性能还未满足高性能储能设备的要求ꎮ本文采用了制备工艺简单㊁条件易于控制及合成周期短的化学共沉淀法ꎬ制备了较均匀的镍钴双金属氢氧化物ꎮ其直接用作电极材料时ꎬ拥有1852F/g的高比电容ꎮ以镍钴氢氧化物为正极ꎬ活性炭(AC)为负极组装的非对称式超级电容器(NiCo ̄LDH//AC)在346W/kg的功率密度下ꎬ能量密度高达52Wh/kgꎬ在循环10000圈之后电容保持率为92%ꎮ优异的电化学性能表明ꎬ片状镍钴氢氧化物是极具前景的电极材料之一ꎮ1㊀实验部分1.1㊀仪器和试剂MAIA3LMH型扫描电子显微镜(SEMꎬ捷克TESCAN公司)ꎻD/MAX2500型X射线衍射仪(XRDꎬ日本Rigaku公司)ꎻEscalabXi型的X射线光电子能谱仪(XPSꎬ英国赛默飞公司)ꎻJW ̄BK122W型比表面及孔径分析仪(BETꎬ北京精微高博公司)ꎮ六水合氯化镍(NiCl2 6H2Oꎬ上海阿拉丁生化科技股份有限公司)ꎬ六水合氯化钴(CoCl2 6H2Oꎬ天津光复科技发展有限公司)ꎬ氨水(NH3 H2Oꎬ天津市科密欧化学试剂有限公司)ꎬ上述试剂均为分析纯ꎮ第37卷第5期应用化学Vol.37Iss.52020年5月㊀㊀㊀㊀㊀㊀㊀CHINESEJOURNALOFAPPLIEDCHEMISTRY㊀㊀㊀㊀㊀㊀㊀May2020085应用化学㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀第37卷㊀1.2㊀样品制备将一定量n(Ni)ʒn(Co)=1ʒ1㊁2ʒ1㊁4ʒ1和1ʒ0的氯化镍㊁氯化钴分散在蒸馏水中得到均匀混合溶液ꎬ然后转移至50ħ的水浴锅中ꎬ边搅拌边逐滴加入0 25mol/L的氨水ꎬ调节pH=7 5后ꎬ静置6hꎻ自然冷却至室温ꎬ通过真空抽滤㊁60ħ烘干得到样品产物ꎮ1.3㊀电化学性能测试将样品与乙炔黑㊁粘结剂按质量比8ʒ1ʒ1混合ꎬ均匀涂覆在泡沫镍上ꎬ烘干备用ꎮ采用制备的泡沫镍电极为工作电极ꎬ铂电极为对电极ꎬ汞/氧化汞为参比电极的传统三电极体系ꎬ在2mol/L的KOH电解液中进行循环伏安(CV)测试ꎬ恒电流充放电(GCD)测试和电化学阻抗谱(EIS)测试ꎮ以活性炭为负极ꎬ所制备样品为正极组装非对称式超级电容器ꎬ进行CVꎬGCD测试和循环性能测试ꎮ1.4㊀电化学测试过程中的数据计算1.4.1㊀电极比容量的计算用质量比容量来衡量活性材料的电化学性能ꎬ计算公式如式(1)所示:C=IΔt/mΔV(1)式中ꎬC(F/g)为质量比容量ꎬI(A)和m(g)分别代表充放电电流和活性物质的质量ꎬΔt(s)和ΔV(V)分别代表放电时间和电势窗口ꎮ1.4.2㊀非对称式超级电容器正负极活性材料质量比的计算以制备的活性材料为正极ꎬ活性炭为负极组装了非对称式超级电容器ꎬ为获得理想的电容器性能ꎬ两个电极片上的电荷量(Q)应平衡ꎬ根据式(2)确定正负极之间活性材料的最佳质量比:m+ˑC+ˑΔV+=m-ˑC-ˑΔV-(2)式(2)中ꎬm+和m-(g)代表正负极活性材料的质量ꎬC+和C-(F/g)代表正负极的比容量ꎬΔV+和ΔV-(V)代表正负极的电势窗口ꎮ1.4.3㊀非对称式超级电容器能量密度和功率密度的计算为了评价非对称式超级电容器的实际应用情况ꎬ需要对电容器的能量密度和功率密度进行计算ꎮ计算公式如式(3)和(4)所示:E=CV2/7.2(3)P=3.6ˑE/Δt(4)式中ꎬE(Wh/kg)表示电容器的能量密度和P(W/kg)表示电容器的功率密度ꎮ2结果与讨论2.1㊀样品的形貌分析图1为不同镍钴物质的量比样品的SEM照片ꎬ可以看到样品均呈现片状结构ꎮn(Ni)ʒn(Co)=1ʒ1时(图1A)ꎬ片层较厚且团聚现象严重ꎻ随着镍钴比例增大ꎬ片层开始变薄且更加细小(图1B)ꎮ当n(Ni)ʒn(Co)=4ʒ1时(图1C)ꎬ片状结构表面粗糙且交叉分布ꎬ相互连接的片状结构有利于电子的传输ꎮ当n(Ni)ʒn(Co)=1ʒ0时ꎬ如图1D所示呈现出片状组装的花形结构ꎬ片层轻薄且表面光滑ꎮ2.2㊀样品的结构和元素分析图2A为不同镍钴物质量的比样品的XRD图谱ꎮ从图2A中可以看到ꎬn(Ni)ʒn(Co)=1ʒ1㊁2ʒ1和4ʒ1时ꎬ样品均有对应于镍钴类水滑石的衍射峰ꎬ峰位置位于约11 0ʎ㊁22 2ʎ㊁33 7ʎ和59 1ʎꎬ且分别对应于(003)㊁(006)㊁(009)和(110)晶面[11]ꎬ表明通过共沉淀法成功合成了镍钴氢氧化物ꎮ随着镍钴比例的增大ꎬ其衍射峰的强度逐渐增强ꎬ表明其结晶度更好ꎮ而镍钴物质的量比为1ʒ0的样品出现了对应于Ni(OH)2的衍射峰ꎬ能够很好的与JCPDS:14 ̄0117相吻合ꎬ且存在类水滑石的衍射峰ꎮ为进一步确定样品中所含元素及其价态ꎬ采用XPS光谱进行了表征ꎬ在总谱中发现了Ni㊁Co㊁O和C的特征峰ꎮ在Ni2p图谱中ꎬ位于873 7和856 0eV处的两个主要特征峰分别对应于Ni2p1/2和Ni2p3/2ꎬ其它两个峰为卫星峰ꎬ表明Ni2+的存在[12 ̄13]ꎻ同样的ꎬ在Co2p图谱中也存在两个对应于Co2p1/2和Co2p3/2的主要特征峰和两个卫星峰ꎬ表示材料中Co2+的存在[14]ꎮ以上结果表明ꎬ样品中镍钴元素均以+2价的形式存在ꎮ图1㊀不同镍钴物质的量比样品的SEM照片Fig.1㊀SEMimagesofsampleswithdifferentmolarratiosofNitoCon(Ni)ʒn(Co):A.1ʒ1ꎻB.2ʒ1ꎻC.4ʒ1ꎻD.1ʒ0图2㊀不同镍钴物质的量比样品的XRD图(A)ꎻn(Ni)ʒn(Co)=4ʒ1样品的XPS图ꎻB.总谱图ꎻC.Ni2p高分辨谱图ꎻD.Co2p高分辨谱图Fig.2㊀XRDpatternsofsampleswithdifferentmolarratioofNitoCo(A)ꎬandXPSsurveyspectrum(B)ꎬhigh ̄resolutionspectraforNi2p(C)andCo2p(D)ofthesamplewithn(Ni)ʒn(Co)=4ʒ12.3㊀不同镍钴比例样品的比表面积和孔径分布分析图3为样品的N2气吸脱附曲线及相应的孔径分布曲线ꎬ可以看到不同镍钴比例的样品均表现出IV型的等温线ꎬ表明样品均为典型的介孔材料ꎻ同时伴有H3型的滞后环ꎬ常见于片状材料中ꎬ是由于材料的狭185㊀第5期安露露等:镍钴氢氧化物的制备及其电化学性能285应用化学㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀第37卷㊀缝型孔隙堆积造成的[15 ̄16]ꎮ样品的孔径主要集中于1~10nmꎬ孔径相对均匀ꎮn(Ni)ʒn(Co)=1ʒ1的材料比表面积仅有6 50m2/gꎬ随着镍钴比例的增加ꎬ比表面积变大ꎬn(Ni)ʒn(Co)=4ʒ1时ꎬ比表面积达到39 94m2/gꎻ而n(Ni)ʒn(Co)=1ʒ0时ꎬ比表面积高达68 32m2/gꎮ较大的比表面积可以增大电极材料与电解液的接触面积ꎬ提供较多的电化学反应位点ꎬ有利于电化学性能的提高ꎮ图3㊀不同镍钴摩尔比样品的N2气吸脱附曲线及孔径分布曲线Fig.3㊀Nitrogenadsorption ̄desorptioncurveandporesizedistributioncurvesofsampleswithdifferentmolarratiosofNitoCon(Ni)ʒn(Co):A.1ʒ1ꎻB.2ʒ1ꎻC.4ʒ1ꎻD.1ʒ02.4㊀三电极电化学性能分析为了评估样品的电化学性能ꎬ对其进行了电容性能测试ꎮ图4A为所有样品在30mV/s的扫描速率下的CV曲线图ꎮ可以明显地看到均出现了明显的氧化还原峰ꎬ且n(Ni)ʒn(Co)=4ʒ1的电极材料拥有最大的CV曲线闭合面积ꎬ表明其具有最大的比容量ꎮ为了得到具体的比容量值ꎬ对n(Ni)ʒn(Co)=4ʒ1的电极材料进行了不同扫描速率下的CV测试和不同电流密度下的GCD测试(图4B和4C)ꎮ在CV曲线中ꎬ不同扫描速率下均出现了明显的氧化还原峰ꎬ相应的电化学反应式如式(5)-(7)[17 ̄18]:Ni(OH)2+OH-=NiOOH+H2O+e-(5)Co(OH)2+OH-=CoOOH+H2O+e-(6)CoOOH+OH-=CoO2+H2O+e-(7)㊀㊀且曲线形状未发生显著变化ꎬ表明此材料具有良好的倍率性能和可逆性能ꎻ而随着扫描速率的增大ꎬ氧化峰向高电势偏移ꎬ还原峰向低电势偏移ꎬ这是由于高电势下电极的极化现象引起的[19]ꎮ根据不同电流密度下的GCD曲线ꎬ可以计算出比容量的大小ꎮn(Ni)ʒn(Co)=4ʒ1的电极材料在0 5A/g的电流密度下ꎬ比容量可以达到1852F/gꎮ在1㊁2㊁3㊁4㊁5和10A/g时ꎬ其比容量分别为1766 2㊁1683 2㊁1624 2㊁1571 2㊁1511和1330F/gꎬ在电流密度增大20倍的情况下ꎬ比容量仍维持71 82%ꎬ具有良好的倍率性能ꎮ从EIS图谱(图4D和4E)上可以看出ꎬn(Ni)ʒn(Co)=4ʒ1的电极材料在高频区的半圆直径较小ꎬ具有较小的电荷转移电阻[20]ꎮ2.5㊀非对称式超级电容器电化学性能分析以活性炭为负极ꎬn(Ni)ʒn(Co)=4ʒ1的电极材料为正极组装非对称式超级电容器(NiCo ̄LDH//AC)ꎬ图4㊀不同镍钴物质的量比样品的CV曲线(A)和EIS图谱(DꎬE)ꎻn(Ni)ʒn(Co)=4ʒ1样品的CV曲线(B)和GCD曲线(C)Fig.4㊀CVcurves(A)andEISspectra(DꎬE)ofsampleswithdifferentmolarratioofNitoCoꎻCVcurves(B)andGCDcurves(B)ofsamplewithn(Ni)ʒn(Co)=4ʒ1通过对其进行电化学性能测试ꎬ来评估电极材料的实际应用潜力ꎮ非对称式超级电容器的电势窗口与正负极电极材料的性质密切相关ꎬ因此对活性炭和镍钴氢氧化物进行了CV测试ꎬ可以发现镍钴氢氧化物的电势窗口为0~0 5Vꎬ活性炭的电势窗口为-1~0Vꎬ同时在不同的电势窗口下对NiCo ̄LDH//AC进行了CV测试ꎬ可以确定其电势窗口可以达到1 6Vꎮ图5C为在不同扫描速率下的CV曲线ꎬ可以发现随着扫描速率的增加ꎬ均呈现相似的形状ꎬ说明NiCo ̄LDH//AC器件具有优良的倍率性能ꎻ且由于镍和钴离子的氧化还原反应出现了氧化还原峰ꎮ通过在不同电流密度下对其进行充放电测试(图5D)ꎬ可以计算出在0 5A/g时ꎬ比容量高达146 1F/gꎻ当电流密度增大10倍后ꎬ仍维持51 8%ꎬ再一次表明NiCo ̄LDH//AC器件具有优良的倍率性能ꎮ而且NiCo ̄LDH//AC器件具有超长的循环稳定性ꎬ循环10000圈之后ꎬ比容量仍保持92%ꎬ如图5E所示ꎮ根据能量密度与功率密度计算公式ꎬ可以得出在346W/kg的功率密度下ꎬ能量密度高达52Wh/kgꎻ当功率密度增大到4001 7W/kg时ꎬNiCo ̄LDH//AC仍拥有26 9Wh/kg的能量密度ꎮ将两个充满电的电容器串联之后ꎬ可以点亮一个黄色的LED灯ꎬ也可以点亮一个黄色和一个红色的LED灯ꎬ表明NiCo ̄LDH//AC在实际应用中具有一定的潜力ꎮ385㊀第5期安露露等:镍钴氢氧化物的制备及其电化学性能图5㊀正负极电极材料(A)㊁不同电压窗口(B)及NiCo ̄LDH//AC(C)的CV曲线ꎻD.GCD曲线ꎻE.循环性能图ꎻF.拉贡图Fig.5㊀(A)CVcurvesꎬ(B)CVcurvesofNiCo ̄LDH//ACatdifferentpotentialwindowꎬ(C)CVcurvesꎬand(D)GCDcurvesꎬE.cyclingstabilityandF.RagoneplotandLEDslightingofNiCo ̄LDH//ACASC3 结㊀论采用化学共沉淀法ꎬ以氯化镍㊁氯化钴为原料ꎬ氨水为沉淀剂ꎬ成功制备了片状镍钴氢氧化物ꎮ通过改变镍钴物质的量比ꎬ得到片状结构良好且比表面积较大的材料ꎮ通过三电极电化学性能测试ꎬ表明n(Ni)ʒn(Co)=4ʒ1的电极材料具有较高的比容量(1852F/g)和良好的倍率性能(71 82%)ꎮ以此电极材料为正极ꎬ活性炭为负极组装的非对称式超级电容器具有较高的能量密度(52Wh/kg)和优良的循环性能(10000圈之后比容量仍保持92%)ꎮ参㊀考㊀文㊀献[1]LiMꎬYangWꎬLiJꎬetal.PorousLayeredStackedMnCo2O4CubeswithEnhancedElectrochemicalCapacitive485应用化学㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀第37卷㊀Performance[J].Nanoscaleꎬ2018ꎬ10(5):2218 ̄2225.[2]DengCꎬYangLꎬYangCꎬetal.SpinelFeCo2S4NanoflowerArraysGrownonNiFoamasNovelBinder ̄FreeElectrodesforLong ̄Cycle ̄LifeSupercapacitors[J].ApplSurfSciꎬ2018ꎬ428:148 ̄153.[3]ChenSꎬYangGꎬZhengH.AlignedNi ̄Co ̄MnOxideNanosheetsGrownonConductiveSubstratesasBinder ̄FreeElectrodesforHighCapacityElectrochemicalEnergyStorageDevices[J].ElectrochimActaꎬ2016ꎬ220(100):296 ̄303.[4]GouJꎬXieSꎬLiuYꎬetal.Flower ̄LikeNickel ̄CobaltHydroxidesConvertedfromPhosphitesforHighRatePerformanceHybridSupercapacitorElectrodeMaterials[J].ElectrochimActaꎬ2016ꎬ210(100):915 ̄924.[5]JingCꎬZhuYꎬLiuXꎬetal.MorphologyandCrystallinity ̄ControlledSynthesisofEtchedCoAlLDO/MnO2HybridNanoarraysTowardsHighPerformanceSupercapacitors[J].JAlloysCompdꎬ2019ꎬ806:917 ̄925.[6]ZHANGXiongꎬWEIMinꎬLIJingꎬetal.MicrowaveRapidSynthesisofNickel ̄CobaltBimetallicHydroxideforSupercapacitors[J].VacElectronꎬ2018ꎬ4:63 ̄72(inChinese).张雄ꎬ魏民ꎬ李敬ꎬ等.应用于超级电容器微波快速合成镍钴层状双金属氢氧化物[J].真空电子技术ꎬ2018ꎬ4:63 ̄72.[7]SinghSꎬShindeNMꎬXiaQXꎬetal.TailoringtheMorphologyFollowedbytheElectrochemicalPerformanceofNiMn ̄LDHNanosheetArraysThroughControlledCo ̄dopingforHigh ̄EnergyandPowerAsymmetricSupercapacitors[J].DaltonTransꎬ2017ꎬ46(38):12876 ̄12883.[8]YangWꎬGaoZꎬWangJꎬetal.SolvothermalOne ̄StepSynthesisofNi ̄AlLayeredDoubleHydroxide/CarbonNanotube/ReducedGrapheneOxideSheetTernaryNanocompositewithUltrahighCapacitanceforSupercapacitors[J].ACSApplMaterInterfacesꎬ2013ꎬ5(12):5443 ̄5454.[9]WangLꎬQinKꎬLiJꎬetal.NanotubularNi ̄SupportedGraphene@HierarchicalNiCo ̄LDHwithUltrahighVolumetricCapacitanceforSupercapacitors[J].ApplSurfSciꎬ2018ꎬ453:230 ̄237.[10]KulkarniSBꎬJagadaleADꎬKumbharVSꎬetal.PotentiodynamicDepositionofCompositionInfluencedCo1-xNixLDHsThinFilmElectrodeforRedoxSupercapacitors[J].IntJHydrogenEnergyꎬ2013ꎬ38(10):4046 ̄4053.[11]WangXꎬHuangFꎬRongFꎬetal.UniqueMOF ̄DerivedHierarchicalMnO2Nanotubes@NiCo ̄LDH/CoS2NanocageMaterialsasHighPerformanceSupercapacitors[J].JMaterChemAꎬ2019ꎬ7(19):12018 ̄12028.[12]LeKꎬWangZꎬWangFꎬetal.Sandwich ̄LikeNiCoLayeredDoubleHydroxide/ReducedGrapheneOxideNanocompositeCathodesforHighEnergyDensityAsymmetricSupercapacitors[J].DaltonTransꎬ2019ꎬ48(16):5193 ̄5202.[13]ZhouLJꎬHuangXꎬChenHꎬetal.AHighSurfaceAreaFlower ̄LikeNi ̄FeLayeredDoubleHydroxideforElectrocatalyticWaterOxidationReaction[J].DaltonTransꎬ2015ꎬ44(25):11592 ̄11600.[14]LiTꎬLiRꎬLuoH.FacileinSituGrowthofNi/Co ̄LDHArraysbyHypothermalChemicalCoprecipitationforAll ̄Solid ̄StateAsymmetricSupercapacitors[J].JMaterChemAꎬ2016ꎬ4(48):18922 ̄18930.[15]LiangHꎬLinJꎬJiaHꎬetal.HierarchicalNiCo ̄LDH/NiCoP@NiMn ̄LDHHybridElectrodesonCarbonClothforExcellentSupercapacitors[J].JMaterChemAꎬ2018ꎬ6(31):15040 ̄15046.[16]LiMꎬChengJPꎬLiuFꎬetal.3D ̄ArchitecturedNickel ̄Cobalt ̄ManganeseLayeredDoubleHydroxide/ReducedGrapheneOxideCompositeforHigh ̄PerformanceSupercapacitor[J].ChemPhysLettꎬ2015ꎬ640(100):5 ̄10.[17]CaoFꎬGanMꎬMaLꎬetal.HierarchicalSheet ̄LikeNi ̄CoLayeredDoubleHydroxideDerivedfromaMOFTemplateforHigh ̄PerformanceSupercapacitors[J].SynthMetꎬ2017ꎬ234:154 ̄160.[18]JiaHꎬWangZꎬZhengXꎬetal.InterlacedNi ̄CoLDHNanosheetsWrappedCo9S8NanotubewithHierarchicalStructureTowardHighPerformanceSupercapacitors[J].ChemEngJꎬ2018ꎬ351:348 ̄355.[19]LiJꎬhenSꎬZhuXꎬetal.TowardAerogelElectrodesofSuperiorRatePerformanceinSupercapacitorsThroughEngineeredHollowNanoparticlesofNiCo2O4[J].AdvSciꎬ2017ꎬ4(12):1700345.[20]LiangHꎬLinJꎬJiaHꎬetal.HierarchicalNiCo ̄LDH@NiOOHCore ̄ShellHeterostructureonCarbonFiberClothasBattery ̄LikeElectrodeforSupercapacitor[J].JPowerSourcesꎬ2018ꎬ378:248 ̄254.585㊀第5期安露露等:镍钴氢氧化物的制备及其电化学性能685应用化学㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀第37卷㊀SynthesisofNickelCobaltHydroxideandItsElectrochemicalPropertiesANLuluꎬMIJie∗(StateKeyLaboratoryofCoalScienceandTechnologyꎬTaiyuanUniversityofTechnologyꎬTaiyuan030024ꎬChina)Abstract㊀Inthisworkꎬtheflakenickelcobalthydroxidewassuccessfullypreparedbythechemicalco ̄precipitationmethodꎬandtheeffectofnickeltocobaltmolarratiosonthemorphologiesandelectrochemicalpropertieswereexplored.ThestructuresandmorphologiesofsampleswerecharacterizedbyX ̄raydiffraction(XRD)ꎬscanningelectronmicroscopy(SEM)ꎬX ̄rayphotoelectronspectroscope(XPS)andspecificsurfaceareaandporesizeanalyzer(BET).Theelectrochemicalpropertieswereanalyzedbycyclicvoltammetryꎬgalvanostaticcharge/dischargeꎬetc.Theresultsshowthatwhennickelcobalthydroxide(n(Ni)ʒn(Co)=4ʒ1)isdirectlyusedaselectrodematerialꎬithasahighspecificcapacitanceof1852F/gatacurrentdensityof0 5A/g.Whenthecurrentdensityisincreasedby20timesꎬitstillhasahighspecificcapacitanceof1330F/g.Theasymmetricsupercapacitorisassembledwithnickelcobalthydroxideasthepositiveelectrodematerialandactivecarbonasthenegativeelectrodematerial.Theasymmetriccellpossessesahighenergydensityof52Wh/kgatapowerdensityof346W/kgꎬandsuperiorcyclestability(thecapacitanceretentionof92%after10000cycles).Excellentelectrochemicalpropertiesindicatethatflakenickelcobalthydroxideisoneofthemostpromisingelectrodematerials.Keywords㊀nickelcobalthydroxideꎻsupercapacitorsꎻcyclestabilityReceived2019 ̄11 ̄25ꎻRevised2020 ̄01 ̄17ꎻAccepted2020 ̄03 ̄11SupportedbytheMajorProjectsofShanxiProvince(No.MC2015 ̄04)Correspondingauthor:MIJieꎬprofessorꎻTel:0351 ̄6018080ꎻE ̄mail:mijie111@163.comꎻResearchinterests:electrochemistry。

铁钻鎳的性质SANY 标准化小组#QS8QHH-HHGX8Q8-GNHHJ8-HHMHGN# 实验六铁.钻.操的性质一、实验目的1.试验并学握铁、钻、银氢氧化物的生成和氣化还原性质:2、试验并学握铁、钻、規配合物的生成及在离子鉴定中的作用。
二、实验原理铁.钻.铢常见氧化值:+2和+ 3另外Fe还有+61.Fe:\ Co:\ N F•的还原性(1)酸性介质Cl2 + 2Fe:* (浅绿)=2Fe>(浅黄)+2CF(2)碱性介质铁(II).钻(II)、银(II)的盐溶液中加入碱.均能得到相应的氢氧化物。
Fe(OH):易被空气中的氧气氧化.往往得不到白色的氢氧化亚铁,而是变成灰绿色.最后成为红棕色的氢氧化铁。
Co (0H),也能被空气中的氧气慢慢氧化。
2.Fe3\ Co"、N广的氧化性由于C&和都具有强氧化性.C O(OH)3,N I O(OH)与浓盐酸反应分别生成Co(II)和小⑴),并放出氯气。
CoO(OH)和NiO(OH)通常由Co (II)和Ni(II)的盐在碱性条件下用强氧化剂(Cl2. BrJ氧化得到。
Fe5•易发生水解反应。
Fe”具有一定的氧化性.能与强还原剂反应生成Fe二3.配合物的生成和FeH Fe”、Co:\ Ni>的鉴定方法(1)氮配合物Fe>和Fe"难以形成稳定的氨配合物。
在水溶液中加入氨时形成Fe(OH):和Fe(OH),沉淀。
将过虽的氨水加入C。
〉或N产离子的水溶液中.即生成可溶性的氨合配离子[C O(NHJF或不过[C O(NHJF不稳定,易氧化成[C O(NH3)J5\(2)氨配合物Fe3\ CoH Fe:\ Co:\ N广都能与Cf形成配合物。
使亚铁盐与KCN溶液作用得Fe(CN)2沉淀,KCN过址时沉淀溶解。
FeS0:+2KCN=Fe (CN):+K:SO;Fe (CN):^1KCN=K. [Fe (CN)』从溶液中析出來的黄色晶体是K.[Fe(CN)d - 3H:0•叫六鼠合诜(II)酸钾或亚铁软化钾.俗称黄血盐。

一、实验目的1. 掌握铁、钴、镍的化学性质及其在反应中的表现。
2. 熟悉铁、钴、镍化合物的制备方法和实验操作技巧。
3. 通过实验观察和分析,培养实验操作能力、观察能力和分析问题的能力。
二、实验原理铁(Fe)、钴(Co)、镍(Ni)是周期表中的过渡金属元素,它们具有相似的化学性质,但在反应中表现出不同的特点。
本实验主要涉及铁、钴、镍的氢氧化物、配合物及其氧化还原性质。
三、实验仪器与试剂1. 仪器:试管、烧杯、酒精灯、滴管、玻璃棒等。
2. 试剂:硫酸亚铁铵、硫酸钴、硫酸镍、氢氧化钠、氨水、溴水、氯水、硫酸等。
四、实验内容1. 铁(II)、钴(II)、镍(II)化合物的还原性(1)铁(II)的还原性- 在酸性介质中,往盛有1毫升溴水的试管中加入3滴1:1 H2SO4的溶液,然后滴加0.2mol/L (NH4)2Fe(SO4)2溶液,观察现象。
反应式:2Fe2+ + Br2 → 2Fe3+ + 2Br-(2)钴(II)的还原性- 往盛有CoCl2和NiSO4的试管中分别滴入氯水,观察现象。
反应式:Co2+ + Cl2 → Co3+ + 2Cl-2. 铁、钴、镍氢氧化物的生成和性质- 将Fe粉3g加入煮沸冷却的NaOH溶液中,观察现象。
反应式:Fe + 2NaOH → Fe(OH)2 + H2↑- 将0.5mL氢氧化钠溶液滴入硫酸亚铁铵溶液中,观察现象。
反应式:Fe2+ + 2OH- → Fe(OH)2↓3. 铁、钴、镍配合物的生成和性质- 将过量的氨水加入Co2+或Ni2+离子的水溶液中,观察现象。
反应式:[Co(NH3)6]2+ + 2OH- → [Co(NH3)6]2+ + 2H2O五、实验现象1. 铁在酸性介质中与溴水反应,溶液由橙红色变为棕黄色。
2. 钴在氯水中反应,溶液由蓝色变为棕黄色。
3. 铁粉与NaOH反应,生成白色沉淀,逐渐变为灰绿色,最后变为红棕色。
4. 硫酸亚铁铵溶液中加入NaOH,生成白色沉淀。
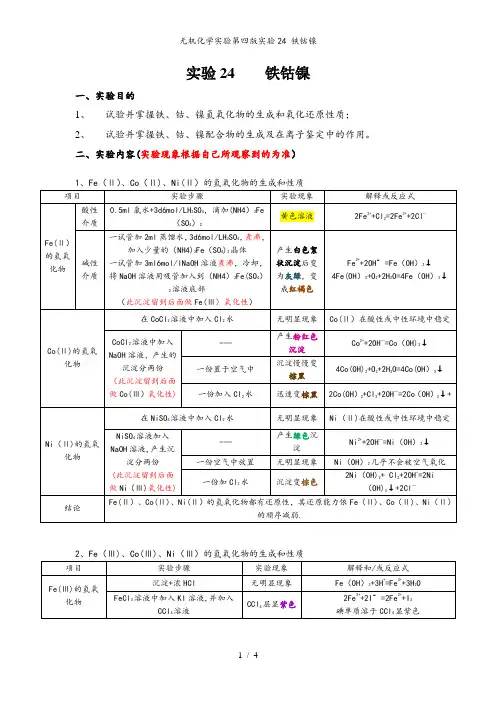
实验24 铁钴镍一、实验目的1、试验并掌握铁、钴、镍氢氧化物的生成和氧化还原性质;2、试验并掌握铁、钴、镍配合物的生成及在离子鉴定中的作用。
二、实验内容(实验现象根据自己所观察到的为准)三、实验讨论(从自己实验操作展开)四、实验思考题和习题1。
实验步骤(2)要求整个实验不能带入空气到溶液中,为什么?Fe(Ⅱ)易被氧化,如若带入了空气,可能不能观察到颜色的转化过程。
2.根据实验现象总结+2价的铁、钴、镍化合物的还原性和+3价的铁钴镍化合物氧化性的变化规律。
Fe(Ⅱ)、Co(Ⅱ)、Ni(Ⅱ)的氢氧化物都有还原性,其还原能力依Fe(Ⅱ)、Co(Ⅱ)、Ni(Ⅱ)的顺序减弱。
Fe(Ⅲ)、Co(Ⅲ)、Ni(Ⅲ)在酸性介质中的氧化能力依Fe(Ⅲ)、Co(Ⅲ)、Ni(Ⅲ)的顺序增加。
3。
比较钴镍氨配合物的氧化还原性相对大小及溶液稳定性。
钴盐和镍盐生成碱式盐溶于过量的氨水生成氨配合物,Co(Ⅱ)氨配合物易氧化转化成 Co(Ⅲ)氨配合物。
即镍盐更稳定.4。
为什么制取+3价的钴镍氢氧化物要用+2价为原料在碱性条件下进行氧化,而不+3价直接制取?首先,作为最高价氧化值,Co3+、Ni3+氧化性比较不稳定,易变成其它价态,故不用采用+3价直接氧化得到。
其次,而Co(OH)2、Ni(OH)2两性,在碱性条件下易被氧化成+3价氢氧化物。
5。
如何分离混合液中的?Fe3+、Cr3+、Ni2+ ?6.总结Fe(Ⅱ、Ⅲ)、Co(Ⅱ、Ⅲ)、Ni(Ⅱ、Ⅲ)主要化合物性质。
Fe(Ⅱ)、Co(Ⅱ)、Ni(Ⅱ)具有强的还原性,都易形成配合物,且Co的配合物极易被氧化,它们的氢氧化物也易被氧化;Fe(Ⅲ)、Co(Ⅲ)、Ni(Ⅲ)具有强的氧化性,也易生成配合物。
7。
(此题面字太多,不好打得,请谅解)A:(NH4)2Fe (SO4)2B:(NH4)2Fe (SO4)2溶液C:Fe(OH)2D:NH3E:I2F:Fe3+G:KFe[Fe(CN)6]H:BaSO4这些方程式都是简单的,都可以轻易写出,在此我不一一写出了。


实验二铁钴镍元素性质浙江工业大学化材学院李远理论介绍:1.铁钴镍性质相近, 称为铁系元素(铁磁性物质)2.Fe、Co、Ni 的电子构型为3d64s2.3d74s2.3d84s2(Cr: 3d54s1、Mn: 3d54s2 引导学生从电子组态分析元素的常见氧化态)一目的要求1.了解Fe(II)、Fe(III)、Co(II)、Co(III)、Ni(II)、Ni(III)的氢氧化物和硫化物的生成与性质。
2.了解Fe2+的还原性和Fe3+的氧化性3.了解Fe(II)、Fe(III)、Co(II)、Co(III)、Ni(II)和Ni(III)的配合物的生成和性质4.了解Fe(II)、Fe(III)、Co(II)和Ni(II)等离子的鉴定方法二基本操作1.离心机的使用: 先调零、开电源、调时间3-4min、调转速2000 rpm, 结束后要调零2.定性实验的试剂滴加练习巩固3.通风橱的使用(饱和硫化氢、浓盐酸等)三主要仪器和药品1仪器: 离心机, 烧杯(200mL), 试管, 离心试管, 试管夹, 滴管2药品:铜片, 铁屑, (NH)2Fe(SO4)2·6H2O( 固), KCl(固) , NH4Cl(固), HCl(2 mol•L-1, 6 mol•L-1, 浓), H2SO4(1mol•L-1), HAc(2mol•L-1), NaOH(2 mol•L-1, 6mol•L-1), 氨水(2mol•L-1, 6mol•L-1, 浓), K4[Fe(CN)6](0.1 mol•L-1), K3[Fe(CN)6](0.1mol•L-1), CoCl2(0.1mol•L-1), NiSO4(0.1mol•L-1), (NH)2Fe(SO4)2(0.1mol•L-1), KI(0.1 mol•L-1), FeCl3(0.1 mol•L-1), CuSO4(0.1mol•L-1), KSCN(0.1 mol•L-1, 1mol•L-1), NaF(1 mol•L-1), 溴水, H2O2(3%), CCl4, 丙酮, 丁二酮肟, 碘化钾-淀粉试纸等。


铁\钴\镍在釉料及微晶玻璃中的作用与影响摘要:本文阐述了铁、钴、镍的基本物理化学性质,以及主要的存在形式,重点介绍了氧化铁、氧化钴、氧化镍对釉料及微晶玻璃主要性能的作用与影响。
结果表明:氧化铁、氧化钴、氧化镍对釉料及微晶玻璃性能的影响较大,它们的玻璃相可强烈地吸收红外长波,造成玻璃相易熔,特别是其表面易熔。
随铁、钴、镍离子的含量增大其粘度和表面张力逐渐降低。
铁、钴、镍大大改善釉料及微晶玻璃的耐水性,机械强度增强,包括抗压强度、硬度、耐磨性、弹性等。
关键词:氧化铁;氧化钴;氧化镍;釉料;微晶玻璃1铁、钴、镍的基本物理和化学性质铁(Fe)、钴(Co)、镍(Ni)属于同一副族元素。
它们核最外电子构型分别为:3d64s2、3d74s2、3d84s2,最外层均为4s2,d轨道均已达到半满以上程度,故d电子成键能力按Fe-Co-Ni的顺序逐渐下降。
铁通常呈+2、+3价,钴主要呈+2价,只在强氧化剂作用下才表现为+3价,镍一般呈+2价。
铁、钴、镍都是白色而有光泽的金属,熔点、沸点相差不大,分别为1537℃、1494℃、1455℃,都属于中等活泼的金属,并且依铁、钴、镍次序活泼性降低。
铁易溶于稀酸,钴和镍在稀酸中的溶解速度较慢。
铁与稀硝酸反应可生成NH3,钴、镍与稀硝酸反应生成NO。
铁、钴、镍与浓硝酸反应生成致密氧化膜而发生钝化,这种钝化作用依铁、钴、镍顺序而降低。
纯铁在空气中较稳定,但含有杂质的铁在空气中易氧化,而且锈层疏松多孔,故会使腐蚀继续深入。
钴、镍在空气中可以氧化,但氧化膜致密,不易深入内层。
铁、钴、镍常温下均不与硫、氯、溴等非金属作用,但在加热条件下可以直接发生反应,铁与氯生成三氯化铁,钴、镍与氯生成二氯化物。
铁、钴、镍与硫均生成二价的硫化物。
铁、钴、镍有生成络合物的倾向,其中,钴最强,镍次之,铁最差。
铁有三种氧化物:氧化亚铁、四氧化三铁、氧化铁。
氧化亚铁在自然界中没有对应的天然矿物,化工合成的氧化亚铁的化学组成接近为Fe0.95O,显黑色,熔点为1369℃,不溶于水和碱,但溶于酸。
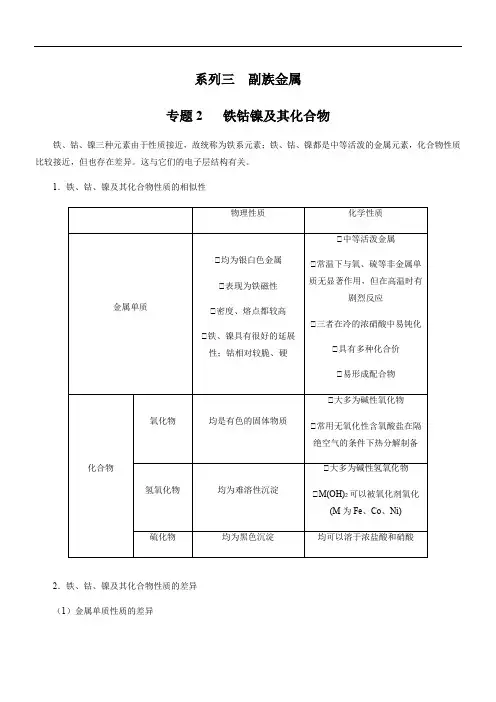
系列三副族金属专题2 铁钴镍及其化合物铁、钴、镍三种元素由于性质接近,故统称为铁系元素;铁、钴、镍都是中等活泼的金属元素,化合物性质比较接近,但也存在差异。
这与它们的电子层结构有关。
1.铁、钴、镍及其化合物性质的相似性2.铁、钴、镍及其化合物性质的差异(1)金属单质性质的差异(2)铁、钴、镍的氧化物和氢氧化物①铁、钴、镍氧化物和氢氧化物的基本性质注:①表示在碱性条件下不具有氧化性。
①比较与总结(1)在酸性溶液中,Fe 2+、Co 2+、Ni 2+分别是铁、钴、镍离子的稳定状态。
高价态的铁(①)、钴(①)、镍(①)在酸性溶液中都有很强的氧化性,空气中的O 2能将酸性溶液中的Fe 2+氧化成Fe 3+,但不能将Co 2+、Ni 2+氧化成Co 3+和Ni 3+。
(2)在碱性介质中,铁的最稳定价态是+3,而钴、镍的最稳定价态仍是+2,在碱性介质中,将低价态的Fe(①)、Co(①)、Ni(①)氧化成高价态比酸性介质中容易。
4.高铁盐的制备在酸性介质中,FeO 2-4(高铁酸根离子)是一种强氧化剂,一般氧化剂很难把Fe 3+氧化成FeO 2-4,但在强碱性介质中,Fe(①)却能被一些氧化剂(如NaClO)所氧化:2Fe(OH)3+3ClO -+4OH -===2FeO 2-4+3Cl -+5H 2O ,将Fe 2O 3、KNO 3和KOH 混合并加热共融,生成紫红色的高铁酸钾:Fe 2O 3+3KNO 3+4KOH=====①2K 2FeO 4+3KNO 2+2H 2O 。
5. 检验Fe 2+和Fe 3+时的注意事项(1)检验Fe 2+时不能先加氯水后加KSCN 溶液,也不能将加KSCN 后的混合溶液加入到足量的新制氯水中(新制氯水可能氧化SCN -)。
(2)Fe 3+、Fe 2+、Cl -同时存在时不能用酸性KMnO 4溶液检验Fe 2+(Cl -能还原酸性KMnO 4,有干扰)。
(3)检验Fe 2+、Fe 3+的其他方法①检验Fe 2+最好、最灵敏的试剂是铁氰化钾K 3[Fe(CN)6]:3Fe 2++2[Fe(CN)6]3-===Fe 3[Fe(CN)6]2↓(蓝色)。

Co和Ni的氧化物一、引言钴(Co)和镍(Ni)的氧化物是重要的无机化合物,广泛应用于能源、环保、化工、电子等领域。
它们具有独特的物理和化学性质,如高熔点、良好的电导性和热稳定性等,使其在各种技术和工业应用中具有重要价值。
本文将对Co和Ni的氧化物的性质、合成方法以及应用进行详细的综述。
二、Co和Ni氧化物的性质1.钴氧化物钴的氧化物有多种,常见的有CoO、Co2O3和Co3O4。
它们具有不同的晶体结构和物理性质。
例如,CoO是浅绿色固体,具有六方晶系结构;Co2O3是红棕色固体,具有三方晶系结构;而Co3O4则是黑色固体,具有立方晶系结构。
这些氧化物在空气中较为稳定,且具有较高的熔点和良好的导电性。
2.镍氧化物镍的氧化物主要包括NiO、Ni2O3和NiOOH。
NiO是白色固体,具有六方晶系结构;Ni2O3是棕黄色固体,具有三方晶系结构;而NiOOH则是绿色固体,具有三方晶系结构。
这些氧化物也具有较高的熔点和良好的电导性。
三、Co和Ni氧化物的合成方法1.直接氧化法直接氧化法是在一定条件下,利用氧气或空气将钴或镍的金属直接氧化生成相应的氧化物。
这种方法需要控制反应条件,如温度、压力和反应时间,以确保得到高纯度的产品。
2.气相氧化法气相氧化法是在高温下,使钴或镍的金属与氧气反应生成相应的氧化物。
这种方法需要在惰性气体保护下进行,以防止氧化物与空气中的氧气发生反应。
3.沉淀法沉淀法是通过向含有钴或镍离子的溶液中加入适当的沉淀剂,使其转化为相应的氢氧化物或碳酸盐沉淀,再将这些沉淀加热分解生成氧化物。
这种方法需要控制溶液的pH值和温度,以确保得到高纯度的产品。
四、Co和Ni氧化物的应用1.催化剂载体Co和Ni的氧化物具有高比表面积和良好的热稳定性,可作为催化剂载体用于各种化学反应中,如烃类燃烧反应、加氢反应等。
在这些反应中,Co和Ni的氧化物可以提供活性中心,促进反应的进行。
2.电池电极材料Co和Ni的氧化物具有良好的电导性和化学稳定性,可作为电池电极材料用于二次电池中,如锂离子电池、镍镉电池等。
实验4. 铬、锰、铁、钴、镍及其化合物的性质和反应
一、实验目的:
1.掌握铬、锰、铁、钴、镍氢氧化物的酸碱性和氧化还原性。
2.掌握铬、锰重要氧化态之间的转化反应及其条件。
3.掌握铁、钴、镍配合物的生成和性质。
4.掌握锰、铁、钴、镍硫化物的生成和溶解性。
5.学习Cr3+,Mn2+,Fe2+,Fe3+,Co2+,Ni2+的鉴定方法。
1
2
3
4
三、注意事项:
1.在制备Mn(OH)2沉淀时,一定要用长滴管深入到溶液底部,将NaOH溶液挤出。
2.Cr(OH)3的颜色是灰绿色,容易被Cr3+的颜色掩盖,要注意观察。
加入NaOH溶液的速度不能太快,否则难以观察到沉淀
的生成。
3.在检验Ni(OH)2沉淀酸碱性时,要用比较强的氧化剂将其氧化。
四、思考题
教材中2、3、5题。
五、实验体会和建议
5。
实验17 铬、锰、铁、钴、镍重点讲内容;:性质铬:《天大》P410—P414 铁;P423—427锰;P418—421 钴;P423—427镍;P423—427一.实验目的;1、掌握铬、锰、铁、钴、镍氢氧化物的酸碱性和氧化还原性。
2、掌握铬、锰重要氧化钛之间的转化反应及其条件3、掌握铁、钴、镍配合物的生成和性质4、掌握锰、铬、铁、钴、镍硫化物的生成和溶解性5、学习Cr3+Mn2+Fe2+Fe3+Co2+Ni2+二.实验原理;铬、锰、铁、钴、镍是周期系第?周期第VIB—VIII族`元素,它们都是能形成多种氧化值的化合物。
铬的重要氧化值为+3和+6;锰的重要氧化值为+2 +4 +6 +7; 铁、钴、镍的重要氧化值是+2 +3.Cr(OH)3是两性的氢氧化物。
Mn(OH)2和Fe(OH)2都很容易被空气的O2氧化,Cr(OH)2也能被空气中的O2慢慢氧化。
由于Co3+和Ni3+都具有强氧化性。
Co(OH)3和Ni(OH)3与浓盐酸反应,分别生成Co(II)和Ni(II)的盐在碱性条件下,用强氧化剂氧化得到。
例;2Ni2++ 6OH-+ Br2===2Ni(OH)3(s)+ 2Br-Cr3+和Fe3+都易发生水解反应。
Fe3+具有一定的氧化性,能与强还原剂反应生成Fe2+在酸性溶液中,Cr3+和MN2+的还原性都较弱,只有用强氧化剂才能将它们分别氧化为CrO72-和MnO4-在酸性条件下,利用Mn2+和NaBiO3的反应可以鉴定Mn2+,例;2Mn2++5NaBiO3+14H+===2MnO4-+ 5Na++ 5Bi3+ + 7H2O (HNO3介质) 在碱性溶液中,[Cr(OH)4]-可被H2O2氧化为CrO42-Cr3++ 4OH-→ [Cr(OH)4]-2[Cr(OH)4]-+ H2O2+ 2OH-→ 2CrO42-+ 8H20 (碱性介质)R酸与CrO42-生成有色沉淀的金属离子均有干扰在酸性溶液中,CrO42-转变为Cr2O72-. Cr2O72-与H2O2反应生成深蓝色的CrO5.此可鉴定Cr3+在重铬酸盐溶液中,分别加入Ag+、Pb2+、Ba2+等。
镍钴锰氢氧化物cas号(最新版)目录1.镍钴锰氢氧化物的概述2.镍钴锰氢氧化物的性质与应用3.镍钴锰氢氧化物的环境影响与储存方式4.镍钴锰氢氧化物的安全措施5.镍钴锰氢氧化物的未来发展前景正文1.镍钴锰氢氧化物的概述镍钴锰氢氧化物(Nickel Cobalt Manganese Hydroxide,简称NiCoMn(OH))是一种由镍、钴、锰和氧元素组成的复合氢氧化物。
它是一种绿色环保的高能电池正极材料,具有良好的电化学性能、环境稳定性和循环稳定性,广泛应用于锂离子电池、镍氢电池和锂金属电池等领域。
2.镍钴锰氢氧化物的性质与应用镍钴锰氢氧化物具有以下性质:(1)良好的电化学性能:镍钴锰氢氧化物具有较高的电位、较宽的电化学窗口和较好的电化学稳定性,可以提供较高的电池输出电压和能量密度。
(2)环境稳定性:镍钴锰氢氧化物在空气中具有良好的稳定性,不易与水、酸和碱等环境因素发生反应。
(3)循环稳定性:镍钴锰氢氧化物在电池充放电过程中具有较好的循环稳定性,可以实现电池的长周期循环使用。
因此,镍钴锰氢氧化物广泛应用于锂离子电池、镍氢电池和锂金属电池等领域,特别是在新能源汽车、便携式电子设备和大规模储能系统等方面具有广泛的应用前景。
3.镍钴锰氢氧化物的环境影响与储存方式镍钴锰氢氧化物在生产过程中可能会产生一定的环境污染,但在合理处理和应用下,对环境的影响较小。
在储存方面,镍钴锰氢氧化物应存放在干燥、通风、避光的环境中,避免与水、酸和碱等物质接触,以保持其性能稳定。
4.镍钴锰氢氧化物的安全措施由于镍钴锰氢氧化物属于化学品,因此在生产、运输和使用过程中需要遵循相关安全规定,采取以下安全措施:(1)生产过程中应采用封闭式生产设备,减少粉尘污染,对废水、废气进行处理。
(2)运输过程中应按照危险品运输规定进行,避免与酸、碱等物质接触。
(3)使用过程中应遵循相关安全操作规程,避免与水、酸和碱等物质接触,做好个人防护。
5.镍钴锰氢氧化物的未来发展前景随着新能源产业的快速发展,镍钴锰氢氧化物作为高能电池正极材料,具有广泛的应用前景。
镍钴双金属氢氧化物
镍钴双金属氢氧化物(nickel-cobalt bimetallic hydroxide)是一
种由镍和钴组成的双金属氢氧化物化合物。
它的化学式为
NiCo(OH)2。
镍钴双金属氢氧化物具有优良的电化学性能,广泛应用于电化学能源转换和存储领域,如超级电容器、锂离子电池、燃料电池等。
它具有高比容量、良好的循环稳定性和较高的电导率等特点,因此被认为是一种有望在能源领域取得重要突破的材料。
目前,人们还在研究如何通过调控合成方法和结构设计来改善镍钴双金属氢氧化物的性能,以满足不同领域的需求。
例如,控制合成条件可以调节其晶体结构和粒径,从而影响其电化学活性和稳定性。
而将其与其他材料组合,如碳材料或氧化物纳米颗粒,可以进一步提高其电化学性能。
总之,镍钴双金属氢氧化物作为一种重要的电化学材料,在能源转换和存储领域有着广泛的应用前景,并且仍然有待进一步研究和优化。
铁\钴\镍在釉料及微晶玻璃中的作用与影响作者:戴长禄杨勇杨明来源:《佛山陶瓷》2011年第09期摘要:本文阐述了铁、钴、镍的基本物理化学性质,以及主要的存在形式,重点介绍了氧化铁、氧化钴、氧化镍对釉料及微晶玻璃主要性能的作用与影响。
结果表明:氧化铁、氧化钴、氧化镍对釉料及微晶玻璃性能的影响较大,它们的玻璃相可强烈地吸收红外长波,造成玻璃相易熔,特别是其表面易熔。
随铁、钴、镍离子的含量增大其粘度和表面张力逐渐降低。
铁、钴、镍大大改善釉料及微晶玻璃的耐水性,机械强度增强,包括抗压强度、硬度、耐磨性、弹性等。
关键词:氧化铁;氧化钴;氧化镍;釉料;微晶玻璃1 铁、钴、镍的基本物理和化学性质铁(Fe)、钴(Co)、镍(Ni)属于同一副族元素。
它们核最外电子构型分别为:3d64s2、3d74s2、3d84s2,最外层均为4s2,d轨道均已达到半满以上程度,故d电子成键能力按Fe-Co-Ni的顺序逐渐下降。
铁通常呈+2、+3价,钴主要呈+2价,只在强氧化剂作用下才表现为+3价,镍一般呈+2价。
铁、钴、镍都是白色而有光泽的金属,熔点、沸点相差不大,分别为1537℃、1494℃、1455℃,都属于中等活泼的金属,并且依铁、钴、镍次序活泼性降低。
铁易溶于稀酸,钴和镍在稀酸中的溶解速度较慢。
铁与稀硝酸反应可生成NH3,钴、镍与稀硝酸反应生成NO。
铁、钴、镍与浓硝酸反应生成致密氧化膜而发生钝化,这种钝化作用依铁、钴、镍顺序而降低。
纯铁在空气中较稳定,但含有杂质的铁在空气中易氧化,而且锈层疏松多孔,故会使腐蚀继续深入。
钴、镍在空气中可以氧化,但氧化膜致密,不易深入内层。
铁、钴、镍常温下均不与硫、氯、溴等非金属作用,但在加热条件下可以直接发生反应,铁与氯生成三氯化铁,钴、镍与氯生成二氯化物。
铁、钴、镍与硫均生成二价的硫化物。
铁、钴、镍有生成络合物的倾向,其中,钴最强,镍次之,铁最差。
铁有三种氧化物:氧化亚铁、四氧化三铁、氧化铁。
高考--常考元素--铁钴镍铁钴镍14.3.1 铁系元素概述铁在地壳中的含量为~5%,居第四位,次于铝。
在常用金属中,铁算得上最丰富、最重要和最廉价的了。
铁矿有赤铁矿Fe2O3 、磁铁矿Fe3O4、褐铁矿Fe2O3·3H2O、菱铁矿FeCO3、黄铁矿FeS2、钛铁矿FeTiO3和铬铁矿Fe(CrO2)2等,我国东北的鞍山、本溪、华北的包头、宣化、华中的大冶等地都有较好的铁矿。
钴相对地说是一种不常见的金属,地壳中的含量为0.0023%,但它分布很广,它通常和硫或砷结合,如辉钴矿CoAsS。
它还存在于维生素B12(一种钴(Ⅲ)的配合物)中。
镍比钴更丰富地存在于自然界,地壳中的含量为0.018%,它主要与砷、锑和硫结合为针镍矿、镍黄铁矿等,在陨石中含有铁镍合金。
铁、钴、镍主要用于制造合金。
铁有生铁、熟铁之分,生铁含碳在1.7﹪~4.5﹪之间,熟铁含碳在0.1﹪以下,而钢的含碳量介于二者之间。
如果在加入Cr、Ni、Mn、Ti等制成合金钢、不锈钢,可大大改善普通钢的性质。
铁Fe、钴Co、镍Ni位于周期表第四周期、第Ⅷ族,其物理性质和化学性质都比较相似,合称铁系元素。
铁系元素单质都是具有金属光泽的白色金属,铁、钴略带灰色,镍为银白色。
依Fe、Co、Ni 顺序,原子半径略有减小,密度增大。
它们的密度都比较大,熔点也比较高,熔点随原子序数的增加而降低,Fe、Co、Ni分别为1535℃、1495℃、1453℃。
这可能是因为3d轨道中成单电子数按Fe、Co、Ni的顺序依次减少(4、3、2),金属键依次减弱的缘故。
钴比较硬而脆,铁和镍却有很好的延展性。
它们都表现有铁磁性,其合金是很好的磁性材料。
由于第一过渡系列元素原子的电子填充过渡到第Ⅷ族时,3d电子已经超过5个,所以它们的价电子全部参加成键的可能性减少,因而铁系元素已经不再呈现出与族数相当的最高氧化态。
铁的常见氧化态是+2和+3,与强氧化剂作用,铁可以生成不稳定的+6氧化态的高铁酸盐;钴和镍的常见氧化态都是+2,与强氧化剂作用,钴可以生成不稳定的+3氧化态,而镍的+3氧化态更少见。