《化学能与电能的转化第一课时》导学案3
- 格式:doc
- 大小:304.00 KB
- 文档页数:6

第2节化学能与电能第1课时化学能与电能的相互转化1.初步认识化学能不仅可以转化为热能,在一定条件下还可以转化为电能。
2.认识氧化还原反应是化学电池形成的基础,了解原电池构成的基本原理并能根据该原理设计简单的原电池。
3.会书写简单的电极反应式。
围绕原电池的概念、原理和组成,组织学生开展发现性学习活动,在“实现化学能直接向电能转化”的一系列探究实验中,让学生积累解决问题的经验及提高化学实验操作的技能。
一、一次能源和二次能源1.定义:一次能源是直接从①自然界取得的能源,一次能源经加工、转换得到的能源是二次能源。
2.实例:a.风力 b.原煤 c.天然气 d.石油 e.电力 f.流水g.蒸汽,其中属于一次能源的是②abcdf;属于二次能源的是③eg。
二、化学能转化为电能1.燃煤发电的能量转化化学能④热能⑤机械能电能2.原电池(1)定义:将⑥化学能转变为电能的装置。
(2)工作原理(以铜-锌-稀硫酸原电池为例)Ⅰ.⑦锌片失去电子,发生⑧氧化反应,电极反应为⑨Zn-2e-Zn2+,所以锌片为原电池的⑩负极。
Ⅱ.H+在铜片上得电子,发生还原反应,电极反应为2H++2e-H2↑,所以铜片为原电池的正极。
1.盐酸与氢氧化钠溶液反应是放热反应,该反应可以设计成原电池吗?为什么?【答案】不可以;因为设计成原电池的反应必须是氧化还原反应。
2.如何判断原电池的正、负极?【答案】失去电子的电极为负极,得到电子的电极为正极(或发生氧化反应的电极为负极,发生还原反应的电极为正极)。
3.构成原电池的条件有哪些?【答案】构成原电池的条件有:①两个活泼性不同的电极(燃料电池中也可以是两个相同的电极);②电解质溶液(或熔融电解质);③电极用导线相连并插入电解质溶液(或熔融电解质);④能自发进行的一个氧化还原反应。
4.原电池原理的应用有哪些?【答案】制作电池、比较金属的活动性强弱、防止金属被腐蚀、提高化学反应速率等。
探究:原电池的工作原理及应用按如图所示装置进行实验,回答下列问题:(1)铜片、锌片上各有什么现象?(2)电流计的指针是否偏转?电子移动方向与电流方向相反,由此推断电子在原电池中是如何流动的?(3)如果铜片和锌片之间没有导线相连,铜片和锌片上各有何现象?(4)分别改变下列条件,继续观察电流计指针是否偏转。

第三节化学能转化为电能——电池导学案第一课时【自学过程】1.直接从自然界取得的能源称为,如、、、、等。
经过加工、转换得到的能源称为如、等。
2.化学能是怎样转化成电能的呢?2001年我国发电总量表明,火电比率仍占首位。
燃煤发电是一个由转化为的过程。
燃煤发电的能量转换过程:→→→【实验探究】:原电池的工作原理实验①如图,把一锌片和一铜片插入稀H2SO4中。
现象:。
反应。
实验②把上图中的Zn、Cu用一导线连接起来,中间接一电流计G.现象:。
结论:。
化学能与电能★1.原电池:。
★2.原电池的构成条件:(1)能自发地发生。
(前提条件)(2)溶液必须为(3)两个电极,其中一个相对,另一个相对较。
两个电极直接或间接的连接在一起,并插入电解质溶液中。
(4)必须形成。
★3.原电池工作过程中:【试一试】请尝试在下图中标出电子流动的方向、电流的方向:由于_____活泼,容易_____电子,锌原子失去电子被______成Zn2+进入溶液,锌片的质量减小,失去的电子通过导线流向铜片, 溶液中的______从铜片得到电子而被______形成氢原子, 氢原子再结合成氢气分子从铜片上逸出。
也可以用如下表示式表示该原电池:(-)Zn|H2SO4|Cu(+)★4.如何判断原电池的正负极?(1)依据原电池两极材料:______作负极(K、Ca、Na太活泼,不能作电极);______作正极。
(2)根据电流方向或电子流向:电流(外电路)由_____流向_____;电子则由_____经外电路流向原电池的______。
(3)根据内电路离子迁移方向:______流向正极,_______流向负极。
(4)根据原电池中反应类型:正极:____电子,发生______,现象是伴随金属的析出或H2的放出。
负极:____电子,发生______,现象是电极本身的消耗,质量减小。
【课堂练习】判断下列哪些装置构成了原电池?若不是,请说明理由;若是,请指出正负极名称,并写出电极反应式。

第二单元化学能与电能的转化第1课时原电池的工作原理一、教学目标1.以铜锌原电池为例,理解原电池的工作原理及应用。
2.学会判断原电池的正负极。
3.掌握原电池的电极反应式和电池反应方程式的书写。
4.能根据氧化还原反应设计简单的原电池。
二、教学重难点原电池的工作原理;电极反应式的书写三、教学过程【课程引入】展示化学能与电能相互转化在生产、生活中的应用,回顾铜锌原电池的装置及工作原理,由此引出本节内容原电池的工作原理。
通过化学原理在生活中的应用第一时间让学生体会生活中的化学无处不在。
能源的利用过程,实际上是能量的转换和传递过程。
化学能与电能的相互转化,是能量转化的重要形式之一。
这种能量转化形式在生产、生活和科学研究中应用十分广泛,如电解、电镀、电池的应用等。
认识和研究化学能与电能相互转化的原理和所遵循的规律具有重要意义。
电解水实验装置电镀产品碱性干电池充电宝(锂电池)知识回顾:铜锌原电池装置的特点:把一块锌片和一块铜片同时插入盛有稀硫酸的烧杯里,用导线把锌片和铜片连起来,在导线中间连接一个灵敏电流计。
电极反应式:负极(Zn):Zn - 2e-===Zn2+正极(Cu):2H+ + 2e-===H2↑电池总反应式:Zn + 2H+===Zn2+ + H2↑【新知讲解】实验探究:【实验1】向一只烧杯中加入1.0 mol·L-1的CuSO4溶液30 mL,再加入适量锌粉,用温度计测量溶液的温度。
观察温度的变化。
实验现象:溶液的温度升高,溶液蓝色变浅。
实验结论:由实验现象,可得出结论Zn与CuSO4溶液反应放热用热化学方程式表示为:Zn(s) + CuSO4(aq)===ZnSO4(aq) + Cu(s) ΔH<0能量变化的主要形式:化学能→热能【实验2】向两只烧杯中分别加入30 mL 1.0 mol·L-1CuSO4溶液和30 mL 1.0 mol·L-1 ZnSO4溶液,将用导线与电流计相连接的锌片和铜片分别插入ZnSO4溶液和CuSO4溶液中,将盐桥(注:盐桥中通常是装有含KCl饱和溶液的琼脂,离子在盐桥中能移动)两端分别插入两只烧杯内的电解质溶液中,观察实验现象。
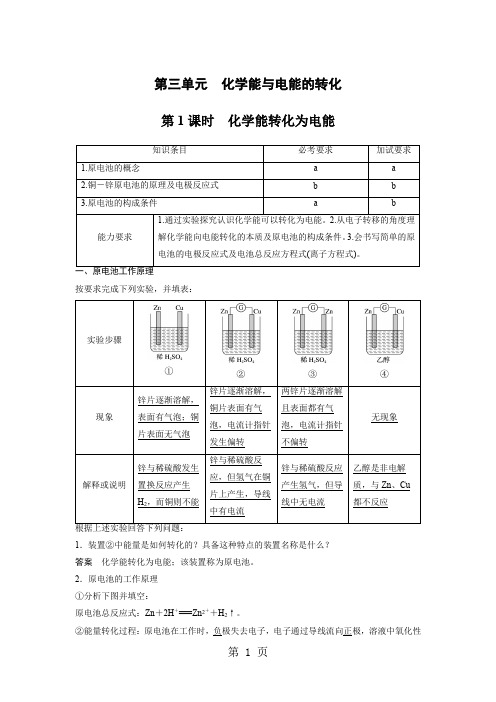
第三单元化学能与电能的转化第1课时化学能转化为电能按要求完成下列实验,并填表:1.装置②中能量是如何转化的?具备这种特点的装置名称是什么?答案化学能转化为电能;该装置称为原电池。
2.原电池的工作原理①分析下图并填空:原电池总反应式:Zn+2H+===Zn2++H2↑。
②能量转化过程:原电池在工作时,负极失去电子,电子通过导线流向正极,溶液中氧化性物质得到电子,发生还原反应,这样氧化反应和还原反应不断发生,闭合回路中不断有电子流产生,也就形成了电流,即化学能转变为电能。
3.结合原电池工作原理及上述实验现象,分析原电池的构成条件是什么? 答案 理论上,自发的氧化还原反应均可构成原电池。
具体条件是 ①具有活动性不同的两个电极(金属与金属或金属与能导电的非金属); ②溶液:两电极均插入电解质溶液中; ③导线:两极用导线相连,形成闭合回路。
1.在如图所示的8个装置中,属于原电池的是________________________。
答案 DFG解析 图中A 、B 都只有一个电极,C 中是两个活动性相同的电极,E 中酒精不是电解质溶液,H 不能形成闭合回路,它们不属于原电池,属于原电池的只有D 、F 、G 。
思维启迪 原电池的判定方法:一看反应原理(能否自发地进行氧化还原反应);二看构成条件(两极一液成回路:两个活动性不同的电极,插入电解质溶液中,装置形成闭合回路)。
2.在如图所示的装置中,a 的金属活动性比氢要强,b 为碳棒,关于此装置的各种叙述不正确的是( )A .碳棒上有气体放出,溶液中c (H +)减小 B .a 是正极,b 是负极C .导线中有电子流动,电子从a 极到b 极D .a 极上发生了氧化反应 答案 B解析 显然,电极a 、b 与电解质溶液稀H 2SO 4组成原电池。
因活动性a >b(碳棒),所以a 为原电池的负极,b 为正极。
电极反应式:a(负)极:a -n e -===a n +(氧化反应);b(正)极:n H++n e -===n2H 2↑(还原反应)。

第二单元 化学能与电能的转化第一课时 化学能转化为电能课前梳理:参看课本P40——41,完成下列填空知识点 一、原电池的工作原理1:将一块锌片和一块铜片分别插入盛有稀硫酸的烧杯里,现象为2:将一块锌片和一块铜片同时插入盛有稀硫酸的烧杯里,现象为3:用导线将实验2的锌片和铜片连接起来,现象为4:在实验3的导线中间连接一个灵敏电流计,现象为1.定义:原电池是将 能转化为 能的一种装置。
2.原电池电极:在实验4中,锌失去电子形成 进入溶液中,电子从锌电极流出,该极称为 极,该极发生 反应,电极反应式为 ;流出锌电极的电子经导 线通过电流计流入铜电极,使溶液中的氢离子得电子形成 ,电子流入的一极称为 极,该极发生 反应,电极反应式为 。
原电池中电子流动的方向为:从 极经外电路...流向 极。
电流方向与电子的流向相反。
原电池中电解质溶液中离子的移动方向:阳离子向 极移动,阴离子向 极移动。
3.综上述实验可以得出构成原电池的条件(1)具有活泼性不同的两个电极,一般较活泼金属作 极,发生 反应。
较不活泼 金属或能导电的非金属单质(如石墨等)作 极,发生 反应。
(2)具有电解质溶液(一般与活泼性强的电极发生氧化还原反应)(3)形成闭合回路(或在溶液中接触)(4)原电池反应是自发的氧化还原反应。
4.Cu-Zn (H 2SO 4)原电池 :正极材料是 ;现象 ,正极电极反应式为 ;负极材料是 ;现象 ,负极电极反应式是 ;原电池工作时总化学方程式为 ,离子方程式为 。
随着时间的推移,溶液的pH 逐渐 ,溶液总质量 。
Z Cu Zn知识点二:钢铁的电化学腐蚀金属跟电解质溶液接触,发生,比较活泼的金属而被氧化,这种腐蚀叫做。
钢铁在潮湿的空气里之所以会很快被腐蚀,是由于在潮湿的空气里,钢铁表面吸附了一层薄薄的水膜,水膜里含有少量的H+和OH-,还溶解了氧气等气体,形成了一层电解质溶液,它与钢铁里的铁和少量碳形成了无数微小的原电池。

第二章第二节化学能与电能学案(第1课时)【学习目标】1、能举例说明化学能与电能的转化关系及其应用;2、初步了解原电池的概念、原理、组成及应用;3、通过实验探究从电子转移角度理解化学能向电能转化的本质。
【学习重难点】原电池的概念及构成条件、原电池的工作原理【知识梳理】一.化学能与电能的相互转化1. 火力发电原理:火力发电是指通过化石燃料的燃烧,使能最终转化为的过程。
在火力发电过程中,经历了一系列的能量转换:【想一想】火力发电的优缺点有哪些?产生污染空气;产生使地球温室效应恶化。
2. 探究实验实验顺序金属实验现象结论或解释(有关离子方程式)1.Zn、Cu分别插入稀H2SO4溶液Zn片Cu片2.Zn、Cu接导线后插入稀H2SO4Zn片Cu片3.Zn、Cu连导线、电流表,插入稀H2SO4 Zn片Cu片【思考】:1.反应2中导线作用:2.反应3中电流计作用:,当把铜片和锌片同时浸入稀硫酸时,由于金属比金属活泼,原子容易电子被成进入溶液中,片上电子通过流向片,溶液中的从片获得电子而被还原成氢原子,氢原子再结合成氢分子从片上逸出。
【结论】:要将化学能直接转化为电能,必须将氧化反应和还原反应在不同区域进行,同时架设桥梁,使电子从还原剂区域转移到氧化剂区域而形成电流,这样将能直接转化为能的装置叫做原电池。
3. 原电池的构成条件和工作原理(1)原电池的构成条件【探究】总结原电池的构成条件:前提:存在一个能自动发生的反应形式:(1)电极:(2)溶液:(3)导线:思考交流:在铜锌原电池中,如果用的是纯锌,则在锌片表面几乎观察不到气泡,而在实验中我们所用的是粗锌(含有碳),在锌片和铜片表面都有气泡产生,你现在能解释这种现象吗?(2)原电池的工作原理从能量转化角度看,原电池是将能直接转化为能的装置;从化学反应来看,原电池的原理是反应中的还原剂失去的电子经过导线传递给氧化剂,从而使氧化还原反应分别在俩个电极上进行。
【小结】1、原电池正负极判断:(1)根据组成原电池的两极材料判断一般是活动性较强的金属为负极,活动性较弱的金属或能导电的非金属为正极。
第三节化学能转化为电能——电池导学案第一课时命题人计芳使用时间:12月19号审核人张广亮王远华杨岩白燕英【学习目标】1.理解原电池的工作原理。
2.会写电极反应式,能够判断原电池正负极3.会设计简单的原电池【重点难点】原电池工作原理,【自学过程】一.原电池的工作原理实验①如图,把一锌片和一铜片插入稀H2SO4中。
现象:。
反应。
此时反应的电子转移有顺序吗?实验②把上图中的Zn、Cu用一导线连接起来,中间接一电流计G.现象:。
结论:。
1.原电池:。
2.原电池的构成条件:(1)能自发地发生。
(前提条件)(2)溶液必须为(3)两个电极,其中一个相对,另一个相对较。
两个电极直接或间接的连接在一起,并插入电解质溶液中。
(4)必须形成。
3.原电池工作过程中:外电路中电子如何移动?内电路中离子如何移动?分析Zn –H2SO4溶液—Cu原电池(右图)反应原理:由于_____活泼,容易_____电子,锌原子失去电子被______成Zn2+进入溶液,锌片的质量减小,失去的电子通过导线流向铜片, 溶液中的______从铜片得到电子而被______形成氢原子, 氢原子再结合成氢气分子从铜片上逸出。
电极反应式:负极:____________________正极:___________________总反应方程式:_____________________, 离子方程式:_________________________【总结】电极的判断:负极发生氧化反应,正极发生还原反应电子流向:→ 导线→【迁移应用】分析图示的原电池现象为:正极反应:负极反应:总反应为:也可以用如下表示式表示该原电池:(-)Zn|CuSO4|Cu(+)【交流·研讨】问题:如下图装置,是否构成了原电池呢?分析:装置中虽有两个电极和电解质溶液,但未构成闭合回路,形不成电流,所以,不能构成原电池。
可在中间加一个盐桥就满足了原电池的构成条件(如下图),Zn仍为负极,Cu为正极,可表示为(-)Zn|ZnSO4||CuSO4|Cu(+),其中“||”表示盐桥。
《化学能与电能的转化》导学案一、学习目标1、理解原电池的工作原理,能写出简单原电池的电极反应式和电池反应方程式。
2、了解常见的化学电源及其工作原理。
3、理解电解池的工作原理,能写出简单电解池的电极反应式和电解反应方程式。
4、了解电解原理在工业生产中的应用。
二、知识梳理(一)原电池1、定义:将化学能转化为电能的装置。
2、构成条件(1)有两种活泼性不同的金属(或一种是非金属导体)作电极。
(2)电极插入电解质溶液中。
(3)形成闭合回路。
(4)能自发地发生氧化还原反应。
3、工作原理以铜锌原电池为例,在稀硫酸溶液中:锌片为负极,发生氧化反应,电极反应式为:Zn 2e⁻= Zn²⁺铜片为正极,发生还原反应,电极反应式为:2H⁺+ 2e⁻= H₂↑总反应式为:Zn + 2H⁺= Zn²⁺+ H₂↑4、原电池中的电子和电流流向电子:从负极流出,经导线流向正极。
电流:从正极流向负极。
(二)常见的化学电源1、干电池(1)普通锌锰干电池负极材料:锌筒正极材料:石墨棒电解质:氯化铵和氯化锌的糊状物(2)碱性锌锰干电池负极材料:锌粉正极材料:二氧化锰电解质:氢氧化钾溶液2、充电电池(1)铅蓄电池负极材料:铅正极材料:二氧化铅电解质:硫酸溶液放电时的电极反应式:负极:Pb + SO₄²⁻ 2e⁻= PbSO₄正极:PbO₂+ 4H⁺+ SO₄²⁻+ 2e⁻= PbSO₄+ 2H₂O 总反应:Pb + PbO₂+ 2H₂SO₄= 2PbSO₄+ 2H₂O (2)锂离子电池优点:质量轻、体积小、性能好等。
3、燃料电池(1)氢氧燃料电池负极:H₂ 2e⁻= 2H⁺正极:O₂+ 4H⁺+ 4e⁻= 2H₂O总反应:2H₂+ O₂= 2H₂O(三)电解池1、定义:将电能转化为化学能的装置。
2、构成条件(1)有与电源相连的两个电极。
(2)电解质溶液(或熔融电解质)。
(3)形成闭合回路。
3、工作原理以电解氯化铜溶液为例:阳极(与电源正极相连):2Cl⁻ 2e⁻= Cl₂↑阴极(与电源负极相连):Cu²⁺+ 2e⁻= Cu总反应式:CuCl₂= Cu + Cl₂↑4、电解池中电子和离子的流向电子:从电源的负极流出,经导线流向电解池的阴极,再从电解池的阳极流出,经导线回到电源的正极。
《化学能与电能》导学案教案背景本节内容是在学生已经建立起电极反应的概念并能够正确地判断阴极和阳极的基础上,精心设计、构建了一个内容体系,以一个学生熟悉的自发的氧化还原反应为研究对象,通过将其拆开在两极上分别进行氧化还原反应并采用逐步深入的手段,来介绍原电池的工作原理,以及阴极和阳极、正极和负极、电池反映的概念。
教学课题第一章第三节《化学能转化为电能——电池》(第1课时)教材分析本节内容是电化学中的重要知识。
由于学生之前没有电化学的基础,理解原电池原理有一定的难度。
第一课时的主要内容有:原电池的概念、原理、组成原电池的条件。
原电池原理和组成条件是本节课的重点,原电池原理是本节课的难点。
本节教材设置了大量的探究教学素材,富有深刻的探究教学思想内涵。
首先,新课引入的两个演示实验为探究教学创设了问题情景,当学生观察到“铜片上产生气泡”这一反常的实验现象,就会情不自禁地提出一系列问题,产生强烈的探索欲望,并提出各种各样的假设;紧接着,通过(4-15 )演示实验为学生提供“实证性”材料,学生根据实验现象,经过严密的逻辑推理,得出相关结论;当学生理解原电池的原理后,教材又设置了一个讨论题,让学生自己归纳“组成原电池的条件”。
同时,课本后面的“家庭小实验---- 水果电池”,习题中的“用铜、银和硝酸溶液设计一个原电池”都是本课时探究教学内容的应用和延伸。
当然,为了更好地实施探究教学,还需对本节教材内容作必要的处理和补充。
(1)变教材中的教师演示实验为学生动手实验。
这样不仅使学生观察到明显的现象,还能使学生直接参与知识的获得过程,获得直接的体验。
(2)对于原电池正负极的判断,教材是以叙述的形式提出的,这不利于学生对概念的理解和记忆。
可以利用一节干电池让学生自己设计实验得出结论。
这比直接提出正负极的判断方法更有利于启发学生的思维,提高学生的实验设计能力。
(3)教材中“组成原电池的条件”这一个讨论题,问题过于空泛,考虑到学生的知识迁移能力和概括能力还不是很强,单纯的讨论可能会无从谈起,因此教学中设计了一组学生实验习题(以教材后面的一个习题为蓝本),让学生通过实验获得直接经验,再通过对比分析,归纳出规律,最终得出组成原电池的三个必要条件。
化学能与电能导学案
班级姓名座号
知识技能
1、能举例说明化学能雨电能的转化关系
2、认识原电池这种化学能与电能直接互化的装置,掌握原电池的组成和工作原理
3、理解原电池原理,了解常见的化学电源。
过程方法
借助探究实验,培养思维能力;认识化学能转化为电能对现代化的重要性
情感态度价值观
认识化学能转化为电能对现代化的重要性
课时1 认识原电池
课前预习
1、火力发电过程中有哪些能量转换?
2、火力发电有何优缺点?
课堂探究:
1、化学能如何转化为电能
1)电流是如何产生的?
2)在化学反应中有无能使化学能转变为电能的反应?火力发电中涉及的化学反应有何特点?
3)如何才能使化学能直接转变为电能?你想到了哪些方法?2、原电池的组成条件
1)实验探究原电池的组成条件(详见实验报告)
2)实验中步骤2有何现象?能否据此认为铜与硫酸发生聊化学反应?涉及实验验证你的猜想
3)通过实验,你认为组成原电池应该具有哪些条件?
课后练习
1、画出原电池装置图
2、从下列仪器药品中选择组合成原电池
铜片、银片、锌片、铁片、石墨、木炭、金属钠、稀硫酸、稀盐酸、浓硫酸、酒精、醋酸;其他材料任取。
《电解池》导学案
【知识梳理】在我们已学过的化学课程里,涉及利用电解反应来制取新物质的例子?
一、电能转化为化学能原理探究
观察与思考:在U形管中加入饱和氯化铜溶液,用石墨棒作电极,接通电源,电解数分钟后,观察现象。
1. 电解池概念:我们把 _____________________的装置称为电解池。
2.电解原理:_____________________ 过程叫做电解。
3. 电极名称:
与电源__________相连的电极称为阴极,发生还原反应。
与电源__________相连的电极称为阳极,发生氧化反应。
二、电解原理的应用
(1)铜的电解精炼
溶液是________________ 溶液。
(2)电解饱和食盐水制取氯气和烧碱(氯碱工业)
电解前应除去食盐溶液中的Ca2+、Mg2+、SO42- 等杂质离子
电极反应:_____________________
阳极反应_____________________
阴极反应 _____________________
电解反应为_____________________ 。
(3)电镀
电镀是一种特殊的电解,要求镀件必须作阴极,阳极、电解质溶液中的阳离子、镀层金属都必须是同一种金属元素。
电镀时,电解质溶液的浓度保持不变。
(4)冶炼活泼金属(铝、钠、镁等)
通电
如:2Al2O3=== 4Al + 3O2↑
归纳与总结:原电池、电解池的比较
【典型例题】
1. 在电解水时,常加入一些稀硫酸,其目的是 ( )
A.使溶液酸性增强 B.使溶液中离子浓度增大
C.加快电解的速率 D.使溶液的氧化性增强
解析:纯水导电性很弱,向水中加入一些电解质可增强导电性,如:稀硫酸、氢氧化钠固体
等,故选BC。
2. 在25℃时.将两个铂电极插入一定量的饱和Na2SO4溶液中进行电解,通电一段时间后在
阴极逸出a摩气体,同时析出w克Na2SO4·10H2O晶体,若温度不变,此时剩余溶液的质量
分数是 ( )
A.
71
100%
161
⨯
B.
100%
36
w
w a
⨯
+
C.
7100
%
161(18)
w
w a
+ D.
71
100%
161(36)
w
w a
⨯
+
解析:用铂做电极电解饱和Na2SO4溶液,实质上电解水,因水电解时分解成氢气和氧气,
因而溶液中有晶体Na2SO4·10H2O析出,析出来的晶体和电解消耗掉的水为原饱和溶液的一
部分,由此可确定C 选项符合题意。
【随堂检测】
1. 原电池的正极和电解池的阴极所发生的反应分别是 ( ) A.氧化、还原 B.还原、氧化 C.氧化、氧化 D.还原、还原
2. 可以将反应Zn+Br2==ZnBr2设计成蓄电池,下列四个电极反应
①Br2+2e-=2Br-②2Br--2e-= Br2 ③Zn-2e-=Zn2+④Zn2++2e-=Zn
其中表示充电时的阳极反应和放电时的负极反应的分别是 ( ) A.②③ B.②① C.③① D.④①
3. 在铁制品上镀一定厚度的锌层,以下方案设计正确的是 ( ) A.锌做阳极,镀件做阴极,溶液中含有锌离子
B.铂做阴极,镀件做阳极,溶液中含有锌离子
C.铁做阳极,镀件做阴极,溶液中含有亚铁离子
D.锌做阴极,镀件做阳极,溶液中含有锌离子
4. 在电解水制取H2和O2时,为了增强导电性,常常要加入一些电解质,最好选用下列
物质中 ( )
A.NaOH B.HCl C.NaCl D.CuSO4
5. 由铝、铁、铜和稀硫酸,可以组成原电池的种数是 ( )
A.2种
B.3种
C.4种
D.6种
6. 用铂电极电解CuSO4溶液,当c(Cu2+)降至原来的一半时停止通电,则加入下面物质能
使溶液恢复成原来浓度的是 ( )
A.无水CuSO4
B.CuO
C.Cu(OH)2
D.CuSO4·5H2O
7. 用Cu电极电解CuSO4溶液时,溶液的pH随时间(t)变化如下图所示。
则曲线与实际情况
相符的是 ( )
A B C D
8. 右图中x 、y 分别是直流电源的两极,通电后发现a 极板质量增加,b 极板处有无色无臭气体放出,符合这一情况的是 ( )
9、已知铅蓄电池在放电时起原电池的作用,充电时起电解
池的作用,铅蓄电池在放电和充电时发生的化学反应可用下式表示Pb + PbO2 + 2H2SO4 2PbSO4
+ 2H2O ,据此判断下列叙述中正确的是
( )
A .放电时的正极反应式:Pb + SO42--2e -==PbSO4
B .充电时的阳极反应式:PbSO4 +2H2O -2e -==PbO2 + 4H++SO42-
C .用铅蓄电池做电源电解AgNO3溶液,阳极放出1.6g 气体时电池内部消耗H2SO4 0.4mol
D .充电时,要使0.606 Kg PbSO4变为Pb 和PbO2需要通过4mol 电子
10. 采用惰性电极从NO3-、SO42-、H+、Cu2+、Ba2+、Ag+、Cl --等离子中,选出适当的离子组成电解质,对其溶液进行电解:
(1)两极分别放出H2和O2时,电解质的化学式可能为_____________________;
(2)若阴极析出金属,阳极放出O2,电解质的化学式可能是_____________________
(3)两极分别放出气体,且体积比为1:1,电解质的化学式可能是_____________________
11. 右图中电极a 、b 分别为Ag 电极和Pt 电极,电极c 、d 都是石墨电极。
通电一段时间后,在c 、d 两极上共收集到336mL(标准状态)气体。
回答:
(1)直流电源中,M 为______________极。
(2)Pt 电极上生成的物质是_______ ,其质量为_______ g 。
(3)电源输出的电子,其物质的量与电极b 、c 、d 分 放电
充电
7 7 7 7
别生成的物质的物质的量之比为_____ ∶_____ ∶_____ 。
H2SO4溶液的浓度_______ ,H2SO4溶液的pH_______ 。
(4)AgNO3溶液的浓度(填增大、减小或不变。
下同)_______,AgNO3溶液的pH_______ ,12. 由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2
实验可以制得白色的纯净的Fe(OH)2
(1)a电极材料应为________ ,电极反应式为_____________。
(2)电解液C可以是_____________(填编号)
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2
(3)d为苯,其作用是__________________________
在加入苯之前对C应作何简单处理_____________。
(4)为了在较短时间内看到白色沉淀,可采取的措施是_____________。
A.该用稀硫酸作电解液 B.适当增大电源电压
C.适当减小两电极间的距离 D.适当降低电解液的温度
(5)若C中用Na2SO4溶液,当电解一段时间看到白色Fe(OH)2沉淀后,再反接电源电解,除了电极上看到气泡外,混合物中另一明显现象为__________________________。
《电解池》导学案答案
1-6BCDCDD
7.【答案】2H++e-=H2↑Cu2++2e-=Cu 2H++2e-=H2↑ D>A>B>C 9.答案:(1)Fe+2H+===Fe2++H2↑
(2)正2H++2e-===H2↑增大负Fe-2e-===Fe2+
(3)Zn Zn+2H+===Zn2++H2↑Zn不断溶解,Fe极上有气体析出
(4)另一电极材料的活泼性
8.(1)不同
(2)Al为负极:Al-3e-=Al3+,石墨为正极:2H++2e-=H2↑,2Al+6H+=2Al3++3H2↑
(3)Al作负极,因为Al能与NaOH溶液反应而Mg不能,Al+4OH--3e-=AlO-2+2H2O
(4)实验5中由于Al在浓硝酸中发生钝化,所以Zn为负极
(5)与另一电极材料的活泼性、电解质溶液的酸碱性以及电解质溶液的氧化性强弱等因素有关。
电解池【参考答案】
1.D
2.A
3.A
4.A
5.B
6.B
7.D
8.A
9.B
10.(1)H2SO4 HNO3 Ba(NO3)2 (2)Cu(NO3)2 CuSO4 AgNO3 (3)HCl BaCl2
11.(1)正 (2)Ag 2.16 (3)2 、0.5、1 (4)不变不变增大减小
12.(1)铁 Fe – 2e- = Fe2+ (2)BC (3)液封,防止Fe(OH)2被氧化;加热煮沸(4)BC (5)白色沉淀迅速变成灰绿色,最后变成红色。