有机化学课件 - 第二、三章烷烯炔二烯
- 格式:ppt
- 大小:3.05 MB
- 文档页数:106

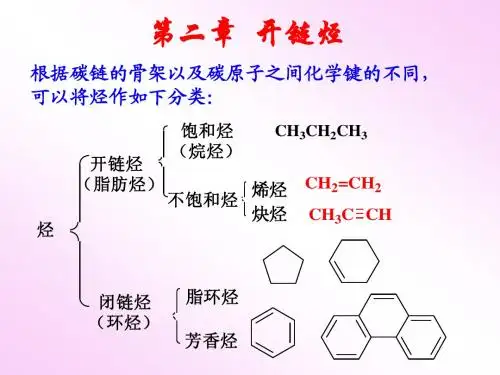

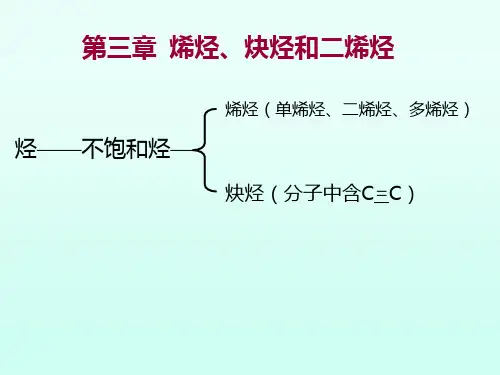
第三章烯烃、炔烃和二烯烃第一节烯烃和炔烃单烯烃是指分子中含有一个C=C的不饱和开链烃,简称烯烃.通式为C n H2n。
炔烃是含有(triple bond) 的不饱和开链烃。
炔烃比碳原子数目相同的单烯烃少两个氢原子,通式CnH2n-2。
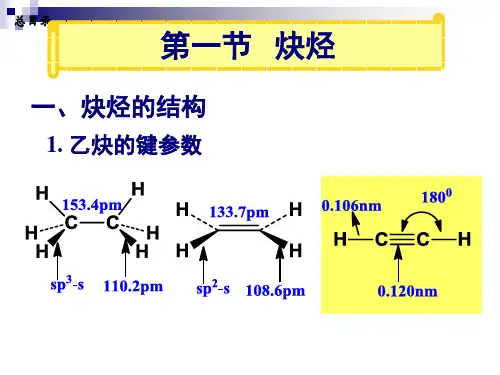
一、烯烃和炔烃的结构乙烯是最简单的烯烃, 乙炔是最简单的炔烃,现已乙烯和乙炔为例来讨论烯烃和炔烃的结构。
(一)乙烯的结构分子式为C2H4,构造式H2C=CH2,含有一个双键C=C,是由一个σ 键和一个π 键构成。
现代物理方法证明,乙烯分子的所有原子都在同一平面上,每个碳原子只和三个原子相连.杂化轨道理论根据这些事实,设想碳原子成键时,由一个s轨道和两个p轨道进行杂化,组成三个等同的sp2杂化轨道,sp2轨道对称轴在同一平面上, 彼此成1200角.此外,还剩下一个2p轨道,它的对称轴垂直于sp2轨道所在的平面。
乙烯:C-C σ键4C-H σ键在乙烯分子中,两个碳原子各以一个sp2轨道重叠形成一个C-Cσ键,又各以两个sp2轨道和四个氢原子的1s轨道重叠,形成四个C-Hσ键,五个σ键都在同一平面上。
每个碳原子剩下的一个py轨道,它们平行地侧面重叠,便组成新的分子轨道,称为π轨道。
其它烯烃的双键也都是由一个σ键和一个π键组成的。
双键一般用两条短线来表示,如:C=C,但两条短线含义不同,一条代表σ键,另一条代表π 键。
π键重叠程度比σ键小,不如σ键稳定,比较容易破裂。
(二)乙炔的结构乙炔的分子式是C2H2,构造式H-C≡C-C,碳原子为sp 杂化。
两个sp杂化轨道向碳原子核的两边伸展,它们的对称轴在一条直线上,互成180°。
在乙炔分子中,两个碳原子各以一个sp轨道互相重叠,形成一个C-Cσ键,每个碳原子又各以一个sp轨道分别与一个氢原子的1s轨道重叠形成C-Hσ键。
此外,每个碳原子还有两个互相垂直的未杂化的p轨道(px,py),它们与另一碳的两个p轨道两两相互侧面重叠形成两个互相垂直的π键。



烯烃 炔烃 二烯烃§2炔 烃§3二烯烃1烯烃§1.1烯烃的结构§1.2烯烃的异构现象§1.3烯烃的化学性质平面分子:双键碳原子的sp2杂化sp120碳原子的CH 3-CH 2-CH=CH 2 、CH 3-CH =CH-CH 3CH 3-CH-CH 2-CH=CH 2 、CH 3-CH 2-CH-CH=CH 2CH 3CH 3包括① 碳架异构③ 顺反异构(几何异构)② 位置异构§1.2 烯烃的异构现象顺反异构的命名HC CCH3顺(相同的原子或基团在ab(大CH 3CH CH (E )-3-211烯烃§1.1烯烃的结构§1.2烯烃的异构现象§1.3烯烃的化学性质一、1. 催化加氢(还原)反应常用催化剂:C H22. 亲电加成反应(1(2)与卤化氢加成(3) 与水加成(酸催化)CH(4)与含氧无机酸CH3CH=CH与次卤酸加成(C C二、氧化反应1. 与高锰酸钾作用① 温和氧化② 强烈氧化CH 2CH =R 1HHC HRC HR1C R2RCH Mechanism: RORORCH( RCH RCHCHCH CHCH 3CH=CH 2 + Br 2 CH 2BrCH=CH 2气相,h υ or 500o C反应机理Br 2 2Br ∙Br ∙ + CH 3CH=CH 2 ∙ CH 2CH=CH 2 + HBr ∙ CH 2CH=CH 2 + Br 2 CH 2BrCH=CH 2 + Br ∙h υ or 500o C五、聚合反应 n H2C= CH2 炔烃§2.1炔烃的结构§2.2 炔烃的化学性质180H — C C — H乙炔结构模型乙炔分子的形成2炔烃§2.1炔烃的结构§2.2 炔烃的化学性质一、加成反应1. 催化加氢— C C —CH3CH=CHCH2. 亲电加成①与卤素加成— C C —②与卤化氢加成H-C C-HHC C-CH③水合反应HC≡CH + H-OH [ CH二. 氧化反应三键RCRC三. 炔淦的生成HC≡CH + AgNO RC≡CH + Cu2 = CH —X ..δ-+CH 2 = CH —CH 2 = CH —CH +共轭体系类型CH 2 = CH CH = CH ++CH 2 CH = O ++共轭体系及共轭效应CH2=CHCH=CH反应历程:H 2C = CH H +δ-+CH 3CH +。