部分酮和醛类溶剂理化特征表
- 格式:doc
- 大小:37.50 KB
- 文档页数:1

常用77种溶剂的理化性质简表2007年07月08日星期日下午 02:05溶剂名沸点溶解性毒性*液氨 -33.35℃ 特殊溶解性:能溶解碱金属和碱土金属剧毒性、腐蚀性液态二氧化硫 -10.08 溶解胺、醚、醇苯酚、有机酸、芳香烃、溴、二硫化碳,多数饱和烃不溶剧毒*甲胺 -6.3 是多数有机物和无机物的优良溶剂,液态甲胺与水、醚、苯、丙酮、低级醇混溶,其盐酸盐易溶于水,不溶于醇、醚、酮、氯仿、乙酸乙酯中等毒性,易燃二甲胺 7.4 是有机物和无机物的优良溶剂,溶于水、低级醇、醚、低极性溶剂强烈刺激性石油醚不溶于水,与丙酮、乙醚、乙酸乙酯、苯、氯仿及甲醇以上高级醇混溶与低级烷相似*乙醚 34.6 微溶于水,易溶与盐酸.与醇、醚、石油醚、苯、氯仿等多数有机溶剂混溶麻醉性戊烷 36.1 与乙醇、乙醚等多数有机溶剂混溶低毒性二氯甲烷 39.75 与醇、醚、氯仿、苯、二硫化碳等有机溶剂混溶低毒,麻醉性强*二硫化碳 46.23 微溶于水,与多种有机溶剂混溶麻醉性,强刺激性*溶剂石油脑与乙醇、丙酮、戊醇混溶较其他石油系溶剂大*丙酮 56.12 与水、醇、醚、烃混溶低毒,类乙醇,但较大1,1-二氯乙烷 57.28 与醇、醚等大多数有机溶剂混溶低毒、局部刺激性*氯仿 61.15 与乙醇、乙醚、石油醚、卤代烃、四氯化碳、二硫化碳等混溶中等毒性,强麻醉性*甲醇 64.5 与水、乙醚、醇、酯、卤代烃、苯、酮混溶中等毒性,麻醉性,四氢呋喃 66 优良溶剂,与水混溶,很好的溶解乙醇、乙醚、脂肪烃、芳香烃、氯化烃吸入微毒,经口低毒己烷 68.7 甲醇部分溶解,比乙醇高的醇、醚丙酮、氯仿混溶低毒。
麻醉性,刺激性三氟代乙酸 71.78 与水,乙醇,乙醚,丙酮,苯,四氯化碳,己烷混溶,溶解多种脂肪族,芳香族化合物1,1,1-三氯乙烷 74.0 与丙酮、、甲醇、乙醚、苯、四氯化碳等有机溶剂混溶低毒类溶剂*四氯化碳 76.75 与醇、醚、石油醚、石油脑、冰醋酸、二硫化碳、氯代烃混溶氯代甲烷中,毒性最强*乙酸乙酯 77.112 与醇、醚、氯仿、丙酮、苯等大多数有机溶剂溶解,能溶解某些金属盐低毒,麻醉性*乙醇 78.3 与水、乙醚、氯仿、酯、烃类衍生物等有机溶剂混溶微毒类,麻醉性丁酮 79.64 与丙酮相似,与醇、醚、苯等大多数有机溶剂混溶低毒,毒性强于丙酮*苯 80.10 难溶于水,与甘油、乙二醇、乙醇、氯仿、乙醚、、四氯化碳、二硫化碳、丙酮、甲苯、二甲苯、冰醋酸、脂肪烃等大多有机物混溶强烈毒性*环己烷 80.72 与乙醇、高级醇、醚、丙酮、烃、氯代烃、高级脂肪酸、胺类混溶低毒,中枢抑制作用乙睛 81.60 与水、甲醇、乙酸甲酯、乙酸乙酯、丙酮、醚、氯仿、四氯化碳、氯乙烯及各种不饱和烃混溶,但是不与饱和烃混溶中等毒性,大量吸入蒸气,引起急性中毒异丙醇 82.40 与乙醇、乙醚、氯仿、水混溶微毒,类似乙醇1,2-二氯乙烷 83.48 与乙醇、乙醚、氯仿、四氯化碳等多种有机溶剂混溶高毒性、致癌乙二醇二甲醚 85.2 溶于水,与醇、醚、酮、酯、烃、氯代烃等多种有机溶剂混溶。


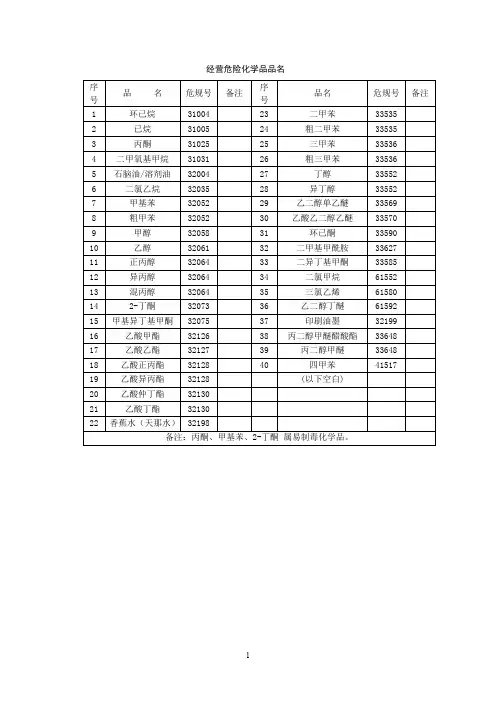
经营危险化学品品名
表1 环己烷理化性质及危险特性
表2 己烷理化性质及危险特性
表3 丙酮理化性质及危险特性
表4 二甲氧基甲烷(甲缩醛)理化性质及危险特性
表5 石脑油理化性质及危险特性
表6 1,1-二氯乙烷理化性质及危险特性
表7 甲基苯理化特性及危险特性
表8 甲醇理化特性及危险特性
表9 乙醇理化特性及危险特性
表10 1-丙醇理化特性及危险特性
表12 2-丁酮理化特性及危险特性
表13 甲基异丁基甲酮理化特性及危险特性
表14 乙酸甲酯理化特性及危险特性
表15 乙酸乙酯理化特性及危险特性
表16 乙酸正丙酯理化性质及危险特性
表17 乙酸异丙酯理化性质及危险特性
表18 乙酸仲丁酯理化特性及危险特性
表19 乙酸丁酯理化特性及危险特性
表20 硝基漆稀释剂理化特性及危险特性
表21 1,2-二甲苯理化性质及危险特性
表22 1,2,4-三甲苯理化性质及危险特性
表23 正丁醇理化性质及危险特性
表24 异丁醇理化性质及危险特性
表26 乙酸乙二醇乙醚理化性质及危险特性
表27 环己酮理化特性及危险特性
表28 N,N-二甲基甲酰胺理化特性及危险特性
表29 二异丁基甲酮理化性质及危险特性
表30 二氯甲烷理化性质及危险特性
表31 三氯乙烯理化性质及危险特性
表32 2-丁氧基二醇理化特性及危险特性。


醛类与酮类化合物的性质与应用实验化学实验是化学学习过程中不可或缺的一部分,通过实验我们可以深入了解化合物的性质与应用。
本文将介绍醛类与酮类化合物的性质与应用,并结合实验进行具体探究。
一、醛类与酮类化合物的性质醛类与酮类化合物都是有机化合物的重要类别,它们的共同特点是含有碳氧双键。
1. 醛类化合物的性质醛类化合物的通式为RCHO,其中R可为烷基、烯基或芳香基。
醛类化合物具有以下性质:(1)氧化性:醛类化合物易被氧化为相应的羧酸,在强氧化剂的作用下能发生氧化反应。
(2)还原性:醛类化合物在还原剂的作用下能够被还原为相应的醇。
(3)合成性:醛类化合物可以通过酸催化下的氧化反应或氧化还原反应等途径合成。
2. 酮类化合物的性质酮类化合物的通式为RCOR',其中R和R'可分别为烷基、烯基、芳香基等。
酮类化合物具有以下性质:(1)稳定性:酮类化合物比醛类化合物更稳定,不容易发生氧化反应。
(2)溶解性:酮类化合物在水中的溶解性相对较差,但溶解于有机溶剂。
(3)活性:酮类化合物可通过还原反应将酮基还原为醇基。
二、醛类与酮类化合物的应用实验通过实验,我们可以更加直观地了解醛类与酮类化合物的性质与应用。
下面将介绍两个常见的实验案例。
1. 醛类化合物的氧化反应实验实验目的:探究醛类化合物的氧化性质。
实验步骤:(1)准备试剂:取适量的甲醛(HCHO)溶液和硫酸铜溶液。
(2)将甲醛溶液倒入试管中,加入硫酸铜溶液。
(3)观察并记录结果。
实验结果:甲醛溶液在硫酸铜溶液的作用下发生氧化反应,产生蓝色碳酸铜络合物,观察到溶液颜色的变化。
2. 酮类化合物的还原反应实验实验目的:探究酮类化合物的还原性质。
实验步骤:(1)准备试剂:取适量的丙酮(CH3-CO-CH3)溶液和氢气气体。
(2)将丙酮溶液倒入反应瓶中。
(3)通过导管引入氢气气体。
(4)观察并记录结果。
实验结果:丙酮溶液在氢气气体的还原作用下发生反应,观察到溶液逐渐变为无色,生成丙醇。

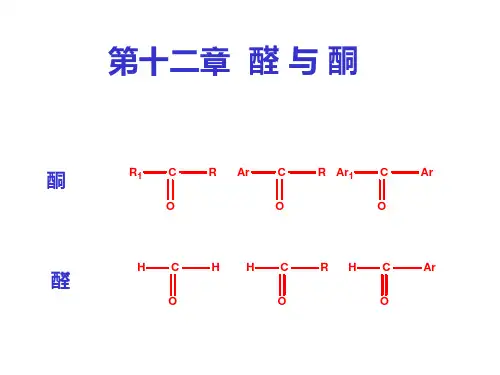
有机化学基础知识点整理酮与醛的性质与反应【有机化学基础知识点整理】酮与醛的性质与反应一、酮与醛的定义酮和醛都是有机化合物中的一类功能团,酮的通式为R1-CO-R2,醛的通式为R-CO-H。
它们在化学结构上都含有一个碳氧双键,而酮分子中的碳氧双键是接在碳链中的,醛分子中的碳氧双键则是接在碳链的末端。
二、酮与醛的性质1. 沸点和熔点:酮和醛的沸点和熔点相对较高,这是由于它们分子中的极性碳氧双键以及分子间的氢键相互作用所致。
2. 溶解性:酮与醛通常可溶于极性溶剂,如水、醇等。
酮是非常好的溶剂,可溶于一些有机溶剂,如醚、醇等。
而醛则与水反应生成相应的醇,因此溶解性较差。
3. 反应活性:由于酮和醛分子中碳氧双键的存在,它们具有一定的反应活性。
酮中的羰基碳亲电性较强,易于发生亲电取代反应;而醛中的羰基碳和羰基氧都具有亲电性,容易发生亲核加成反应。
4. 氧化性和还原性:酮具有相对较低的氧化性和还原性。
醛则比酮更容易被氧化,可以发生醛的氧化反应生成相应的羧酸。
而酮的羰基碳不能够被氧化。
三、酮与醛的反应1. 加成反应:酮和醛都可以与亲核试剂发生加成反应。
例如,可以与氨或胺发生加成反应,生成相应的亚胺或胺;与水或醇发生加成反应,生成相应的醇。
酮和醛与罗丹明B等亲核试剂的加成反应可用于化学定量分析中。
2. 缩合反应:酮和醛可以与亲核试剂发生缩合反应,生成相应的α-羟基化合物。
例如,与氨或胺发生缩合反应,生成相应的肼;与含氢试剂(如硼氢化钠)发生缩合反应,生成相应的醇。
3. 氧化反应:醛具有较强的氧化性,可以与氧和氧化性试剂反应,生成相应的羧酸。
常用的氧化性试剂有高锰酸钾、过氧化氢等。
4. 还原反应:酮可以通过还原反应转化为相应的醇。
常用的还原试剂有金属钠、金属铝等。
四、应用领域酮和醛广泛应用于医药、农药、染料、香料、合成材料等领域。
例如,酮类化合物多具有良好的生物活性,是许多重要药物的结构骨架;醛类化合物常用于染料和香料的合成。

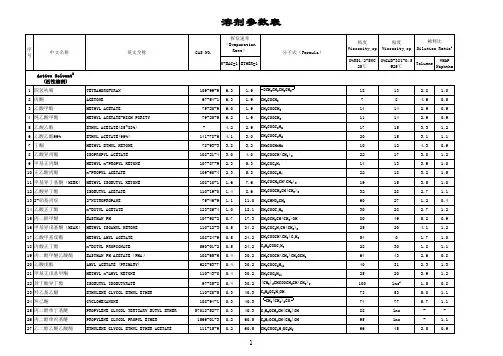
常用溶剂极性、粘度、密度、紫外吸收、毒性和互溶性表
有机溶剂是指在生活和生产中广泛应用,分子量不大,常温下呈液态,能够溶解多种物质的一大类有机化合物。
有机溶剂的种类较多,按其化学结构可分为以下10大类:
①芳香烃类:甲苯、苯、二甲苯等;
②脂肪烃类:戊烷、己烷、辛烷等;
③脂环烃类:环己烷、环己酮、甲苯环己酮等;
④酮类:丙酮、甲基丁酮、甲基异丁酮等;
⑤醇类:甲醇、乙醇、异丙醇等;
⑥醚类:乙醚、环氧丙烷等;
⑦酯类:醋酸甲酯、醋酸乙酯、醋酸丙酯等;
⑧卤化烃类:氯苯、二氯甲烷、二氯苯等;
⑨二醇衍生物:乙二醇单甲醚、乙二醇单乙醚、乙二醇单丁醚等;
⑩其他:乙腈、吡啶、苯酚等。
虽然有机溶剂的种类已达3万多种,不过有机/生物/分析/药学/食品等实验室平时用到的有机溶剂种类并不太多。
笔者结合实际情况,整理了几十种常用有机溶剂(下面统计包括水),并对其相对分子极性、粘度、沸点、相对密度、紫外、毒性进行了简单梳理,分享给各位同仁,希望能够方便大家查阅。
有机溶剂互相之间大多可以互溶,但这也并非绝对。
很多人会对一些常见溶剂的互溶性判断失误,或者对一些溶剂的
互溶性并不确定,例如乙腈能否溶于水?乙腈跟正庚烷是否互溶?等等诸如此类问题。
为了更好的让大家及时准确判断常见溶剂的互溶性,笔者总结梳理了以下表格,仅供大家学习交流之用。
熟悉了解常见溶剂的互溶性问题,对我们在实际生产和科研生活中具有很好的现实指导意义。
第十一章醛和酮教学目的:能正确命名醛、酮,掌握羰基亲核加成反应的历程和影响反应速度的因素,了解其在分离、鉴别、有机合成中的应用。
掌握醛、酮的主要化学性质及其在分离、鉴别、有机合成中的应用。
教学重点:羰基亲核加成反应,醛、酮的化学性质教学难点:羰基亲核加成反应历程。
第一节醛、酮的分类,同分异构和命名一、分类根据烃基的不同可以分为脂肪醛、酮和芳香醛、酮。
脂肪醛CH3CH2CHO 脂肪酮CH3COCH3脂环醛CHO脂环酮O=芳香醛CHO芳香酮COCH3根据烃基是否含有重键又可以分为饱和醛、酮和不饱和醛、酮。
不饱和醛CH3CH=CHCHO不饱和酮CH3CH=CHCOCH3根据羰基的个数可以分为一元醛、酮和多元醛、酮。
二元醛CH2CHOCH2CHO二元酮CH3CH2COCH2COCH3二、同分异构现象醛的同分异构---碳链异构引起。
酮的同分异构---碳链异构、碳基位置异构。
同碳数饱和一元醛酮,分子式CnH 2n O ,互为同分异构:三、命名1. 系统命名法:(1)选择含羰基最长碳链作主链,称为某醛或某酮;(2)由于醛基是一价原子团,必在链端,命名时不必用数字标明其位置。
酮基的位置则需用数字标明,写在“某酮”之前,并用数字标明侧链所在的位置及个数,写在母体名称之前。
例如:2- 甲基丙醛 2- 苯基丙醛3-甲基-6-庚炔醛C 6H 5CHCHOCH 37HCCCH 2CH 2CHCH 2CHOCH 3654321CH 3CHCHOCH 3CH 3COCH 3丙酮CH 3COCH 2CH 3丁酮CH 3CO(CH 2)CH 32-己酮CH 3COCH 2COCH 2CH 32,4-己二酮COCH 2CH 31-苯-1-乙酮(苯乙酮)1-环己基-1-丙酮COCH 32. 普通命名法醛的命名与醇的习惯命名法相似,称某醛;脂肪酮则按酮基所连接的两个烃基而称为某(基)某(基)酮。
例如:CH 3CHO 乙醛 CH 3CH (CH 3)CHO 异丁醛甲基乙基酮甲基苯基酮(1-苯基-1-乙酮)CH 3C OCH 3C 2H 5C O另外,醛、酮命名时习惯上还采用希腊字母α、β、γ等,α碳指与醛基或酮基直接相连的碳原子。