药物化学-02-第二章_新药研究与开发概论
- 格式:pdf
- 大小:67.31 KB
- 文档页数:11
第二章新药研究与开发概论药物的创制,就是构建具有预期药理活性的新药(新化学实体, New Chemical Entity)。
其特点就是: 周期长,风险大,回报丰厚。
据统计:13年时间,3亿美元。
这就需要对此工程整体有充分理智的认识,使整个研究工作建立在比较合理的基础之上,提高成功的概率,尽可能地降低不必要的财力、人力和物力的耗费。
涉及药学及生物学科、化学学科、临床医学等多个领域。
只有将这一系统工程中的各个环节统筹协调,合理安拍,才能使新药的研究和开发顺利进行,获得安全、有效、可控的药品,为人民的健康服务.随着科学的发展,新药的创制也有过去的随机偶然发现,逐渐走向系统化,甚至可以通过药物分子设计(Molecular drug design)来简化和缩短药物开发过程。
第一节新药开发的基本途径与方法(the Approuch and Methods in Drug Research)•研究阶段和开发阶段:•有重叠,但各有侧重。
•研究阶段强调学术和技术意义。
开发阶段则强调市场价值和经济意义。
•新药的研究----新化学实体(NCE)•新药的开发----药物•新药的研究和开发的关键是发现新药,也就是要发现结构新颖的,有自主知识产权保护的新化学实体(NCE),这是一个创造性和探索性的研究工作,需要多学科的相互配合,其中包括药学、生物学科、化学学科和临床医学等学科。
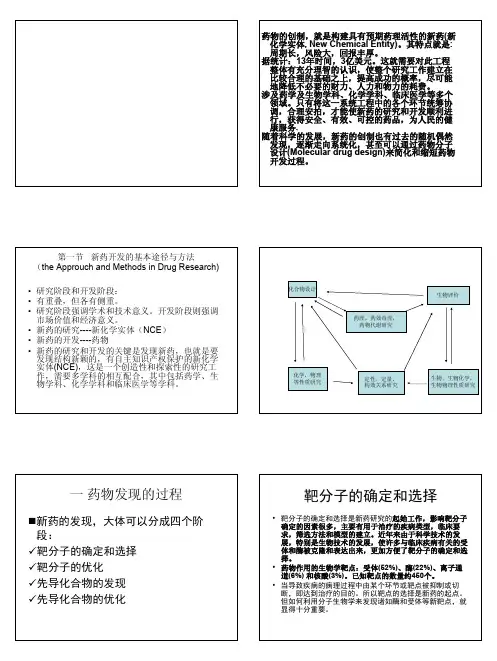
化合物设计药理,药效毒理,药物代谢研究化学,物理等性质研究定性,定量,构效关系研究生物,生物化学,生物物理性质研究生物评价药物研究中中各研究分支学科之间的相互作用和关系一药物发现的过程新药的发现,大体可以分成四个阶段:9靶分子的确定和选择9靶分子的优化9先导化合物的发现9先导化合物的优化靶分子的确定和选择•靶分子的确定和选择是新药研究的起始工作,影响靶分子确定的因素很多,主要有用于治疗的疾病类型,临床要求,筛选方法和模型的建立。
近年来由于科学技术的发展,特别是生物技术的发展,使许多与临床疾病有关的受体和酶被克隆和表达出来,更加方便了靶分子的确定和选择。


第2章新药研究的基本原理与方法选择题每题1分
第2章新药研究的基本原理与方法填空题1每空1分
填空题2 每空1分
填空题3每空1分
第2章新药研究的基本原理与方法概念题每题2分
第2章新药研究的基本原理与方法问答与讨论题每题6分
前列腺素E2(PGE2)为结晶固体,但室温稳定期短,几个月内可迅速分解,不稳定因素是C-11位羟基易在酸性条件下,发生消除反应生成前列腺素A2(PGA 2) 这也是其口服无效的主因。
请设计两种较为稳定的衍生物。
举例说明根据受体结构进行药物分子设计
HIV蛋白水解酶催化机理
根据催化机理设计的HIV蛋白水解酶抑制剂
第2章新药研究的基本原理与方法合成/代谢/反应/设计题每题6分。
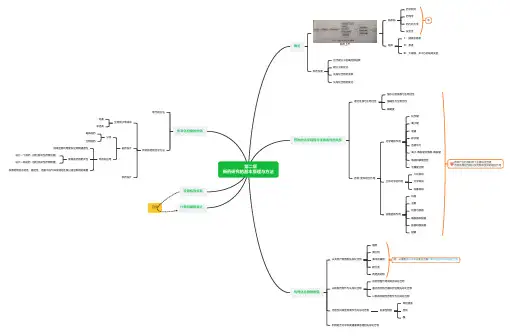
第二章新药研究的基本原理与方法概论新药上市临床前药学研究药效学药代动力学安全性等临床Ⅰ:健康志愿者Ⅱ:患者Ⅲ:大规模、多中心的临床实验新药发现治疗靶分子的确定和选择靶分子的优化先导化合物的发现先导化合物的优化药物的化学结构与生物活性的关系理化性质与生物活性脂水分配系数与生物活性酸碱性与生物活性解离度药物-受体相互作用化学键的作用化学键离子键氢键疏水键范德华力离子-偶极键及偶极-偶极键电荷转移复合物金属配合物立体化学的作用几何异构光学异构构象异构官能团的作用烷基卤素羟基与巯基磺酸基和羧基氨基和酰胺基醚键药物产生药效的两个主要决定因素:药物的理化性质以及药物和受体的相互作用先导化合物的发现从天然产物得到先导化合物植物微生物海洋动植物爬行类两栖类动物例:从植物黄花蒿中分离出含有过氧桥的倍半萜内酯化合物以现有药物作为先导化合物由药物副作用发现先导化合物通过药物的代谢研究发现先导化合物以现有突破性药物作为先导化合物用活性内源性物质作为先导化合物内源性物质神经递质受体酶利用组合化学和高通量筛选得到先导化合物先导化合物的优化现代的方法传统的药物化学方法生物电子等排体经典非经典前药设计分类载体前药生物前药目的和应用提高生物利用度和生物膜通透性提高前药的靶向性设计一个前药(部位指向性药物运输)设计一种前药(部位特异性药物释放)改善药物的水溶性、稳定性、克服不良气味或理化性质以适应制剂的需要软药设计定量构效关系计算机辅助设计自学。







新药研发与药物化学研究第一章研发背景与意义随着医学科技的不断发展,新药研发和药物化学研究成为当今医药领域的热门话题。
新药的研发对于提高人类的健康水平、应对新的疾病、解决医学难题具有重大意义。
而药物化学研究则是新药研发的核心,通过深入了解和研究药物分子的化学性质和构造,能够加速新药开发的进程。
第二章药物化学研究的基本原理药物化学研究的基本原理是通过合理设计、合成和改良药物分子的结构,来寻找具有良好活性、选择性和安全性的新药。
在药物化学研究中,化学家运用有机合成化学、分析化学、物理化学等相关知识和技术,结合药物发现中的高通量筛选、计算化学和化学生物学等方法,对药物分子的活性、引入改进和优化进行全面的研究。
第三章药物化学研究的关键技术药物化学研究依赖于多种关键技术的支持。
其中,合理设计和合成药物分子的能力是首要考虑的技术,需要化学家具备较强的有机合成能力和结构优化思路。
此外,了解分子识别原理和药物靶点的结构也是必要的,通过对靶点结构的分析和模拟,可以为药物设计和改良提供重要信息。
此外,高通量筛选技术、计算化学方法和化学生物学技术也在药物化学研究中得到广泛应用。
第四章药物化学研究的重要应用领域药物化学研究在多个领域都有重要的应用。
首先,药物设计与合成是探索新药领域的重点,通过合理设计和合成药物分子,可以开发出具有多种治疗作用的新药。
其次,药物改良和优化可以提高现有药物的疗效和安全性,减少副作用。
药物化学对药物代谢和药代动力学的研究也能为药物研发提供重要参考。
此外,药物化学研究还广泛应用于药物分子标记和探针的开发、药物传递系统的设计等领域。
第五章新药研发的挑战和前景新药研发面临许多挑战,包括药物发现和设计的复杂性、相关法规的不断变化、临床试验的安全性和效果评估等。
但随着技术和知识的不断进步,新药研发的前景也越来越广阔。
药物化学研究将继续在新药研发中发挥核心作用,通过不断创新和提高技术水平,为人类带来更多有效、安全的药物,促进医药事业的发展。
新药研究与开发概论
新药研究与开发的基本概念包括确定研究目标、搜集药物素材、进行
活性筛选、进行药物化学和药理学研究、进行临床试验和评价新药的安全
性和疗效。
新药的研发过程一般可以分为药物发现、药物开发和相关临床
试验三个阶段。
第一阶段是药物发现,其目的是寻找具有治疗潜力的新化合物。
在这
一阶段,研究人员需要通过对疾病机制的了解和分子生物学技术的应用,
确定新药的靶标和搜集药物素材。
搜集药物素材可以通过天然产物、化学
合成、高通量筛选等方法进行。
活性筛选是药物发现的关键步骤,通过对
药物素材进行测试,筛选出具有良好治疗潜力的化合物。
第二阶段是药物开发,其目标是通过药物化学和药理学研究,改进和
优化新药的性质和活性。
药物化学是指对新药的分子结构进行修饰和合成,以增加其化学稳定性和药物代谢特性。
药理学研究是指对新药的药物效应、毒性和代谢途径等进行评价和研究,以确保其安全性和疗效。
第三阶段是相关临床试验,其目标是评价新药的安全性和疗效。
临床
试验是新药研究与开发的最后关键环节,也是新药上市的前提条件。
临床
试验分为三个阶段:第一阶段是安全性评价,主要针对健康志愿者,了解
药物的安全性和耐受性;第二阶段是疗效评价,主要针对患者,评价新药
的疗效和副作用;第三阶段是大样本临床试验,主要针对大规模患者群体,验证新药的疗效和安全性。
总之,新药研究与开发是一项综合性的工作,包括药物发现、药物开
发和相关临床试验三个阶段。
通过科学的方法和技术,可以不断探索和开
发出具有治疗潜力的新药,为人类的健康和疾病治疗作出重要贡献。
药物化学第一部分;绪论及药学基本概念6,2绪论第一章:新药研究与开发概论第二章:药物设计的基本原理和方法第三章:药物的结构和生物活性第四章:药物代谢第二部分:中枢神经系统用药9, 6第五章:镇定催眠药和抗癫痫药第六章:精神神经病治疗药第七章:神经退行性疾病治疗药第八章:镇痛药第三部分:外周神经用药10,8第九章:局部麻醉药第十章:拟胆碱和抗胆碱药第十一章:组胺受体拮抗剂及抗过敏和抗溃疡药第十二章:作用于肾上腺能受体的药物第四部分;与血有关疾病用药7, 4第十三章:抗高血压药和利尿药第十四章:心脏疾病药物和血脂调节药第十六章:降血糖药和骨质疏松治疗药第五部分:抗病毒及抗菌及抗寄生虫药9,7第十七章:合成抗菌药第十八章:抗病毒药第十九章:抗生素第二十一章:抗寄生虫药第六部分;其他7, 5第十五章:甾体激素药物第二十二章:非甾体抗炎药第二十章:抗肿瘤药第二十三章:维生素药物化学习题第一部分:绪论及药学基本概念 61. 什么是药物?什么是药物化学?药物化学的主要任务?2.什么是先导化合物?发现先导物主要有哪些途径,举出二种从天然产物中发现先导物的例子。
3.什么是前体药物(前药)举例说明。
4.应用前药原理进行化学结构修饰的目的主要有哪些?5.为什么药物的脂水分配系数在一定范围内,才能显示最佳的药效?6.为什么药物的解离度对药效有影响?7.药物分子中电子密度分布是否均匀,对药效有何影响?8.药物分子与受体作用的键合形式主要有哪些?9.立体异构对药效的影响主要包括那些?10.举出至少三个对映异构体的药理活性有显著差异的例子。
11. 什么是药物代谢?举例说明药物代谢所涉及的反应类型。
12. 药物代谢在药物开发中有哪些主要用途?第二部分:中枢神经系统用药91.写出苯二氮卓类的基本结构及化学命名2.地西泮在体内胃肠道发生什么样的化学变化?对其生物利用度有何影响?3.奥沙西泮与地西泮在化学结构上有何区别,如何进行鉴别?4.艾司唑仑化学结构与地西泮有何区别,对活性有何影响?5.写出巴比妥类药物的基本结构,为什么巴比妥酸无活性?6.为什么苯巴比妥显弱酸性,可与碱成盐?7.苯妥英钠属哪种结构类型?写出卡马西平的结构及用途?8.写出抗精神病药物主要结构类型,各举出一例药物。
第二章新药研究与开发概论药物的创制,就是构建具有预期药理活性的新药(新化学实体, New Chemical Entity)。
其特点就是: 周期长,风险大,回报丰厚。
据统计:13年时间,3亿美元。
这就需要对此工程整体有充分理智的认识,使整个研究工作建立在比较合理的基础之上,提高成功的概率,尽可能地降低不必要的财力、人力和物力的耗费。
涉及药学及生物学科、化学学科、临床医学等多个领域。
只有将这一系统工程中的各个环节统筹协调,合理安拍,才能使新药的研究和开发顺利进行,获得安全、有效、可控的药品,为人民的健康服务.随着科学的发展,新药的创制也有过去的随机偶然发现,逐渐走向系统化,甚至可以通过药物分子设计(Molecular drug design)来简化和缩短药物开发过程。
第一节新药开发的基本途径与方法(the Approuch and Methods in Drug Research)•研究阶段和开发阶段:•有重叠,但各有侧重。
•研究阶段强调学术和技术意义。
开发阶段则强调市场价值和经济意义。
•新药的研究----新化学实体(NCE)•新药的开发----药物•新药的研究和开发的关键是发现新药,也就是要发现结构新颖的,有自主知识产权保护的新化学实体(NCE),这是一个创造性和探索性的研究工作,需要多学科的相互配合,其中包括药学、生物学科、化学学科和临床医学等学科。
化合物设计药理,药效毒理,药物代谢研究化学,物理等性质研究定性,定量,构效关系研究生物,生物化学,生物物理性质研究生物评价药物研究中中各研究分支学科之间的相互作用和关系一药物发现的过程新药的发现,大体可以分成四个阶段:9靶分子的确定和选择9靶分子的优化9先导化合物的发现9先导化合物的优化靶分子的确定和选择•靶分子的确定和选择是新药研究的起始工作,影响靶分子确定的因素很多,主要有用于治疗的疾病类型,临床要求,筛选方法和模型的建立。
近年来由于科学技术的发展,特别是生物技术的发展,使许多与临床疾病有关的受体和酶被克隆和表达出来,更加方便了靶分子的确定和选择。
•药物作用的生物学靶点:受体(52%)、酶(22%)、离子通道(6%) 和核酸(3%)。
已知靶点的数量约450个。
•当导致疾病的病理过程中由某个环节或靶点被抑制或切断,即达到治疗的目的。
所以靶点的选择是新药的起点。
但如何利用分子生物学来发现诸如酶和受体等新靶点,就显得十分重要。
靶分子的优化•靶分子的优化是指在确定了所研究的靶分子后,对该靶分子的结构及其与配基的结合部位、结合强度以及所产生的功能等进行的研究。
通过研究要弄清楚酶(或受体)和配基结合后产生功能的强度和持续时间,以及激动剂和拮抗剂之间的活性差别。
靶分子可以发展成为筛选的工具,或用于高通量筛选。
在此基础上还可以研究这些靶分子(多为酶或蛋白)的X-射线单晶衍射,便于开展计算机辅助药物设计。
•以上两个方面是药理学为创制新药所作的必需准备。
剩下的两个环节,则是药物化学的主要任务。
先导化合物的寻找和发现•先导化合物(Lead compound, 又称原型物,或先导物),是通过各种途径或方法得到的具有某种生物活性的化学结构。
先导物未必是好药。
由于活性不很强,药动性质不合理,特异性不强,毒性大,不能作为药用,但为我们提供了可供改造的线索。
•先导化合物的寻找和发现是在对靶分子研究和认识的基础上开展的工作。
在选定靶分子后,接着要寻找对靶分子有较高亲和力,且能产生较高活性和选择性的先导化合物。
亲和力是指配基和酶或受体结合的紧密程度:活性表示配基与靶分子结合后,产生生化或生理响应的能力:而选择性表示配基识别所作用靶分子,而不和其他靶分子产生相互作用的能力。
先导化合物的优化•先导化合物的优化是在确定先导化合物后所展开的进一步研究,对于先导化合物物,不仅要求其具有亲和性;一定的活性和选择性,还应该有较好的生物利用度、化学稳定性,以及对代谢的稳定性。
影响这些特性的是化合物内在的理化性质,开展对先导化合物的结构优化的目的是要为了获得药效最佳、副作用最少的新化学实体。
二新药的开发阶段•前期开发和后期开发•1:前期开发研究:•包括:临床前病理学研究,研究中新药的制备,临床前各类研究,有选择的Ⅰ期临床研究和早期的Ⅱ期临床研究•2:后期开发研究:主要涉及大量的临床研究工作,以及这些临床前及临床中所得到的数据的整理和药物的工艺化过程。
•临床研究ⅠⅡⅢ期,各期研究所解决的问题不同。
•临床研究Ⅰ期:健康的志愿者・不对其疗效进行评价。
•临床研究Ⅱ期:病人.主要是确定试验药品的药效学作用.通过与对照药的比较,了解其治疗价值和安全性:确定新药的适应证及最佳治疗方案,包括剂量、给药途径、给药次数,疗程等:考察新药的不良反应及其危险性。
•临床研究Ⅲ期:随机规范化的管理和要求•药品的生产:GMP(good manufacturing practice)•临床前的实验研究:GLP( good laboratory practice)•临床研究:GCP(good clinic practice)第二节药物合成研究和质量标准•一药物合成与工艺研究•一方面:合适的合成路线来合成化合物•一方面:工艺研究和工艺优化,为工业化大生产做准备OONH 2Cl+FmocHNRCOOHOO H NClO NHFmocRONH NClO ROHNN ClO RR'苯并二氮类化合物库合成的示意图•组合化学:一种新的合成策略OHHONO 2HONH 2HONHCOCH 3NO 2PtNHOHHO HOC OCH 3HOC NOH CH 3工艺研究的根本原则:以最小的消耗,获得最大的效益,但产生最小的污染。
acetaminophen 扑热息痛应称醋氨酚二药品质量和质量标准•(一)药物的质量评定原则:一个理想的药物无疑应疗效好,毒副作用小。
因为任何一个高效低毒的药物,如果质量达不到要求,亦不能用于临床,因此,作为一名药学工作者,必须牢固树立药品质量第一的观点。
•评价一个药物的质量,主要有两个方面:•1.药物的疗效和毒副作用一般疗效好的药物,应在治疗剂量范围内不产生严重的毒性反应,副作用小,不影响疗效。
•2.药物的纯度药物的纯度又称药用纯度或药用规格,它是指药物的纯杂程度,可由药物的性状、物理常数、杂质限量、有效成分的含量、生物活性等多方面来体现。
药物的纯度会影响到药物的疗效和副作用。
药物要能供药用,必须达到一定的质量标准,才能安全有效。
(二)药物的杂质:通常将药物以外的其他化学物质称为杂质。
•药物中杂质来源有两个途径:•1.生产过程引入或产生。
如原料不纯、反应不完全、反应的中间产物或副产物、加入的试剂、制备所用的设备等;•2.由贮存过程中引入。
如保存方法不当,药物受外界条件(空气、日光、湿度、温度等)变化的影响,引起药物发生水解、氧化等化学变化。
(三)药品的质量标准:•我国现行的药品质量标准是国家级标准,即《中华人民共和国药典》•药品只有合格品和不合格品两种,它应以药品质量标准为判断准则,达不到药品质量标准的药品为劣质药品,若生产药品质量标准上没有的药品则为假药。
•1.《中华人民共和国药典》简称《中国药典》,的构成:•分为“一部”和“二部”。
“一部”收载天然药物,化学药物收载于“二部”内。
•2.药典的主要内容有:凡例、正文、附录、中文和英文索引等。
•①凡例:是药典的总说明,它叙述了药典中有关术语的含义及使用时应注意的要点,并对正文和附录的项目、内容等作了说明;•②正文:是药典的主要内容部分,它记载了药品或其制剂的质量标准。
其内容主要包括药品的名称、结构式、分子式与分子量,性状、鉴别、检查、含量测定、类别、剂量、注意事项、规格、贮藏方法及制剂等;•③附录:记载了制剂通则、物理常数测定法、一般杂质检查法、一般鉴别试验法和色谱法、分光光度法、电泳法、电位滴定与永停滴定等多种分析方法通则以及试药、试液、试纸、指示液、缓冲液、标准比色液等的配制、滴定液的配制及标定等。
•3.发展•我国从1953年、1963年、1977年、1985年、1990年、1995年、2000年和2005年已先后出了8版药典。
•4.作用•药典在一定程度上反映了我国药品生产、医疗和科技水平,切合我国的实际国情,对保证药品质量,增进药品疗效和用药安全,促进药品质量的不断提高和药品生产的发展等,均起着重要作用。
三我国新药的分类和管理要求•1984年,《中华人民共和国药品管理法》•1985年《新药审批办法》•现行2001年•2002年《药品注册管理办法》•新药申请是指未曾在中国境内上市销售药品的注册申请。
已上市药品改变剂型,改变给药途径的,仍按照新药进行管理。
除此之外,药品的注册申请还包括对已有国家标准药品的申请。
化学药品的注册分类:¾1未在国内外上市的新药¾2改变给药途径但未在国内外上市销售的制剂¾3已在国外上市销售但尚未在国内上市销售的药品¾4改变上市销售盐类药物的酸根,碱基(或者金属元素),但不改变其药理作用的原料药及其制剂。
¾5改变国内已上市销售的药品的剂型,但不改变销售途径的制剂。
¾6已有国家标准的原料药或者制剂。
申请时还必须按照管理要求提供下述四方面的研究资料•1:综述资料(1-6)•(l)药品名称:•(2)证明性文件:•(3)主题目的与依据;•(4)对主要研究结果的总结及评价:•(5)药品说明书样稿、起草说明及最新参考文献:•(6)包装、标签设计样稿。
•2;药学研究资料(7-15)•(7)药学研究资料综述:•(8)原料药生产工艺的研究资料及文献资料,制剂处方及工艺的研究资料及文献资料:•(9)确证化学结构或者组分的试验资料及文献资料•(10)质量研究工作的试验资料及文献资料:•(11)药品标准草案及起草说明,并提供标准品或者对照品•(12)样品的检验报告书:•(13)辅料的来源及质量标准;•(14)药物稳定性研究的试验资料及文献资料:•(15)直接接触药品的包装材料和容器的选择依据及质量标准。
•3:药理,毒理研究资料(16-27)•(16)药理毒理研究资料综述;•(17)主要药效学试验资料及文献资料;•(18) –般药理研究的试验资料及文献资料:•(19)急性毒性试验资料及文献资料;•(20)长期毒性试验资料及文献资料;•(21)特殊安全性试验研究资料和文献资料;•(22)复方制剂中多种成分的药效、毒性、药代动力学相互影响的试验资料及文献资料:•(23)致突变试验资料及文献资料;•(24)生殖毒性试验资料及文献资料:•(25)致癌试验资料及文献资料;•(26)依赖性试验资料及文献资料;•(27)动物药代动力学试验资料及文献资料。
•4:临床研究资料(28-32)•(28)国内外相关的临床研究资料综述;•(29)临床研究计划及研究方案:•(30)临床研究者手册;•(31)知情同意书样稿,伦理委员会批准件;•(32)临床研究报告。