新药研究与开发概论PPT课件
- 格式:ppt
- 大小:728.00 KB
- 文档页数:30

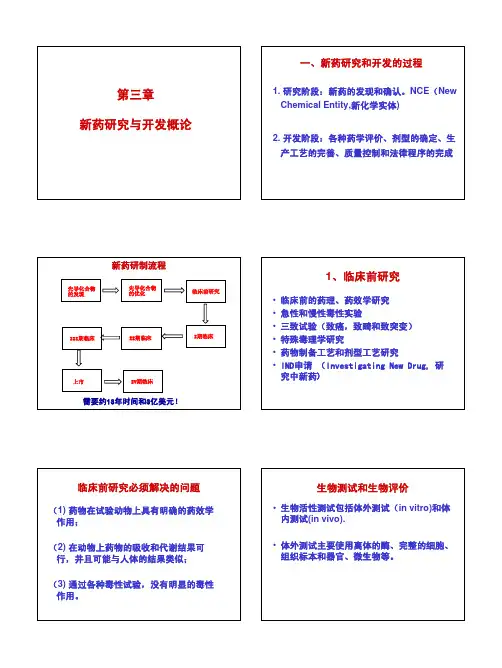
第三章新药研究与开发概论一、新药研究和开发的过程1. 研究阶段:新药的发现和确认。
NCE(New Chemical Entity,新化学实体)2. 开发阶段:各种药学评价、剂型的确定、生产工艺的完善、质量控制和法律程序的完成新药研制流程先导化合物的发现先导化合物的优化临床前研究I期临床II期临床III期临床IV期临床上市需要约13年时间和3亿美元!1、临床前研究•临床前的药理、药效学研究•急性和慢性毒性实验•三致试验(致癌,致畸和致突变)•特殊毒理学研究•药物制备工艺和剂型工艺研究•IND申请(Investigating New Drug, 研究中新药)临床前研究必须解决的问题(1) 药物在试验动物上具有明确的药效学作用;(2) 在动物上药物的吸收和代谢结果可行,并且可能与人体的结果类似;(3) 通过各种毒性试验,没有明显的毒性作用。
生物测试和生物评价•生物活性测试包括体外测试(in vitro)和体内测试(in vivo).•体外测试主要使用离体的酶、完整的细胞、组织标本和器官、微生物等。
•体内测试的重要性在于确定候选的药物在有生命系统中能否达到预期的靶点,产生希望的生理效应,是否有其他的不良反应。
NSCOOMeMe Me H H NR OH ON S COOHMe MeH H NROH O水解酶青霉素青霉素甲酯生物测试的指标•ED 50是指50%的受试动物产生预期生理活性的药物剂量。
•LD 50(半数致死剂量)是指50%受试动物死亡时的药物剂量。
•药物的治疗指数(LD 50与ED 50的比值),越大表示药物越安全。
9550551050100药物效能治疗剂量曲线致死剂量曲线剂量(mg)ED 50LD 50一种镇静药物的治疗和致死剂量-药物效应曲线2、临床研究•I期临床研究:确定新药在人体上的毒性和耐受性,获得药物代谢动力学数据。
•II期临床研究:在少量的病人身上进行新药的药效学研究,确证药物具有明确的疗效,观察药物的安全性和不良反应,确定最佳的用药剂量等。








