第十二章 杂环化合物 - 内江师范学院-精品课程平台
- 格式:doc
- 大小:760.00 KB
- 文档页数:31







第⼗⼆章杂环化合物第⼗⼆章杂环化合物⼀、定义和分类分⼦中含有由碳原⼦和其它原⼦共同组成的环的化合物称为杂环化合物。
杂环中的⾮碳原⼦称为杂原⼦,最常见的杂原⼦有N 、O 、S 等。
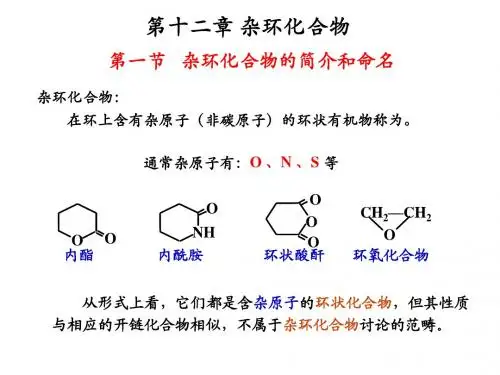
象环醚、内酯、环酐及内酰胺等似乎也应属于杂环化合物。
但是,由于这些环状化合物容易开环形成脂肪族化合物,其性质⼜与相应的脂肪族化合物类似,因此,⼀般不放在杂环化合物中讨论。
本章讨论的是环系⽐较稳定,并且在性质上具有⼀定芳⾹性的杂环化合物。
根据环数的多少分为单杂环和多杂环;单杂环⼜可根据成环原⼦数的多少分为五元杂环及六元杂环等;多杂环稠杂环、桥杂环及螺杂环,其中以稠杂环较为常见。
⼆、命名杂环化合物的名称包括杂环母体及环上取代基两部分。
杂环母环的命名有⾳译法和系统命名法2种。
⾳译法:是⽤外⽂谐⾳汉字加“⼝”偏旁表⽰杂环母环的名称。
如呋喃等。
系统命名法:是把杂环看作杂原⼦转换了相应碳环中的碳原⼦,命名时以相应的碳环为母体,在碳环名称前加上杂原⼦的名称,称为“某(杂)某”。
如吡啶称为氮(杂)苯,喹啉称为1-氮(杂)萘。
杂环母环的编号规则(1)含1个杂原⼦的杂环,从杂原⼦开始⽤阿拉伯数字或从靠近杂原⼦的碳原⼦开始⽤希腊字母编号。
(2)如有⼏个不同的杂原⼦时,则按O 、S 、-NH-、-N=的先后顺序编号,并使杂原⼦的编号尽可能⼩。
(3)有些稠杂环母环有特定的名称和编号原则。
杂环的命名如下:2-硝基吡咯 4-甲基吡啶 2-甲基-5-苯基噻唑α-硝基吡咯γ-甲基吡啶3-甲基-8-羟基喹啉 1-甲基-7-氯异喹啉 1-甲基-2-巯基咪唑 2-呋喃甲醛(糠醛) 2-噻吩磺酸 3-吡啶甲酰胺α-呋喃甲醛α-噻吩磺酸β-吡啶甲酰胺N H NO 2N CH 3N S C 6H 5CH 3N CH 3CH 3N Cl N CH 3N SH O CHO S SO 3H N CONH 2三、五元杂环化合物(⼀)吡咯、呋喃和噻吩1、结构与芳⾹性吡咯环的4个碳原⼦和1个氮原⼦都以SP 2杂化轨道成键。



第十二章杂环化合物杂环化合物指分子结构中含有除碳原子外,其他原子共同组成的环状化合物。
杂环中除碳原子外的其他原子称为杂原子,常见的杂原子有N、O、S等。
杂环化合物广泛存在于自然界中,数量庞大,大多具有一定的生理活性,是许多生物体的重要组成部分。
如植物体中的叶绿素、动物体中的血红素、核苷酸中的碱基等都含有杂环化合物。
杂环化合物对生物体的生长、发育、繁殖和衰亡等过程都起着非常重要的作用。
杂环化合物的应用范围非常广泛,在生物材料、分子器件、医药、染料及农药等领域均十分常见。
杂环一般包括脂环和芳环,其中,脂环易开环,其性质与开链化合物类似,因此,一般不把它们放在杂环化合物中讨论,本章主要讨论的是性质稳定也具有一定芳香性的杂环化合物。
一、杂环化合物的分类根据杂环母环的结构中所含环的数目,可将杂环化合物分为单杂环和稠杂环化合物两大类。
最常见的单杂环化合物中,根据原子的数目不同,可分为五元环和六元环。
根据杂原子的种类和数目,可分为1个、2个或以上杂原子的杂环化合物。
另外,稠杂环按稠合环的形式分为苯杂环化合物和杂环稠环杂环化合物。
常见杂环化合物的结构和名称见表12-1。
表12-1 一些常见杂环化合物的母环和分类二、杂环化合物的命名杂环化合物的命名比较复杂,目前在我国主要有两种方法:一种是音译法;另一种是系统命名法。
在命名时,杂环化合物的名称包括杂环母核及环上的取代基,其中,对杂环母核的命名一般采用音译法,对取代基的命名与前述章节基本一致。
音译法是按照1979年规定的IUPAC 命名原则所推荐的通用名,按外文发音来汉化命名,名称带“口”字旁。
例如:吡啶(pyridine )吲哚 (indole )N N HO S 呋喃(furan )噻吩(thiophene )当杂环上有取代基时,以杂环为母体,需先将杂环母环编号,以注明取代基的位次。
编号一般从杂原子开始,若含有2个或2个以上相同杂原子构成单杂环进行编号时,从连接有氢原子的杂原子开始编号,例如:4-甲基嘧啶2345O N N 16 25 341H 3C H 3C 4,5-二甲基呋喃CH 3当只有1个杂原子时,从杂原子开始用阿拉伯数字编号,也可用希腊字母编号,以靠近杂原子的第一个的碳原子为α-位,其次用β、γ等编号。
第十二章杂环化合物教学目的要求:1、掌握杂环化合物的含义,分类和简单杂环化合物的命名;2、掌握呋喃、噻吩、吡咯、吡啶、喹啉(包括喹啉的合成法-Skraup法)的结构和性质;3、掌握糠醛的性质和用途;4、了解喹啉、噻唑及其衍生物,吡啶、嘧啶衍生物;吲哚、嘌啉及其衍生物的结构、性质;5、了解生物碱的一般知识。
重点:五员杂环和六员杂环的亲电取代反应和亲核取代反应,糠醛、喹啉的合成及性质用途。
难点:对呋喃、噻吩、吡咯、吡啶的结构与芳香性和亲电取代活性的影响等知识的理解。
杂环化合物是指构成环系的原子除碳以外还有其他杂原子,如O、S、N、P、Sn、As、B、Cu等,这类化合物广泛存在于自然界。
许多天然杂环化合物在动植物体内起着非常重要的生理作用。
如血红素、叶绿素、核酸和某些维生素、生物碱等。
许多合成药物也是杂环化合物。
近年来,随着对工业有机物的深入研究与合成,又不断地发现新的特殊的杂环体系。
杂环化合物种类之多、数目之大,是有机物种数目最庞大的,约占有机物总数的一半以上。
前已叙及的环状酸酐、亚胺、内酯、环状缩醛、环氧化物等都是含杂原子的杂环体系。
但由于其易开环,性质和开链烃相似,故不属于杂环讨论的范畴。
杂环在此是指含有杂原子的具有芳香结构和一定稳定性的环状化合物。
其成环规律和碳环相同,最稳定的为五、六元环,常见的杂原子有N,O,S。
12.1 杂环化合物的分类与命名一、分类根据杂环化合物的性质分为脂杂环和芳香杂环脂杂环——没有芳香特征的杂环化合物称为脂杂环。
芳杂环——具有芳香特征的杂环化合物称为芳杂环。
本章主要讨论芳杂环。
芳杂环:单环:成环原子数(五元杂环、六元杂环)稠杂环:苯环+单杂环或单杂环+单杂环OSN HNON SN NH NN H呋喃 噻吩 吡咯 噁唑 噻唑 咪唑 吡唑六元杂环:NNNO吡啶 嘧啶 吡喃(无芳香性)稠杂环:N HNNNNN HN吲哚 喹啉 异喹啉 嘌呤二、命名1、音译法:根据英文音义,用带口字偏旁的同音字。
O 1234αβ5S 1234αβ55N H1234αβ N N HN N HN SN O 12345123451234512345呋喃 吡咯 噻吩 口恶唑 噻唑 咪唑 吡唑含有两个杂原子的五元杂环,若至少有一个杂原子是氮,则该杂环化合物称为唑。
H N NN NO 1234567S 1234567N H 1234567 3-吡唑啉 吡啶 嘧啶 苯并呋喃 苯并噻吩 苯并吡咯[吲哚87654321N 765432N 987654231H NN N N 3765421N H 987654321N H喹啉 异喹啉 嘌呤 吲哚 咔唑2、系统命名法将杂环母体看作是有相应的碳环母体掺入杂原子而成,命名时在碳环母体前加“某杂”。
NH NO 氮杂苯 氮杂茚(吲哚) 氧杂茂对取代的杂环化合物,其编号规则为:(1)含一个杂原子时从杂原子开始编号,同时使取代基位次最小(取代基的位次从杂原子算起依次用1,2,3,… (或α,β,γ…)编号)。
3-甲基吡啶(β)(2)含两个相同杂环时,编号从连有取代基或H 的杂原子开始,并使另一个杂NCH 3原子位次最小。
4-甲基咪唑 N N NH 24321N CH 3N H4-氨基嘧啶 N N H PhPh123452,5-二苯基咪唑(3)含不同杂原子时,则按O,S,N 顺序依次编号。
编号时杂原子的位次数字之和应最小。
(4)稠杂环一般选择相应的稠环母体命名,编号如前。
N CH 2COOH HH 698754321OHNN N N OH HO3-吲哚乙酸 2,6,8-三羟基嘌呤12.2五元杂环化合物12.2.1呋喃、噻吩、吡咯一、结构从结构上看,三者为共轭二烯的醚、硫醚和胺类化合物。
实际上,只有呋喃具有共轭加成的性质,其典型的化学性质类似于苯。
易于发生亲电取代,NMR 谱中显示环流效应,具有一定的芳香性,物理实验方法证明:三者都为平面分子,键长、键角数据如下:O 0.135m 0.137m0.70D 0.144n nm 0.51D N 0.143nm0.137nm 0.138nm 1.81DH ++氧杂茂bp=31.36℃ 硫杂茂bp=84.1℃ 氮杂茂bp=129℃相应的饱和杂环: 1.73D 1.90D 1.58D 方向由环向杂原子键长:C-C 0.154nm C=C 0.134nm C-N 0.147nm C=N 0.128nm C-O 0.143nm C=O 0.120nm C-S 0.182nm C=S 0.160nm键角 ∠OCC=110.7° ∠SCC=111.5° ∠NCC=108.08°∠CCC=106.0° ∠CCC=112.4°. ∠CCC=107.45°N SNH 2H 3C512432-氨基-4-甲基噻唑N HN 12345N N 12345CH 3吡唑1-甲基咪唑∠COC=106.6° ∠CSC=92.2° ∠CNC=108.9° 键角与正常键角差别越小,张力也越小,环越稳定。
噻吩环的张力最小。
电子结构:呋喃、噻吩、吡咯三种杂环体系中,在结构上具有共同点,即构成环的五个原子都为sp 2杂化,故成环的五个原子处在同一平面,所有原子都有一个P 轨道,杂原子上的孤对电子参与共轭,形成形状封闭的π电子共轭体系为π56,其π电子数符合休克尔规则(π电子数 = 4n+2),具有芳香性。
其共轭能分别为:苯:150.5KJ/mol, 呋喃:66.9KJ/mol,噻吩:121.3KJ/mol ,吡咯:87.8KJ/mol 。
或NH由共轭能可知,芳香性:苯>噻吩>吡咯>呋喃, 电负性:O>N>S 。
二、性质1、 物理性质由于O ,S 的电负性均大于碳,故其分子具有极性,偶极矩的方向是由碳环指向杂原子,又由于杂原子的P 轨道的一对电子参与共轭,故其偶极矩均低于非共轭环化合物,因而吡咯分子中由于氮的共轭作用其偶极矩的方向与非共轭的环状物的相反(也可以认为+I>-C )。
-HN NN N HHH-+-+N H+2、光谱性质OSN HΠ56π为共轭体系电子= 6符合4n + 2具有芳性富电子芳环由于形成了闭电子壳层,在NMR 谱中,由于外磁场的作用形成环电流和与外磁场方向相反的感应磁场,环外质子处于去屏蔽区,因此化学位移强烈的移向低场,δ≈7。
OS NH 6.626.687.107.306.377.42△δ: 1.05 0.20 0.46呋喃、噻吩、吡咯,是具有芳香性的共轭体系,因此可以发生芳香的亲电取代,由于杂原子具有电子的共轭效应,使杂环活化,因此比苯更容易发生亲电取代反应,反应在温和条件下进行。
而且遇强酸及氧化剂时环很容易被破坏,发生加成、水解、聚合等反应。
3、 化学性质因呋喃、噻吩、吡咯,是具有芳香性的共轭体系,因此可以发生芳香的亲电取代,由于杂原子具有给电子共轭效应,使杂环活化,因此比苯更容易发生亲电取代反应,反应在温和条件下进行。
亲电取代反应活性:吡咯>呋喃>噻吩>苯,吡咯对亲电试剂最敏感。
呋喃、噻吩、吡咯遇强酸及氧化剂时环很容易被破坏,发生加成、水解、聚合等反应。
如在强酸条件下,呋喃、噻吩、吡咯的共轭体系被破坏,发生水解、聚合,环表现出不稳定性。
其水解、聚合等反应活性顺序为:呋喃>吡咯>噻吩>苯。
可能因噻吩环的张力较小,较稳定的缘故,不易发生聚合。
(1) 呋喃、噻吩、吡咯的质子化反应分子接受一个质子的反应称为质子化反应。
呋喃、噻吩、吡咯在酸的作用下可质子化;质子化反应主要发生在C-2上;H N+H HHN H由于α-C 的质子化反应,吡咯在强酸作用下会因聚合而被破坏。
在稀的酸性水溶液中,呋喃的质子化在氧上发生并导致水解开环。
(2)亲电取代反应首先推测亲电取代活性:从电荷分布情况:根据结构,五元杂环为π65共轭体系。
环电荷密度大于苯,比苯更容易进行亲电取代;电负性O>N ,N 比O 易于给出电子,因此环电荷密度:吡咯>呋喃,吡咯更易于进行亲电加成;噻吩的空的d 轨道参与碳p 轨道的杂化重叠,共轭能很高,分子稳定。
如以苯环上碳原子的电荷密度为标准(作为0),则五元杂环化合物的有效电荷分布为:五元杂环有芳香性,但其芳香性不如苯环,因环上的π电子云密度比苯环大,且分布不匀,它们在亲电取代反应中的速率也比苯快得多。
而且从μ可知,环电荷密度为:吡咯>呋喃>噻吩。
环电流密度越大越易发生 亲电取代反应。
从中间体稳定性:亲电取代活泼性与中间体正离子的稳定性有关,形成的中间体离子越稳定,反应越容易进行。
其中中间体正离子的稳定性顺序为:N 比O 具有更大的容纳正电荷的能力,杂原子比碳更具有更大的容纳正电荷的能力,更易于发生亲电取代反应。
吸电子诱导:O(3.5) > N(3.0) > S(2.6) 给电子共轭效应:N > O > S 。
综合:N 贡献电子最多,O 其次,S 最少。
离域能:苯:150.5KJ/mol, 呋喃:66.9KJ/mol,噻吩:121.3KJ/mol ,吡咯:87.8KJ/mol 。
噻吩、吡咯的芳香性较强,所以易取代而不易加成;呋喃的芳香性较 弱,虽然也能与大多数亲电试剂发生亲电取代,但在强亲核试剂存在下,能发生亲核加成。
故亲电取代反应活性:吡咯>呋喃>噻吩>苯,吡咯对亲电试剂最敏感。
且亲 电取代主要进入α-位,原因后述。
注意:亲电试剂不同,反应速率也有差别。
因此吡咯、呋喃、噻吩的亲电取代反应,对试剂及反应条件必须有所选择和控制。
①卤代不需要催化剂,要在较低温度和进行。
呋喃、噻吩室温时与Cl 2、Br 2反应很OSNH0000+ 0.1- 0.03- 0.02+ 0.20- 0.06- 0.04+ 0.32- 0.10- 0.06NEH SEH H EH+++>>+OEH >剧烈,得多卤代产物。
在温和条件下,如用溶剂稀释或低温下可得一卤代产物,不活泼的I 2需要在催化剂作用下进行。
吡咯常得四卤化物,α-氯代吡咯是直接氯代的唯一产物。
OO Cl +OBrOClCl 80%S78%SBrSI70%2-碘噻吩80%0222N HC 00Br 2N Br Br BrHN ClH呋喃与次溴酸甲酯发生加成反应,生成2,5-二甲氧基二氢呋喃,经催化氢化,酸性条件下水解,生成琥珀醛。
琥珀醛常用此法生产。
② 硝化:呋喃、噻吩、吡咯易于被氧化,不能用混酸硝化,一般是用乙酰基硝酸酯(CH 3COONO 2)作硝化试剂,在低温下进行。
反应发生在α位。
③ 磺化:呋喃、吡咯不能用浓硫酸磺化,要用温和的非质子磺化试剂—吡啶三氧化硫加合物进行磺化,反应主要发生在α位。