超滤法去除细菌内毒素
- 格式:pdf
- 大小:157.63 KB
- 文档页数:3

除内毒素的方法内毒素是一种对人体健康有害的毒素,它广泛存在于细菌、真菌和其他微生物中。
当内毒素进入人体后,它们会引发炎症反应、免疫系统紊乱及其他多种不良反应,严重影响健康。
因此,寻找有效的方法除去内毒素变得非常重要。
本文将介绍几种除内毒素的方法,包括物理方法、化学方法和生物方法。
物理方法物理方法是以物理性质对内毒素进行处理,使其失去毒性。
其中一种常见的物理方法是超滤。
超滤通过利用不同孔径的滤膜,将内毒素分离出来。
超滤膜可以选择性地阻止内毒素以及其他大分子物质通过,从而实现内毒素的去除。
此外,离心过滤也是一种物理方法,通过高速旋转使内毒素沉淀,从而将其除去。
化学方法化学方法主要是通过化学反应将内毒素转化为无害物质。
一个常见的化学方法是使用活性炭吸附内毒素。
活性炭具有高表面积和强吸附能力,可以将内毒素吸附在其表面,从而起到除毒作用。
此外,有些化学制剂,如聚乙烯吡咯烷酮(PEI)和多肽,也被用于结合内毒素,形成复合物,从而降低其毒性。
生物方法生物方法利用生物体内的酶或细胞来降解或清除内毒素。
其中一种常见的生物方法是使用内毒素结合蛋白(LBP)。
LBP是一种由宿主产生的蛋白质,它可以结合内毒素并将其清除。
另一种生物方法是利用乳酸菌。
乳酸菌是一类有益菌,研究表明它们可以分解内毒素并减少其毒性。
综合方法除了以上介绍的单一方法,综合方法也是一种有效的除内毒素策略。
综合方法将物理、化学和生物方法相结合,以提高除毒效果。
例如,可以同时使用超滤和活性炭吸附,以实现高效的内毒素去除。
此外,在除去内毒素的过程中,还应重视预防内毒素的生成。
一些措施包括保持食品的卫生、加强环境的消毒和防止霉菌滋生。
通过预防内毒素产生,可以降低内毒素对健康的危害,减少内毒素去除的工作量。
综上所述,除内毒素的方法多种多样,包括物理方法、化学方法和生物方法。
这些方法各有特点,并可以相互结合以提高除毒效果。
在除去内毒素的同时,也需要预防内毒素的生成,以进一步保护人体健康。



简述超滤的原理及其应用超滤的原理超滤是一种通过孔径较小的膜实现分离、浓缩和净化液体的方法。
超滤膜的孔径通常为0.1微米到0.01微米,介于微滤和纳滤之间。
超滤膜可以去除溶质、胶体和大分子物质,而保留溶剂和小分子物质。
超滤的原理是利用膜孔的大小选择性进行分离。
当液体通过超滤膜时,较小的溶质、胶体和大分子物质无法通过膜孔,而被截留在膜表面形成浓缩液,而较小的溶剂和分子则可以通过膜孔,形成滤液。
这样就实现了对溶质和溶剂的分离。
超滤的应用超滤技术在水处理、食品加工、生物医药等领域有着广泛的应用。
水处理超滤技术在水处理中常用于去除重金属离子、色素、微生物、胶体等污染物。
超滤膜可以去除水中的悬浮物、细菌、病毒和有机物质,提高水的质量和透明度。
在工业废水处理中,超滤技术可以实现废水的回收和资源化利用。
食品加工超滤技术在食品加工中起到了重要的作用。
例如,在乳品加工中,利用超滤技术可以去除乳中的微生物、脱脂、浓缩和分离乳清,产生高质量的乳制品。
超滤还可以用于果汁和酿酒的澄清、蔬菜汁的浓缩等。
生物医药超滤在生物医药领域的应用也较为广泛。
超滤技术可以用于药物的纯化、酶的分离、蛋白质的富集和去除杂质等。
超滤可以实现对体内毒素的清除,对药物和有害物质的分离和浓缩,对细胞的分离和培养液的澄清。
环境保护超滤技术在环境保护中也发挥着重要的作用。
例如,超滤可以用于处理酸洗废液、电镀废水和垃圾渗滤液等。
超滤可以去除废水中的重金属离子和有机污染物,减少污染物对环境的影响。
其他应用超滤技术还可以应用于饮料生产、制药工业、电子工业、纸浆造纸等领域。
在饮料生产中,超滤可以去除水中的杂质和微生物,提高饮料的质量和口感。
在制药工业中,超滤可以用于制备高纯度的药物和抗体。
在电子工业中,超滤可以用于制备纳米材料和纳米纤维。
在纸浆造纸中,超滤可以净化浆水,降低废水的排放。
总结超滤是一种通过膜孔大小选择性分离、浓缩和净化液体的方法。
它在水处理、食品加工、生物医药等领域有着广泛的应用,带来了许多积极的影响。

内毒素的去除是做蛋白表达时至关重要的一步,同时也是非常棘手的问题,本文就针对内毒素的去除方法以及各方法的注意事项进行了归纳总结。
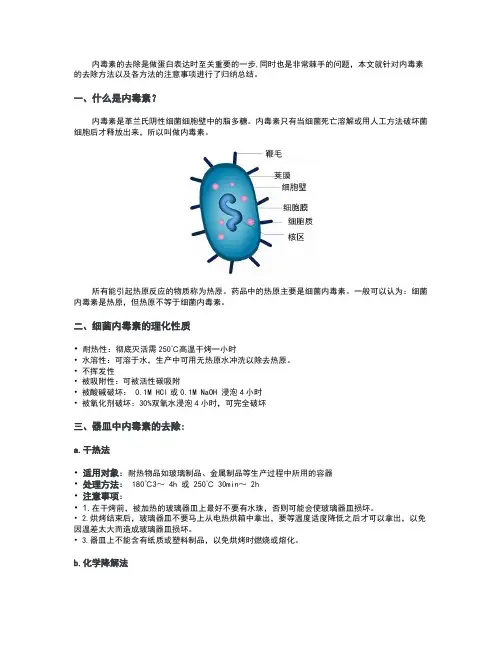
一、什么是内毒素?内毒素是革兰氏阴性细菌细胞壁中的脂多糖。
内毒素只有当细菌死亡溶解或用人工方法破坏菌细胞后才释放出来,所以叫做内毒素。
所有能引起热原反应的物质称为热原。
药品中的热原主要是细菌内毒素。
一般可以认为:细菌内毒素是热原,但热原不等于细菌内毒素。
二、细菌内毒素的理化性质•耐热性:彻底灭活需250℃高温干烤一小时•水溶性:可溶于水,生产中可用无热原水冲洗以除去热原。
•不挥发性•被吸附性:可被活性碳吸附•被酸碱破坏: 0.1M HCl或0.1M NaOH 浸泡4小时•被氧化剂破坏:30%双氧水浸泡4小时,可完全破坏三、器皿中内毒素的去除:a.干热法•适用对象:耐热物品如玻璃制品、金属制品等生产过程中所用的容器•处理方法: 180℃3~ 4h 或 250℃ 30min~ 2h•注意事项:• 1.在干烤前,被加热的玻璃器皿上最好不要有水珠,否则可能会使玻璃器皿损坏。
• 2.烘烤结束后,玻璃器皿不要马上从电热烘箱中拿出,要等温度适度降低之后才可以拿出,以免因温差太大而造成玻璃器皿损坏。
• 3.器皿上不能含有纸质或塑料制品,以免烘烤时燃烧或熔化。
b.化学降解法•适用对象:主要用于去除玻璃、塑料和其它高分子材料器皿上的内毒素。
•处理方法:常用3~5%双氧水、重铬酸钾硫酸清洁液(重铬酸钾∶硫酸∶水常用配比1∶1∶10 或1∶2∶8 )、0.1M HCl或0.1 M NaOH浸泡去除。
一般处理4h以上。
•注意事项:佩戴防护用具,防止皮肤直接接触。
四、溶液中内毒素的去除但是,各种去内毒素的方法不是孤立的,可以相互结合使用。
比如,如果液相分离法得到的蛋白内毒素水平未达标,可以接着利用分子筛法进一步去除内毒素。
五、作为目前去内毒素常用的方法,液相分离法的注意事项值得我们重视1.液相分离方法应用于蛋白纯化中内毒素的去除a.目的蛋白上样后,用预冷的基础溶液+1% Triton X-114缓慢淋洗柱子,直至A280数值稳定不变;b.用预冷的去内毒素基础溶液淋洗柱子,直至A280数值达到基线,稳定不变;c.用各梯度去内毒素的洗脱液洗脱,收集各洗脱液于去内毒素的收集管中。

内毒素去除工艺
内毒素是一种存在于细菌细胞壁中的毒性物质,对于许多领域的生物制药、食品加工和医疗保健等都是一个重要问题。
内毒素去除是一个关键的工艺,尤其在生物制药中非常重要,因为内毒素可能会对最终产品的安全性和有效性产生负面影响。
以下是一些常见的内毒素去除工艺:
1.细胞培养条件优化:通过调节培养条件,如温度、pH、营养物质等,可以减少内毒素的产生。
优化培养条件可以降低内毒素在生产过程中的生成量。
2.细胞壁破裂:利用物理或化学方法破裂细胞壁,释放细胞内的目标产物,同时也释放内毒素。
后续的纯化过程需要采取方法去除内毒素。
3.色谱分离技术:某些色谱技术( 如离子交换色谱、凝胶过滤色谱、亲和层析等)可以通过选择性地分离内毒素以及其他目标物质,从而实现内毒素的去除。
4.超滤/透析:利用超滤或透析技术,根据内毒素与其他物质在分子大小和性质上的差异,将内毒素从溶液中去除。
5.吸附剂:使用特定的吸附剂或树脂,如多肽、多糖、凝胶等,可以将内毒素选择性地吸附并去除。
6.免疫吸附法:利用针对内毒素的抗体或亲和层析树脂,将内毒素从混合溶液中特异性地吸附去除。
7.端毒素化工艺:有些生物制品经过特定化学修饰,将内毒素转化成无毒的形式。
在实际应用中,通常需要结合多种方法来有效去除内毒素,以确保最终产品的质量和安全性。
不同的产品和工艺可能需要定制化的内
毒素去除方案。
在生产过程中,严格的质量控制和监测是至关重要的,以确保内毒素的去除效果和产品质量的稳定性。

超滤法去除重组腺相关病毒中内毒素的应用唐明青;张文豪;侯莹;成志云;郭思佳;王立振;刘慧;许瑞安【摘要】为探讨超滤法在重组腺相关病毒精制中的可行性,采用不同截留分子量的超滤管对重组腺相关病毒样品rAAV9-Kal进行超滤处理.利用鲎试剂盒和qPCR法定量检测截留液和滤过液中的内毒素和病毒含量,评价超滤技术对样品中内毒素的去除效果.结果表明:在乙二胺四乙酸二钠和脱氧胆酸钠的预处理下,30 kD的超滤管对样品的回收率及内毒素去除率分别为0.9122,0.8706.因此,在单一超滤条件下,30 kD的超滤管是重组腺相关病毒样品超滤纯化的最佳选择.%To explore the possibility of ultrafiltration technology used in recombinant adeno-associated virus purification,the recombinant adeno-associated virus sample termed rAAV9-Kal was first treated by different molecular weights cut off ultrafiltration devices,then the endotoxin and virus in the retentates and filtrates were assayed with quantitative tachypleus amebocyte lysate regents and real-time PCR respectively,and last the effects of ultrafiltration on endotoxin removal were evaluated.The results showed that the recovery rate and endotoxin removal rate of sample were 0.912 2 and 0.870 6 respectively,under the treatment of EDTA, DOC and 30 kD ultrafiltration devices.Therefore,the 30 kD should be the most suitable ultrafiltration device for sample ultrafiltration and endotoxin removal.【期刊名称】《华侨大学学报(自然科学版)》【年(卷),期】2017(038)001【总页数】5页(P64-68)【关键词】重组腺相关病毒;超滤;截留分子量;内毒素;纯化【作者】唐明青;张文豪;侯莹;成志云;郭思佳;王立振;刘慧;许瑞安【作者单位】华侨大学生物医学学院,福建泉州 362021;华侨大学生物医学学院,福建泉州 362021; 福建医科大学基础医学院,福建福州 350108;华侨大学生物医学学院,福建泉州 362021;华侨大学生物医学学院,福建泉州 362021;华侨大学生物医学学院,福建泉州 362021;华侨大学生物医学学院,福建泉州362021;华侨大学生物医学学院,福建泉州 362021;华侨大学生物医学学院,福建泉州 362021【正文语种】中文【中图分类】Q93重组腺相关病毒(rAAV)属于微小病毒科的单链DNA病毒,具有天然非致病性、免疫原性低、宿主范围广、可转染分裂细胞和非分裂细胞及介导外源基因长期表达等特性,是最有前景的基因治疗载体之一[1].目前,基于rAAV的基因治疗药物Glybera已率先在欧盟上市[2].内毒素(ET)是由革兰氏阴性菌细胞壁裂解释放的脂多糖类物质,极微量(1~5 ng·kg-1)的内毒素作用于机体内的内生致热原生成细胞即可导致机体发热,大剂量可引起血液循环障碍和内毒素休克[3].在rAAV制备过程中,一个重要的质控指标就是内毒素,尤其是应用于临床的rAAV,内毒素安全限量为小于83.35 μkat·L-1[4].目前常用的内毒素去除手段如活性炭吸附法、阴离子交换层析法和TritonX-114液相萃取法普遍存在选择性低的问题,而高选择性的亲和膜色谱法又存在配基选择、介质合成困难、过程繁琐、技术要求高的限制[5].超滤技术是通过膜表面的微孔结构对物质进行选择性分离,从而实现大、小分子的分离、浓缩、净化的目的.虽然内毒素单体的相对分子质量仅为10~20 kD,但由于内毒素通常以聚合态形式存在,其相对分子质量可以高达1 000 kD以上.因此,超滤技术非常适合在小分子量产品中进行内毒素的去除工作,如注射制剂及工程疫苗内毒素的去除[6],但其在rAAV这种超大分子量产品(大于10 000 kD)中的内毒素去除效应却未见相关报道.为探讨在rAAV制备中应用超滤管进行rAAV浓缩与清除内毒素的可行性,本文研究采用不同截留分子量(molecular weight cut off,MWCO)的超滤管,对实验室制备的携带人组织激肽释放酶结合蛋白基因(Kal)的rAAV9-Kal样品进行超滤离心处理,收集滤过液和截留液进行内毒素及病毒基因组(viral genome,VG)定量检测和衣壳蛋白定性表征,以综合评价超滤管对rAAV浓缩与内毒素去除效果.1.1 试剂耗材rAAV9-Kal样品由分子药物教育部工程研究中心下辖的rAAV中试车间提供;Amicon Ultra-4超滤管(厦门市鹭隆生物公司);快速银染试剂盒(海门市碧云天生物技术研究所);显色基质鲎试剂盒(厦门市鲎试剂实验厂有限公司);SYBR Select Master Mix(上海市英潍捷基贸易有限公司);定量PCR引物(南京市金斯瑞生物科技有限公司);小鼠抗VP1/VP2/VP3单克隆抗体和兔抗小鼠IgG单克隆抗体(上海市英潍捷基贸易有限公司);ECL化学发光试剂盒(厦门市鹭隆生物公司).1.2 Realtime PCR引物设计根据GenBank中人Kallistatin基因序列(L19684.1),使用Primer 5.0软件设计引物序列为Kal-S: 5′-GCTGTCTGAGTCCGATGTCC-3′,Kal-AS: 5′-TGTCGTAGAAGTTGGTGTGG-3′,扩增产物长度191 bp.1.3 超滤离心取rAAV9-Kal(2.5×1012 VG·L-1)4 mL,分别加于MWCO为3,10,30,50,100 kD 的Amicon Ultra-4超滤管中,以7 500g,4 ℃,离心15 min收集截留液和滤过液.1.4 内毒素检测按照2010版《中华人民共和国药典》吸光度法内毒素检测要求及显色基质鲎试剂盒使用说明进行标准曲线绘制、可靠性试验、干扰实验及内毒素测定.提前配制显色基质溶液、偶氮化试剂1、偶氮化试剂2、偶氮化试剂3,用内毒素检查用水配制活性浓度为0.10,0.25,0.50,16.67 μkat·L-1细菌内毒素标准液.按标示量,加细菌内毒素检查用水于鲎试剂中,并轻轻振摇使其溶解完全.在装有100 μL加内毒素检查用水、内毒素标准液或经超滤处理后的待测rAAV9-Kal样品(截留液和滤过液)的无热原试管中,加入100 μL鲎试剂溶液,混匀,在37 ℃温育10 min.接着,加入100 μL显色基质溶液,混匀,再次在37 ℃温育6 min.温育结束,依次加入500 μL偶氮化试剂1、偶氮化试剂2、偶氮化试剂3,每次加完试剂后均混匀,并在加入偶氮化试剂3混匀后室温静置5 min,于545 nm波长处测吸光度值,每个检测反应设3个平行管.1.5 定量检测分别取2 μL的截留液及超滤液、10 μL的2×SYBR Select Master Mix、0.5 μL的引物Kal-S及Kal-AS,7 μL的纯水,在StepOne Plus定量PCR仪上运行.95 ℃预变性5 min,95 ℃变性15 s,60 ℃退火30 s,72 ℃延伸30 s,40个循环.最后,进行相对定量计算,即1.6 病毒鉴定配制质量分数为10%的分离胶和质量分数为4.5%的浓缩胶,分别取截留液及超滤液25 μL,加入5 μL蛋白上样缓冲液.煮沸变性5 min,每孔上样28 μL,60 V恒压电泳分离;电泳结束后进行PVDF膜转膜,条件为250 mA,2 h;随后小鼠抗VP1/VP2/VP3单克隆抗体4℃孵育过夜,兔抗小鼠IgG单克隆抗体室温孵育2 h,ECL显色,置于凝胶成像系统中显影、定影.1.7 统计学分析采用SPSS21.0统计学软件进行数据统计分析,不同实验组间病毒及内毒素水平用x表示.2.1 rAAV9-Kal的回收率收集不同规格超滤管超滤后的滤过液(3kD-P,10kD-P,30kD-P,50kD-P,100kD-P)、截留液(3kD-R,10kD-R,30kD-R,50kD-R,100kD-R)、原液(rAAV9-Kal)并统一稀释至4 mL初始体积,通过qPCR仪进行滴度相对定量.在统一体积条件下,定量计算rAAV9-Kal的回收效率,如表1所示.由表1可知:MWCO为3,10,30,50,100 kD的超滤管对rAAV9-Kal进行超滤(7 500g,4 ℃,15 min)后的产品回收率分别为0.957 0,0.941 3,0.919 9,0.842 0,0.642 5.鉴于前3者对产品的损伤率均小于10%,因此,单纯考虑产品回收率时,在实际rAAV超滤中,以选择MWCO为3,10,30 kD的超滤管为佳.2.2 rAAV9-Kal的内毒素去除率超滤管超滤后,收集不同规格的滤过液、截留液、原液,并统一稀释至4 mL的初始体积,通过鲎试剂盒测定各自内毒素活力,发现超滤前样品的内毒素活力为31.006 nkat·mL-1,经MWCO为3,10,30,50,100 kD的超滤管超滤后截留液的内毒素活力分别为30.173,30.006,28.893,24.005,17.504 μkat·L-1,其对应的截留率分别为0.998 7,0.987 7,0.982 263,0.944 1,0.785 8,0.573 0,而滤过液的内毒素活力分别为1.000,3.501,4.501,6.001,10.169 nkat·mL-1,其对应的滤过率分别为0.032 8,0.114 6,0.147 3,0.196 5,0.332 9,如图1所示. 图1中:管号1~10分别为3k-R,10k-R,30k-R,50k-R,100k-R,30k-P,10k-P,50k-P,100k-P,3k-P.由图1可知:内毒素的滤过率虽然随着MWCO增大而增大,但基本不能透过MWCO小于30 kD的超滤管,去除效率并不理想,超滤工艺有待进一步优化.2.3 超滤工艺的优化及效果用质量浓度为0.2 mg·mL-1的乙二胺四乙酸二钠(EDTA)和质量浓度为5 mg·mL-1的脱氧胆酸钠(DOC)预处理rAAV9-Kal样品30 min(冰浴搅拌),再用3,10,30 kD的超滤管进行超滤处理,分析滤过液和截留液中rAAV9-Kal的滴度及内毒素的活力变化.结果发现,样品预处理后,超滤管对rAAV9-Kal的滤过性有轻微增加,但对内毒素的滤过性则有显著性增大.rAAV9-Kal回收率及内毒素去除率测定,如表2所示.由表2可知:3,10,30kD的超滤管对样品的回收率分别为0.953 0,0.938 5和0.9122,对内毒素的去除率分别为0.772 3,0.831 4和0.870 6.综合考虑超滤时间、回收率、内毒素去除率等因素,30 kD超滤管可以作为rAAV9-Kal样品超滤纯化的基本选择.其纯化效果还可以通过进一步优化样品预处理的条件实现进一步优化.2.4 超滤纯化后rAAV的鉴定收集不同规格超滤管超滤后的滤过液、截留液、原液并统一稀释至4 mL初始体积,通过WB对各组分进行定性鉴定,如图2所示.图2 中:泳道1~3分别为3kD-R,10kD-R,30kD-R.由图2可知:在超滤条件优化后,MWCO为3,10,30 kD的超滤管超滤后截留液中rAAV9-Kal的目的条带完整(VP1,VP2,VP3)且比例正确(1∶1∶10);优化后的超滤处理并不影响回收对象rAAV9-Kal的物理性质.超滤离心的原理是以特定孔径的微孔滤膜为过滤介质,在一定的离心力作用下,使待处理液体经过超滤管,迫使小分子物质和溶剂经过膜面进入下部的收集管,而大分子物质被截留从而达到浓缩和分离的目的[7].由于此类方法操作简便,对设备要求不高,加上超滤管经再生处理后可重复使用,在注射制剂中内毒素的去除上已初见成效,但尚未有关其在rAAV产品纯化与内毒素去除方面的研究报道.通过选用不同截留分子量的超滤管对rAAV9-Kal样品进行超滤离心处理,以期获得一种能够实现产品纯化与内毒素去除的超滤条件.实验结果表明:在7 500g,4 ℃,15 min 超滤条件下,MWCO小于30 kD的超滤管对rAAV样品具有较高的回收率,最低为0.919 9,但此时内毒素去除率并不理想,最高仅为0.017 8,超滤工艺有待进一步优化.通过对内毒素自身性质的分析可以发现,内毒素具有化学异源性,来源不同的内毒素形态和相对分子质量均不确定,相对分子质量变化范围可从几千到几万,而且在水溶液中存在多种分散形态,如胶束和缔合体,尤其是缔合体的分子质量可达1 000 kD,直径达10 nm[8].由于rAAV是经过氯化铯梯度离心后的半成品,此时样品中所含内毒素的分子量及物理尺寸与分离对象rAAV极为相似,因此,样品中残留的内毒素主要以缔合体形式存在[9],进而可能导致本实验中内毒素与rAAV样品的分离效果差.其次,内毒素在Ga2+等二价阳离子的存在下极容易聚合,而rAAV在制备过程中正好需要使用一定质量浓度的GaCl2及MgCl2.因此,在超滤优化中尝试采用去污剂DOC及螯合剂EDTA预处理样品,以实现将聚合态内毒素解聚,从而降低其分子量.最终优化后超滤效果表明:样品预处理后,超滤管对rAAV9-Kal的滤过性有轻微增加,但对内毒素的滤过性则有显著性增大.30 kD的超滤管对样品的回收率及内毒素去除率分别为0.912 2和0.870 6,优化效果明显,可以作为rAAV9-Kal样品超滤纯化的基本选择.虽然建立了rAAV超滤纯化的初步工艺,但鉴于不同超滤材质的超滤效果存在明显差异[10-11],离心型和泵驱动型超滤装置在膜分离动力学方面存在差异[12],溶液中蛋白质量浓度和去污剂的质量分数都可能影响到实际的内毒素清除效果[13].在接下来的研究中,将重点开展相关条件的系统优化,以求实现rAAV样品纯化与内毒素清除的快捷、简单化,为规模化临床级rAAV的制备奠定基础.【相关文献】[1] 肖桂清,杨会勇,刁勇.重组腺相关病毒质量控制的qPCR技术研究进展[J].华侨大学学报(自然科学版),2014,35(2):191-195.[2] MORRISON C.$1-million price tag set for Glybera gene therapy[J].Nature Biotechnology,2015,33(3):217-218.[3] ROURKE K S,MAYER C A,MACFARLANE P M.A critical postnatal period of heightened vulnerability to lipopolysaccharide[J].Respiratory Physiology andNeurobiology,2016,232:26-34.[4] WRIGHT J F,ZELENAIA O.Vector characterization methods for quality control testing of recombinant adeno-associated viruses[J].Methods in Molecular Biology,2011,737(1):247-249.[5] MAGALHAES P O,LOPES A M,MAZZOLA P G,et al.Methods of endotoxin removal from biological preparations: A review[J].Journal of Pharmaceutical Sciences,2007,10(3):388-404.[6] HASHEMI H,POUYANFARD S,BANDEHPOUR M,et al.Efficient endotoxin removal from T7 phage preparations by a mild detergent treatment followed by ultrafiltration[J].Aacta Virologica,2013,57(3):373-374.[7] CLEVER M,JORDT F,KNAUF R,et al.Process water production from river water by ultrafiltration and reverse osmosis[J].Desalination,2000,131(1/2/3):325-336.[8] KULP A,KUEHN M J.Biological functions and biogenesis of secreted bacterial outer membrane vesicles[J].Annual Review of Microbiology,2010,64(1):163-184.[9] 许瑞安,唐明青,刁勇,等.腺相关病毒:从病毒到临床[M].北京:科学出版社,2015:1-8.[10] NESTOLA P,MARTINS D L,PEIXOTO C,et al.Evaluation of novel large cut-off ultrafiltration membranes for adenovirus serotype 5 (Ad5) concentration[J].PLoSOne,2014,9(12):e115802.[11] 刘芸,周骏,王冬英,等.混合材质超滤膜去除丹参滴注液中细菌内毒素的应用研究[J].南京中医药大学学报,2011,27(6):558-560.[12] MATTIASSION B.Isolation and purification of proteins[M].New York:Marcel Dekker Inc,2003:194-204.[13] JANG H,KIM H S,MOON S C,et al.Effects of protein concentration and detergent on endotoxin reduction by ultrafiltration[J].BMB Reports,2009,42(7):462-466.。

无菌产品细菌内毒素的控制胡文滨【摘要】论述了细菌内毒素的有关问题,以及与热原,细菌的关系,并结合无菌原料药生产企业中无菌室的实际情况,分析了产生细菌内毒素的关键点,提出了如何去除细菌内毒素,为无菌车间注射级产品细菌内毒素的管理提供了思路方法.【期刊名称】《河北省科学院学报》【年(卷),期】2010(027)004【总页数】5页(P57-61)【关键词】细菌内毒素;热原;细菌【作者】胡文滨【作者单位】石药集团高科医药科技开发有限公司,河北石家庄,052160【正文语种】中文【中图分类】R954细菌内毒素,英文称作 Endotoxin,是革兰氏阴性菌(G-菌)细胞壁个层上的特有结构,内毒素的主要化学成分为脂多糖中的类脂A,内毒素只有当细菌死亡溶解或用人工方法破坏菌细胞后才释放出来,所以叫做内毒素。
脂多糖(lipopolysaccharide,LPS)由多糖 O抗原、核心多糖和类脂A(lipid A)组成,位于最外层。
多糖O抗原向外,由若干个低聚糖的重复单位组成的多糖链,即革兰氏阴性菌的菌体抗原(O抗原),有特异性。
核心多糖由庚糖、半乳糖、2-酮基-3-脱氧辛酸 (2-keto-3-deoxyoctonic acid, KDO)等组成,所有革兰氏阴性细菌都有此结构。
类脂A是以脂化的葡萄胺二糖为单位,通过焦磷酸酯键组成的一种独特的糖脂化合物,具有致热作用,是革兰氏阴性细菌内毒素的毒性成分。
内毒素的致病机理:主要是由于革兰氏阴性菌和其它微生物(病毒、立克次氏体、衣原体螺旋体等)感染时,这类菌属随病灶渗液进入血液循环,并扩散到各种组织器官和体液细胞内繁殖,这类菌属在体内死亡和解体后,才稀放出大量的细菌内毒素脂多糖(LPS),这些因子刺激体温调节中枢导致机体发热。
细菌英文叫Bacteria,人们通常所说的即为狭义的细菌,狭义的细菌为原核微生物的一类,是一类形状细短,结构简单,多以二分裂方式进行繁殖的原核生物,是在自然界分布最广、个体数量最多的有机体,是大自然物质循环的主要参与者。


超滤技术去除羟基喜树碱中细菌内毒素的研究【摘要】本实验采用超滤技术去除羟基喜树碱中的细菌内毒素。
超滤后有效成分透过率为96.2%。
超滤后细菌内毒素的去除效果:细菌内毒素去除率为96.0%。
实验结果表明此方法可用于羟基喜树碱中细菌内毒素的去除。
【关键词】超滤技术;羟基喜树碱;研究羟基喜树碱是从我国特有的珙垌科乔木―喜树中分离提取的一种微量生物碱。
羟基喜树碱抗癌机制独特,通过选择性的抑制拓扑异构酶I而干扰DNA的复制,具有高效低毒、广谱抗癌的特点,与其它常用抗肿瘤药物无交叉耐药性,对多种抗药性肿瘤仍然有效[1-2]。
羟基喜树碱是目前从喜树中分离的20多个单体中抗癌作用最强的化合物。
羟基喜树碱临床用于膀胱癌、直肠癌、肝癌、白血病及头颈部肿瘤等[3-9]。
超滤技术是通过膜表面的微孔结构对物质进行选择性分离,从而实现大、小分子的分离、浓缩、净化的目的。
超滤技术具有滤过程是在常温下进行,条件温和无成分破坏;滤过程不发生相变化;能耗低;超滤技术分离效率高;流程短;操作简便;易于控制和维护等特点。
本实验采用超滤技术去除羟基喜树碱中的细菌内毒素。
1.仪器与试药P230高效液相色谱仪(大连依利特分析仪器有限公司);ABS220-4分析天平(德祥科技有限公司);板框超滤膜(海宁市桃沅膜分离厂,截留分子量MWCO=10kDa);QTR3120基本加热型超声波清洗器(天津市瑞普电子仪器公司);BET-72细菌内毒素测定仪(天大天发科技有限公司);LPD2500多管漩涡混合仪(莱普特科学仪器(北京)有限公司);XYG-H帕恩特痕量分析级超纯水机(北京湘顺源科技有限公司);10L大型旋转蒸发仪(北京赛美思仪器设备有限公司);KHW-D-1LC精密拉伸水浴锅(上海科恒实业发展有限公司);SHB-III 循环水真空泵(西安中诺仪器有限公司);BT100-01蠕动泵(保定齐力恒流泵有限公司);TGL20MW台式大容量高速冷冻离心机(湖南赫西离心机仪器有限公司);0.5平米板框式超滤器(吉林敖腾生物科技有限责任公司);DGG-9030A电热鼓风干燥箱(北京鸿达天矩试验设备有限公司)。
内毒素的检测和去除1 内毒素及其来源1.1内毒素内毒素(endotoxin)是存在于革兰氏阴性菌细胞壁外膜表面的一种大分子物质,一般只有在细胞死亡或分解时自行释放到周围介质中,特殊条件下也可以从活细胞中直接泄漏出来。
内毒素又被称为热原,是一种脂多糖物质,具有耐热性,不易被去除。
若疫苗中存在一定浓度的内毒素,接种动物后,可引起动物发热,休克等,严重时甚至造成死亡。
1.2内毒素的来源因为革兰氏阴性菌无处不在,所以内毒素几乎存在于任何地方。
在疫苗生产中一定要重视和尽可能减少内毒素的污染。
生产用水中内毒素的含量是导致疫苗安全性的关键因素之一。
大量研究表明,疫苗生产过程中内毒素主要来源于培养液和配制用水,其在贮存过程中易受到革兰氏阴性菌的污染。
贮水罐,纯水系统的过滤器和连接管道,以及培养液容器等都可能受到革兰氏阴性菌的污染。
工作人员进出车间携带的物品,以及空气净化系统久不维护,都有可能造成生产车间内的空气尘埃浓度升高,导致内毒素污染。
生产用具、管道、泵、阀门、滤器等的清洗消毒不彻底也会造成内毒素污染。
生产原料的污染,如血液制品,细胞培养基。
人为操作不规范也会引起内毒素污染。
2内毒素的检测目前,内毒素的检测方法较多,但是各存在利弊,因此,选取检测方法要根据实际需求,不建议采取单一的检测方法。
2.1鲎试验法鲎试验法是通过酶的级联反应而实现,内毒素在二价阳离子的参与下激活C因子(FC),然后激活其它酶原,产生一系列凝集酶反应。
该方法是目前检测内毒素最特异和最灵敏的方法。
2.2重组C因子法重组C因子法是使用一个单一的蛋白(重组C因子)作为有效活性成分。
反应中内毒素激活重组C因子,活化的重组C因子将荧光底物裂解,产生荧光复合物,定量检测荧光复合物来量化内毒素。
这种方法可有效避免假阳性的产生。
该方法可用于药品生产,环境,器械生产中的内毒素检测。
2.3热原试验法该方法是比较广泛的检测热原的方法,利用微量内毒素可引起动物体温升高的特性来测试其含量。
超滤技术在狂犬病疫苗生产中除内毒素的应用
罗濛
【期刊名称】《中国药业》
【年(卷),期】2008(17)16
【摘要】目的利用超滤技术去除狂犬病疫苗生产过程中产生的细菌内毒素.方法采用截留相对分子质量30万的超滤膜对狂犬病毒收获液进行浓缩超滤,检测超滤后狂犬病毒浓缩液中内毒素残留量.结果用超滤技术去除狂犬病疫苗生产过程中产生的热原时,在适宜的压力下,狂犬病毒收获液浓缩80倍、洗脱25倍,细菌内毒素去除率可达87.5%~98.7%.结论采用截留相对分子质量为30万的超滤膜,以最佳运行参数进行去除内毒素的方法可以在工业化生产中推广.
【总页数】2页(P51-52)
【作者】罗濛
【作者单位】辽宁省沈阳市药品快速检验所,辽宁,沈阳,110013
【正文语种】中文
【中图分类】TQ460.7
【相关文献】
1.超滤技术在化工生产中的应用 [J], 张兴;王钢;罗仕现;徐云椿
2.超滤技术在三聚氰胺生产中的应用 [J], 李娟
3.浅谈超滤技术在中药生产中的应用 [J], 赵晋红
4.超滤技术在Cream干酪生产中的应用 [J], 周璐;张莉;杨贞耐
5.应用鲎试剂法检测人用纯化狂犬病疫苗的内毒素 [J], 王忠海;苏文全;孙英;刘洪旭
因版权原因,仅展示原文概要,查看原文内容请购买。
超滤法去除中药注射液中的细菌内毒素
尹楠;李红阳;彭国平;郑云枫
【期刊名称】《中国医药工业杂志》
【年(卷),期】2008(39)12
【摘要】用动态浊度法定量检测细菌内毒素的含量,以10k及50k截留分子量的超滤膜超滤,评价超滤技术去除三种自制中药注射液中细菌内毒素的效果。
结果显示,各药液经超滤后,内毒素的含量均在0.388~0.843EU/ml,内毒素去除效率大于90%。
【总页数】3页(P927-929)
【关键词】超滤;细菌内毒素;动态浊度法;中药注射液
【作者】尹楠;李红阳;彭国平;郑云枫
【作者单位】南京中医药大学中医药研究院
【正文语种】中文
【中图分类】R927.12;TQ028
【相关文献】
1.超滤技术去除羟基喜树碱中细菌内毒素的研究 [J], 杨茹
2.细菌内毒素定量法研究活性炭与超滤法热原去除工艺 [J], 李存玉;郑云枫;李红阳;尹楠;彭国平
3.超滤技术去除刺五加注射液中细菌内毒素 [J], 范能全;陈光春;彭兰
4.超滤法去除森林脑炎灭活疫苗原液细菌内毒素的效果分析 [J], 费刚
5.超滤法去除细菌内毒素 [J], 王铮;张惠新;戴海平
因版权原因,仅展示原文概要,查看原文内容请购买。