第12章s区元素课后习题答案
- 格式:doc
- 大小:57.50 KB
- 文档页数:7


第9章 s 区元素【9-1】试说明碱金属和碱土金属在同一族从上到下,同一周期从左到右下列性质递变的情况:(1)离子半径,(2)电离能,(3)离子水和能。
并解释原因。
解:(1)碱金属和碱土金属从上到下离子半径增大,这是因为随着主量子数的增加,外层电子在核外出现概率最大的距离明显增加;在同一周期中,从左到右离子半径减小,这是因为随着核电荷的增加,核对于核外电子的吸引力(即有效核电荷)增强的缘故。
(2)碱金属和碱土金属从上到下电离能减小,是因为随着原子半径的增加,原子核对外层电子的束缚力减小;在同一周期中,从左到右电离能增大,这是因为随着有效核电荷的增加,和对外层电子的束缚力增加的缘故。
(3)碱金属和碱土金属从上到下水合能减小,这是因为随着原子序数增加,离子半径增加,正离子与水分子相互作用力减小的缘故。
在同一周期中,从左到右水合能增加,碱土金属离子在水溶液中,均为正二价离子,所以电荷高于正一价碱金属离子的缘故。
【9-2】锂、钠、钾在氧气中燃烧生成何种氧化物?这些氧化物与水反应情况如何?以化学方程式来说明。
解:分别生成Li 2O 、Na 2O 2、KO 2 ; 【9-3】写出下列反应方程式: (1)Al 溶于NaOH 溶液中 (2)Ba(NO 3)2加热分解 (3)Na 2O 2+CO 2 (4)CaH 2+H 2O(5)Na 2O 2+Cr 2O 3(6)K+KNO 3解:(1) 2Al + 2NaOH + 6H 2O = 2NaAl(OH)4 + 3H 2↑(2)Ba(NO 3)2 = Ba(NO 2)2 + O 2↑(3) 2Na 2O 2 + 2CO 2 =2NaCO 3 + O 2(4) CaH 2 + 2H 2O =Ca(OH)2 + 2H 2↑(5) 3Na 2O 2 + Cr 2O 3 = 2Na 2CrO 4 + Na 2O(6) 10K + 2KNO 3 = 6K 2O + N 2↑【9-4】比较下列性之的大小: (1)溶解度:CsI ,LiI ,CsF ,LiF ,LiClO 4,KClO 4 (2)碱性的强弱:Be(OH)2, Mg(OH)2,Ca(OH)2, NaOH (3)分解温度:Na 2CO 3,NaHCO 3,MgCO 3, K2CO 3 (4)水和能:Na +, K +,Mg 2+,Be 2+ 解:(1)溶解度:CsI<LiI; CsF>LiF; LiClO 4>KClO 4(2)碱性的强弱:Be(OH)2<Mg(OH)2<Ca(OH)2<NaOH (3)分解温度: K 2CO 3>Na 2CO 3> MgCO 3>NaHCO 3 (4)水和能:Na +>K +> Be 2+>Mg 2+【9-5】解释下列事实:(1)卤化锂在非极性溶剂中的溶解度大小顺序为LiI >LiBr >LiCl >LiF 。



第37讲原子结构与元素周期表、元素性质考纲要求1.了解原子核外电子的运动状态、能级分布和排布原理,能正确书写1~36号元素原子核外电子、价电子的排布式和轨道表达式。
2.了解电离能的含义,并能用以说明元素的某些性质。
3.了解电子在原子轨道之间的跃迁及其简单应用。
4.了解电负性的概念,并能用以说明元素的某些性质。
考点一原子核外电子排布原理1.电子层、能级与原子轨道(1)电子层(n):在多电子原子中,核外电子的能量是不同的,按照电子的能量差异将其分成不同电子层。
通常用K、L、M、N……表示,能量依次升高。
(2)能级:同一电子层里电子的能量也可能不同,又将其分成不同的能级,通常用s、p、d、f 等表示,同一电子层里,各能级的能量按s、p、d、f的顺序依次升高,即:E(s)<E(p)<E(d)<E(f)。
(3)原子轨道:电子云轮廓图给出了电子在核外经常出现的区域。
这种电子云轮廓图称为原子轨道。
特别提醒第一电子层(K),只有s能级;第二电子层(L),有s、p两种能级,p能级上有三个原子轨道p x、p y、p z,它们具有相同的能量;第三电子层(M),有s、p、d三种能级。
2.基态原子的核外电子排布(1)能量最低原则:即电子尽可能地先占有能量低的轨道,然后进入能量高的轨道,使整个原子的能量处于最低状态。
如图为构造原理示意图,即基态原子核外电子在原子轨道上的排布顺序图:注意所有电子排布规则都需要满足能量最低原则。
(2)泡利不相容原理每个原子轨道里最多只能容纳2个电子,且自旋状态相反。
如2s轨道上的电子排布为,不能表示为。
(3)洪特规则当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,且自旋状态相同。
如2p3的电子排布为,不能表示为或。
洪特规则特例:当能量相同的原子轨道在全满(p6、d10、f14)、半满(p3、d5、f7)和全空(p0、d0、f0)状态时,体系的能量最低,如:24Cr的电子排布式为1s22s22p63s23p63d54s1或[Ar]3d54s1。
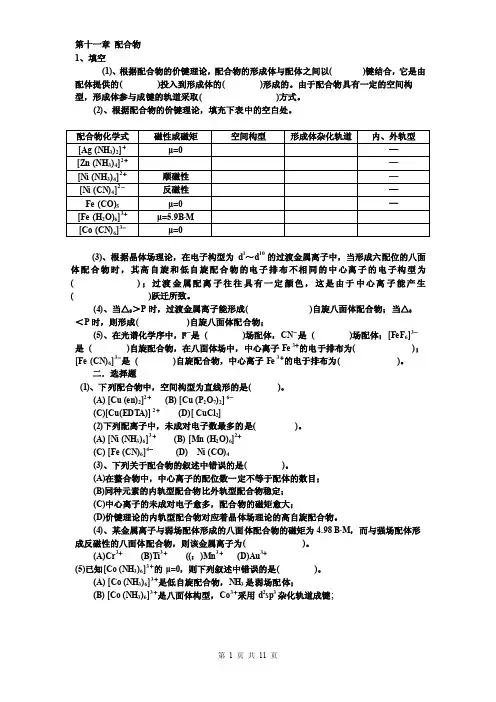
第十一章配合物1、填空(1)、根据配合物的价键理论,配合物的形成体与配体之间以( )键结合,它是由配体提供的( )投入到形成体的( )形成的。
由于配合物具有一定的空间构型,形成体参与成键的轨道采取( )方式。
(2)、根据配合物的价键理论,填充下表中的空白处。
(3)、根据晶体场理论,在电子构型为d1~d10的过渡金属离子中,当形成六配位的八面体配合物时,其高自旋和低自旋配合物的电子排布不相同的中心离子的电子构型为( );过渡金属配离子往往具有一定颜色,这是由于中心离子能产生( )跃迁所致。
(4)、当△0>P时,过渡金属离子能形成( )自旋八面体配合物;当△0<P时,则形成( )自旋八面体配合物;(5)、在光谱化学序中,F-是( )场配体,CN-是( )场配体;[FeF6]3-是( )自旋配合物,在八面体场中,中心离子Fe 3+的电于排布为( );[Fe (CN)6]3-是( )自旋配合物,中心离子Fe 3+的电于排布为( )。
二.选择题(1)、下列配合物中,空间构型为直线形的是( )。
(A) [Cu (en)2]2+(B) [Cu (P2O7)2] 6-(C)[Cu(EDT A)] 2+(D)[ CuCl2](2)下列配离子中,未成对电子数最多的是( )。
(A) [Ni (NH3)6]3+(B) [Mn (H2O)6]2+(C) [Fe (CN)6]4-(D) Ni (CO)4(3)、下列关于配合物的叙述中错误的是( )。
(A)在螯合物中,中心离子的配位数一定不等于配体的数目;(B)同种元素的内轨型配合物比外轨型配合物稳定;(C)中心离子的未成对电子愈多,配合物的磁矩愈大;(D)价键理论的内轨型配合物对应着晶体场理论的高自旋配合物。
(4)、某金属离子与弱场配体形成的八面体配合物的磁矩为4.98 B·M,而与强场配体形成反磁性的八面体配合物,则该金属离子为( )。
(A)Cr3+(B)Ti3+((:)Mn3+(D)Au3+(5)已知[Co (NH3)6]3+的μ=0,则下列叙述中错误的是( )。

第12-16章P区元素习题目录一判断题;二选择题;三填空题;四完成方程式;五计算并回答问题一判断题 (返回目录)1 硼在自然界主要以含氧化合物的形式存在。
()2 在硼与氢形成的一系列共价型氢化物中,最简单的是BH3。
()3 硼酸是三元酸。
()4 硼是非金属元素,但它的电负性比氢小。
()5 由于B-O键键能大,所以硼的含氧化合物很稳定。
()6 硼砂的化学式为Na2B2O7。
()7 B2H6为平面形分子。
()8 硼是缺电子原子,在乙硼烷中含有配位键。
()9 三卤化硼熔点的高低次序为BF3<BCl3<BBr3<BI3。
()10 三卤化硼沸点的高低次序为BF3>BCl3>BBr3>BI3。
()11 地壳中丰度最大的金属元素是铝。
()12 Al2O3是两性氧化物,因而各种晶型的Al2O3既可溶于酸,又可溶于碱。
()13 只有在强酸性溶液中才有Al(H2O)63+存在。
()14 在气相中三氯化铝以双聚分子Al2Cl6的形式存在。
()15 AlX3都是共价型化合物。
()16 KAl(SO4)2·12H2O与KCr(SO4)2·12H2O属于同分异构体。
()17 在氯化氢气流中加热金属铝可制得无水AlCl3。
()19 因AlCl3分子中Al为缺电子原子,所以AlCl3中有多中心键。
()20 碳酸盐的溶解度均比酸式碳酸盐的溶解度小。
()21 Na2CO3比NaHCO3的溶解度大,同理,CaCO3比Ca(HCO3)2的溶解度也大。
()22 硅在地壳中的含量仅次于氧。
()23 分子筛是人工合成的硅铝酸盐,具有吸附和催化作用。
()24 活性炭具有吸附作用,它是颗粒状的石墨。
()25 金刚石比石墨更稳定,即使在纯氧气中,金刚石也不能燃烧。
()26 一般情况下,CO2不能助燃,但是镁在二氧化碳气体中能燃烧。
()27 高纯度的硅和锗是良好的半导体。
()28 金刚石与石墨是同素异形体,由金刚石转变为石墨的△r H>0。

第11章s区元素和稀有元素习题解答(总21页)--本页仅作为文档封面,使用时请直接删除即可----内页可以根据需求调整合适字体及大小--第11章习题解答第11章(03525)重水是由H和O组成的水。
.()解:错第11章(03526)氢在自然界中主要以单质形式存在。
()解:错第11章(03527)由于H是双原子分子,所以H比He的扩散速率小。
.()解:错第11章(03528)氢气是最轻的单质,所以它的熔点和沸点在所有单质中最低。
.()解:错第11章(03529)因为氢分子的极化率大于氦分子的极化率,所以氢的熔点比氦高。
.()解:对第11章(03530)常温下H的化学性质不很活泼,其原因之一是H-H键键能较大。
()解:对第11章(03531)实验室所用氢气钢瓶应放在室外,这是因为氢气.()。
(A)密度小;(B)扩散快;(C)易燃易爆;(D)导热性好。
解:C第11章(03532)水煤气的主要成分是.()。
(A)CO和N;(B)CO和O;(C)CO和H;(D)CO和HO。
解:C第11章(03533)下列氢气制法中,工业上不常采用的是.()。
(A)电解法;(B)水煤气法;(C)甲烷转化法;(D)活泼金属与酸反应。
解:D第11章(03534)下列反应方程式中,不适用于工业制氢的是()。
(A)HO(电解)→H+O;(B)Zn+HSO→ZnSO+H;(C)C+HO(g)∆−CO+H;−→(D)CH+HO(g)∆,Ni,Co−−−−CO+H。
−→解:B第11章(03539)在某些工厂用氢气做冷却剂,这是因为氢气.()。
(A)密度小;(B)扩散快;(C)易燃易爆;(D)导热性好。
解:D第11章(03535)下列氢气制法中,工业上不常采用的是.()。
(A)电解法;(B)水煤气法;(C)甲烷转化法;(D)碱金属氢化物与水反应。
解:D第11章(03536)下列分子或离子不能存在的是.()。
(A)H;(B)H;(C)H;(D)H。


s区、d区、ds区重要元素及其化合物(s Block, ds Block, d Block Elements and Compounds)9.1 s区元素s区元素中锂(Lithium)、钠(Sodium)、钾(Potassium)、铷(Rubidium)、铯(Cesium)、钫(Francium)六种元素被称为碱金属(alkali Metals)元素。
铍(Beryllium)、镁(Magnesium)、钙(Calcium)、锶(Strontium)、钡(Barium)、镭(Radium)六种元素被称为碱土金属(alkaline earth metals)元素。
锂、铷、铯、铍是稀有金属元素,钫和镭是放射性元素。
碱金属和碱土金属原子的价层电子构型分别为ns1和ns2,它们的原子最外层有1~2个电子,是最活泼的金属元素。
9.1.1 通性碱金属和碱土金属的基本性质分别列于表9-1和表9-2中。
表9-1碱金属的性质碱金属原子最外层只有1个ns电子,而次外层是8电子结构(Li的次外层是2个电子),它们的原子半径在同周期元素中(稀有气体除外)是最大的,而核电荷在同周期元素中是最小的,由于内层电子的屏蔽作用较显著,故这些元素很容易失去最外层的1个s电子,从而使碱金属的第一电离能在同周期元素中最低。
因此,碱金属是同周期元素中金属性最强的元素。
碱土金属的核电荷比碱金属大,原子半径比碱金属小,金属性比碱金属略差一些。
s区同族元素自上而下随着核电荷的增加,无论是原子半径、离子半径,还是电离能、电负性以及还原性等性质的变化总体来说是有规律的,但第二周期的元素表现出一定的特殊性。
例如锂的EΘ(Li+/Li)反常地小。
表9-2碱土金属的性质s区元素的一个重要特点是各族元素通常只有一种稳定的氧化态。
碱金属的第一电离能较小,很容易失去一个电子,故氧化数为+1。
碱土金属的第一、第二电离能较小,容易失去2个电子,因此氧化数为+2。
在物理性质方面,s区元素单质的主要特点是:轻、软、低熔点。
第四章物质结构元素周期律第一节原子结构与元素周期表第1课时原子结构元素周期表课后篇素养形成合格考达标练1.元素X的原子有3个电子层,最外电子层上有4个电子。
则X元素位于元素周期表的()A.第四周期第ⅢA族B.第四周期第ⅦA族C.第三周期第ⅣB族D.第三周期第ⅣA族=电子层数,主族序数=最外层电子数,可知D项正确。
2.下列说法肯定错误的是()A.某原子K层上只有一个电子B.某原子M层上电子数为L层上电子数的4倍C.某离子M层上和L层上电子数均为K层上电子数的4倍D.某离子的核电荷数与最外电子层上的电子数相等层、L层、M层上最多能容纳的电子数分别为2、8、18。
K层上可排1个电子,也可排2个电子,A项有可能;当M层上排有电子时,L层已经排满电子,即排了8个电子,而M层最多可以排18个电子,B项不可能;符合“M层上和L层上电子数均为K层上电子数的4倍”的离子可以是S2-、Cl-、K+、Ca2+等,C项有可能;D项,最外电子层上的电子数可为2或8,核电荷数和最外层电子数均为2的只有He,不符合条件,核电荷数和最外层电子数均为8的为O2-,D项有可能。
3.下列各原子结构示意图中所表示的核外电子排布正确的是():①电子排布遵循能量最低原理;②各电子层最多所能容纳的电子数目为2n2;③原子最外层电子数不能超过8(K层为最外层时不能超过2)。
A项不符合能量最低原理,应该先排满K层再排L层,所以A项错误;B项不符合各层最多排2n2个电子,K层最多排2个电子,所以B项错误;D项不符合最外层最多只能排8个电子,所以D项错误。
4.(2020湖北天门、潜江、应城高一期中联考)元素周期表是学习化学的重要工具。
如图是元素周期表中的一格,从中获取的信息不正确的是()A.该元素的元素符号为TeB.该元素属于金属元素C.该元素的原子核外有52个电子D.该元素的相对原子质量为127.6,该元素的元素符号为Te,A项正确;根据元素周期表中的一格可知,该元素的名称是碲,带“石”字旁,属于非金属元素,B项错误;根据元素周期表中的一格可知,左上角的数字为52,表示原子序数为52,根据原子序数=核电荷数=质子数=原子核外电子数,则该元素的原子核外电子数为52,C项正确。
ds 区元素1、试从原子结构方面说明铜族元素和碱金属元素在化学性质上的差异。
解:铜族元素价电子层结构为(n -1)d 10ns 1,与碱金属元素相比,最外层电子数相同,都是ns 1,而次外层电子数目不同,铜族元素次外层为18电子,而碱金属次外层8个电子,18电子的屏蔽比8电子要小得多,铜族的有效核电荷多,最外层s 电子受核的引力强,不易失去,相应的电离势高,原子半径小。
故与碱金属元素在化学性质上有很大的差异。
2、简述:(1)怎样从闪锌矿冶炼金属锌?(2)怎样从辰砂制金属汞?解:(1)闪锌矿通过浮选法得到含有ZnS 40—60%的精矿后,加以焙烧使它转化为氧化锌再把氧化锌和焦碳混合,在鼓风机中加热至1473—1573K ,使锌蒸馏出来,主要反应为:2ZnS + 3O 2 == 2ZnO + 2SO 22C + O 2 == 2COZnO + CO == Zn(g) + CO 2(2)辰砂在空气中焙烧与铁或氧化钙共热都可以得到汞:HgS + O 2 Hg + SO 2↑HgS + Fe == FeS + Hg4HgS + 4CaO == 4Hg + 3CaS + CaSO 44、利用金属的电极电势值,说明铜、银、金在碱性氰化物水溶液中被溶解的原因,空气中的氧对溶解过程有何影响,CN -离子在溶解液中的作用是什么?答: θϕCu/Cu 2+= 0.3402V θϕCu /Cu += 0.522V θϕAg /Ag + = 0.799V θϕA u /A u +=1.68V O 2 + 4H +(10-7mol ·L -1) + 4e == 2H 2OθϕO H /O 22= 0.814V 当溶解液中存在NaCN 时,CN -能与Cu +、Ag +、Au +形成稳定的配离子,Cu +、Ag +、Au +浓度大大降低,使它们的电势也降低很多,它们的还原能力大为提高,这时空气中的氧就能将它们氧化为配离子而溶解:[Cu(CN)2]-+ e == Cu + + 2CN - θE = -0.43V [Ag(CN)2]- + e == Ag + 2CN -θE = -0.31V [Au(CN)2]- + e == Au + 2CN - θE = -0.6VO 2 + 2H 2O + 4e == 4OH -θE = 0.401V溶液中[H +]应根据CN -水解计算,当[CN -]=1mol ·L -1时,水解得到溶液中的[H +]=10-12 mol ·L -1,故下面的溶解反应能进行。