s区元素概述
- 格式:pdf
- 大小:727.45 KB
- 文档页数:16


无机化学S区元素概述单质及其物理化学性质S区元素是指周期表中第三周期的元素,包括Sc、Ti、V、Cr、Mn、Fe、Co、Ni、Cu和Zn。
这些元素的单质是指它们在自然界中以纯态存在的形态。
下面将对这些S区元素的单质及其物理化学性质进行概述。
Scandium(Sc)是一种银白色金属,熔点1541℃,沸点2836℃。
它的密度为2.989 g/cm³,熔化热为15.8 kJ/mol。
Scandium的化学性质活泼,可以与氢气、氧气和氮气反应。
它可以形成多种化合物,如ScCl3、Sc2O3等。
Titanium(Ti)是一种银灰色金属,熔点1668℃,沸点3260℃。
它的密度为4.506 g/cm³,熔化热为13.8 kJ/mol。
Titanium具有低密度、高强度和良好的耐腐蚀性。
它与氧、氮、氢等非金属元素反应生成化合物,如TiO2、TiN等。
Vanadium(V)是一种银白色金属,熔点1890℃,沸点3380℃。
它的密度为6.0 g/cm³,熔化热为21.5 kJ/mol。
Vanadium的化学性质活泼,可以与氧气、氮气和氟气反应。
它可以形成多种氧化态,如V2O5、VO2等。
Chromium(Cr)是一种银灰色金属,熔点1907℃,沸点2672℃。
它的密度为7.18 g/cm³,熔化热为20.5 kJ/mol。
Chromium的外层电子构型为3d54s1,具有良好的抗腐蚀性。
它可以形成多种化合物,如Cr2O3、CrCl3等。
Manganese(Mn)是一种银灰色金属,熔点1244℃,沸点1962℃。
它的密度为7.21 g/cm³,熔化热为13.2 kJ/mol。
Manganese与氧气反应生成二氧化锰(MnO2),具有一定的催化性能。
它还可以形成多种化合物,如MnCl2、MnSO4等。
Iron(Fe)是一种银灰色金属,熔点1538℃,沸点2861℃。
它的密度为7.874 g/cm³,熔化热为13.8 kJ/mol。


无机化学第七章S区元素第七章主要介绍了S区元素的性质和应用。
S区元素是指周期表中第16族元素,包括氧、硫、硒、碲和钋。
这些元素具有一些共同的性质和特点,包括氧化态的规律和趋势、同族元素的化学性质等。
S区元素的氧化态规律和趋势是其重要的特点之一、氧化态是指元素在化合物中的电荷数。
在S区元素中,氧通常呈-2的氧化态,露卜那呈-1的氧化态,硫、硒和碲的氧化态则比较复杂,可以是正或负的多个值。
这种规律是由于这些元素的外层电子结构决定的。
氧的外层有6个电子,可以通过接受2个电子来填满外层,从而达到稳定的8个电子的结构。
而露卜那的外层只有一个电子,可以通过捐赠一个电子来达到稳定的结构。
而硫、硒和碲的外层电子结构类似,有6个电子,可以通过得失2个电子来达到稳定的8个电子的结构。
在S区元素中,氧是一个非金属元素,而硫、硒和碲则是亚稳金属。
氧具有较高的电负性,能够与其他元素形成较强的电负性键。
它在自然界中广泛存在,包括空气中的氧气、水中的水分子等。
由于氧的高电负性,它可以与其他元素形成氧化物,包括过氧化物、酸性氧化物和碱性氧化物等。
氧化物有着重要的应用,例如过氧化氢可用作漂白剂和消毒剂。
硫、硒和碲是黄顺子亚稳金属,它们具有较高的化学活性。
它们主要存在于矿石中,包括铁矿石中的硫化铁矿石。
硫还广泛存在于化学品中,包括硫酸、硫酸铜等。
硫还可以形成众多的无机化合物,例如硫化物和亚硫酸盐。
硫化物在冶金工业中有重要应用,例如焦炭的熔融炉和脱硫设备。
在亚稳金属中,硒是比较特殊的元素。
它可以形成六亚硒酸盐,具有良好的光敏性。
六亚硒酸盐可以用于摄影中的胶片和相纸的显影剂,以及红外线辐射计的探测剂。
此外,硒还可以形成硒化物,具有一定的半导体性能。
碲也是一种亚稳金属,具有类似硒的性质。
它可以形成一种黑色固体的碲化铋,具有比较好的半导体性能。
碲化铋被广泛应用于红外线成像和热电传感器等领域。
除了硫、硒和碲,S区元素中还有钋,它是一种放射性元素。
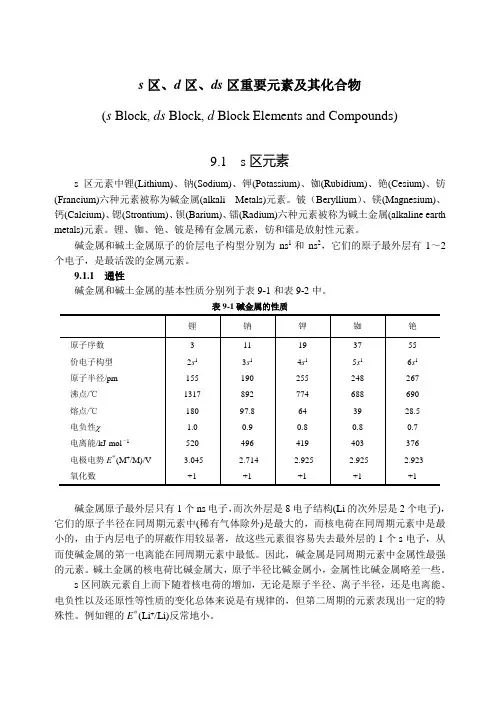
s区、d区、ds区重要元素及其化合物(s Block, ds Block, d Block Elements and Compounds)9.1 s区元素s区元素中锂(Lithium)、钠(Sodium)、钾(Potassium)、铷(Rubidium)、铯(Cesium)、钫(Francium)六种元素被称为碱金属(alkali Metals)元素。
铍(Beryllium)、镁(Magnesium)、钙(Calcium)、锶(Strontium)、钡(Barium)、镭(Radium)六种元素被称为碱土金属(alkaline earth metals)元素。
锂、铷、铯、铍是稀有金属元素,钫和镭是放射性元素。
碱金属和碱土金属原子的价层电子构型分别为ns1和ns2,它们的原子最外层有1~2个电子,是最活泼的金属元素。
9.1.1 通性碱金属和碱土金属的基本性质分别列于表9-1和表9-2中。
表9-1碱金属的性质碱金属原子最外层只有1个ns电子,而次外层是8电子结构(Li的次外层是2个电子),它们的原子半径在同周期元素中(稀有气体除外)是最大的,而核电荷在同周期元素中是最小的,由于内层电子的屏蔽作用较显著,故这些元素很容易失去最外层的1个s电子,从而使碱金属的第一电离能在同周期元素中最低。
因此,碱金属是同周期元素中金属性最强的元素。
碱土金属的核电荷比碱金属大,原子半径比碱金属小,金属性比碱金属略差一些。
s区同族元素自上而下随着核电荷的增加,无论是原子半径、离子半径,还是电离能、电负性以及还原性等性质的变化总体来说是有规律的,但第二周期的元素表现出一定的特殊性。
例如锂的EΘ(Li+/Li)反常地小。
表9-2碱土金属的性质s区元素的一个重要特点是各族元素通常只有一种稳定的氧化态。
碱金属的第一电离能较小,很容易失去一个电子,故氧化数为+1。
碱土金属的第一、第二电离能较小,容易失去2个电子,因此氧化数为+2。
在物理性质方面,s区元素单质的主要特点是:轻、软、低熔点。


s中s元素的化合价化合价是指元素在化合物中与其他元素结合时所具有的电荷数目。
它是描述元素化学性质的重要参数之一,对于理解元素间的化学反应和化合物的性质至关重要。
本文将详细介绍s区中各个元素的化合价及其相关特点。
1. 氢(H)氢是最简单的元素,其原子核只含有一个质子,没有中子。
在大多数情况下,氢原子只能形成+1价离子(H+)。
但在某些特殊情况下,氢可以捕获一个电子形成-1价离子(H-)。
2. 铷(Rb)、铯(Cs)、钾(K)、钠(Na)、锂(Li)这些元素都属于碱金属,它们具有非常活泼的性质。
在化合物中,它们通常以+1价离子形式存在。
3. 镁(Mg)镁是一种碱土金属,在大多数情况下以+2价离子形式存在。
4. 钙(Ca)、锶(Sr)、钡(Ba)这些元素也属于碱土金属,它们通常以+2价离子形式存在。
5. 铝(Al)铝是一种典型的金属元素,它通常以+3价离子形式存在。
6. 碳(C)碳是一种非金属元素,它在化合物中可以形成多种化合价,最常见的是+4价和-4价。
+4价的碳形成了许多常见的有机物,如甲烷(CH4)、乙烷(C2H6)等。
-4价的碳则形成了一些特殊的化合物,如二氧化碳(CO2)。
7. 硼(B)硼是一种金属loid元素,在大多数情况下以+3价离子形式存在。
8. 氮(N)氮是一种非金属元素,它在化合物中通常以-3价离子形式存在。
例如,在氨气(NH3)中,氮原子带有三个额外的电子。
9. 氧(O)氧是一种非金属元素,它在化合物中通常以-2价离子形式存在。
例如,在水分子(H2O)中,氧原子带有两个额外的电子。
10. 硫(S)硫也是一种非金属元素,在大多数情况下以-2或+6价离子形式存在。
例如,在硫化物(如硫化氢,H2S)中,硫以-2价存在;而在二氧化硫(SO2)中,硫以+6价存在。
11. 氟(F)氟是一种非金属元素,它在化合物中通常以-1价离子形式存在。
例如,在氟化钠(NaF)中,氟原子带有一个额外的电子。


第 三 部 分 元 素 化 学•熟悉元素性质与电子层结构的关系 •掌握单质和重要化合物的性质•了解它们在医药中的应用结束无机化学 2014/12/1 §12-15 : 2从上到下 半径增大 电离能减小 电负性减小第一节 s 区元素概述第十一章 s 区元素ⅠA ns 1 Li Na K Rb Cs ⅡA ns 2 Be Mg Ca Sr Ba碱金属 碱土金属从左到右,半径减小电离能增大 电负性增大除Li 和Be 外,多数金属形成离子化合物。
p273结束 无机化学 2014/12/1 §12-15 : 7NaHCO 3:小苏打,用于治疗胃酸过多和酸中毒; CaCO 3: 珍珠、钟乳石、贝壳的主要成分;Na 2SO 4·10H 2O : 中药称芒硝或朴硝,作缓泻剂; Na 2SO 4 :中药称玄明粉或元明粉,作缓泻剂; BaSO 4: 重晶石,难溶于水、酸、碱,能强烈吸收X 射线,因无毒用作胃肠造影剂之“钡餐”; BaCl 2:剧毒(致死量0.8g )。
CaSO 4·2H 2O 生石膏,内服清热泻火; CaSO 4· H 2O 熟石膏(煅石膏, 烧石膏)粉末遇水膨胀硬化,石膏绷带,外敷治疗烫伤疥疮等。
MgSO 4·7H 2O :又称泻盐,作缓泻剂。
四、重要的盐类 p28112结束无机化学 2014/12/1 §12-15 : 8 五、对角线规则 p282在周期表s 区和p 区,某元素与左上方或右下方的元素及其化合物的性质相似。
例如:Be 和Al 的还原性相近; Be(OH)2和Al(OH)3 均为两性;例如:LiCl,、MgCl 2 都是共价化合物; LiOH 、Mg(OH)2都是中强碱,微溶于水Li Be B C Na Mg Al Si结束 无机化学 2014/12/1 §12-15 : 9VIIA 族 n s 2n p 59F 17Cl 35Br 53I 85At一、卤族元素的通性 (p284)(1) 是非极性分子,难溶于水,易溶于有机溶剂及碘化钾溶液中:KI + I 2 = KI 3 碘酒(碘酊)(p306习题3) F 2→I 2 的熔点、沸点、密度增大。
s区元素蓝色代表s区元素,氦也属于s区元素。
s区元素主要包括元素周期表中IA族元素和IIA族元素,IA族元素包括氢、锂、钠、钾、铷、铯、鍅七种元素,由于钠和钾的氢氧化物是典型的碱,因此除氢外的这六种元素又称碱金属,IIA族元素包括铍、镁、钙、锶、钡、镭六种元素,由于钙,锶,钡的氧化物之性质介于碱金属与稀土元素之间,因此又称碱土金属。
由于氦的电子排布为1s2,故被分为S区元素。
钫和镭都是放射性元素。
锂最重要的矿石是锂辉石(LiAlSi2O6)。
钠主要以氯化钠溶液的形式存在于海洋,盐湖及岩石中。
钾的主要矿物是钾石盐(2KCl·MgCl2·6H2O)。
铍的主要矿物是绿柱石(3BeO·Al2O3·6SiO2)。
镁的主要矿石是菱镁矿(MgCO3)及白云石。
另外,钙,锶,钡则主要以碳酸盐及硫酸盐的形式存在,如方解石(碳酸钙),石膏(二水合硫酸钙),天青石(硫酸锶),重晶石(硫酸钡)。
在本区元素中同一主族从上到下、同一周期从左至右性质的变化都呈现明显的规律性。
p区元素p区元素包括元素周期表中IIIA族元素~VIIIA族元素。
IIIA族元素又称为硼族元素,包括硼、铝、镓、铟、铊等元素;IVA族元素又称作碳族元素,包括碳、硅、锗、锡、铅等元素;VA族元素又称作氮族元素,包括氮、磷、砷、锑、铋等元素;VIA族元素又称为氧族元素,包括氧、硫、硒、碲、钋等元素;VIIA族元素又称卤素,包括氟、氯、溴、碘、砹等元素;VIIIA族元素或0族元素,又称为稀有气体或惰性气体,包括氦、氖、氩、氪、氙、氡等元素。
d区元素d区元素是元素周期表中的副族元素,即第3至第12族元素。
这些元素中具有最高能量的电子是填在d轨道上的。
这些元素有时也被称作过渡金属。
D区的D来自英语的“diffuse”。
ds区元素ds区元素是指元素周期表中的ⅠB、ⅡB两族元素,包括铜、银、金、锌、镉、汞6种自然形成的金属元素和錀、鎶2种人工合成元素。