新教案13c
- 格式:doc
- 大小:217.50 KB
- 文档页数:5

第一课时烷烃的结构[明确学习目标] 1.了解有机物中碳原子的成键特点。
2.掌握甲烷的分子结构。
3.了解烷烃的概念、通式及结构特点。
4.理解同系物、同分异构体的概念并会判断和书写简单烷烃的同分异构体。
学生自主学习1.有机化合物中碳原子的成键特点014个共价键,而且碳原子与碳原子之有机化合物中的每个碳原子不仅能与其他原子形成□05间也能形成□02单键、□03双键或□04三键。
多个碳原子之间可以结合形成碳链,也可以结合形成□碳环。
2.甲烷的分子结构(1)分子结构(2)空间结构3.烷烃的结构特点与命名(1)结构特点(2)烷烃的命名碳原子数不多于10时,以□13甲、乙、丙、丁、戊、己、庚、辛、壬、癸依次代表碳原子数;碳原子数在10以上时,以汉字数字代表,如“十一烷”。
(3)分子通式烷烃的分子通式为□14C n H 2n +2。
4.同系物与同分异构体 (1)同系物(2)同分异构体 ①概念②实例:正丁烷、异丁烷互为同分异构体。
③同分异构现象的广泛存在是造成有机物种类繁多的重要原因之一。
[特别提醒] (1)同分异构体的分子式相同,因此其相对分子质量相同,但相对分子质量相同的化合物不一定互为同分异构体,如NO和C2H6。
(2)互为同分异构体的化合物不一定属于同一类物质,如CH3—O—CH3和CH3CH2OH。
(3)互为同分异构体的化合物一定不互为同系物,同样,互为同系物的化合物一定不互为同分异构体。
多碳原子烷烃(如CH3CH2CH2CH2CH3)分子中,碳原子的排列是直线形吗?提示:不是。
烷烃分子中的碳原子以单键与其他原子相连,与之成键的4个原子构成四面体结构。
因此碳原子一定不在同一直线上,直链烷烃中碳原子的排列呈锯齿状。
课堂互动探究知识点一甲烷的分子结构、烷烃1.有机化合物组成和结构的表示方法[知识拓展]甲烷空间结构的拓展根据甲烷的正四面体结构推知,有机物分子中碳原子以4个单键与其他原子相连。
若CH4分子中的4个氢原子全部用其他相同的原子代替,即a、b、c、d相同,则形成的分子为正四面体结构,如CCl4;若CH4分子中的4个氢原子被其他不同的原子代替,即a、b、c、d不完全相同,则形成的分子为四面体,但不属于正四面体,如CH3Cl、CH2Cl2、CHCl3等。

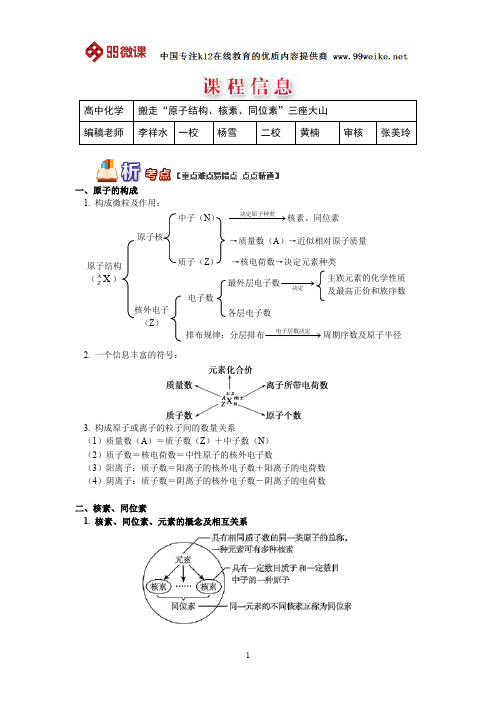
第三课时 核素[明确学习目标] 1.了解核素、同位素的概念。
2.知道AZ X 的含义。
学生自主学习核素 1.概念具有一定数目□01质子和一定数目□02中子的一种原子。
2.核素的表示方法即:A Z X 表示□05质量数是A ,□06质子数是Z 的X 原子。
3.实例——氢的三种核素同位素 1.概念质子数相同而□01中子数不同的同一元素的不同原子互称为□02同位素,即同一元素的不同核素互称为同位素。
2.特点——两同两不同(1)两同:□03质子数相同,元素相同。
(2)两不同:□04中子数不同,□05质量数不同。
3.性质(1)同位素在周期表里占据□06同一位置。
(2)同位素的化学性质几乎完全相同。
(3)天然存在的同位素,相互间保持一定的比率。
4.用途□0714 6C 在考古工作中用于测定文物的年代;235 92U 用于制造原子弹、核发电;□0821H 、31H 用于制造氢弹等。
原子的相对原子质量与元素的相对原子质量 1.原子的相对原子质量=一个该原子的质量一个12C 原子质量×112。
2.元素的相对原子质量,是按照该元素各种核素所占的一定百分比计算出的平均值。
1.质量数相同的原子一定属于同种元素吗?提示:不一定属于同种元素。
质子数相同的原子属于同一种元素,而质量数相同的原子不一定属于同种元素,如146C 和147N 。
2.X 元素原子的质量数为m ,核内中子数为n ,则a g X 含有的电子的物质的量是多少? 提示:am(m -n ) mol 。
3.18O 2和16O 2互为同位素吗?提示:不是,同位素指的是质子数相同而中子数不同的同一元素的不同原子,这两种微粒属于分子,是同一种物质。
4.互为同位素的不同核素的物理性质不同,而它们的化学性质为什么几乎完全相同? 提示:互为同位素的不同核素其原子的电子层结构相同,故它们的化学性质几乎完全相同。
课堂互动探究 知识点一 构成原子的粒子1 已知氮原子的质量数为14,在NH 3D +中,电子数、质子数、中子数之比为( ) A.10∶7∶11 B .11∶11∶8 C.11∶10∶8 D .10∶11∶8[批注点拨][解析] 氮原子的质子数为7,已知其质量数为14,则其中子数为7,NH 3D +的质子数为7+4=11,电子数为11-1=10,H 中不含中子,D 中含1个中子,故NH 3D +的中子数为7+1=8,则电子数、质子数、中子数之比为10∶11∶8,故D 正确。

第1节 原子结构与元素性质 第1课时 原子核 核素发 展 目 标体 系 构 建1.认识原子结构,能知道符号AZ X 中各字母的含义,能正确理解质子、中子、电子、质量数之间的关系。
2.能从宏观和微观相结合的视角认识元素、核素、同位素的含义。
3.通过了解同位素的应用,培养“科学态度与社会责任”的学科素养。
一、原子核 1.原子及构成微粒原子⎩⎨⎧原子核⎩⎨⎧质子:带有一个单位正电荷中子:不带电核外电子:带有一个单位负电荷对于一个确定的原子存在关系: 核电荷数=质子数=核外电子数。
2.质量数3.原子的表示方法一般用符号A Z X表示,字母表示意义如下:表示质量数——AX——表示元素符号表示质子数——Z如3717Cl表示质量数为37、质子数为17、中子数为20的氯原子。
微点拨:(1)原子中不一定含有中子,且中子数不一定等于质子数,如11H。
(2)同种元素的原子与其相应离子的质量数相等,如23Na与23Na+。
二、核素1.核素具有相同数目的质子和相同数目的中子的一类原子。
2.同位素质子数相同而中子数不同的同一种元素的不同核素互为同位素。
如氢元素的三种核素1H 21H 31H1俗称-重氢超重氢符号H D T质子数 1 1 1中子数0 1 2到目前为止,人类发现的元素有118种,能否说发现的原子有118种?为什么?提示:不能。
因为很多元素存在同位素。
3.几种重要的核素(1)制造氢弹的原料为21H、31H。
(2)核反应堆的燃料是23592U。
(3)作为相对原子质量和阿伏加德罗常数测定用的标准原子为126C。
微点拨:同位素的两个特点(1)相同存在形态的同位素,化学性质几乎完全相同,物理性质不同。
(2)天然存在的某种元素,不论是化合态还是游离态,各种同位素在自然界里丰度一般是不变的。
4.元素的相对原子质量元素的相对原子质量是其各种核素的相对原子质量分别与各种核素在自然界里的丰度的乘积之和。
如氯元素有两种核素:3517Cl,相对原子质量为34.97,其丰度为75.77%;3717Cl,相对原子质量为36.97,其丰度为24.23%。

仪器分析电子教案(一)第一章:概述1.1 课程介绍了解仪器分析课程的基本内容和目标。
明确仪器分析在化学、化工、环境、生物等领域的应用。
1.2 仪器分析的基本概念定义仪器分析及其分类。
掌握仪器分析的基本原理和特点。
1.3 仪器分析的发展趋势了解仪器分析技术的历史和发展。
认识当前仪器分析技术的发展趋势和挑战。
仪器分析电子教案(二)第二章:光学分析仪器2.1 光谱分析仪器了解光谱分析的基本原理。
掌握紫外-可见光谱仪、红外光谱仪、原子光谱仪等常见光谱仪器的结构、原理和应用。
2.2 色谱分析仪器理解色谱分析的基本原理。
熟悉气相色谱仪、液相色谱仪、色谱-质谱联用仪等色谱仪器的结构、原理和应用。
仪器分析电子教案(三)第三章:电化学分析仪器3.1 电化学分析法的基本原理理解电化学分析的基本原理。
掌握电位分析法、库仑分析法、电导分析法等电化学分析方法。
3.2 电化学分析仪器的应用认识电化学分析仪器的结构和工作原理。
熟悉电化学工作站、电化学传感器等电化学分析仪器的应用。
仪器分析电子教案(四)第四章:色谱-质谱联用技术4.1 色谱-质谱联用技术的基本原理了解色谱-质谱联用技术的基本原理。
掌握气相色谱-质谱联用(GC-MS)、液相色谱-质谱联用(LC-MS)等常见色谱-质谱联用技术。
4.2 色谱-质谱联用技术的应用认识色谱-质谱联用技术在化学、生物、环境等领域中的应用。
熟悉色谱-质谱联用技术在药物分析、食品安全、环境监测等方面的应用案例。
仪器分析电子教案(五)第五章:样品前处理技术5.1 样品前处理技术的基本原理了解样品前处理技术的基本原理。
掌握固相萃取、液-液萃取、离子交换等样品前处理方法。
5.2 样品前处理技术的应用认识样品前处理技术在仪器分析中的应用。
熟悉样品前处理技术在环境分析、生物分析、食品分析等领域的应用案例。
仪器分析电子教案(六)第六章:原子吸收光谱分析6.1 原子吸收光谱分析原理解释原子吸收光谱分析的基本原理。

第 1 章原子结构与元素周期系[ 教学要求]1 .掌握近代理论在解决核外电子运动状态问题上的重要结论:电子云概念,四个量子数的意义,s 、p 、d 原子轨道和电子云分布的图象。
2 .了解屏蔽效应和钻穿效应对多电子原子能级的影响,熟练掌握核外电子的排布。
3 .从原子结构与元素周期系的关系,了解元素某些性质的周期性。
[ 教学重点]1 .量子力学对核外电子运动状态的描述。
2 .基态原子电子组态的构造原理。
3 .元素的位置、结构、性质之间的关系。
[ 教学难点]1 .核外电子的运动状态。
2 .元素原子的价电子构型。
[ 教学时数] 8 学时[ 教学内容]1 .核外电子运动的特殊性:核外电子运动的量子化特征(氢原子光谱和玻尔理论)。
核外电子运动的波粒二象性(德布罗衣的预言,电子的衍射试验,测不准关系)。
2 .核外电子运动状态的描述:波函数、电子云及其图象表示(径向与角度分布图)。
波函数、原子轨道和电子云的区别与联系。
四个量子数(主量子数n ,角量子数l ,磁量子数m ,自旋量子数ms )。
3 .核外电子排布和元素周期表;多电子原子的能级(屏蔽效应,钻穿效应,近似能级图,原子能级与原子序数关系图)。
核外电子排布原理和电子排布(能量最低原理,保里原理,洪特规则)。
原子结构与元素周期性的关系(元素性质呈周期性的原因,电子层结构和周期的划分,电子层结构和族的划分,电子层结构和元素的分区)。
4 .元素某些性质的周期性,原子半径,电离势,电子亲和势,电负性。
1-1 道尔顿原子论古代自然哲学家对物质之源的臆测:本原论(元素论)和微粒论(原子论)古希腊哲学家德谟克利特(Democritus, 约460—370 B C ):宇宙由虚空和原子构成,每一种物质由一种原子构成。
波意耳:第一次给出了化学元素的操作性定义---- 化学元素是用物理方法不能再分解的最基本的物质组分,化学相互作用是通过最小微粒进行的,一切元素都是由这样的最小微粒组成的。
郑州工业应用技术学院教案2014~2015学年第二学期课程名称天然药物化学院系(部)医学院授课班级 2012级药物制剂1、2班主讲教师朱笛教材名称:《天然药物化学》使用教材主编:吴立军出版社:人民卫生出版社二○一五年三月课程简介《天然药物化学》是以天然产物为研究对象,是建立在多学科基础之上,天然药物化学是一门应用现代化学、物理学、生物学等理论和方法研究天然药物生物活性成分的学科。
这门课程主要介绍天然药物中各类化学成分的结构类型、特点、理化性质、提取分离方法、结构鉴定方法以及一些重要化学成分的生物活性等。
《天然药物化学》课程是药物制剂专业本科学生的专业必修课,是培养学生自学的能力以及逻辑思维、独立思考和独立的分析解决问题的能力的重要课程。
通过对天然药物化学课程的学习,要求学生掌握天然药物化学主要类型成分的结构特征、理化性质、提取、分离、精制及鉴定的基本理论和技能,了解天然药物化学成分结构测定的一般原则方法,同时概括性地了解寻找天然药物有效成分的途径。
学习该课程应该先修有机化学、药物分析、药物化学、药物设计、制药分离工程等课程。
要求学生掌握一定数量的专业英语词汇。
课程教学日历课程名称天然药物化学院(系)医学院专业药物制剂(本科)年级2012课程学期总学时周学时学分考核方式采用教材情况教材名称天然药物化学主编(著)吴立军出版社名称人民卫生出版社51 3 3 考试出版时间 2011.07周次每周时数分配教学内容备注理论实验(实践)合计时数1 4 4 第一章第一、二节2 2 2 第一章第三节3 4 4 第一章第四节;第二章第一、二节4 2 2 第二章第三、四节5 4 4 第二章第五、六节;第三章第一、二节6 2 2 第三章第三节7 4 4 第四章第一、二、三、四、五节8 2 2 第五章第一、二节9 4 4 第五章第三、四节10 2 2 第五章第五节11 4 4 第六章第一、二、三、四、五、六节12 2 2 第七章第一、二、三、四节13 4 4 第七章第五、六、七、八节第八章第一、二节14 2 2 第八章第三、四节;第九章第一节15 4 4 第九章第二、三节16 2 2 第九章第三节17 3 3 复习郑州工业应用技术学院医学院课程教案首页课程名称天然药物化学总学时:51学分: 3课程类别专业必修课课程性质考试理论:51实践:任课教师朱笛职称部门药学教研室授课班级12级药物制剂1、2班教学参考资料推介1、吴继洲.《天然药物化学学习指导》.北京:人民卫生出版社,2005, ISBN: 9787117065702;2、吴立军.《天然药物化学》. 北京:人民卫生出版社,2006,ISBN:9787117055604。
气排球教案最新版一、教学内容本节课选自《体育与健康》教材第七章“球类运动”中的第三节“气排球”。
具体内容包括气排球的基本技术要领,如发球、扣球、传球和防守;气排球比赛规则;以及团队配合与战术运用。
二、教学目标1. 让学生掌握气排球的基本技术,如发球、扣球、传球和防守。
2. 培养学生团队协作精神,提高战术运用能力。
3. 让学生了解并遵守气排球比赛规则,提高比赛能力。
三、教学难点与重点重点:气排球的基本技术要领,如发球、扣球、传球和防守。
难点:团队配合与战术运用,以及比赛规则的灵活运用。
四、教具与学具准备1. 教具:气排球、球网、记分牌、哨子等。
2. 学具:运动服、运动鞋、护具等。
五、教学过程1. 实践情景引入(5分钟)教师组织学生进行简单的气排球比赛,让学生感受气排球运动的乐趣,激发学习兴趣。
2. 基本技术讲解与示范(10分钟)教师讲解气排球的基本技术要领,如发球、扣球、传球和防守。
教师进行示范,让学生直观地了解技术动作。
3. 例题讲解(10分钟)教师通过具体例题,讲解气排球比赛中如何运用基本技术和战术。
4. 随堂练习(10分钟)学生分组进行基本技术练习,教师巡回指导。
学生进行团队配合练习,教师点评并指导。
5. 比赛实践(10分钟)学生进行气排球比赛,教师担任裁判,及时指出比赛中出现的问题。
学生分享学习心得,提出改进措施。
六、板书设计1. 气排球基本技术:发球、扣球、传球、防守2. 气排球比赛规则3. 团队配合与战术运用七、作业设计1. 作业题目:设计一个气排球比赛中的进攻和防守战术,以书面形式提交。
2. 答案:比赛战术:可根据教材内容和课堂学习进行设计。
八、课后反思及拓展延伸1. 反思:教师在本节课结束后,对教学过程进行反思,找出不足之处,为下一节课做好准备。
2. 拓展延伸:组织学生观看气排球比赛视频,了解高水平运动员的技术和战术运用。
邀请专业气排球教练进行讲座,提高学生的专业素养。
重点和难点解析1. 基本技术讲解与示范2. 例题讲解3. 随堂练习4. 比赛实践5. 作业设计一、基本技术讲解与示范(1)发球技术:强调手臂摆动、腰部力量和脚步移动的协调,确保发球稳定且具有攻击性。
全国中小学“教学中的互联网搜索”优秀教学案例评选教案设计四、教学方法学生对正负数的概念比较陌生,但有一定的生活经验。
针对学生的这些情况让学生提前做好天气预报记录感知正负数。
再利用教材支援从温度入手来学习正负数。
这样从学生的生活实际出发,让学生学习起来觉得容易接受。
五教学过程教学过程:一、课前收集资料:记录一星期内每天的最低温度和最高温度及温度差。
二、汇报记录的温度,知会交流。
生1:星期一最高温度20度,最低温度8度……生2:我知道星期三的温差是10度。
生3:我知道最低和最高是相反的。
师:你还知道那些“相反”的事?生1:放学了,有同学向左拐,有同学向右拐,这就是“相反”的事生2:有的同学上楼,有的同学下楼,这也是“相反”意义的事生3:我比较胖,同位比较瘦,这也是“相反”意义的事。
师:你们理解的太好了,生活中“相反”意思的事情很多,你知道用数学的方法怎么表示这些事情吗?大胆猜一猜。
三、交流疑惑,大胆猜想生1:加减号生2:正负数师:好!我们一起用数学的方法来研究这个“相反”的问题四、结合课件分层导学1、结合气温初步认识正负数。
师:吐鲁番还是我国日温差特别大的地方,现在同学们一起来看一下这条信息,(课件出示信息:“早穿棉袄午穿纱,围着火炉吃西瓜。
”说的是吐鲁番日温差特别大。
3月份日平均最高气温在零上13c左右,日平均最低气温在零下3c 左右。
)你从信息中了哪些知识?生1:吐鲁番的日温差特别大。
生2:日平均最高气温是零上13℃。
(板书:零上13℃)生3:日平均最低气温是零下3℃。
(板书:零下3℃)师:你能在温度计上分别指出它们的刻度吗?(每个小组一个温度计)(小组合作,分别在温度计上指出零上13c和零下3℃)师:那谁能到前面指出零上13℃?(找一名同学到前面来指)师:能告诉大家你是怎么找的吗?生:我看到这里有个零,从零向上找到13,就是13度了。
师:你为什么不找这个13℃呢?(指零下13℃)生:那是零下13度.师:那零下3℃怎么找?生:我手指的这儿就是零下3度。