《甲烷与烷烃》
- 格式:ppt
- 大小:2.28 MB
- 文档页数:41

甲烷烷烃2.难点聚焦1.有机物:含碳.化合物叫做有机化合物...,简称有机物。
(除CO、CO2、碳酸盐、碳化物、硫氰化物、氰化物等外)它们虽然含碳,但性质和组成与无机物很相近,所以把它们看作为无机物。
也就是说,有机物一定含碳元素,但含碳元素的物质不一定是有机物。
而且有机物都是化合物,没有单质。
那么究竟哪些物质是有机物,哪些物质是无机物,有什么判断依据呢?我们可以通过有机物与无机物的主要区别加以判断。
3.有机物的组成C、H、O、N、S、P、卤素等元素。
构成有机物的元素只有少数几种,但有机物的种类确达三千多种?几种元素能构几千万种有机物质?(学生自学后概括)有机物种类之所以繁多主要有以下几个原因:①碳原子最外电子层上有4个电子,可形成4个共价键;②有机化合物中,碳原子不仅可以与其他原子成键,而且碳碳原子之间也可以成键;③碳与碳原子之间结合方式多种多样,可形成单键、双键或叁键,可以形成链状化合物,也可形成环状化合物;(结构图5—1)④相同组成的分子,结构可能多种多样。
(举几个同分异构体)在有机物中,有一类只含C、H两种元素的有机物。
4.烃:仅含碳和氢两种元素的有机物称为碳氢化合物,又叫烃 在烃中最简单的是甲烷,所以我们就先从甲烷开始学起。
甲烷一、甲烷的物理性质(学生回答)无色、无味,难溶于水的,比空气轻的,能燃烧的气体,天然气、坑气、沼气等的主要成分均为甲烷。
收集甲烷时可以用什么方法?(1.向下排空气法,2.排水法) 二、甲烷的分子结构已知甲烷的气体密度在标准状况下为0.717 g/L ,其中含碳的质量分数为75%,含氢质量分数为25%,求甲烷的分子式。
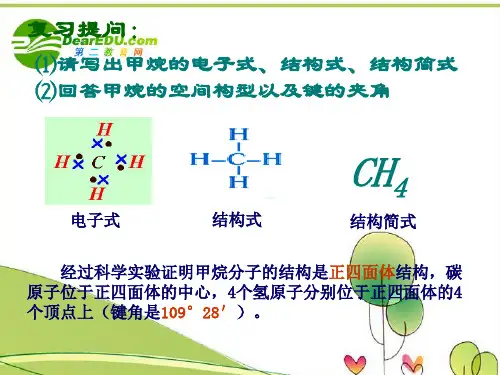
(平行班提示:M=ρV m )甲烷的分子式:CH 4 电子式: 结构式:CH 4:正四面体 NH 3:三角锥形三、甲烷的化学性质 1.甲烷的氧化反应CH 4+2O 2−−→−点燃CO 2+2H 2Oa.方程式的中间用的是“ ”(箭头)而不是“====”(等号), 主要是因为有机物参加的反应往往比较复杂,常有副反应发生。



第三章有机化合物第一节最简单的有机化合物——甲烷【学习目标】1.掌握烷烃的分子组成、结构等的特征;基本学会比较同分异构体的分析方法,能够书写分子中含5个碳原子以下烷烃的同分异构体的结构简式。
2.从甲烷的性质推导到烷烃的性质的过程中,学会从一种代表物质入手掌握同系列有机物性质的方法。
3.培养关心科学、研究科学和探索科学的精神,激发学习化学的兴趣和探索新知识的欲望.重点:烷烃的性质和同分异构体的概念。
难点:简单同分异构体的书写.甲烷一.甲烷分子组成与结构1.分子式:__________电子式:____________结构式:_______________。
2.甲烷的空间构型_________________________ 键角________________二.甲烷的性质1.物理性质:____色____味____体,比空气____,____溶于水。
2.化学性质:一般情况下,性质_____稳定,跟强酸.强碱或强氧化剂_____反应。
(1)甲烷的氧化反应:__________________________________________________(2)甲烷的取代反应:(与氯气在光照条件)__________________________________________________(3)热分解反应:__________________________________________________练习:1.下列有关甲烷的说法中错误的是 ( ) A.采煤矿井中的甲烷气体是植物残体经微生物发酵而来的B.天然气的主要成分是甲烷C.甲烷是没有颜色.没有气味的气体,极易溶于水D.甲烷与氯气发生取代反应所生成的产物四氯甲烷是一种效率较高的灭火剂2.甲烷气体在氧气中燃烧生成二氧化碳和水的实验事实说明()B.甲烷气体中含碳元素和氢元素A.甲烷的分子式为CH4C.甲烷气体中只含有碳元素和氢元素 D.甲烷的化学性质比较稳定3.甲烷和氯气以物质的量1∶1混合,在光照条件下,得到的产物是 ( )①CH3Cl ②CH2Cl2③CHCl3④CCl4A.只有① B.①和②的混合物C.只有② D.①②③④的混合物烷烃一.烷烃定义及通性:(1)定义______________________________________________通式:________ (n ),(2)物理通性:①n≤4____体,②溶沸点:______ __③密度: __ __(3)化学通性:通常状况下,性质____稳定,与酸.碱和氧化剂____反应,也难与其它物质化合。




有机化学实验甲烷和烷烃的性质
甲烷:
甲烷是一种无色、臭气,无色透明的气体,其分子式为CH4。
它是一
种极易燃的气体,能够与氧气发生火焰反应。
它在室温下通常以气态存在,而且具有非常低的沸点(-161.6℃)和蒸发点(-164.3℃),因此很容易
蒸发。
甲烷是一种有害气体,可引起头痛、恶心、昏迷等症状,可引发燃
烧毒气。
由于其分子结构中没有氢键,因此它无法和其他分子杂化形成氢键,而是通过单键相互联结。
烷烃:
烷烃是一类碳氢化合物,其分子内含有一个或多个由碳和氢组成的链,使它们拥有着较高的热容量和稳定性,在实验室中最常见的烷烃有乙烷,
丁烷,苯,甲苯等。
其分子结构中的碳氢单键特别稳定,因此它们的分子
间极易形成氢键进行极性交互作用,形成稳定的液态或固态混合物,使它
们拥有高熔点和沸点,易蒸发或溶解。
有机化学基础——烷烃一、甲烷1、物理性质:甲烷是一种无色、无味的气体,密度比空气小,极难溶于水,是最简单的有机物。
2、甲烷的分子结构:正四面体分子式:CH 4结构式:电子式:3、化学性质: (1)可燃性:CH 4+2O 2点燃CO 2+2H 2O(2)取代反应:CH 4+Cl 2 CH 3Cl+HClCH 3Cl+Cl 2 2Cl 2+HClCH 2Cl 2+Cl 3+HClCHCl 3 + Cl CCl 4+ HCl二、烷烃:2、同系物2、命名规则(1)习惯性命名法:碳原子数后加一个“烷”字,就是简单烷烃的名称,碳原子的表示方法。
①碳原子在1~10之间,用“天干”甲、乙、丙、丁、戊、己、庚、辛、壬、癸表示;②10以上的则用汉字“十一、十二、十三…”表示,如C6H14叫己烷,C17H36叫十七烷。
(2)系统命名法步骤:①选主链,称某烷:选定分子中最长的碳链为主链,且依主链上碳原子的数目称之为“某烷”;例:CH3—CH—CH2—CH—CH2—CH3,主链为“己烷”33②编号码,定支链:把主链中离支链最近的一端作为起点,用阿拉伯数字给主链上的各个碳原子依次编号定位,以确定支链的位置;1 2 3 4 5 6CH3—CH—CH2—CH—CH2—CH333③取代基,写在前,注位置,连短线:把支链作为取代基,把取代基的名称写在烷烃名称的前面,在取代基的前面用阿位伯数字注明它在烷烃直链上所处的位置,并在数字与取代基名称之间用一短线隔开;1 2 3 4 5 6CH3—CH—CH2—CH2—CH2—CH32—甲基己烷3④不同基,简在前,相同基,二三连:a.如果主链上有相同的取代基,可以将取代基合并起来,用二、三等数字表示,在用于表示取代基位置的阿拉伯数字之间要用“,”隔开;b.如果主链上有几个不同的取代基,就把简单的写在前面,把复杂的写在后面。
1 2 3 4 5 6CH3—CH—CH2—CH—CH2—CH32,4—二甲基己烷331 2 3 4 5 6CH3—CH—CH2—CH2—CH2—CH32—甲基—4—乙基己烷CH332系统命名法命名图例3、同分异构体:具有相同化学式不同结构的化合物。
《烷烃》甲烷:烷烃之母在化学的广袤世界中,烷烃是一类极为重要的有机化合物,而甲烷则堪称烷烃家族的“母亲”。
要深入理解烷烃,我们首先得从甲烷说起。
甲烷,化学式为 CH₄,是最简单的烷烃。
它在自然界中的分布相当广泛。
在地球上,甲烷的来源多种多样。
比如,在湿地中,由于微生物的分解作用,会产生大量的甲烷。
此外,在一些煤矿中,也存在着甲烷,这就是我们常说的“瓦斯”。
从结构上看,甲烷具有正四面体的空间构型。
碳原子位于正四面体的中心,四个氢原子分别位于正四面体的四个顶点。
这种独特的结构决定了甲烷具有相对稳定的化学性质。
甲烷是一种无色、无味、无臭的气体。
它的密度比空气小,极难溶于水。
在常温常压下,甲烷性质较为稳定,但在特定条件下,它也能发生一系列化学反应。
甲烷燃烧是我们最常见到的它的化学反应之一。
甲烷与氧气反应,生成二氧化碳和水,并释放出大量的能量。
这一反应为我们的生活提供了重要的能源,例如在家庭中用于燃气取暖和做饭。
在工业领域,甲烷也是许多化工过程的重要原料。
甲烷作为烷烃的代表,为我们研究其他烷烃的性质和反应提供了基础。
从甲烷出发,我们可以逐步认识到更长链的烷烃。
随着碳原子数的增加,烷烃的物理性质会发生规律性的变化。
比如,沸点和熔点逐渐升高,密度逐渐增大。
这是因为随着分子中碳原子数的增多,分子间的作用力逐渐增强。
在化学性质方面,烷烃通常比较稳定,但在一定条件下,如高温、光照或催化剂存在时,也能发生取代反应等。
例如,甲烷在光照条件下可以与氯气发生取代反应,生成一氯甲烷、二氯甲烷、三氯甲烷和四氯化碳等。
对于长链烷烃,它们在工业和日常生活中的应用也十分广泛。
例如,汽油、柴油等燃料主要就是由不同碳链长度的烷烃组成。
烷烃的存在对于地球上的生命也具有重要意义。
在生物体内,一些脂肪酸和脂肪醇也是烷烃的衍生物,它们在构成细胞膜、储存能量等方面发挥着关键作用。
总之,甲烷作为烷烃之母,不仅自身具有重要的性质和用途,还为我们理解和研究整个烷烃家族的性质和变化规律奠定了基础。
烃的化学方程式一、甲烷与烷烃 1、甲烷燃烧:CH 4+2O 2 CO 2+2H 2O 2、乙烷燃烧:2C 2H 6+7O 2 4CO 2+6H 2O 3、丙烷燃烧:C 3H 8+5O 22CO 2+4H 2O 4、丁烷燃烧:2C 4H 10+13O 2 8CO 2+10H 2O 5、甲烷与氯气见光:CH 4+Cl 2CH 3Cl +HCl CH 4+2Cl 2CH 2Cl 2+2HCl CH 4+3Cl 2 CHCl 3+3HCl CH 4+4Cl 2CCl 4+4HCl6、乙烷与氯气见光: CH 3CH 3+Cl 2CH 3CH 2Cl +HCl7、丙烷与氯气见光: CH 3CH 2CH 3+Cl 2 CH 3CH 2CH 2Cl +HCl CH 3CH 2CH 3+Cl 2CH 3CHCH 3+HCl8、甲烷隔绝空气加强热:CH 4C +2H 29、十六烷的裂化:C 16H 34C 8H 18+C 8H 16 10、辛烷的裂化:C 8H 18C 4H 10+C 4H 8 11、丁烷的裂化:C 4H 10C 2H 6+C 2H 4 C 4H 10C 3H 6+CH 412、加热醋酸钠与碱石灰的混合物制备甲烷:CH 3COONa +NaOH Na 2CO 3+CH 4↑ 二、乙烯与烯烃1、乙烯燃烧:C 2H 4+3O 2 2CO 2+2H 2O2、丙烯燃烧:2C 3H 6+9O 26CO 2+6H 2O点燃 点燃加热CaO加热催化剂 加热 催化剂 加热 催化剂 加热 催化剂高温光照 光照光照光照 光照 光照 光照点燃点燃 点燃 点燃 Cl3、乙烯使酸性高锰酸钾溶液褪色: 5CH 2=CH 2+12KMnO 4+18H 2SO 410CO 2↑+12MnSO 4+6K 2SO 4+28H 2O4、丙烯使酸性高锰酸钾溶液褪色: 5CH 3CH=CH 2+10KMnO 4+15H 2SO 45CH 3COOH +5CO 2↑+5K 2SO 4+10MnSO 4+20H 2O5、乙烯的催化氧化:2CH 2=CH 2+O 2催化剂 △2CH 3CHO 6、丙烯的催化氧化:2CH 3CH=CH 2+O 2催化剂 △2CH 3CH 2CHO 2CH 3CH=CH 2+O 22CH 3COCH 37、乙烯使溴的四氯化碳溶液褪色:CH 2=CH 2+Br 2BrCH 2CH 2Br8、丙烯使溴的四氯化碳溶液褪色:CH 3CH 2=CH 2+Br 2CH 3CHCH 2BrBr 9、乙烯与氢气的催化加成:CH 2=CH 2+H 2催化剂 △CH 3CH 310、丙烯与氢气的催化加成:CH 3CH=CH 2+H 2催化剂△CH 3CH 2CH 311、乙烯与氯化氢的加成:CH 2=CH 2+HCl CH 3CH 2Cl 12、丙烯与氯化氢的加成:CH 3CH=CH 2+HClCH 3CHCH 3ClCH 3CH=CH 2+HClCH 3CH 2CH 2Cl13、乙烯与水的加成:CH 2=CH 2+H 2OCH 3CH 2OH14、丙烯与水的加成:CH 3CH=CH 2+H 2OCH 3CH 2CH 2OHCH 3CH=CH 2+H 2OCH 3CHOHCH 315 C16 17、乙烯与丙烯的加聚:18、实验室制备乙烯:CH 3CH 2OH CH 2=CH 2↑+H 2O三、1,3—丁二烯与二烯烃1、1,3—丁二烯的燃烧:2C 4H 6+11O 28CO 2+6H 2O170℃浓硫酸点燃 加热、加压催化剂加热、加压 催化剂加热、加压催化剂加热催化剂 nCH 2=CH 2+nCH 3CH=CH 2 CH 2—CH 2—CH —CH 2催化剂 n CH 3CH —CH 2 催化剂n CH 3 nCH 3CH=CH2 催化剂n nCH 2=CH 2 CH 2—CH 22、1,3—丁二烯的燃烧的催化氧化:CH 2=CH —CH=CH 2+O 2CH 3COCOCH 3CH 2=CH —CH=CH 2+O 2OHCCH 2CH 2CHO3、1,3—丁二烯使酸性高锰酸钾溶液褪色:CH 2=CH -CH=CH 2+4KMnO 4+6H 2SO 42CO 2↑+2K 2SO 4+4MnSO 4+HOOC —COOH +8H 2O4、1,3—丁二烯与溴水的加成:CH 2=CH —CH=CH 2+Br 2BrCH 2CHBrCH=CH 2 CH 2=CH —CH=CH 2+Br 2BrCH 2CH=CHCH 2BrCH 2=CH —CH=CH 2+2Br 2BrCH 2CHBrCHBrCH 2Br5、1,3—丁二烯的加聚:6、2—甲基—1,3—丁二烯的加聚:7、2—氯—1,3—丁二烯的加聚:8、1,3—丁二烯与丙烯腈的加聚:9、1,3—丁二烯与苯乙烯的加聚: 10、1,3—丁二烯的制备: CH 3CHBrCHBrCH 3+2NaOH CH 2=CH —CH=CH 2↑+2NaBr +2H 2O四、乙炔与炔烃1、乙炔的燃烧:2C 2H 2+5O 2 4CO 2+2H 2O2、丙炔的燃烧: C 3H 4+4O 23CO 2+2H 2O3、乙炔使酸性高锰酸钾溶液褪色: C 2H 2+2KMnO 4+3H 2SO 42CO 2+K 2SO 4+2MnSO 4+4H 2O5CH 3C CH +8KMnO 4+12H 2SO 45CH 3COOH +5CO 2+8MnSO 4+4K 2SO 4+12H 2O4、乙炔与氢气的加成:HC CH +H 2催化剂 △ CH 2=CH 2 HC CH +2H 2催化剂 △CH 3CH 3点燃 点燃 加热CH 3CH 2OH加热催化剂 加热催化剂催化剂 nCH 2=CH —CH=CH 2 CH 2—CH = CH —CH 2n催化剂 nCH 2=C —CH=CH 2CH 2—C = CH —CH 2nCH 3CH 3催化剂nCH 2=C —CH=CH 2 CH 2—C = CH —CH 2nClClnCH 2=CH —CH=CH 2 +nCH 2=CHCN 催化剂CH 2—CH=CH —CH 2—CH —CH 2nCN nCH 2=CH —CH=CH 2+nCH=CH 2催化剂CH 2—CH=CH —CH 2—CH —CH 2nC 6H 5C 6H 55、乙炔与溴水的加成: HC CH +Br 2BrCH=CHBr HC CH +2Br 2BrCH —CHBrBr Br 6、丙炔与氢气的加成: CH 3C CH +2H 2催化剂 △ CH 3CH 2CH 3 CH 3C CH +2Br 2催化剂 △CH 3CBr 2CHBr 2 7、乙炔与氯化氢的加成:HC CH +HCl催化剂 △CH 2=CHCl8、氯乙烯的加聚:nCH 2=CHCl CH —CH 2Cl 9、丙炔与氯化氢的加成:CH 3C CH +HCl催化剂 △ CH 3CH=CHCl CH 3C CH +HCl催化剂 △CH 3CHCl=CH 210、乙炔与水的加成:HC CH +H 2O催化剂CH 3CHO 11、丙炔与水的加成:CH 3C CH +H 2O催化剂CH 3CH 2CHO CH 3C CH +H 2O催化剂CH 3COCH 312、乙炔的加聚:nHC CH CH = CH13、丙炔的加聚:nCH 3C CH C ===CHCH 3 14、电石与水反应制备乙炔:CaC 2+2H 2O Ca(OH)2+C 2H 2↑五、苯和苯的同系物 1、苯的燃烧:2C 6H 6+15O 2 12CO 2+6H 2O 2、甲苯的燃烧:C 7H 8+9O 27CO 2+4H 2O3、甲苯使酸性高锰酸钾溶液褪色: 5 CH 3+6KMnO 4+9H 2SO 45 COOH +6MnSO 4+3K 2SO 4+14H 2O4、苯在铁的作用下与液溴反应: +Br 2催化剂—Br +HBr5、甲苯在铁的作用下与液溴反应:H 3C +Br 2催化剂H 3C — —Br +HBr点燃 点燃 催化剂n催化剂n 催化剂nH3C+Br2催化剂H3C+HBrH36、甲苯与氯气见光:CH3+Cl2CH2Cl+HCl7、苯与浓硫酸、浓硝酸的混合溶液水浴加热:+HNO3 NO2+H2O8、甲苯和浓硫酸、浓硝酸的混合溶液水浴加热:O2H3C3HNO3H3C NO2+3H2OO29、苯与浓硫酸共热:+H2SO4 SO3H+H2O10、苯和氢气的加成:+3H211、甲苯和氢气的加成:—CH3+3H CH3六、石油、煤炭和天然气的综合利用1、石油的裂化如十六烷的裂化:C16H34催化剂△C8H18+C8H16C8H18催化剂△C4H10+C4H82、石油气的裂解:C4H10C2H6+C2H4C4H10C3H6+CH43、煤炭的气化:C(s)+H2O(g)高温CO(g)+H2 (g)CO+3H2催化剂CH4+H2O4、煤炭的液化:2C+2H2O+2H22CH3OHCO+2H2CH3OH5、天然气转变成合成气:CH4+H2O CO+3H2高温、高压催化剂催化剂高温、高压催化剂加热催化剂加热催化剂光照浓硫酸加热。
甲烷和烷烃的性质甲烷和烷烃的性质甲烷和烷烃(alkanes)是有机化合物中最简单的一类化合物。
它们的化学结构非常简单,由单一的碳-碳 (C-C)和碳-氢 (C-H)键组成,而且它们在自然界中普遍存在。
甲烷是一种无色、无味、无毒的气体,在大自然中广泛存在,是天然气和沼气的主要成分。
烷烃是由多个碳原子和氢原子构成的分子,其中最简单的是乙烷(C2H6),它不溶于水、具有强烈的气味和易燃性。
物理性质甲烷是一种无色、无味、无毒的气体,密度为0.7174g/L,沸点为-161.5℃,燃点为680℃。
它是一种易挥发的气体,具有强烈的温室效应,可以在大气层中吸收太阳光,并导致全球气候变暖。
烷烃的物理性质随其碳原子数的增加而逐渐改变,它们通常是无色、透明液体或气体,密度较小,熔点和沸点逐渐增加。
化学性质甲烷是一种非常稳定的化合物,难以被氧化或加氢。
它只能通过光化学反应或高温下的裂解反应发生化学反应。
与氧气反应时,甲烷能够发生爆炸性反应,生成二氧化碳和水。
$CH_4 + 2O_2 \to CO_2 + 2H_2O$烷烃可以被氢气和卤素(氯、溴、碘)加成,生成相应的烷基卤素化合物。
烷基卤素(如四氯化碳、三氯甲烷)是一种很好的有机试剂,可以用于有机合成和环境治理。
烷烃还可以通过加氢、脱氢、烷基化、裂解、环化等反应发生化学反应,形成其他有机化合物。
反应示例:加氢:$C_2H_4 + H_2 \to C_2H_6$脱氢:$C_2H_6 \to C_2H_4 + H_2$烷基化:$C_2H_4 + CH_3Cl \to CH_3CH_2Cl$裂解:$C_8H_18 \to C_4H_8 + C_4H_{10}$环化:$C_6H_{12} \to C_5H_{10} + H_2$应用领域甲烷是一种非常重要的天然气和工业气体,广泛应用于燃料、能源、冶金、化工、制药等领域。
烷烃也是化工工业中的基础化合物,用作溶剂、合成高级化学品和塑料等原料。
甲烷、烷烃【学习目标】1、初步认识有机化合物种类繁多的原因;2、掌握甲烷的结构特点、性质和用途,理解取代反应的本质;3、掌握烷烃的特征、性质和通式;4、了解同系物、同分异构现象、同分异构体等概念,并掌握烷烃同分异构体的书写。
【要点梳理】要点一、有机物1、有机物的定义含碳元素的化合物叫有机化合物,简称有机物。
要点诠释:①个别含碳的化合物如CO、CO2及碳酸和碳酸盐等结构与性质跟无机物相似,故仍属无机物。
②有机物一定是含碳元素的化合物。
③有机物除含有氢、氧元素外,还含有氮、硫、卤素、磷等。
有机物与无机物的区别见下表所示性质和反应有机物无机物溶解性多数不溶于水,易溶于有机溶剂大多数溶于水,而不溶于有机溶剂耐热性多数不耐热,熔点较低,一般在400℃以下多数耐热,难熔化,熔点一般比较高可燃性多数可以燃烧多数不能燃烧电离性多数是非电解质多数是电解质2、有机物种类繁多的主要原因:①碳原子的结构特征是最外层有4个电子,常常以共价键与碳原子或别的原子结合;②碳碳间除能形成单键外,还能形成双键和三键,并且能形成长的碳链或碳环,;③有机物普遍存在同分异构现象。
3、烃的定义仅由碳和氢两种元素组成的一类有机物称为烃,也叫碳氢化合物。
要点二、甲烷1、分子结构在甲烷分子里,1个碳原子与4个氢原子形成4个C—H共价键。
甲烷分子是正四面体形,C原子居于正四面体的中心,4个H原子位于4个顶点,4个C—H键的键长、键能相等,键角均为109°28′。
①分子式:CH4②电子式:③结构式:2、物理性质甲烷是无色无味的气体,标准状况下的密度为0.717g/L,极难溶于水。
3、化学性质(1)稳定性:通常情况下,甲烷与强酸、强碱、强氧化剂一般都不发生反应,也不能使酸性KMnO4溶液和溴水褪色。
但在特定的条件下,也会发生某些反应。
【:最简单的有机化合物——甲烷ID:405334#甲烷与氯气的反应】(2)取代反应:有机物分子里的某些原子或原子团被其它原子或原子团所代替的反应叫取代反应。