细胞培养中支原体污染的特点及检验的笔记
- 格式:doc
- 大小:23.00 KB
- 文档页数:2

支原体污染及其检测支原体污染在细胞培养中最为常见,培养体系中支原体污染的最可能途径是经已被支原体污染的细胞蔓延和传扬,据报道目前约有11%的二倍体细胞和传代细胞存在支原体污染;支原体污染的另一重要来源是培养液中加入了被支原体污染的血清。
支原体是一种介于细菌和病毒之间的能自立生活的微生物,它无细胞壁,形态呈多形性。
最小的支原体直径约200nm,可通过滤菌器。
支原体污染后培养基普通不发生混浊,细胞形态无显然变幻,但事实上细胞已受到各方面的潜在影响,如影响DNA合成,代谢减慢,生长被抑制等。
这种污染造成的危害较大,但支原体污染不易被发觉,因此对支原体的污染必需引起足够的重视,应严加防范。
支原体污染常用的检查办法如下。
1.形态学检查常用相差显微镜检测取洁净载玻片,滴加少许待检的细胞悬液,压上盖片,用相差显微镜油镜观看。
如有支原体污染,镜下可见暗色极小颗粒,类似布朗运动,可位于细胞表面或细胞之间。
要注重支原体与细胞破裂后溢出的内容物如线粒体等相区分。
电镜检测:用普通染色办法难以确定时,可用电镜检查。
详见电子显微镜技术一节。
2.支原体染色镜检支原体经低张处理后用地衣红染色观看,本法简便易行,不仅适用于检测支原体,亦可用于检查真菌和细菌。
【材料】 (1)待检疑有支原体污染的培养物; (2)检测用试剂:低张处理液(0.45%),Carnoy固定液(配方:60ml纯加30ml和10m1),2%的地衣红染液(配方:2g地衣红,60ml加蒸馏水至100m1 )。
【办法】 (1)取材:吸取待检培养液1 ml, 500~800r/min,离心5分钟后去上清液,余留0.2m1备用。
(2)低张处理:用新奇配制的0.45%溶液0.2m1,加入上述待检标本中,静止低张处理10分钟,然后离心去上清液,留取沉淀物0. 2m1,涂片2~3张,晾干。
(3)固定:用新配制的Carnoy液固定2次,共10分钟。
(4)染色:将晾干的涂片用2%的地衣红染5分钟。

细胞培养中的支原体污染的预防及处理Mycoplasma国内主要有三种译名,医学文献译为“支原体”(分枝原体,枝原体,类菌质体),动物医学文献译为“霉形体”或“支原体”,台湾、香港则译为微浆菌。
支原体是目前已知一类能在无生命培养基上生长繁殖的最小的原核细胞型微生物。
自然界分布广泛,种类多,有80余种,分为两个属:一为支原体属(Mycoplasma),有几十个种;另一为脲原体属(Ureaplasma),仅有一种。
与人类感染有关的主要是肺炎支原体和解脲脲原体。
支原体无细胞壁,多呈不规则球状、长丝状,可分枝,营寄生共生或腐生。
一般侵害对象为动植物,可造成多种疾病。
细胞培养(特别是传代细胞)被支原体污染是个世界性问题。
国内外研究表明,95%以上是以下四种支原体:口腔支原体(M.orale)、精氨酸支原体(M.arginini)、猪鼻支原体(M.hyorhinis)和菜氏无胆甾原体(idlawii),为牛源性。
国外调查证明,大约有二十多种支原体能污染细胞,有的细胞株可以同时污染两种以上的支原体。
支原体污染的来源包括工作环境的污染、操作者本身的污染(某些支原体在人体是正常菌群)、培养基的污染、被污染细胞造成的交叉污染、实验器材的污染、制备细胞的原始组织或器官的污染,等等。
体外生长的细胞对微生物及一些有害有毒物质没有抵抗能力,因此培养基应达到无化学物质污染、无微生物污染(如细菌、真菌、支原体、病毒等)、无其他对细胞产生损伤作用的生物活性物质污染(如抗体、补体)。
对于天然培养基,污染主要来源于取材过程及生物材料本身,应当严格选材,严格操作。
对于合成培养基,污染主要来源于配制过程,配制所用的水,器皿应十分洁净,配制后应严格过滤除菌。
由于体外培养细胞自身没有抵抗污染的能力,而且培养基中的抗生素抗污染能力有限,因而培养细胞一旦发生污染多数将无法挽回。
支原体污染后,因为它们不会使细胞死亡可以与细胞长期共存,培养基一般不发生浑浊,细胞无明显变化,外观上给人以正常感觉,实则细胞手到多方面潜在影响,如引起细胞变形,影响DNA合成,抑制细胞生长等。

支原体清除实验支原体污染是细胞培养过程中的常见现象。
细胞被支原体污染之后,在显微镜下无法直接观察到,生长状态可能发生或不发生改变,因此一般不易被察觉。
但是支原体会改变细胞的很多生长参数,因而极易对后续实验造成影响,所以对支原体污染的检测和清除非常重要。
以下为一次支原体检测和清除的实例。
材料:细胞系:SH-SY5Y支原体PCR检测试剂盒:Myco-P-20 (上海炎熙生物 )支原体清除剂:Myco-E-1 (上海炎熙生物 )方法与结果:1,将已检测出有支原体污染的SH-SY5Y细胞以正常传代密度铺到6孔板中,一个孔加清除剂,作为测试孔,另一孔不加清除剂,作为阴性对照孔。
两孔之间间隔一个孔,以免互相污染。
2,在清除支原体的过程中细胞以常规方法传代培养,并使细胞在培养过程中一直处于清除剂的作用下。
在加清除剂后第4、8、9、11天各取1毫升培养上清。
每份上清与细胞已共培养48小时,除第9天的上清只共培养了24小时。
3,将这些培养上清在16000g离心5分钟,小心去除离心上清,将沉淀用无菌PBS洗三次,每次以16000g离心5分钟。
最后获得的沉淀用100微升纯水重悬,在100℃水浴中孵育5分钟,然后用于PCR反应。
4,按照支原体检测试剂盒Myco-P-20的说明书进行PCR检测操作,结果如下:4.1,与对照样品共同反应,用这种方式可以判断是否出现了假阴性结果。
在加清除剂后第4天的样品中仍可见到支原体阳性条带(约440bp),在第8、9、11天的样品中,已看不到支原体阳性条带。
4.2,不加对照样品,检测样品单独反应,用这种方式可以提高测试灵敏度。
可见在第8天和第9天的样品中,支原体阳性条带仍然出现,但是弱于第4天的样品。
在第11天的样品中,有明显的200bp以下的非特异的条带,且亮度高于阳性条带,所以判断此时的PCR产物是非特异反应的产物,样品中已没有支原体DNA。
注释:由于PCR是一种非常灵敏的检测方法,所以很容易出现假阳性条带。

浅析细胞体外培养的三大污染细胞培养技术是离体方法中主要的一种,是从动物体内取出细胞,模拟体内的生理环境,在无菌、适温、丰富的营养条件下,使离体细胞生存、生长并维持结构和功能的一门技术。
细胞实验是科学探究的基础,然而在细胞培养中,常会因为不适宜的环境条件以及不得当的操作导致细胞被污染。
在细胞培养实验中如何避免污染是一项很重要的工作,现在我们来看一下细胞体外培养中常见的污染种类,以及避免方法。
1、外源性污染外源性污染中应注意实验室内空气保持洁净,定期清扫、紫外消毒,操作者严格按照无菌操作进行。
由于离体细胞对各种毒物都很敏感,所以细胞培养所用器材的清洗、消毒处理非常关键。
培养所用的物品器具要彻底清洗消毒,超净台的物品摆放要井然有序,避免反复烧烤已经高温灭菌的物品以及避免因细胞株种类过多而引起的细胞间交叉污染。
细胞实验室的构建也是各个细胞实验服务公司必备的实验室,实验室需要配备CO2培养箱、超净工作台/生物安全柜、纯水系统以及液氮罐等设备,同时需要保证细胞实验室的干净与整洁。
2、支原体污染支原体是一种没有细胞壁的原核生物,大多呈不规则球状或丝状,由于它的直径小(约为0.15-2 µm),而且形状灵活,所以能逃过实验室常用的滤膜。
在光学显微镜下支原体不可见,对培养基的需求有限,一般不会引起培养物混浊,因此支原体像慢性毒药一般杀细胞于无形之中。
细胞被支原体污染后,其生长繁殖和形态、代谢及功能、染色体及免疫细胞产量均会受到影响,支原体污染能够消耗营养物,促进代谢积累,导致PH改变,诱导或抑制细胞因子表达,并改变培养细胞的代谢、增殖特征以及形态。
据一些资料报道,支原体污染在细胞体外培养过程中发生率高达15%~80%。
为了避免支原体污染的发生,对培养物进行常规的支原体检测非常重要,应严格按照细胞培养操作程序进行操作、确保适宜的环境条件、严格的无菌观念操作、定期清洁消毒、任何培养用液使用前均进行无菌检查、只引进来源可靠的细胞,同时一旦发现污染的细胞应灭活弃之避免进一步污染扩散。

细胞培育过程中的污染不仅仅指微生物,而且还包括全部混入培育环境中的、对细胞生存有害或造成细胞不纯的物质,包括生物和化学物质。
培育细胞受细菌污染后,会消失培育液变混浊,pH转变。
也有的培育液肉眼观看无多少转变,只能在镜下发觉菌体才知污染。
所以,每天应认真观看。
污染后细胞发生病理转变,胞内颗粒增多、增粗,最终变圆脱落死亡,造成试验失败和细胞株(系)丢失。
培育细胞受真菌污染后,可见培育液中漂移着白色或浅黄色的小点,有的散在生长,培育液一般不发生混浊;倒置显微镜下可见丝状、管状或树枝状的菌丝纵横交叉在细胞之间或培育基中,有的呈链状排列。
念珠菌和酵母菌呈卵圆形散在细胞周边和细胞之间。
个体细小,有增多趋势。
镜下看时,要将培育瓶用酒精棉球擦洁净,以防止与瓶外尤其瓶底外面生长的菌丝相混淆。
真菌污染后,细胞生长变慢,但最终由于养分耗尽及毒性作用而使细胞脱落死亡。
支原体是介于细菌与病毒之间能独立生活的最小微生物,最小直径0.2μm, 一般过滤除菌无法去除它,光镜下难以看清它的形态结构。
开头不易发觉,能在偏碱条件(pH7.6~8.0)下生存,对育霉素有抗药性,多吸附于细胞表面或散在于细胞之间。
电镜下可见其有三层结构,无细胞壁,中心有电子密度大的密集颗粒或丝状的中心囊。
培育细胞受支原体污染后,部分敏感细胞可见细胞生长增殖变慢,部分细胞变圆,从瓶壁脱落。
但多数细胞污染后无明显变化,或略有变化,若不准时处理,还会产生交叉污染。
采纳组织细胞培育法生产疫苗,假如没有除去潜在病毒的组织培育物,会产生病毒污染。
目前,从原代猴肾细胞的培育中已发觉不少于20种血清性病毒。
尽管病毒污染的细胞不影响原代培育,但生产疫苗是担心全的。
若二倍体细胞系有SV40或多发瘤病毒,B淋巴细胞含EB病毒,细胞和会发生变异、转化,形成异倍体的细胞系。
因此,潜在病毒是细胞大量生产和疫苗、干扰素等生物制品制作中的难题。
五、非同种细胞污染由于细胞培育操作时各细胞株所需的器材和溶液没有严格分开,操作不当,往往会使•种细胞被另•种细胞污染。


细胞支原体污染相关知识简介(2016年10月16日)(1)支原体简介:支原体(Mycoplasma)是一种没有细胞壁的原核生物,大小约0.1 - 0.6微米。
目前,已发现的支原体品种有100多种。
其中,有近20种曾经在各种细胞培养体系中检测到,但超过98%以上的支原体污染是由6-8种引起的(注:具体的支原体种类,上海易色的《一步法恒温支原体检测试剂盒》说明书中有详细介绍)。
而且同一种细胞经常被多种支原体污染。
(2)支原体污染细胞的途径:由于支原体直径较小,经常可以穿过实验室常规的0.20微米孔径的除菌滤膜,高压过滤时,甚至可以穿过0.10微米孔径的除菌滤膜,造成细胞的支原体污染。
细胞培养的支原体污染来源主要有:(1)细胞之间的交叉污染,这是支原体污染的最主要原因;(2)细胞培养操作人员的口腔、皮肤等。
(3)细胞培养用的组分,如血清、培养液等。
(3)细胞支原体污染的隐蔽性:由于支原体体积比细菌小很多,通常支原体污染密度非常的高,可达107-9/mL培养液,但即使这么高密度的支原体污染也无法通过普通显微镜的肉眼观察进行判断。
而且,轻度到中度的支原体污染并不会导致细胞形态或生长速度的明显改变,也不会明显改变培养液的浑浊度或培养液的pH值。
以上两个原因就导致体外培养的细胞即使被支原体污染了,一般的科研工作者也不会觉察到。
也就是说:如果不进行支原体的常规检测,你甚至不知道你培表1,细胞支原体污染统计结果,数据来自参考文献 [4]3. Edward Burnett and Liz Penn, European Collection of Cell Culture(ECACC®). Mycoplasma Detection and Elimination. Don Finley, Market Segment Manager, Sigma® Life Science. Biofiles, Vol. 8, No. 184. John Ryan (2008). "Understanding and Managing Cell CultureContamination". Corning Incorporated. p. 24.。

细胞培养中支原体污染的检测方法由于细胞支原体污染的隐蔽性及对细胞的严重影响,细胞的支原体污染已经成为了一个比较棘手的世界性难题。
实验室新引进的细胞,应该比较采取一定的方法检疫确定没有支原体污染才能使用。
为了提高动物细胞培养生物制品的质量和安全性,中华人民共和国药典规定主细胞库、工作细胞库、病毒种子批、对照细胞以及临床治疗用细胞应进行支原体检测。
美国食品药品监督管理局(FDA)强烈建议,应该用合适的方法检测细胞的支原体污染状况。
欧洲药典European Pharmacopoeia(EP,7 the dition,Section2.6.7.)规定对细胞治疗产品需要进行严格的支原体检测。
提高对支原体污染的警惕,坚持定期做支原体的检测,努力杜绝污染。
所以寻找一种快速简单灵敏的方法进行细胞支原体常规检测就显得尤为重要。
2017年先达基因()研发了一种细胞污染支原体检测试剂盒,每次检测只需半个小时,减少了很多工作量,其原理是基于其自主研发的恒温核酸检测技术(ERA),结合恒温荧光定量检测仪,可以在恒定的低温下(25℃-42℃)对痕量的支原体种内保守性DNA 片段进行特异性的扩增,扩增反应可以在20min内完成,该试剂盒检测范围涵盖130种支原体,实现了快速、简单、灵敏的进行细胞支原体常规检测。
1956年,Robinson等首次发现细胞培养物中的支原体污染以来,对其形态、繁殖、分类、体外培养、细胞膜结构和膜蛋白分析、代谢途径等方面都进行了深入研究。
1995年10月,来自马里兰盖瑟斯堡的基因组研究协会(TIGR)与位于ChapelHill的北卡罗来纳州立大学的团队合作,共同完成生殖支原体全基因组580kb测序,这也是人类首次完成支原体全基因组测序的,随后RichardHerrma实验室完成了肺炎支原体全基因组800kb的测序,使得支原体的检测进入分子检测领域成为可能。
到目前为止,出现了很多支原体的检测方法,有传统检测方法(包括直接培养法和DNA荧光染色法)、ATP酶法、免疫法(ELISA法等)以及分子诊断方法(包括普通PCR和荧光PCR、LAMP,重组酶扩增技术等),这些技术在检测时间,检测准确性,灵敏度和特异性上有不同的差别。
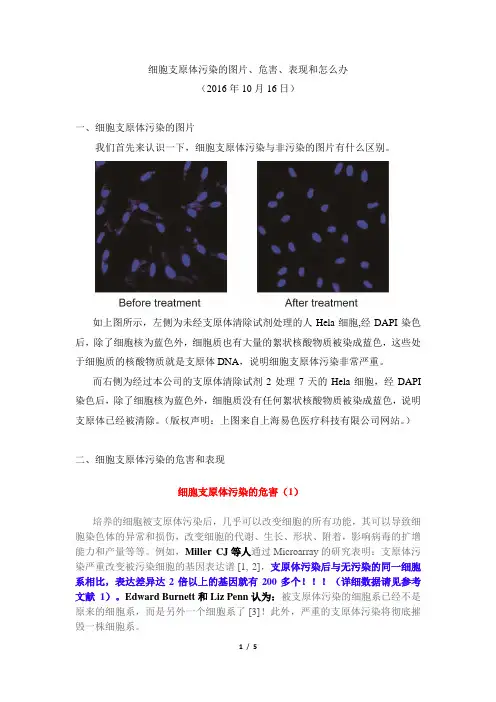
细胞支原体污染的图片、危害、表现和怎么办(2016年10月16日)一、细胞支原体污染的图片我们首先来认识一下,细胞支原体污染与非污染的图片有什么区别。
如上图所示,左侧为未经支原体清除试剂处理的人Hela细胞,经DAPI染色后,除了细胞核为蓝色外,细胞质也有大量的絮状核酸物质被染成蓝色,这些处于细胞质的核酸物质就是支原体DNA,说明细胞支原体污染非常严重。
而右侧为经过本公司的支原体清除试剂2处理7天的Hela细胞,经DAPI 染色后,除了细胞核为蓝色外,细胞质没有任何絮状核酸物质被染成蓝色,说明支原体已经被清除。
(版权声明:上图来自上海易色医疗科技有限公司网站。
)二、细胞支原体污染的危害和表现细胞支原体污染的危害(1)培养的细胞被支原体污染后,几乎可以改变细胞的所有功能,其可以导致细胞染色体的异常和损伤,改变细胞的代谢、生长、形状、附着,影响病毒的扩增能力和产量等等。
例如,Miller CJ等人通过Microarray的研究表明:支原体污染严重改变被污染细胞的基因表达谱 [1, 2],支原体污染后与无污染的同一细胞系相比,表达差异达2倍以上的基因就有200多个!!!(详细数据请见参考文献1)。
Edward Burnett 和 Liz Penn认为:被支原体污染的细胞系已经不是原来的细胞系,而是另外一个细胞系了 [3]!此外,严重的支原体污染将彻底摧毁一株细胞系。
从2013年开始,《Nature》期刊已正式要求投稿的文章,如涉及细胞培养都要进行支原体检测。
相信会有越来越多的高水平期刊将做出同样的支原体检测要求。
总之,在细胞系上进行生物医学方面的科学研究,如果不能保证所用的细胞系无支原体污染(Mycoplasma-free),则所得出的结论是极端不可靠甚至是完全错误的!可以想象:全球范围内,每年因支原体污染导致白白浪费的科研经费的数量是多么的巨大,有人估计至少高达数十亿美金!细胞支原体污染的危害(2)1. 细胞生物学:支原体污染将直接导致最常用的MTT细胞毒性实验结果的严重错误!●结果:由于支原体对MTT的额外还原作用,对阿霉素(Doxorubicin, 一种抗肿瘤药物)的抗性,支原体污染和非污染的细胞二者相差15倍!(Due to an additional reduction of tetrazolium by mycoplasmas, contaminated cells appeared up to 15 fold resistant to doxorubicin.)●参考文献:Falsification of tetrazolium dye (MTT) based cytotoxicity assayresults due to mycoplasma contamination of cell cultures. Anticancer Res. 1999 Mar-Apr; 19(2A):1245-8.2. 免疫学:支原体污染本身将可以直接诱导树突状细胞的成熟!这对于目前国内外普遍开展的人体免疫细胞的肿瘤治疗将是灾难性的。

细胞培养中支原体污染的检测细胞培养中最令人头疼的问题之一是微生物的污染,而支原体的污染更给人一种看不见摸不着的感觉。
长期以来,这个问题一直令细胞培养工作者困惑。
在人们日常生活的工作环境中,支原体可以说无处不在,它可以通过人的毛发、口腔、穿着的衣服、动物的皮毛以及日常的细胞培养的操作环境造成对细胞污染。
国内外研究表明造成细胞培养污染的支原体主要为以下四种支原体,即口腔支原体、精氨酸支原体、猪鼻支原体和莱氏无胆甾原体。
但能够造成细胞污染的支原体种类还很多,有些细胞甚至同时感染两种以上的支原体。
由于支原体体积很小,直径约在0.2—2.0um之间,通常可以通过过滤膜而直接造成培养基或血清的污染。
另外,被支原体污染的细胞培养基液体往往并不浑浊,细胞受损程度并不明显,形态很少改变,这样就更增加了人们对其的防范难度。
从形态结构上,支原体形态多变,它多吸附在细胞表面或散于细胞与细胞之间。
从其理化或生物学特性上讲,所有支原体代谢均需胆固醇,部分需要精氨酸和葡萄糖。
支原体的生存要求要比细菌高,同时,除需基本营养物质外,还需10—20%血清条件,最适pH值在7.8—8.0之间,多数支原体呈兼性厌氧,其繁殖方式主要是二分裂繁殖,分裂和其DNA复制不同步,可形成多核长丝体。
由于支原体是一类缺乏细胞壁的微生物,因此它对作用于细胞壁类的抗生素(如青霉素G)不敏感。
支原体对热的抵抗力和细菌相似,而对环境渗透压的变化比较敏感。
支原体对细胞的影响,可以从两方面考虑。
一方面是对细胞的直接影响,细胞被支原体污染后,增殖缓慢,部分细胞变圆,从瓶壁上脱落,部分细胞虽然表面变化不十分明显,实际上潜伏着多方面的危险。
另一方面,支原体可以通过消耗培养基中的精氨酸,抑制细胞DNA、RNA的合成,降低细胞的抵抗力。
因此,支原体污染对细胞的影响是非常广泛和深远的。

支原体污染细胞培养的检测方法
由于支原体种类不同,应采取不同的方法进行检测,常用的方法有如
下几种。
1、观察细胞的形态和生长特征
支原体污染比较严重时可出现生长减慢,有的培养基pH明显变酸,并
出现细胞病变,其病变特征与病毒感染相似,因此不能准确诊断。
2、分离培养法
大多数支原体可出现特有的典型菌落。
该方法准确、可靠,但时间长,敏感性不够高。
3、DNA结合荧光素染色法
此法简便、价廉,但若细胞片制备不当则结果难以判断。
4、电子显微镜和免疫电子显微镜法
此法较准确,但受条件限制,时间长,敏感性不高。
5、间接免疫荧光法和免疫印迹
简便、快速、特异性强,如果应用单克隆抗体试剂,效果会更好。
6、PCR技术
快速、敏感性高,但若条件控制不当容易出现假阴性和假阳性。
7、其他方法
放射性核素掺入法、放射自显影法、基因探针法等。
细说细胞培养中的的支原体污染以及生长曲线测定-麒盟生物1、问:测定细胞生长曲线的意义是什么?答:细胞生长曲线是测定细胞绝对生长数的常用方法,也是判定细胞活力的重要指标,是培养细胞生物学特性的基本参数之一。
因为细胞太小,无法测单个细胞的生长状态,所以测细胞群体的生长曲线。
2、问:如何选择细胞接种数?答:可根据细胞传代培养过程中接种数及细胞生长周期进行计算,细胞接种数因细胞的不同而不同。
3、细胞计数时为什么要用台盼蓝染色?答:加入台盼蓝后,活细胞不着色,台盼蓝着色的细胞呈深蓝色,是不健康或已死亡的细胞,不能计数。
4、细胞生长曲线测定时为什么要做重复孔?答:测定细胞生长曲线细胞计数时选择3个复孔,每孔分别计三次,取其平均值,目的是减小操作误差。
5、细胞生长曲线测定周期是几天?答:一般是一个星期。
6、为什么绘制的细胞生长曲线没有达到平台期?答:可能有以下原因:一是细胞接种密度过低;二是细胞培养时间过短;三是细胞生长状态不好,使其不能正常增殖。
更多专业知识,登陆麒盟生物网站查询。
7、为什么细胞计数第一天,细胞数没有增加反而减少?答:一般细胞传代后,会有一个生长缓慢的潜伏期,细胞不增殖,而细胞会有正常的死亡,故细胞数不增加反而减少。
8、细胞生长曲线还有其他方法绘制吗?答:当然有。
我们提到最多的是直接计数的方法,除此以外还有相对计数的方法,该类方法首先要绘制标准曲线,标定细胞数和某个变量的函数关系,然后我们只需要测定每天这个变量的值便可以计算出细胞数。
常用的是MTT、CCK8等比色的方法。
细胞培养中的的支原体污染支原体是一种大小仅为0.2~0.3μm,无细胞壁,可透过一般过滤膜(0.22~0.45μm)的原核生物。
支原体是让每个细胞培养者崩溃的家伙。
因为它极小,可以很轻松的通过滤膜,混入培养系统中,而且没有细胞壁,可以轻而易举的躲过抗生素,就这样悄无声息的杀死细胞,与细菌和真菌相比,支原体造成的污染不论在检测、预防还是去除上都更为困难。
细胞支原体污染较长一段时间,一直觉得细胞培养有点问题,无缘无故的出现细胞代谢异常现象,培养基内小渣渣变多,看不到细菌污染,看不到培养基浑浊,但可以感觉到细胞状态不行,即使是单层没有复层时也一样,当时考虑支原体污染,查了一些有关支原体污染的内容,由于细胞状态可以在换新鲜培养基的时候转变过来,而自己的实验也是需要在换培养基后进行,故而疏忽了可恶的支原体污染,今天决定解决这个问题。
先查了一下资料:细胞支原体污染的一般情况及预防措施细胞株若受到细菌、真菌、支原体、或是特定病毒等之污染时,会严重的影响实验的结果。
而细菌、真菌等之微生物污染时,较易自培养基等的外观变化察觉。
但是若受到支原体之污染时,细胞之外观较无明显变化,但是其污染会造成细胞之生长速率缓慢、细胞产生病变之型态改变等等变化。
各国细胞库支原体污染的统计表,如下:国家受支原体污染(%) 报告年度USA-FDA 15 1993(past 30 years)USA-ATCC 15-20 1992Japan-(IFO,RIKEN,JCR 80~30~22 1981 1987-19931998Germany-DSM 36 1990-1994Argentina 65 1987Israel 32 1986-1993China 95 1990造成支原体高污染率的原因:1、支原体size 0.1~0.8 um,无细胞壁,可透过一般过滤膜(0.22-0.45 um)2、支原体污染时,没有明显的肉眼或一般光学显微镜可观察到的特征变化3、过去缺乏简单、快速且可靠的检测方式4、细胞流通间缺乏品管,造成实验室间的相互污染5、研究或操作人员忽略污染问题支原体污染的来源:1、已受污染的细胞2、操作人员的疏失3、已受污染的培养基、血清4、操作环境不良、实验器具不洁等由于支原体为人体口腔中之正常菌丛,实验室之操作人员的污染亦可能为污染源,须十分注意。
而万一细胞已受支原体污染时,最佳的处理原则为将细胞高压灭菌后丢弃,以免污染其它洁净的细胞株。
支原体污染及检测
1)支原体污染在细胞培养中最常见、不易被查觉,但支原体污染可显著
影响细胞功能干扰实验结果。
支原体是介于细菌和病毒之间的目前所知能独立生活的最小微生物,它无细胞壁,形态呈高度多形性,最小直径0.2um,可通过滤器。
支原体在污染细胞后,它通过影响细胞的DNA、RNA 的合成及急速消耗
培养基中的氨基酸来抑制细胞的生长,并能降低细胞的融合率。
因此,在运用各种细胞系进行实验研究时,首先要证明所用细胞有无支原体的污染。
2)支原体污染后,培养基可不发生浑浊,细胞病变轻微或不明显,因此
难以发现。
目前,支原体检测的方法有以下几种。
(a)相差显微镜观察;
(b)低张处理地衣红染色法;
(c)荧光染色法;
(d)酶标法;
(e)PCR法:基础医学细胞中心使用该方法进行检测。
优点:灵敏度高,检测耗时短,样品量小
Cellmax胎牛血清Max choice, Max cells
此外,使用高品质的血清培养细胞,可以降低细胞被支原体污染的可能性。
Cellmax胎牛血清Max choice, Max cells。
细胞培养常见问题(一)1.如何判断细胞株有支原体污染?细胞培养过程中,最常见的污染是支原体污染,一旦发现有下列情况,应怀疑细胞已被支原体污染:1.培养基过早变色(变黄)。
2.细胞生长率明显下降,生长缓慢,破碎细胞多。
3.悬浮细胞特别容易成团。
4.细胞形态发生改变,细胞间隙大。
5.只有频繁改善培养环境,才能继续传代。
为了确保实验的严谨性,建议选择支原体检测试剂盒进行支原体污染的检测。
2.支原体污染会对细胞培养有何影响?支原体污染几乎可影响所有细胞的生长参数、代谢及研究的任一数据。
故进行实验前,必须确认细胞为mycoplasma-free,实验结果的数据方有意义。
3.检测出细胞株有支原体污染时,该如何处理?支原体污染细胞后,特别是重要的细胞株,有必要去除支原体。
由于支原体没有细胞壁,故作用于细胞壁生成的抗生素是不敏感的,而且,抗生素对细胞有毒性,容易产生耐药性。
目前,市场上已有支原体去除试剂盒,利用生物物理方法快速杀死支原体,且无毒无耐药,从而达到永久去除支原体的目的。
4.血清解冻后发现有絮状沉淀物出现,该如何处理?血清中沉淀物的出现有许多种原因,但最普遍的原因是由于血清中脂蛋白的变性所造成,而血纤维蛋白(形成凝血的蛋白之一)在血清解冻后,也会存在于血清中,亦是造成沉淀物的原因之一。
但这些絮状沉淀物,并不影响血清本身的质量。
若欲去除这些絮状沉淀物,可以将血清分装至无菌离心管内,以400转/分离心1-2分钟,上清液即可接着加入培养基内一起过滤。
最好不使用过滤的方法去除这些絮状沉淀物,因为它可能会阻塞过滤膜。
在解冻血清时,建议随时将血清摇晃均匀,使温度及成分均一,减少沉淀的发生。
5.为什么储存在冰箱中的胎牛血清会出现沉淀?胎牛血清储存在2-8℃时,血清中的各种蛋白和脂蛋白(如冷凝集素、纤维蛋白原、玻粘连蛋白等)可能聚集而形成沉淀或可见的混浊。
这不会影响血清的质量。
推荐在-20℃储存胎牛血清,避免反复冻融。
检测你的细胞是否有支原体污染告诉你们这一桌年夜饭都是我做的哦(得意脸)。
一般实验做的好的人,做饭也不会太差。
今年跟大家分享的最后一个帖子就是怎么检测细胞支原体污染。
支原体感染的细胞样子在细胞培养过程中支原体污染经常出现且不易消除,95%以上是由口腔支原体造成(所以细胞培养戴口罩是很必要的,感觉你再怎么小心对待你的细胞都不为过)。
1.支原体污染初期, 在高倍显微镜下(400倍),虽然细胞无明显变化,但是在细胞膜周围或细胞间隙可以发现细小黑色颗粒。
2.细胞培养时间延长, 尽管培养液不浑浊(一般细菌污染培养液会变浑浊), 但培养液pH值变化明显然后颜色变黄(虽然一般的细胞培养培养基也会变黄,但是速度要慢很多)。
3.在支原体感染较重的时候可以引起细胞变形。
4.如果你们实验室没有常规杀除支原体的操作,那么我相信只要你们在用细胞培养标本去送RNA-seq、LncRNA测序、CirRNA测序时,公司给出的结果都会有支原体污染。
下图是nature杂志给出的如果用细胞系做的实验,需要提供无支原体污染的证据(果子老师,重新ATCC购买细胞哦)Nature.jpg因此在细胞培养过程中进行支原体检测与防治十分必要。
今天先跟大家分享支原体怎么检测,也就是你怎么检测你的细胞有无支原体污染。
常见的支原体检测方法有直接培养法和间接法。
直接培养法这个方法其实对于不做支原体研究的人来说基本用不上,这里就不细讲。
如果需要可以留言交流。
间接法1. DNA荧光染色法在免疫荧光那一期没有具体介绍活细胞怎么做免疫荧光。
这里稍微讲讲活细胞怎么染核。
活细胞可以用Hoechst染色。
可将DNA标示,此种染色方式也可以用来辨识DNA,意思就是细胞内有DNA的都可以识别出来,在正常细胞中就是细胞核及线粒体可以被识别。
那支原体污染时的染色是什么样的呢?首先,支原体有自己的基因组,所以,如果有支原体污染的情况,会在细胞表面或者培养基中发现有小点或者碎片状的荧光,有时候会形成连续的一圈。
关于细胞培养中的污染细胞培养中常见的污染情况总结如下:常见的污染如下:1、细菌:常见的污染细菌有革兰氏阴性菌和大肠杆菌,假单胞菌等,革兰氏阴性菌中白色葡萄菌等比较常见。
一旦发生细胞污染交易发现,多数情况下培养液短期内颜色变黄;表明有大量的酸性物质产生,,出现明显的混浊现象,有的静止的培养液液体初看不混浊,但稍加振荡,就有很多混浊物漂起。
细菌在普通倒置显微镜下为黑色细沙状,根据感染细菌的不同,可有不同的外形,对细胞生长影响明显。
仔细检查一下器皿的灭菌情况,是否在高压灭菌时放气时间足够,压力足够!尤其是和储存培养液接触的移液管等物品,连续两次污染的话有可能造成储存液污染,一定要注意!下次使用前检查一下培养液是否存在浑浊的现象!可在培养液中加相应的抗生素处理2、霉菌:培养液是清亮的,倒置显微镜下无杂质,37度孵箱培养2-3天,仍清亮,但出现絮状杂质,镜下可见呈细丝状的团状漂浮物,可看到明显的菌丝,细胞仍可生长,但时间长之后,细胞的活力状态变差,用硫酸铜溶液擦拭CO2孵箱内,再把水盘里也加上饱和量的硫酸铜。
或者在培养箱的托盘加入饱和的消毒磷酸氢二钠高盐液体,可以防止霉菌污染。
CO2孵箱被霉菌污染后,可把所有细胞暂时转移,采用过氧乙酸擦洗孵箱(包括隔板,箱壁)。
并把过氧乙酸放置在孵箱内一个小时,使其蒸汽弥漫。
待过氧乙酸的气味消散后,再移入细胞。
孵箱应定期清洁(2月左右),尤其在多雨的季节。
其它培养箱清洗方法是:用84液擦洗-清水擦洗-75%酒精擦洗-紫外灯照。
预防霉菌污染,可在培养基里加3u/ml的两性霉素或制霉菌素或放线菌素D或双抗;但细胞一旦污染,很难挽救,制霉菌素或放线菌素D或双抗都于事无补,建议舍弃该污染细胞。
,将环境彻底消毒,如果所有细胞都污染,可能是系统污染,检查一下培养基和器材,如果只是个别污染,可能是操作问题,就要注意操作3、支原体:黑色的,好象多为多形,培养液一般培养液一般会浑浊,原体感染,国内血清很多都没有做支原体阴性检测,而支原体是牛血清中最常见的微生物之一。
细胞培养中支原体污染的特点及检验的笔记
支原体是一种大小介于细菌和病毒之间(最小直径0.2um)并独立生活的微生物。
约有1%可通过滤菌器。
支原体无细胞壁形态呈高度多形性。
可为圆形、丝状或梨形。
支原体形态多变,在光境下不易看清内部结构。
电镜下观察支原体膜为三层结构。
其中央有电干密度大的密集颗粒群或丝状的中心束。
支原体多吸附或散在于细胞表面和细胞之间。
横断面与细胞微绒毛相似,但微绒毛电子密度比支原体小,且中央无颗粒群
或中央束。
支原体代谢需固醇类物质、部分种类需要精氨酸、O2或葡萄糖,每一种支原体都有自身持点。
多数支原体适合于偏碱条件下生存(PH7.6-8.0),对酸耐受性差。
对热比较敏感,对一般抗生素不敏感。
支原体污染细胞后,培养液可不发生混浊。
多数情况下细胞病理变化轻微或不显著,细微变化也可由于传代、换液而缓解,因此易被忽视。
但个别严重者,可致细胞增殖缓慢,甚至从培养器皿脱落。
为确定有无支原体污染可做如下检测:
①相差显微境检测:将细胞按种于事先放置于培养瓶内的盖玻片上,24h后取出,用相差油镜观察,支原体呈暗色微小颗粒位于细胞表面和细胞之间。
②荧光染色法:荧光染色用能与DNA特异性结合的荧光染料Hoechst 33258,可使支原体内含有的DNA 着色,染色后用荧光显微镜观察。
具体方法如下:首先将细胞接种盖玻片上,在细胞未长满前取出玻片,用不合酚红的Hanks液漂洗一下,用l:3醋酸甲酵固定10Min,然后用生理盐水漂洗,置于用生理盐水配浓度为50pg/ml的Hoechst 33258中染色10min。
染色后用蒸溜水洗1-2min,向细胞面滴加pH5.5磷酸缓冲液数滴,然后置荧光显微镜下观察。
镜下支原体为散在于细胞同围或附于细胞膜表面的亮绿色小点。
③电镜检查;用扫描电镜方法简便快速,也可以利用透射电镜。
④DNA分子条文检查或支原体培养等方法:检出率高,但方法较为复杂。
支原体是一类缺乏细胞壁的原核细胞型微生物,大小一般在0.3-0.5μm之间,呈高度多形性,有球形、杆形、丝状、分枝状等多种形态。
它不同于细胞,也不同于病毒。
支原体用普通染色法不易着色,用姬姆萨染色很浅,革兰染色为阴性。
支原体可在鸡胚绒毛尿囊膜上或细胞培养中生长,营养要求比细菌高。
细胞培养(特别是传代细胞)被支原体污染是个世界性问题。
在细胞培养中支原体感染发生率达到63%,支原体感染发生后能改变细胞的DNA,RNA及蛋白表达,又不能通过可视法对其进行检测,而且它对细胞的生长率影响较小,不易引起注意。
国内外研究表明,95%以上是以下四种支原体:口腔支原体(M.oral e)、精氨酸支原体(M.arginini)、猪鼻支原体(M.hyorhinis)和莱氏无胆甾原体(idlawii),为牛源性。
以上是最常见的污染细胞培养的支原体菌群,但能够污染细胞的支原体种类是很多的,国外调查证明,大约有二十多种支原体能污染细胞,有的细胞株可以同时污染两种以上的支原体。
支原体污染的来源包括工作环境的污染、操作者本身的污染(一些支原体在人体是正常菌群)、培养基的污染、污染支原体的细胞造成的交叉污染、实验器材带来的污染和用来制备细胞的原始组织或器官的污染。
组织细胞培养工作中,主要从以下几个方面来预防支原体的污染:控制环境污染;严格实验操作;细胞培养基和器材要保证无菌;在细胞培养基中加入适量的抗生素。
支原体污染细胞后,特别是重要的细胞株,有必要清除支原体,常用方法有抗生素处理、抗血清处理、抗生素加抗血清和补体联合处理。
支原体最突出的结构特征是没有细胞壁,一般来讲,对作用于细胞壁生物合成的抗生素,如β-内酰胺类、万古霉素等完全不敏感;对多粘菌素(polymycin)、利福平、磺胺药物普遍耐药。
对支原体最有抑制活性及常用于支原体感染治疗的抗生素是四环素类、大环内酯类及一些氟喹诺酮;其他类抗生素如氨基糖苷类、氯霉素对支原体有较小抑制作用,所以常不用来作为支原体感染的化学治疗剂。
InvivoGen公司研究开发的新一代支原体抗生素M-Plasmocin能有效地杀灭支原体,不影响细胞本身的代谢,并且用M-Plasmocin处理过的培养细胞,不会重新感染支原体。