2019铁离子与亚铁离子转化语文
- 格式:doc
- 大小:14.06 KB
- 文档页数:4

亚铁离子与铁离子的转化亚铁离子与铁离子的转化及其在生物体中的作用亚铁离子(Fe2+)和铁离子(Fe3+)是铁元素(Fe)的两种氧化态。
在化学反应中,亚铁离子和铁离子可以相互转化,这种转化在生物体内起着重要的作用。
本文将探讨亚铁离子与铁离子的转化过程,以及它们在生物体内的生理功能。
亚铁离子和铁离子在水溶液中的转化是一个氧化还原反应。
当亚铁离子和氧气接触时,氧气将亚铁离子氧化成铁离子,并生成水。
这个反应可以简化为:4Fe2+ + O2 → 4Fe3+ + 2H2O反之,当铁离子和还原剂(如铁离子还原酶)接触时,铁离子会被还原成亚铁离子,同时还原剂被氧化。
这个反应可以简化为:4Fe3+ + 4e- → 4Fe2+这种氧化还原反应是生物体内一些关键生化过程的基础。
亚铁离子和铁离子在生物体内起着许多重要的生理作用,特别是在血液和细胞的代谢过程中。
亚铁离子在体内主要存在于铁蛋白中,这是一种可以储存和运输铁离子的蛋白质。
铁蛋白能够将亚铁离子吸附在其分子结构中,从而有效地避免其被氧气氧化成铁离子。
当亚铁离子需要被释放时,铁蛋白会通过一系列生化反应将其中的亚铁离子氧化为铁离子,从而释放出来。
铁离子是血红蛋白和肌红蛋白中的关键组成部分。
血红蛋白是红细胞中的一种蛋白质,它能够携带氧气到全身各个组织和器官。
血红蛋白中的铁离子可以与氧气结合形成氧合血红蛋白,而在组织中释放氧气。
当血红蛋白中的铁离子被氧气氧化成铁红蛋白时,它会失去对氧气的亲和力,从而将氧气释放出来。
铁离子在细胞的代谢过程中也扮演着重要角色。
细胞需要铁离子来合成DNA,RNA和许多重要的蛋白质。
铁离子还参与细胞中的呼吸链反应,这是一种将食物转化为可使用能量的过程。
此外,铁离子还参与体内的免疫反应,调节细胞的生长和分裂,以及许多其他生物化学过程。
然而,亚铁离子和铁离子过量或缺乏都会对生物体产生不利影响。
当体内铁离子过量时,它们可以与细胞和组织中的其它物质结合,形成自由基,导致细胞膜的氧化损伤和DNA的突变。

第1篇一、实验目的1. 了解亚铁离子的性质,包括其氧化还原性质。
2. 探究亚铁离子在不同条件下的转化过程。
3. 通过实验现象,分析亚铁离子的化学行为。
二、实验原理亚铁离子(Fe²⁺)是铁元素的一种氧化态,具有还原性。
在特定条件下,亚铁离子可以被氧化成三价铁离子(Fe³⁺),也可以被还原成金属铁(Fe)。
本实验主要围绕亚铁离子的氧化还原性质进行,通过加入不同的试剂观察其转化过程。
三、实验材料1. 氯化亚铁(FeCl₂)溶液2. 氯水(Cl₂溶液)3. 铁粉4. 硫氰酸钾(KSCN)溶液5. 稀盐酸(HCl)6. 实验试管、滴管、烧杯、酒精灯、玻璃棒等四、实验步骤1. 制备亚铁离子溶液:取一定量的氯化亚铁固体,加入适量蒸馏水溶解,配制成亚铁离子溶液。
2. 观察亚铁离子溶液的颜色:将亚铁离子溶液倒入试管中,观察其颜色。
正常情况下,亚铁离子溶液呈浅绿色。
3. 氧化亚铁离子:a. 向亚铁离子溶液中加入氯水,观察溶液颜色变化。
b. 加入KSCN溶液,观察溶液颜色变化。
4. 还原亚铁离子:a. 向亚铁离子溶液中加入铁粉,观察溶液颜色变化。
b. 加入KSCN溶液,观察溶液颜色变化。
5. 观察亚铁离子的沉淀反应:a. 向亚铁离子溶液中加入稀盐酸,观察溶液颜色变化。
b. 加入过量铁粉,观察溶液颜色变化。
五、实验现象1. 亚铁离子溶液呈浅绿色。
2. 加入氯水后,溶液颜色变为棕黄色,说明亚铁离子被氧化成三价铁离子。
3. 加入KSCN溶液后,溶液颜色变为红色,进一步证实了三价铁离子的存在。
4. 加入铁粉后,溶液颜色逐渐变浅,说明亚铁离子被还原成金属铁。
5. 加入过量铁粉后,溶液颜色变为无色,说明三价铁离子已被还原成金属铁。
6. 加入稀盐酸后,溶液颜色变为无色,说明亚铁离子与盐酸反应生成氯化铁。
7. 加入过量铁粉后,溶液颜色变为浅绿色,说明氯化铁被还原成亚铁离子。
六、实验分析1. 亚铁离子具有还原性,可以被氯水氧化成三价铁离子。

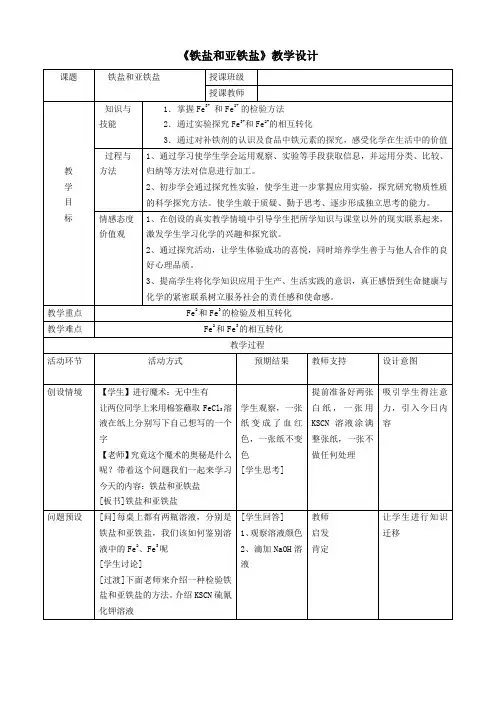
《铁盐和亚铁盐》教学设计
教学反思
本节课的目的是让学生应用所学的分类思想和氧化还原知识,研究重要含铁化合物的化学性质。
从实施后的效果看,有以下几个特点:
组织学生分小组经过预测、选择试剂,自主设计实验和有关活动方案探究Fe3、Fe2的相互转化。
在此过程中,注重让学生体会科学探究的一般过程和方法,激发学生学习化学的兴趣,培养他们科学探究的能力。
实施实验后,引导学生对实验结果进行分析、整理,确定含有不同价态铁元素物质具有的性质和相互转化关系。
这一环节由于受到高一学生化学知识和实验能力的限制,开放程度的确定需要慎重把握,学生的探究能力也需要在今后的学习中循序渐进的培养。
最后让学生根据实验得到的结论去解决生活中的实际问题,解释实验室中配制试剂的注意事项,使所学知识得到及时的巩固和落实。
本节课实施后的情况来看,开放程度总体把握比较合理,几个开放点的设置体现出了一定梯度,有针对性的培养学生多方面能力。
根据课上学生的配合情况和各方面表现,体现出了较好的课堂实效性。

亚铁离子和铁离子的转化化学方程式
亚铁离子和铁离子的转化可以通过氧化还原反应实现。
例如,亚铁离子可以被氧气等氧化剂氧化成铁离子,反应方程式为:
4Fe2+ + O2 + 4H+ → 4Fe3+ + 2H2O
而铁离子也可以被还原剂还原成亚铁离子,例如铁离子与铁反应生成亚铁离子:2Fe3+ + Fe → 3Fe2+
另外,铁离子也可以与一些还原性酸根离子发生反应,转化为亚铁离子,例如:2Fe3+ + 2S2- → 2Fe2+ + S
2Fe3+ + Sn2+ → 2Fe2+ + Sn4+
需要注意的是,这些反应都需要在特定的条件下进行,并且具体的反应条件和反应产物可能因反应物的种类和浓度等因素而有所不同。

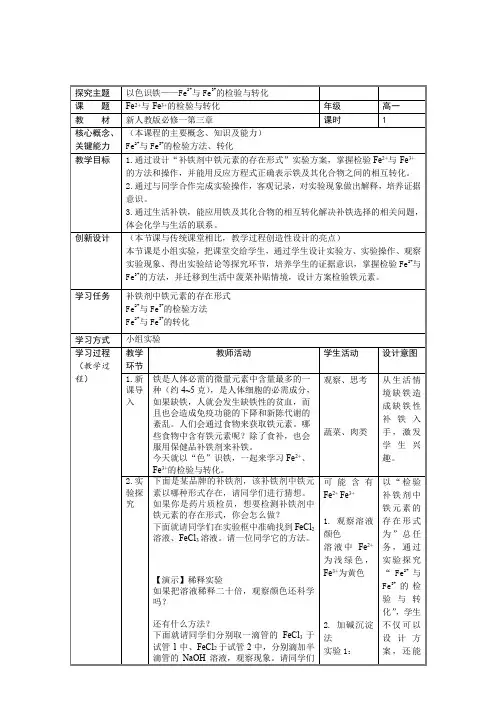
探究主题以色识铁——Fe2+与Fe3+的检验与转化课题Fe2+与Fe3+的检验与转化年级高一教材新人教版必修一第三章课时 1核心概念、关键能力(本课程的主要概念、知识及能力)Fe2+与Fe3+的检验方法、转化教学目标 1.通过设计“补铁剂中铁元素的存在形式”实验方案,掌握检验Fe2+与Fe3+的方法和操作,并能用反应方程式正确表示铁及其化合物之间的相互转化。
2.通过与同学合作完成实验操作,客观记录,对实验现象做出解释,培养证据意识。
3.通过生活补铁,能应用铁及其化合物的相互转化解决补铁选择的相关问题,体会化学与生活的联系。
创新设计(本节课与传统课堂相比,教学过程创造性设计的亮点)本节课是小组实验,把课堂交给学生,通过学生设计实验方、实验操作、观察实验现象、得出实验结论等探究环节,培养学生的证据意识,掌握检验Fe2+与Fe3+的方法,并迁移到生活中菠菜补贴情境,设计方案检验铁元素。
学习任务补铁剂中铁元素的存在形式Fe2+与Fe3+的检验方法Fe2+与Fe3+的转化学习方式小组实验学习过程(教学过程)教学环节教师活动学生活动设计意图1.新课导入铁是人体必需的微量元素中含量最多的一种(约4~5克),是人体细胞的必需成分,如果缺铁,人就会发生缺铁性的贫血,而且也会造成免疫功能的下降和新陈代谢的紊乱。
人们会通过食物来获取铁元素。
哪些食物中含有铁元素呢?除了食补,也会服用保健品补铁剂来补铁。
今天就以“色”识铁,一起来学习Fe2+、Fe3+的检验与转化。
观察、思考蔬菜、肉类从生活情境缺铁造成缺铁性补铁入手,激发学生兴趣。
2.实验探究下面是某品牌的补铁剂,该补铁剂中铁元素以哪种形式存在,请同学们进行猜想。
如果你是药片质检员,想要检测补铁剂中铁元素的存在形式,你会怎么做?下面就请同学们在实验框中准确找到FeCl2溶液、FeCl3溶液。
请一位同学它的方法。
【演示】稀释实验如果把溶液稀释二十倍,观察颜色还科学吗?还有什么方法?下面就请同学们分别取一滴管的FeCl3于试管1中、FeCl2于试管2中,分别滴加半滴管的NaOH溶液,观察现象。

关于亚铁离子和铁离子的一点破事大家都知道颜色不一样含Fe2+的溶液------浅绿色(很不明显)如果足够浓的话会明显含Fe3+的溶液-----不一定,形成不同的配合物【Fe(H2O)6】3+为淡紫色,而【FeCl6】3-为黄色。
关于铁离子的氧化性2Fe3+ + 2Iˉ= 2Fe2+ + I22Fe3+ + H2S = 2Fe2+ + S↓+2H+2Fe3+ + Cu = 2Fe2+ + Cu2+奇葩的四氧化三铁铁元素化合价为332,俗称磁铁矿,但磁化率低,现在基本不用了(现在见到的强磁铁也不是黑的啊)Fe3O4与稀盐酸的反应:Fe3O4+8HCl=FeCl2+2FeCl3+4H2O亚铁盐的注意点亚铁盐与碱的反应:先生成白色沉淀Fe(OH)2,迅速转变成灰蓝绿色,最后转化成棕红色的Fe(OH)34Fe(OH)2+O2+2H2O=4Fe(OH)3但实际上如果在水里全变红要好久,水里溶氧不够还有一个好看的水合硫酸亚铁(FeSO4·7H2O ):蓝绿色晶体,俗称绿矾最后关于它们的检验1. Fe2+的检验1.如果是很浓的浓溶液,看颜色就好,绿色2.如果不浓且无色,瞪眼看就抓瞎了(1)加OHˉ若产生白色沉淀,且沉淀开始出现时为白色,后变成灰绿色,最后变成棕红色,则证明溶液中有亚铁离子。
(2)与氧化剂反应如加入被稀硫酸酸化的高锰酸钾溶液FeSO4 + 8H2SO4 + 2KMnO4=2MnSO4+ 5Fe2(SO4)3+ K2SO4 + 8H2OMnO4- + 5Fe2+ + 8H+ ----> Mn2+ + 5Fe3+ + 4H2O但此方法怕原溶液中有还原性离子如Clˉ,与高锰酸根反应出氯气,这也是不用盐酸酸化的原因(3)加入KSCN 再加氧化剂若为含亚铁离子的溶液,先加入KSCN,不变色,再加入氯水,溶液变(血)红,(氯气氧化亚铁离子成铁离子),则证明有亚铁离子Ps.不必担心氯水里的次氯酸使溶液褪色而无法鉴别,HClO的漂白作用是强氧化性漂白破坏结构的,但是血红色溶液的颜色是三价铁离子与SCN-形成的配合物的颜色不会被破坏加硫氰化钾(KSCN),加入含铁离子的溶液中,溶液变成(血)红色,则证明有铁离子。


《铁及其化合物》教学设计方案(第一课时)一、教学目标1. 知识与技能:理解铁及其化合物的性质和转化,掌握铁盐和亚铁盐的性质和应用。
2. 过程与方法:通过实验探究,培养学生的观察、分析和解决问题的能力。
3. 情感态度与价值观:激发学生对化学的兴趣,培养科学探究的精神。
二、教学重难点1. 教学重点:铁及其化合物的性质和转化实验。
2. 教学难点:铁盐和亚铁盐的性质和应用,特别是Fe2+与Fe3+的鉴别。
三、教学准备1. 实验器械:试管、烧杯、胶头滴管、酒精灯、砂纸、砂轮等。
2. 实验试剂:铁粉、硫酸铁、硫酸亚铁、氢氧化钠、硫氰化钾等。
3. 多媒体课件:铁及其化合物性质和应用的图片、视频等。
四、教学过程:(一)引入课题通过展示铁制品生锈的图片,引导学生思考铁生锈的原因和条件。
接着,引出铁及其化合物的性质和用途,为后续的学习做好铺垫。
(二)新课教学1. 铁的氧化物和氢氧化物通过实验展示铁在氧气中燃烧生成四氧化三铁,引导学生观察实验现象并分析化学方程式。
接着,介绍铁的氢氧化物——氢氧化亚铁的性质和制备方法,通过实验演示氢氧化亚铁的生成和变化过程。
2. 铁离子的性质和用途介绍铁离子的颜色和性质,通过实验展示铁离子与指示剂的反应,让学生观察实验现象并诠释原因。
接着,介绍铁离子的用途,如食品包装袋中的防腐剂、印刷线路板中的镀层剂等。
3. 铁的化合物之间的转化通过实验展示铁离子与亚铁离子的转化干系,让学生观察实验现象并诠释原因。
接着,介绍铁的化合物之间的其他转化干系,如氢氧化亚铁与氧气、盐酸的反应等。
(三)教室小结引导学生回顾本节课所学内容,总结铁及其化合物的性质、用途和转化干系。
同时,强调实验安全和环保认识,培养学生的科学素养。
(四)作业安置安置相关习题,让学生进一步稳固本节课所学知识。
同时,鼓励学生结合生活实际,思考铁及其化合物的应用前景,培养其科学探究能力和创新认识。
(五)课后延伸推荐学生阅读相关文献资料,了解铁及其化合物的最新钻研效果和应用前景,拓宽学生的知识面和视野。

生成铁离子和亚铁离子的所有方程生成铁离子和亚铁离子的所有方程铁离子(Fe3+)和亚铁离子(Fe2+)是常见的金属离子,它们在化学反应中起着重要的作用。
下面将介绍生成铁离子和亚铁离子的几种常见方程。
1. 铁的氧化反应:铁可以与氧气反应生成铁(III)氧化物(Fe2O3),同时生成铁离子。
4Fe + 3O2 → 2Fe2O32. 铁的酸性溶液中的氧化反应:铁可以与酸性溶液中的氧气反应生成铁(III)离子。
4Fe2+ + O2 + 4H+ → 4Fe3+ + 2H2O3. 铁的还原反应:铁(III)离子可以被还原为亚铁离子。
Fe3+ + e- → Fe2+4. 铁的酸性溶液中的还原反应:铁(III)离子可以被酸性溶液中的亚铁离子还原。
Fe3+ + e- + 3H+ → Fe2+ + H2O5. 铁的氯化反应:铁可以与氯气反应生成铁(III)氯化物(FeCl3),同时生成铁离子。
2Fe + 3Cl2 → 2FeCl36. 铁的硫酸反应:铁可以与硫酸反应生成铁(II)硫酸盐(FeSO4),同时生成亚铁离子。
Fe + H2SO4 → FeSO4 + H27. 铁的硫酸反应(氧化性条件):铁(II)离子可以被硫酸氧化为铁(III)离子。
2Fe2+ + H2SO4 + H2O2 → 2Fe3+ + SO4^2- + 2H2O8. 铁的硫酸反应(还原性条件):铁(III)离子可以被硫酸还原为铁(II)离子。
Fe3+ + H2SO4 + H2O2 → Fe2+ + SO4^2- + 2H2O9. 铁的硝酸反应:铁可以与硝酸反应生成铁(III)硝酸盐(Fe(NO3)3),同时生成铁离子。
2Fe + 6HNO3 → 2Fe(NO3)3 + 3H2O + NO10. 铁的氢氧化物反应:铁可以与氢氧化钠反应生成亚铁氢氧化物(Fe(OH)2),同时生成亚铁离子。
Fe + 2NaOH + H2O → Fe(OH)2 + 2Na+ + H2以上是生成铁离子和亚铁离子的几种常见方程。
第三章第一节铁及其化合物第3课时铁盐和亚铁盐教案教学目标宏观辨识与微观探析:掌握铁盐和亚铁盐化学性质,了解铁离子和亚铁离子的常用检验方法。
变化观念与平衡思想:运用氧化还原反应理论分析铁、亚铁离子与铁离子相互转化。
证据推理与模型认知:能依据实验证据推出合理的结论,构建“铁三角”转化关系模型,运用模型解释化学问题。
科学探究与创新意识:设计铁离子和亚铁离子相互转化探究实验方案,与学生合作完成实验探究,培养初步的科学探究能力。
科学态度与社会责任:结合应用实例,将铁盐和亚铁盐的性质的知识运用于解决生产、生活中简单的化学问题,强化性质决定用途的观念。
教学重难点重点:铁盐与亚铁盐的转化、Fe3+的检验。
难点:Fe、Fe2+、 Fe3+“铁三角”转化关系模型的建构。
教学过程【魔术设疑】课前选择一张干净的滤纸,剪一个“铁”字。
老师首先将“铁”字放入盛有少量近为无色(约带浅绿色,因浓度稀,颜色不明显)溶液(氯化铁和KSCN的混合溶液)的烧杯中,然后再放入另一杯盛有无色溶液(H2O2溶液)的烧杯中。
放入第一杯液体中,“铁”字依然是白色的,放入第二杯液体中,“铁”变成红色了。
魔术很精彩,魔术后面的真相更精彩,同学们想揭开这魔术后面的真相吗?【过渡】下面我们开始探秘,一起揭开真相。
【讲述】在同学们面前的桌子上帮大家准备了氯化铁,硫酸铁,氯化亚铁,硫酸亚铁,请大家观察颜色。
【学生】氯化铁(FeCl3)、硫酸铁(Fe2(SO4)3)-------棕黄色氯化亚铁(FeCl2)、硫酸亚铁(FeSO4)--------浅绿色【分小组实验】实验3-2:在两支试管中分别加入少量的FeCl3溶液和FeCl2溶液,各滴入几滴KSCN溶液。
【学生活动】仔细观察上面的教师演示实验,复述一下教师的实验操作以及你所观察到的实验现象,并得出结论。
【应用】可利用此KSCN(硫氰化钾)来确定Fe3+的存在和鉴别Fe3+、 Fe2+。
【板书】1.Fe3+的检验【设问】同学们现在能不能揭开魔术真相的奥秘呢?【学生揭秘】白色“铁”字变为红色的“铁”字,是三价铁遇见SCN-显红色。
铁三角的转化方程式嘿,朋友,今天咱们来唠唠铁三角的转化方程式,那可就像一场奇妙的魔法变身秀呢!首先是铁到亚铁离子的转化,就像铁这个硬汉突然变得柔情似水了。
方程式是:Fe + 2H⁺ = Fe²⁺+ H₂↑,你看,铁就像一个勇敢的战士冲进了氢离子的大军里,然后被氢离子扒掉了一些“铠甲”,变成了亚铁离子,还释放出了像调皮小泡泡一样的氢气。
接着亚铁离子变成铁,这就像是亚铁离子这个离家出走的孩子又回来了。
Fe²⁺ + Zn = Fe + Zn²⁺,亚铁离子拉着锌这个热情的小伙伴,结果锌把自己的电子分给了亚铁离子,亚铁离子就又变回铁这个硬邦邦的家伙了,而锌就像个慷慨的大侠,牺牲自己成全别人。
再说说铁到铁离子的转化,那可不得了。
2Fe + 3Cl₂ = 2FeCl₃,铁就像闯进了氯气这个超级魔法阵里,被氯气这个大魔法师一通折腾,直接从铁变成了铁离子,就像从一个小土丘一下子变成了高山,铁离子可比亚铁离子更“威风”了。
然后铁离子变成亚铁离子,Fe³⁺ + Fe = 3Fe²⁺,这就像是铁离子这个严厉的大哥遇到了铁这个小弟,大哥心一软,把自己的一些能量分给了小弟,然后自己从三价变成了二价,铁离子就像个老大哥突然变得和蔼可亲了。
还有亚铁离子到铁离子的转化,2Fe²⁺+ Cl₂ = 2Fe³⁺+ 2Cl⁻,亚铁离子在氯气这个捣蛋鬼的影响下,一下子就从低调的亚铁离子变成了高调的铁离子,就像一个小喽啰突然穿上了将军的铠甲,变得趾高气昂。
铁离子变成铁呢,2Fe³⁺+ 3Zn = 2Fe + 3Zn²⁺,铁离子就像个贪婪的财主,想从锌这里得到电子,结果锌太实在了,直接把铁离子又变回了铁,这就像财主被平民给扳回了原形。
亚铁离子和铁离子在氢氧化亚铁和氢氧化铁之间的转化也很有趣。
Fe²⁺+ 2OH⁻ = Fe(OH)₂↓,亚铁离子和氢氧根离子一见面,就像两个磁铁一样紧紧抱在一起,变成了白色的氢氧化亚铁,不过这氢氧化亚铁就像个害羞的小姑娘,很容易就被氧化变成红褐色的氢氧化铁,4Fe(OH)₂+ O₂+2H₂O = 4Fe(OH)₃,就像小姑娘被风吹了一下,脸就变红了。
铁离子与亚铁离子转化
实验演示
操作方法
在试管里注入少量氯化铁溶液,滴入几滴稀盐酸,加入少量铁屑,轻轻振荡片刻,再滴入几滴硫氢化钾溶液,观察现象。
实验现象
棕黄色的氯化铁加入铁屑后振荡,溶液颜色变为浅绿色,滴入硫氰化钾溶液后溶液颜色变浅。
实验结论
氯化铁与铁发生氧化还原反应,反应方程式为:
2FeCl3+Fe=3FeCl2 ,溶液呈浅绿色,遇硫氰化钾反应不显红色。
实验考点
1、亚铁离子的还原性;
2、亚铁离子的检验方法。
经典考题
1、下列试剂不能使Fe2+转变为Fe3+的是()
①Cl2 ②N aOH溶液③KMnO4溶液④HNO3溶液⑤H3PO4溶液⑥Na2S溶液
A、①②③
B、①③④
C、④⑤⑥
D、②⑤⑥
试题难度:易
2、下列反应没有发生Fe2+ Fe3+变化的是()
A、把铁屑投入带有黄色的粗盐酸中
B、过量的铁屑与稀硝酸反应
C、向三氯化铁溶液中投入铜片
D、过量的稀硝酸与铁屑反应
试题难度:中
3、往浅绿色的Fe(NO3)2溶液中,加入足量稀盐酸,溶液的颜色变化应该是()
A、浅绿色变浅
B、浅绿色变深
C、没有改变
D、变为黄色试题难度:中
1 答案:D
2 答案:D
解析:A中有黄色的粗盐酸中含有铁离子,被铁还原成亚铁离子;B中铁被氧化成+3价,又与过量铁作用还原成亚铁离子。
以上两项都有+3价铁转化成+2的过程。
3 答案:D
解析:硝酸根离子在酸性条件氧化亚铁离子为铁离子。
科学世界
铁是人体必需的元素,下面介绍一些补铁药物:
富马酸亚铁
【别名】富马铁,富血铁
【作用】铁是形成血红蛋白必需的物质,体内缺铁会发生缺铁性贫血。
缺铁的原因主要是大量出血或长期吸收不良。
治疗既要求补铁,同时也要消除病因。
本品含铁量较高。
体内
吸收好。
【适应症】适用于各种缺铁性贫血。
如胃酸缺少性贫血、孕期贫血、月经过多贫血、婴儿营养不良贫血及大量出血性贫血等。
【剂量与用法】口服:成人每次0.2~0.4克,每日3次。
小儿1岁以内每次35毫克;1~5岁每次70毫克;6~12岁每次140毫克,每日3次。
饭后服用。
【不良反应】本品对胃肠道有一定刺激,可引起恶心、呕吐或便秘等。
【注意事项】
1. 对铁过敏者禁用;
2. 溃疡病、溃疡性结肠炎患者慎用;
3. 服本品时忌与茶、抗酸剂碳酸氢钠、四环素等同服,以免妨碍吸收。
葡萄糖酸亚铁
【作用】本品对胃肠的刺激作用小,起作用快,铁的利用率高。
【适应症】适用于缺铁性贫血疾病的补铁。
【剂量与用法】口服:成人每次0.4~0.6克,小儿0.1克,每日3次,2~3周为一疗程。
【不良反应】
偶有胃肠道刺激症状,如腹部不适、腹泻、便秘或呕吐等,
饭后服用可减轻。
【注意事项】
1. 对铁剂过敏者禁用;
2. 服用本品时忌饮茶及食用含鞣酸的食品;
3. 消化道溃疡病人慎用;
4. 服铁剂后大便呈黑色,不需处理。
硫酸亚铁
【别名】硫酸低铁
【作用】缺铁性贫血患者补充铁。
【适应症】参见“富马酸亚铁”。
【剂量与用法】口服:成人每次0.3克,每日3次;小儿每次0.05~0.1克,每日3次。
饭后服用。
【不良反应】常见恶心、呕吐、腹痛、腹泻、便秘等。
【注意事项】1. 重症贫血患者在血红蛋白恢复正常后仍要继续服药3~6个月;
2. 消化道疾病、铁过敏者、严重肝肾功能损害者禁用。