硒的分子结构 (2)
- 格式:doc
- 大小:25.50 KB
- 文档页数:4

硒分子结构
硒是一种非金属元素,化学符号为Se,原子序数为34。
它与氧、硫、碲和聚碳硅烷等元素有密切关系。
硒具有许多重要的应用,例如在电子工业、光电子学、制药工业和化工工业等领域中都有广泛的应用。
硒的分子结构是由Se原子通过共价键结合而成的。
硒原子的电子排布为1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p4,即其价层上有6个电子,可以形成6个共价键。
硒分子的形状为八面体,硒原子中心与八个相邻硒原子通过共价键相连,形成一个八面体结构。
硒分子的化学性质与其分子结构密切相关,硒分子具有很强的还原性和氧化性,可以被氧化剂氧化为硒酸或硒酸盐,也可以还原为硒化物或元素硒。
硒分子的电子能带结构具有半导体特性,具有电子传导性和正孔传导性。
硒的半导体性质使其在光电子学和电子器件制造中有广泛应用。
总之,硒分子结构的研究对于深入了解硒的物理、化学和应用方面具有重要意义,也为其广泛的工业应用提供了有力的理论基础。
- 1 -。


有机硒化合物有机硒化合物是一类含有碳硒键的有机化合物,它们的分子结构中包含着一个或多个硒原子。
有机硒化合物具有许多生物活性、药理活性和化学活性,因此被广泛应用于医药、农业、化学工业等领域。
本文将从有机硒化合物的基本概念、分类、性质、应用等方面进行介绍。
一、基本概念有机硒化合物是由碳(C)、氢(H)和硒(Se)构成的化合物,它们的分子中存在碳硒键(C-Se)和碳-氢键(C-H)。
根据硒原子在分子中的数目,有机硒化合物可以分为单硒化合物、双硒化合物和多硒化合物。
有机硒化合物的命名方法与有机硫、有机氮化合物类似,通常根据它们的分子结构和化学性质进行组合。
例如,丙酮硒(2-丙酮酸)、亚乙硒定(N-苯基甲酰亚胺硒)、硒替米松(selenomethy-prednisolone)等。
二、分类根据硒原子的个数和成键方式,有机硒化合物可分为以下几类:(一)单硒化合物:由一个硒原子和一个或多个碳原子组成,由于硒电子云的共价作用,单硒化合物中硒原子的价态常常是-II,+2等。
常见的有机单硒化合物有:硒甲烷(CH3SeH)、硒丙烷(C3H6Se)、硒苯(C6H5SeH)等。
(二)双硒化合物:由两个硒原子和一个或多个碳原子组成,其中硒原子之间成键的电子对可以是共价键、离子键或者配位键。
常见的有机多硒化合物有:硒代硫酸酯(RSeSx)类化合物、硒桥酰胺((RCONHSe)n)等。
三、性质有机硒化合物与有机硫化合物、有机氮化合物是具有很大区别的化合物,其物理性质和化学性质也因分子结构、官能团的差异而对应地表现出来。
下面主要从熔点、溶解度、酸碱性、氧化还原性等四个方面进行介绍:(一)熔点有机硒化合物的熔点一般介于无机物和有机硫化合物之间。
与有机硫代苯和有机氮化合物相比,有机硒化合物的熔点更高,很容易形成结晶。
例如,硒丙烷的熔点为55℃,而硫丙烷的熔点仅为42℃。
(二)溶解度有机硒化合物的溶解度取决于它们的结构和分子量。
一般来说,随着分子量的增加,溶解度减小。

硒的形态分析方法概述及其在生物有效性研究中的应用摘要:硒的形态研究是了解环境中硒的毒性、生物可利用性、迁移和生物地球化学循环等方面的基础。
本文总结了环境样品中硒形态的研究方法,及其形态分析在生物有效性研究中的应用。
关键词:硒;形态分析;方法;生物有效性;应用1前言硒位于第六主族, 是一种准金属元素。
地壳中硒的丰度仅为0.05-0.09 µg/g, 但由于人为因素与自然因素的影响使硒在自然界中分布日益广泛, 一般大气、水、土壤中硒水平为µg/g-ng/g级。
一定条件下, 各种形态的硒类化合物可相互转化。
有报道以葡萄糖作为外加碳源, 研究天然水体中亚硒酸钠通过微生物反应转化为单质硒和挥发态硒(如二甲基硒、二甲基二硒) 的实验。
1957年,Schwar首先证明硒作为谷胱甘肽过氧化物酶的活性中心, 是人体必需的微量元素。
近年来, 适量的硒摄入水平与癌症、心血管病、糖尿病、白内障、老年痴呆症等各种疾病的密切相关性日益引起人们的重视。
我们在贫硒地区通过口服亚硒酸钠来治疗预防克山病、大骨节病。
硒作为多种重金属元素(如Cd、Hg等)的天然解毒剂、可拮抗环境中多种有害物质的毒性。
硒化合物的生理、生物活性,及其在环境中的迁移转化规律,同硒存在的化学形态及不同化学形态下硒的浓度水平直接相关。
硒分析方法在研究生命科学、环境科学、材料科学等领域均具重要意义。
1 环境中硒的存在形式硒存在形式的早期研究主要集中于矿床学、矿物学和环境地球化学。
朱建明等[1]于2003年对已发现的107种硒矿物进行了总结和归类,概述了表生环境中硒的存在形式。
环境中硒主要以无机和有机硒形式存在(表1)[2-4,5],不同硒形态间会因pH、Eh和生物作用(如甲基化)等因素的影响而发生转变,其中pH-Eh是主要的影响因素。
图1给出了常温常压下不同形态硒稳定存在的pH-Eh范围。
表一环境中主要的硒化合物[2,5]Table 1 The major selenium compounds in the environment硒化合物化学式存在条件无机硒硒化氢(-Ⅱa) H2Se b气体,不稳定,水中易分解成Se0硒氢化物(-Ⅱ) Se2-还原环境,金属硒化物,土壤中元素硒(0) Se0还原环境稳定存在,水中不溶解亚硒酸盐(Ⅳ) SeO32-弱氧化条件,易溶解,如土壤或大气颗粒偏亚硒酸盐(Ⅳ) HSeO32-酸性或中性条件,易还原,如土壤中二氧化硒(Ⅳ) SeO2化石燃料燃烧放出的气体,易溶于水硒酸盐(Ⅵ) SeO42-弱氧化条件,易还原,易为植物利用硒酸根(Ⅵ) SeO42-,HSeO4-一般土壤环境有机硒二甲基硒化物(DMSe) (CH3)2Se b土壤中微生物、细菌形成的挥发组分二甲基二硒化物(DMDSe) (CH3)2Se2b植物形成的挥发组分二甲基硒砜(CH3)2SeO2b DMSe的前期还原挥发产物,由代谢形成三甲基硒(CH3)3Se+动物代谢产物,以尿形式排放注:a表示无机硒化合物中硒的价态;b表示该硒化合物具有挥发性。

第一章《原子结构与性质》测试题一、单选题(共15题)1.下列微粒半径大小比较正确的是A.Na+<Mg2+<Al3+<O2-B.S2->Cl->Na+>Al3+C.Na<Mg<Al<Si D.Cs<Rb<K<Na2.工业上将氯气通入石灰乳中制备漂白粉:2Cl2+2Ca(OH)2=2H2O+CaCl2+Ca(ClO)2。
下列说法错误的是A.Cl2分子的结构式:Cl—ClB.H2O的比例模型:C.中子数为19的钙原子:39CaD.Ca(ClO)2溶液显碱性的原因:ClO-+H2O HClO+OH-3.下列离子半径的大小顺序正确的是①Na+:1s22s22p6①X2-:1s22s22p63s23p6①Y2-:1s22s22p6①Z-:1s22s22p63s23p6 A.①>①>①>①B.①>①>①>①C.①>①>①>①D.①>①>①>①4.下列各组元素性质的叙述中,正确的是A.第一电离能:C<N<O<FB.电负性:C<N<O<FC.最高正化合价:C<N<O<FD.原子半径:O>F>Na>Mg5.如图为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素原子的核电荷数为X元素的2倍。
下列说法正确的是A.X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次增大B.Y、Z、W元素的最高价氧化物的水化物的酸性依次减弱C.简单离子半径:Z<WT X具有氧化性和还原性D.根据元素周期律,可以推测T元素的单质具有半导体特性,236.原子序数依次增大的X、Y、Z、W、Q五种短周期主族元素中,X元素原子的最外层有三个未成对电子,且第一电离能比Y大,Z元素的简单离子半径在同周期中最小,Y、W位于同一主族。
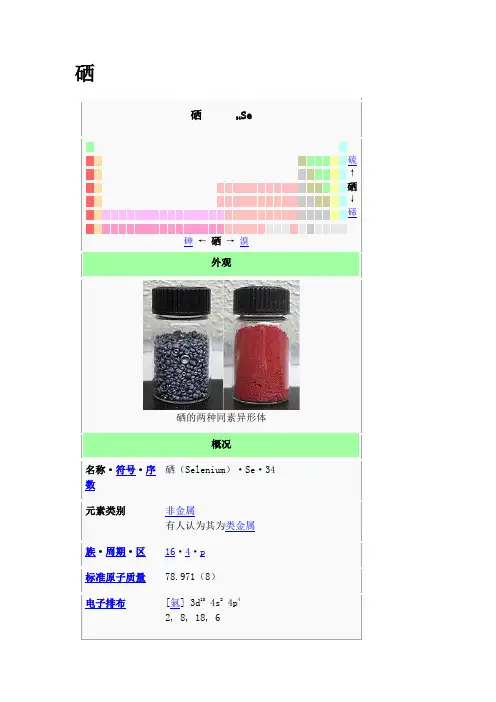
硒硒 34Se硫 ↑ 硒 ↓ 碲 砷 ← 硒 → 溴外观硒的两种同素异形体概况名称²符号²序数 硒(Selenium )²Se²34 元素类别非金属有人认为其为类金属族²周期²区 16²4²p 标准原子质量 78.971(8) 电子排布[氩] 3d 10 4s 2 4p 4 2, 8, 18, 6硒是一种化学元素,它的化学符号是Se,它的原子序数是34,是一种非金属。
硒对生物同时具有必需性和毒性。
性质与硫及碲相似。
它在有光时,导电性能较黑暗时好,故用来做光电池。
目录∙ 1 历史∙ 2 对人体的影响o 2.1 含量与分布o 2.2 食物来源o 2.3 建议量o 2.4 对硒的特殊需求者o 2.5 吸收o 2.6 运输o 2.7 代谢o 2.8 生化功能o 2.9 硒蛋白生合成分子机制o 2.10 缺乏与毒性▪ 2.10.1 缺乏综合症▪ 2.10.2 毒性o 2.11 与其他营养素的关系∙ 3 有机硒化学o 3.1 硒醇o 3.2 硒醚∙ 4 参考历史硒之英文全名为Selenium,取自希腊文Σελήνη(月亮女神塞勒涅的名字),为月亮之意。
因为它是一种固体非金属,故此用石字部首,并赋予西字音译。
灰黑色的硒粉对人体的影响硒是人体必需的微量矿物质营养素[1],多以氧化态(Se(Ⅱ)、Se(Ⅳ)、和Se(Ⅵ)存在,化学性质与硫相似,许多含硫氨基酸,如甲硫胺酸(Met)、半胱氨酸(Cys)、胱氨酸也可用硒取代硫。
硒在动物组织中最常以甲硒胺酸(selenomethionine,简称SeMet)和硒半胱氨酸(selenocysteine,简称SeCys)的形态存在,其中甲硒胺酸无法由人体合成,仅能由植物合成后经摄食再经消化代谢而获得,故食材动植物来源组成将决定硒在饮食中的形式,此外,人体中甲硒胺酸可以取代甲硫胺酸;但硒半胱胺酸不能取代半胱胺酸。

扬州中学高三化学月考试题2024.01试卷满分:100分考试时间:75分钟可能用到相对原子质量:H1O16C12N14Co59一、单项选择题:共13题,每题3分,共39分。
每题只有一个选项最符合题意。
1.材料是高新科技发展的物质基础,下列材料主要成分属于合金的是A.高性能铜箔B.半导体氮化镓C.快中子反应堆钠钾导热剂D.聚氨酯树脂2.某医用胶水的结构如图,下列说法正确的是A.第一电离能:N>C>OB.分子中含π键数目为4C.合成单体中1-丁醇为非极性分子D.元素电负性:N>H>C3.化学家舍勒将软锰矿(主要成分是MnO2)与浓盐酸作为原料制氯气。
兴趣小组利用下列装置进行如下实验,能达到预期目的的是A.制取氯气B.净化氯气C.收集氯气D.制备漂白液4.下列说法正确的是A.键角:Cl2O>OF2B.酸性:CH3COOH>CH2FCOOHC.分子的极性:O2>O3D.基态原子未成对电子数:Mn>Cr阅读以下资料回答5~7题:周期表中ⅥA族元素及其化合物应用广泛。
O3具有杀菌、消毒、漂白等作用;H2S是一种易燃的有毒气体(燃烧热为562.2kJ/mol),常用于沉淀重金属离子;氯化亚砜(SOCl2)是重要的有机试剂;硒(34Se)和碲(52Te)的单质及其化合物在电子、冶金、材料等领域有广阔的发展前景,Se是人体不可或缺的微量元素,工业上通过电解强碱性Na2TeO3溶液制备Te。
5.下列说法不正确的是A.16O、17O、18O互为同位素B.H3O+和SOCl2的的中心原子杂化轨道类型均为sp3C.H2O2为极性分子D.CaO2中阴阳离子数目比为2:16.下列方程式书写正确的是A.SOCl2遇水强烈水解:SOCl2+H2O=2H++SO32-+2Cl-B.H2S与硫酸铜溶液反应:Cu2++H2S=CuS↓+2H+C.H2S的燃烧:H2S(g)+2O2(g)=SO3(g)+H2O(l)△H=-562.2kJ/molD.工业制Te阴极反应:TeO32-+6H++4e-=Te+3H2O7.下列物质的性质与用途具有对应关系的是A.浓硫酸有强氧化性,可用于实验室制乙烯B.FeS2难溶于水,可用于工业制二氧化硫C.二氧化硫有漂白性,可用于去除织物的石蕊污迹D.Na2S2O3有还原性,可用于消除纺织品漂白后的残留氯8.一种合金M催化BH3NH3水解释氢的反应机理如图所示。

气态二氧化硒结构式气态二氧化硒是一种具有特殊结构的化合物,其结构式为SeO2。
在这个结构式中,Se代表硒原子,O代表氧原子。
气态二氧化硒的结构由硒原子和氧原子通过共价键连接而成。
硒原子的原子核包含34个质子和一定数量的中子,电子排布为2, 8, 18, 6。
氧原子的原子核包含8个质子和一定数量的中子,电子排布为2, 6。
在气态二氧化硒中,硒原子与两个氧原子通过共价键相连。
硒原子与每个氧原子共享两对电子,形成硒与氧之间的双键。
这两个双键使得气态二氧化硒的结构呈现出V字形,硒原子位于V字的顶点,两个氧原子位于V字的两个顶点。
硒原子周围的电子云呈线性排列,氧原子周围的电子云呈角度排列。
气态二氧化硒的结构使得它具有一些特殊的性质。
首先,由于硒和氧之间的双键存在,气态二氧化硒具有较高的极性。
这使得它在溶解性和化学反应性上与其他非极性分子有所不同。
其次,气态二氧化硒的结构中含有共价键和非键电子对,这些电子对使得气态二氧化硒具有一定的立体构型,从而影响了其物理和化学性质。
气态二氧化硒在室温下为无色气体,具有刺激性气味。
它是一种强氧化剂,能与许多物质发生剧烈反应。
在空气中,气态二氧化硒能与氧气反应生成硒酸。
此外,它还能与许多有机化合物发生反应,产生一些有机硒化合物。
气态二氧化硒在工业上具有广泛的应用。
它可以用作杀虫剂、杀菌剂和消毒剂,因为它对许多昆虫和微生物有毒。
此外,气态二氧化硒还用于制备硒酸、硒化物和其他硒化合物。
它还可用于光学玻璃的生产、化学分析和有机合成等领域。
气态二氧化硒的结构式为SeO2,它由硒原子和氧原子通过共价键连接而成。
其特殊的结构赋予了气态二氧化硒一些独特的性质和广泛的应用。
通过对气态二氧化硒结构的研究,我们可以更好地理解和利用它的性质。

分子构成的固态非金属单质
一些分子构成的固态非金属单质包括:
1. 碳:固态的纯碳存在于多种形态,如金刚石和石墨。
金刚石是由碳
原子通过共价键连接而成的非金属物质,具有非常高的硬度和热稳定性。
石墨则是由碳原子通过共面的层状结构连接而成,具有良好的导
电性和润滑性。
2. 硫:硫是固态的非金属单质,通常呈现出黄色的结晶态。
硫的分子
式为S8,也就是八个硫原子形成一个环状结构。
这种结构使硫具有较
低的熔点和沸点,并且在常温下呈现出脆性。
3. 硒:硒是一种固体非金属单质,呈现出银灰色的晶体。
硒的分子式
为Se8,也是八个硒原子形成一个环状结构。
硒具有较低的熔点和沸点,且在光照下呈现出磷光性质。
4. 氢氟化硼:氢氟化硼是由氢、硼和氟三种元素构成的固态非金属化
合物。
它的化学式为HF·BF3,是一种半离子化合物。
氢氟化硼通常是白色结晶的固体,具有较高的熔点和沸点。
5. 氯氟甲烷:氯氟甲烷是由碳、氢、氯和氟四种元素构成的固态非金
属化合物。
它的化学式为CHClF2。
氯氟甲烷通常是无色结晶的固体,
具有较低的熔点和沸点,用作溶剂和制冷剂。
这只是一些固态非金属分子构成的例子,还有其他很多的分子构成的
固态非金属单质存在。

【中文名称】硒
【英文名称】selenium
【结构或分子式】
Se
【相对分子量或原子量】78.96
【密度】4.81(六方),4.26~4.28(无定形)
【熔点(℃)】217(无定形)
【沸点(℃)】685(无定形)
【毒性LD50(mg/kg)】
大鼠静脉注射6
【性状】
红色或灰色粉末。
【溶解情况】
溶于二硫化碳、苯、喹啉等中。
【用途】
是一种半导体材料和光导材料。
用于镇流器(今多被硅、锗代替)、照相曝光剂、冶金添加剂,石油产品异构化中作催化剂以及塑料、油漆、搪瓷、玻璃中的颜料。
【制备或来源】
硒是一种稀散元素。
电解精铜时硒即沉淀如泥状,可以分出。
【其他】
原子序数34,原子量78.96,主要化合价+2、-2、+4、+6。
有六种同素异形体。

北京市东城区2023届一模考试化学试题学校:___________姓名:___________班级:___________考号:___________一、单选题1.生活中的一些现象常常涉及化学知识。
下列分析中不正确...的是A.咀嚼米饭时,越嚼越甜,因为淀粉水解生成了麦芽糖B.向食盐浓溶液中加入鸡蛋清溶液,有白色沉淀析出,因为食盐能使蛋白质变性C.铁锅用水清洗后,出现铁锈,因为潮湿环境中铁锅会发生电化学腐蚀D.打开汽水瓶盖,有大量气泡冒出,因为减小压强后二氧化碳的溶解度减小2.硒代半胱氨酸(含C、H、N、O、34Se5种元素)是一种氨基酸,其分子空间结构如图,下列说法不正确...的是A.Se位于元素周期表中第四周期VIA族B.图中最大的球代表SeC.硒代半胱氨酸分子中含一个手性碳原子D.硒代半胱氨酸难溶于水,易溶于苯3.下列实验中,所选装置(可添加试剂,可重复使用)不合理...的是A.盛放NaOH溶液,选用③B.用NH4Cl和Ca(OH)2固体制备氨,选用②C.配制100mL1.00mol•L-1NaCl溶液,选用⑤D.用大理石和盐酸制取CO2并比较碳酸和苯酚的酸性强弱,选用①④4.下列指定微粒或化学键的个数比为1:2的是A.126C原子中的质子和中子B.Na2O2固体中的阴离子和阳离子C.SiO2晶体中的硅原子和共价键D.FeCl2溶液中的Fe2+和Cl—5.解释下列事实的方程式不正确...的是A.将二氧化硫通入硝酸钡溶液中,产生白色沉淀:SO2+Ba2++H2O=BaSO3↓+2H+ B.将碳酸氢钠溶液与氯化钙溶液混合,产生白色沉淀:2HCO3 +Ca2+=CaCO3↓+H2O+CO2↑C.将氯化铜溶液加热,溶液由蓝色变为绿色:[Cu(H2O)4]2+(aq)+4Cl—(aq)[CuCl4]2—(aq)+4H2O(l)△H>0D.用氢氧化钠溶液吸收氯气:Cl2+2OH—=Cl—+ClO—+H2O6.关于下列4种物质的说法正确的是A.①的晶体为共价晶体B.①与②完全反应时,转移2mol电子C.室温时,②在水中的溶解度小于其在乙醇中的溶解度D.③和④体积不同的主要原因是分子数不同7.3-O-咖啡酰奎尼酸是金银花抗菌、抗病毒的有效成分之一,其分子结构如图。
硒和硒化锂体积全文共四篇示例,供读者参考第一篇示例:硒和硒化锂是两种常见的物质,它们在不同的领域有着重要的应用价值。
本文将分别介绍硒和硒化锂的性质及其在不同领域的应用,同时还会探讨硒和硒化锂的体积特性。
首先我们来介绍一下硒。
硒是一种化学元素,符号为Se,原子序数为34,属于IVB族。
硒是一种非金属元素,其性质比较特殊。
硒在自然界中主要以硒化物的形式存在,比如硒化铜、硒化锌等。
硒具有很好的导电性和光电性能,因此在太阳能电池、半导体器件等领域有着广泛的应用。
在太阳能电池领域,硒被广泛应用于薄膜太阳能电池的制造中。
硒的导电性能和光电性能使得硒薄膜太阳能电池的效率非常高,同时硒薄膜还具有较好的稳定性和耐候性,能够长时间稳定工作。
硒还可以用于制造光敏电阻、光敏二极管等光电器件,为光电子技术的发展做出了重要贡献。
接下来我们来介绍一下硒化锂。
硒化锂是一种具有一定硒化率的化合物,其化学式为Li₂Se。
硒化锂主要用于锂电池等领域。
锂电池是一种充电式电池,具有高能量密度、轻便、长寿命等优点,被广泛应用于移动通讯设备、电动汽车等领域。
硒化锂在锂电池中被用作正极材料。
由于硒化锂具有高的离子导电性和电子导电性,能够有效地储存和释放锂离子,因此可以显著提高锂电池的电池性能和循环寿命。
硒化锂还具有较高的比能量和比功率,可以使锂电池在同等体积下具有更高的能量密度和功率密度,从而提高电池的使用效率。
硒和硒化锂作为两种重要的物质,在不同领域都有着重要的应用价值。
尽管它们在性质和用途上有所不同,但它们都具有体积特性,这也是它们在应用中需要考虑的一个重要因素。
硒的晶体结构为六方晶系,晶体呈现出六方柱状结构,硒的晶胞体积比较大,因此硒在应用中通常以微粉、薄膜等形式存在。
硒的体积较大,在一定空间内,硒的质量较轻,因此硒在一些轻量化的领域有着广泛的应用,比如太阳能电池、半导体器件等领域。
硒化锂的晶体结构为立方晶系,硒化锂的晶胞结构比较紧密,因此硒化锂的密度较大,体积相对较小。
硒硒是一种化学元素,化学符号是Se,在化学元素周期表中位于第四周期VI A族,是一种非金属。
可以用作光敏材料、电解锰行业催化剂、动物体必需的营养元素和植物有益的营养元素等。
硒在自然界的存在方式分为两种:无机硒和有机硒。
无机硒一般指亚硒酸钠和硒酸钠,从金属矿藏的副产品中获得。
后者是硒通过生物转化与氨基酸结合而成,一般以硒蛋氨酸的形式存在。
一、历史发展发现人永斯·雅各布·贝采利乌斯(Jöns Jakob Berzelius),并把它命名为Selene,希腊语,月亮的意思。
发现过程:1817年,瑞典的贝采利乌斯从硫酸厂的铅室底部的红色粉状物物质中制得硒。
他还发现到硒的同素异形体。
他还原硒的氧化物,得到橙色无定形硒;缓慢冷却熔融的硒,得到灰色晶体硒;在空气中让硒化物自然分解,得到黑色晶体硒。
硒又分为很多种,硒化卡拉胶和酵母硒是最常见的,常常用于肿瘤癌症克山病大骨节病、心血管病、糖尿病、肝病、前列腺病、心脏病、癌症等40多种疾病。
广泛运用于癌症、手术、放化疗等。
硒分为无机硒和有机硒,将无机硒转化为有机硒的载体最常见的是:海藻和酵母,即常说的硒化卡拉胶和硒酵母。
这两种生产工艺已经非常成熟,生产成本也很低,医院里配一瓶硒酵母不到50元,还能进医保。
中国科学技术大学硒与人体健康重点实验室尹雪斌团队运用生物营养强化和纳米技术,定量改良土壤中的有机硒含量,通过植物自身光合作用,自然转化生成富含天然有机硒的高硒玉米。
人体吸收利用率更是高达99%以上,天然,安全,真正达到“药补不如食补”的理念。
并且得到安徽省政府,江苏省政府,甘肃省政府,黑龙江省政府等的大力扶持。
有机硒的科技水平主要看人体的吸收利用率,从这点上看:中国自主研发的硒比国外的硒更适合人体吸收。
二、硒产业1、趋势硒是稀散非金属之一,粗硒是铜冶炼过程中的副产品,硒产量增长一直较为缓慢,年供应量有限。
而硒的用途非常广泛,可应用于冶金、玻璃、陶瓷、电子、太阳能、饲料等众多领域,且随着世界经济的发展和新的应用领域的出现,硒的下游需求不断增长,在一定程度上导致硒的价格不断上涨。
二硫化硒原理
二硫化硒(Se2)是一种无机化合物,由硒原子和硫原子组成。
它的结构类似于二氧化硫(SO2),但是硒原子取代了氧原子。
二硫化硒的原理涉及其化学结构和性质。
以下是二硫化硒的一些原理:
1. 分子结构:二硫化硒分子中,硒原子和硫原子通过共价键连接在一起,形成一个直角三角形(倒L形)分子结构。
硒原
子与硫原子之间的键长较长,硒原子周围有两对孤对电子。
2. 化学性质:二硫化硒是一种不稳定的化合物,在常温下会逐渐分解。
它是一种酸性物质,在水中能够形成硒酸(H2SeO4)或亚硒酸(H2SeO3)。
3. 光电特性:二硫化硒是一种光敏材料,可用于制造光敏电阻和光敏电容。
当二硫化硒受到光照时,硒原子周围的孤对电子会被激发,导致电阻或电容的电性质发生改变。
4. 电化学性质:二硫化硒在电解液中可以形成硒酸根离子(SeO4^2-),具有一定的电化学活性。
这使得二硫化硒可用
于电化学电池或电化学传感器。
总而言之,二硫化硒的原理涉及其化学结构、性质以及光电和电化学特性。
这些特性使得二硫化硒在光电子学、电化学和材料科学等领域具有广泛的应用。
基态硒的价层电子排布式摘要:本文从结构上解释了基态硒的价层电子排布式。
首先,介绍了价层电子排布式的基本特征,并概述了如何使用化学原理和电子结构计算来确定基态硒的价层构型。
然后,结合实验结果,全面总结了基态硒的价层电子排布式。
最后,指出了基态硒的价层电子排布式在地球大气表层上的重要作用。
关键词:基态硒;价层电子排布式;学原理;子结构计算基态硒的价层电子排布式一、绪论在自然界中,硒(S)具有多种价态,包括-2、-1、0、+4、+5和+6,而它的基态价态是+6。
硒的形成和反应依赖于其价层电子排布式。
然而,这种价层电子排布式十分复杂,使得硒的行为在很大程度上不可预测。
本文从结构上解释了基态硒的价层电子排布式,以此为基础,总结出硒的基本行为特征,并分析它在地球大气表层上的重要作用。
二、价层电子排布式的基本特征价层电子排布,是指原子或分子层包含的电子数量和结构。
它的基本特征是由电子的阿基米德构型和费米子数决定的。
电子的阿基米德构型,是指原子核周围电子的分布模式,以此来描述原子的能量结构。
费米子模式,是指电子在原子外层的排布,它可以通过共价键形成分子结构。
基态硒的价层电子排布式,属于典型的僵化构型,由六个费米子形成六面体结构,其中四个费米子为正费米子,另外两个费米子为负费米子。
六个费米子分布在原子能级层内,排列形成平面,构成原子的价层构型。
由于此种构型的安稳性较高,一般来说,基态硒会稳定地存在于六面体价层构型。
三、以化学原理和电子结构计算来确定基态硒的价层构型确定基态硒的价层构型,可以采用化学原理和电子结构计算的方法。
其中,化学原理,是指根据元素的相对原子质量、半电荷和原子半径等在原子外层安排电子的规律,通常称为费米子选择原理或阿基米德原理。
电子结构计算,是指根据分子的电子密度分布,用数值方程对原子内外的电子和核行为进行计算,以获得原子的电子层构型。
四、实验结果实验结果表明,基态硒有六个费米子,其中四个费米子是正费米子,另外两个费米子是负费米子。
基态硒原子的价电子排布式
硒是指化学元素硒,其原子结构中含有六个价电子,它们按照民族化学理论的
法则排布,形成4s2p4的排列方式。
每一层的电子数都是2,共有4个层次,首先
由最外层计算,最外层由4个价电子构成,所以排列为:4s^2。
接下来是第二层,由2个价电子构成,所以排列为:2p^4。
最后是内部电子:2s^2,可以得出硒原子的基态价电子排布式为4s^22p^42s^2。
基态价电子排布式的概念是非常重要的,它能够让我们有更好的了解材料的特性。
硒原子的基态价电子排布式不仅可以用于硒的识别,还可以用于研究原子的能量状态,以及原子的相互作用。
值得注意的是,硒原子的价电子排布式只是其中一种排布方式,它还可以有多种不同的状态,例如半价电子排布式。
此外,基态价电子排布式也可以用于描述不同元素及材料的性质或结构,因为
这可以帮助我们了解原子的电性和化学性质,从而为识别物质和有效的控制物质的结构提供较为精确的依据。
因此,基态价电子排布式已经成为化学研究的重要部分,广泛应用于电子工程、材料科学和超级电容器等领域中。
总而言之,硒原子的基态价电子排布式既是一种研究硒原子特性的重要手段,
也是其他原子和材料识别、研究及控制结构的重要依据。
了解和掌握硒原子的价电子排布式对于化学家及其他科学家有着重要的意义,对于研究新材料和分子结构至关重要。
Reaction mechanism and molecular basis for selenium/sulfur discrimination of selenocysteine lyase.硒/硫分离硒代半胱氨酸裂解酶的反应机理和分子基础。
该酶对l-硒代半胱氨酸表现出严格的底物特异性,对其同源的1-半胱氨酸没有活性。
在柔性环上的Cys-375将1-硒代半胱氨酸而非1-半胱氨酸引导至活性位点中的正确位置和方向以引发催化反应。
这些发现首次提供了理解如何将痕量含硒底物与生物系统中过量的含有同类硫的化合物区分开来的基础。
硒代半胱氨酸裂解酶(SCL)催化吡哆醛5'-磷酸依赖性从1-硒代半胱氨酸中去除硒以产生1-丙氨酸。
提出该酶用于从含有硒代半胱氨酸残基的降解硒蛋白中回收微量营养素硒作为必需成分。
该酶对l-硒代半胱氨酸表现出严格的底物特异性,对其同源的1-半胱氨酸没有活性。
然而,尚不清楚酶如何区分硒代半胱氨酸和半胱氨酸。
在这里,我们提出了大鼠硒代半胱氨酸裂解酶的机制研究。
野生型和C375A突变体SCL的ESI-MS分析显示催化反应通过在催化必需的Cys-375残基上形成酶结合的硒硫化物中间体而进行。
紫外- 可见光谱分析和与1-半胱氨酸复合的SCL的晶体结构证明该酶可逆地与1-半胱氨酸形成非生产性加合物。
在柔性环上的Cys-375将1-硒代半胱氨酸而非1-半胱氨酸引导至活性位点中的正确位置和方向以引发催化反应。
这些发现首次提供了理解如何将痕量含硒底物与生物系统中过量的含有同类硫的化合物区分开来的基础。
硒是哺乳动物正常功能所必需的微量元素(1)。
它的化学性质与硫相似,需要在生物学上区别于代谢过程中硫含量丰富。
在合成过程中含硒蛋白,硒被特异性地并入含硒系统酶,并最终进入uga密码子指示的新生多肽链(二)。
由seryltrnasec和selenide合成硒代半胱氨酸trnasec的具体过程包括协调的顺序反应。
硒磷酸合成酶(3,4),seryl-trna催化激酶(5)和硒代半胱氨酸合成酶(6,7)。
但是,硒特异性底物识别的机制在这些酶中仍然未知。
正常食品中最常见的硒源是蛋白质中的硒代半胱氨酸和硒代蛋氨酸(8)。
上一个研究表明,硒代蛋氨酸通过反式硒化途径转化为硒代半胱氨酸(9,10)。
特定硒代半胱氨酸裂合酶(SCL)5对硒代半胱氨酸的裂解是被认为是循环利用的关键代谢步骤硒代半胱氨酸,由含硒蛋白类。
SCL是一种催化5-磷酸吡哆醛(PLP)酶。
从L-硒代半胱氨酸中除去硒,得到L-丙氨酸。
在以前的研究中,我们确定并描述了SCL的特征。
以猪肝(11)和柠檬酸杆菌(12)为首例区别作用于含硒化合物而不是其同源硫类似物的酶。
cDNA克隆小鼠SCL(13)显示SCL属于V亚群。
折叠转氨酶I型(14)。
其中,总的来说哺乳动物SCL序列相似(30%)。
半胱氨酸脱硫酶(13)。
SCL和半胱氨酸脱硫酶催化相同类型的反应,即从硒代半胱氨酸或半胱氨酸中除去硒或硫,生成丙氨酸。
尽管细菌半胱氨酸脱硫酶对半胱氨酸和硒代半胱氨酸都有活性。
(15),SCL对硒代半胱氨酸有显著的特异性。
机械和晶体结构研究表明半胱氨酸脱硫酶的反应包括在活性部位形成以半胱氨酸过硫酸盐形式存在的磺胺硫。
酶(16-18)。
硫从过硫酸盐转移到它的伙伴蛋白的半胱氨酸残基,如iscu(19),thi(20)、Tusa(21)和Sufe(22、23)与直接蛋白质-蛋白质相互作用,从而确保过硫酸盐硫向最终目标分子(如铁硫簇、硫胺和硫化核苷,细胞内无活性硫非特异性扩散(24)。
尽管SCL在这个位置有一个保守的半胱氨酸残基。
对应于过硫酸盐形成的半胱氨酸残基半胱氨酸脱硫酶,其在催化作用中的作用酶尚未建立。
在这里,我们研究了大鼠SCL的机制。
现场指导野生型和C375A诱变和ESI-MS 研究SCL的突变表明,cys-375对细胞的活性至关重要。
SCL是半胱氨酸硒化物形成的部位。
以非生产性加合物形式与L-半胱氨酸络合的SCL的紫外可见光谱分析和晶体结构表明硒代半胱氨酸鉴别的结构基础和半胱氨酸。
紫外可见光谱分析表明Cys-375的损失导致了与硒代半胱氨酸形成非生产性加合物,表明Cys-375作为指导,引导底物以适当的方向进行催化反应。
结果大鼠SCL的纯化及性质研究为了获得从小鼠肝脏(13)克隆的SCL晶体不成功,我们构建了大鼠SCL的表达系统。
将重组SCL纯化至同质性。
稳态动力学分析显示L-硒代半胱氨酸为26 molmin1。
mg1和5.5毫米,分别(补充图S1)。
这种酶没有显示对L-半胱氨酸的可检测活性(在5-50 mm处检测)。
抑制研究表明,L-半胱氨酸具有竞争性。
酶抑制剂与Ki 9.6 mm (补充图S1)。
因此,SCL的基本性质与那些报告的酶来自猪(11)和老鼠(13)。
cys-375-scl 的作用具有一个保守的半胱氨酸残基,对应于半胱氨酸脱硫酶中形成过硫酸盐的半胱氨酸残基(补充图S2)(16,35)。
为了研究保存的半胱氨酸残基在SCL中的作用,我们制备了一种突变的SCL蛋白(C375A),其中cys-375在SCL中表达。
被丙氨酸残余物替代。
纯化的C375A 突变体对L-硒代半胱氨酸无活性,提示cys-375是一种类似于保守催化半胱氨酸残基半胱氨酸脱硫酶(35)。
ESI-MS法分析硒代苯磺酸盐中间体,进一步阐明CYS-375的催化作用,形成一种SCL 结合的硒代过硫酸盐中间产物经电喷雾质谱分析。
观察到的质量野生型(47273 da)和突变型(47243 da)SCL与计算的质量一致。
从氨基酸序列(分别为47261和47229 da)在ESI-MS 可接受误差范围内测量(0.1%)(图1、a和D)。
野生型SCL的孵化用L-硒代半胱氨酸导致一个新物种的形成质量为[m 80](图1c)。
相反,与L-半胱氨酸孵育没有形成这样的物种(图1b)。
数据表明[M 80]物种与硒结合。
SCL的形式。
用L-硒代半胱氨酸或L-半胱氨酸培养的C375A突变体没有产生[M 80]分子(图1,e和f),表明从L-硒代半胱氨酸中消除的硒以a 的形式与酶的cys-375结合。
半胱氨酸亚硒酸盐中间体(SCL-S-SE)。
紫外可见光谱分析SCL 显示吸收最大416纳米,这是内部特征plp酶的醛亚胺形式。
将SCL与L-硒代半胱氨酸一起孵育,可显著提高细胞的吸收率。
420纳米(图2a)。
相反,L-半胱氨酸添加到酶引起的吸收峰在416纳米,伴随着350纳米的增加(图2b)。
用D-半胱氨酸、D-硒代半胱氨酸或2-巯基乙醇孵育也会导致吸收峰从416纳米移动到416纳米。
以与在酶中观察到的相同方式达到330–340纳米。
用L-半胱氨酸孵育(数据未显示)。
这些结果表明L-半胱氨酸、D-半胱氨酸、D-硒代半胱氨酸和2-巯基乙醇可以进入酶的活性部位,影响吸收。
PLP部分的性质,即使它们不作为酶的底物。
有趣的是,c375a突变酶用L-硒代半胱氨酸或L-半胱氨酸培养也显示出一个峰值。
从416纳米移动到350纳米(图2,c和d)。
这些结果表明,cys-375对底物L-硒代半胱氨酸的正确捕获至关重要。
总体结构SCL的总体结构如图3a.多肽链折叠成二聚体形式每个亚单位由小的(从N端到LEU-30和从THR-306到C末端)和大的(从glu-31到glu-305)结构域。
小域具有一个/结构,由两股平行线组成-三股反平行薄板-薄板和六个螺旋(补充图S3b)。
大领域显示典型/结构其中七股平行股(s2–S8),除了S8,形成一个开口由六个螺旋围绕的核心扭曲的薄片溶剂侧和双螺旋蛋白质方面。
七层薄板构成了结合辅酶PLP的活性位点,具有PLP依赖性折叠Ⅰ型酶(14,36)。
这个分子有两个活性部位围绕分子2折叠轴形成空腔。
每个空腔都位于在一个亚单位的域界面和亚单位界面。
使用了Dali(37)程序检测具有三维结构最类似于无门的来自PLP依赖者之间的SCL蛋白质中折叠I型酶数据库。
最高的Z分数被计算为62.4对于人类SCL(尚未发布的结构,PDB)2hdy),49.5用于大肠杆菌ISCS(38),48.2用于嗜热菌MaritimaNifs样蛋白(39),40.6用于同囊孢子虫PCC 6803 SUF(40),38.9用于大肠杆菌CSDB(17,18),35.2用于同回声囊肿胱氨酸c-s裂合酶(41),荧光假单胞菌Kynureniase(42)为30.5。
结果表明,SCL的结构相当复杂。
与人的症状自评量表相似,与人的症状自评量表相似。
I组半胱氨酸脱硫酶(ISCS和NIFS样蛋白)比第二组半胱氨酸脱硫剂(SUF和CSDB)(35、43)(图3b)。
SCL将其整体结构从开放式改为由小域作为刚性的3.8°旋转形成的闭合形式。
半胱氨酸与活性部位缝隙结合形成的体辅因子半胱氨酸复合物(图3a)。
除了刚性体旋转的小区域,半胱氨酸结合诱导扩展叶的局部构象变化(小域残留物从SER-374到ILE-392)。
扩展的叶无门开放式SCL紊乱,无门开放式SCL。
位于电子密度图上。
相比之下,在配体封闭形式被有序地形成螺旋11(310螺旋)–环––螺旋12环结构,覆盖主动网站作为一个盖子。
与SCL相比,开闭构象半胱氨酸脱硫(17,18,38,39,44)中没有观察到配体结合的变化(参见开放-封闭构象“讨论”小细胞肺癌半胱氨酸复合物PLP的活性位点结构位于子单元接口和域接口处形成的活动站点包的底部(图4a)。
侧面链S-结合半胱氨酸的原子,而不是-氨基基团,与PLP的C4原子形成共价键。
这个结合半胱氨酸S原子的剩余电子密度它非常接近于plp的c4,因此s原子形成了一个共价键。
与C4结合(补充图S3c)。
当C4-N键在plp和lys-247之间被精炼成双键(schiff碱基),C4-N键偏离相应的电子密度与希夫碱在无栅形式。
C4-N和C4-S 被精炼成单键与电子密度匹配,距离为1.51和1.86_,分别。
C4原子周围的键角是106,111和112°,确认C4的四面体几何结构原子。
吸收光谱的峰移从416到因此,在SCL半胱氨酸复合晶体(补充图S3a)和溶液(图2)中观察到的350 nm是由于半胱氨酸-plp-lys247四面体加合物的形成(补充图S3d)。
中的更改)。
L-半胱氨酸结合后,小区域向活动部位和扩展叶(小域残基SER-374至ILE-392),未分类排列,显示其有序结构,将L-半胱氨酸封装在活性部位空腔(图3和4a)。
结合物的羧酸盐半胱氨酸与银胍基形成盐桥-402,通过氢键与SER-374(扩展瓣)和ASN-186。
原氨基结合半胱氨酸的一组,它应该形成一个分支。
在半胱氨酸脱硫酶(15,16)中,用PLP代替Lys-247的碱(外醛亚胺)是氢键结合在侧边的。