铬对玻璃的着色
- 格式:doc
- 大小:121.00 KB
- 文档页数:3

玻璃与搪瓷GLASS & ENAMEL1999年 第27卷 第3期 No.3 Vol.27 1999解决翠绿料玻璃异常着色的经验李峰 张梅梅摘要:介绍了铬着色生产翠绿料瓶罐玻璃出现异常着色时的解决方法,主要涉及硫碳着色导致的绿色夹带黄色和Cr3+被氧化为Cr6+导致的黄褐色。
关键词:玻璃瓶罐;翠绿料;异常着色中图分类号:TQ171.7 文献标识码:B 文章编号:1000-2871(1999)03-0044-03 Experience of Eliminating Colour Shading of Emerald Green GlassLI Feng ZHANG Mei-mei 采用铬着色法生产翠绿料玻璃,颜色通常易于控制。
由于玻璃着色是一个复杂的多种化学反应过程,着色离子存在高低价态之间的动态平衡关系,离开了一定的条件,铬着色也会出现异常。
本文对我厂两个异常着色的实例做介绍。
1 硫碳着色和铬着色造成的异常 我厂一座40m2蓄热式马蹄焰池炉生产农药瓶,玻璃颜色发生变化。
起初,绿色中夹杂淡黄色,随后黄色加重,产品形成绿中带棕黄色调,严重影响了外观质量。
经反复排查分析,认为棕黄色是由于硫碳着色产生的,去掉配方中重晶石后玻璃颜色恢复正常。
另一次发生在52m2马蹄焰池窑生产啤酒瓶时,用户反映颜色浅,当采取增大玻璃中铬离子含量措施时,玻璃颜色发生异常变化,出现了黄褐色并逐步加重,呈现出颜色灰暗现象。
经分析试验判定系Cr3+被强氧化剂硝酸钠氧化为Cr6+着色所致。
重新设计配方,去掉了硝酸钠后颜色恢复正常。
2 硫碳着色分析 我厂农药瓶生产的主要工艺条件(见表1)是稳定的。
检查工艺过程,原料、配方没有变化,玻璃全分析结果基本稳定(见表3),但是入炉外购玻璃变化大、杂质多,其中最突出的是煤块及煤渣杂质;有的玻璃被机油浸泡,机油在炉内被急剧加热,燃烧不充分产生积碳;窑炉后期运行,自然进风助燃空气相对不足,使火焰具有还原气氛。

玻璃的主要化学成分玻璃是人类使用的最古老的合成材料之一,那它有什么化学成分呢?以下是本人要与大家分享的:玻璃的主要化学成分,供大家参考!玻璃的主要化学成分一玻璃的主要化学成分是二氧化硅及氧化铝、氧化钙、氧化镁、氧化钠、氧化钾,其作用如下:1、二氧化硅为形成玻璃的主要组分,并使玻璃具有一系列优良性能,如透明度、机械强度、化学稳定性和热稳定性等。
缺点是其熔点高、熔液粘度大,造成熔化困难、热耗大,故生产玻璃时还需加入其他成分以改善这方面的状态。
2、玻璃原料中加入少量氧化铝,能够降低玻璃的析晶倾向,提高化学稳定性和机械强度,改善热稳定性,但当其含量过多时(Al2O3>5%),就会增高玻璃液的黏度,使熔化和澄清发生困难,反而增加析晶倾向,并易使玻璃原板上出现波筋等缺陷。
3、加入适量氧化钙,能降低玻璃液的高温黏度,促进玻璃液的熔化和澄清。
温度降低时,能增加玻璃液黏度,有利于提高引上速度。
缺点是含量增高时,会增加玻璃的析晶倾向,减少玻璃的热稳定性,提高退火温度。
4、氧化镁其作用与氧化钙类似,但没有氧化钙增加玻璃析晶倾向的缺点,因此可用适量氧化镁代替氧化钙。
但过量则会出现透辉石结晶,提高退火温度,降低玻璃对水的稳定性。
5、氧化钠、氧化钾为良好的助溶剂,降低玻璃液的年度,促进玻璃液的熔化和澄清,还能大大降低玻璃的析晶倾向,缺点则是会降低玻璃的化学稳定性和机械强度。
由于二氧化硅、氧化铝、氧化钙、氧化镁、氧化钠、氧化钾具有以上一些特点,故在中国玻璃工业中一般大致控制在下列含量范围:SiO2 70%~%,Al2O3 1%~2.5%,CaO 8%~10%,MgO 1.5%~4.5%,(Na2O+K2O)13%~15%。
此外,玻璃原料中常含有少量三氧化二铁、氧化铁、三氧化二铬等有害成分,其作用如下:a、三氧化二铁能使玻璃着色,降低玻璃的透明度、透紫外线性能、透热性和机械强度,造成熔化澄清困难,并给玻璃的熔制品带来不良影响。

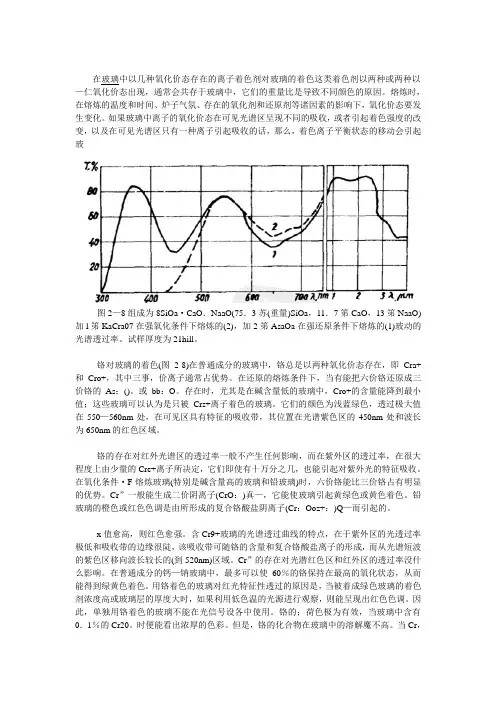
在玻璃中以几种氧化价态存在的离子着色剂对玻璃的着色这类着色剂以两种或两种以—仁氧化价态出现,通常会共存于玻璃中,它们的重量比是导致不同颜色的原因。
熔炼时,在熔炼的温度和时间、炉子气氛、存在的氧化剂和还原剂等诸因素的影响下,氧化价态要发生变化。
如果玻璃中离子的氧化价态在可见光谱区呈现不同的吸收,或者引起着色强度的改变,以及在可见光谱区只有一种离子引起吸收的话,那么,着色离子平衡状态的移动会引起玻图2—8组成为8SiOa·CaO.NaaO(75.3苏(重量)SiOa,11.7笫CaO,13笫NaaO)加l笫KaCra07在强氧化条件下熔炼的(2),加2笫AsaOa在强还原条件下熔炼的(1)玻动的光谱透过率。
试样厚度为21hill。
铬对玻璃的着色(图2-8)在普通成分的玻璃中,铬总是以两种氧化价态存在,即Cra+和Cro+,其中三事,价离子通常占优势。
在还原的熔炼条件下,当有能把六价铬还原成三价铬的As:()。
或bb:O。
存在时,尤其是在碱含量低的玻璃中,Cro+的含量能降到最小值;这些玻璃可以认为是只被Crs+离子着色的玻璃。
它们的颜色为浅蓝绿色,透过极大值在550—560nm处,在可见区具有特征的吸收带,其位置在光谱紫色区的450nm处和波长为650nm的红色区域。
铬的存在对红外光谱区的透过率一般不产生任何影响,而在紫外区的透过率,在很大程度上由少量的Cre+离子所决定,它们即使有十万分之几,也能引起对紫外光的特征吸收。
在氧化条件·F熔炼玻璃(特别是碱含量高的玻璃和铅玻璃)时,六价铬能比三价铬占有明显的优势。
Cr”一般能生成二价阴离子(CrO:)真—,它能使玻璃引起黄绿色或黄色着色。
铅玻璃的橙色或红色色调是由所形成的复合铬酸盐阴离子(Cr:Ooz+:)Q—而引起的。
x值愈高,则红色愈强。
含Cr9+玻璃的光谱透过曲线的特点,在于紫外区的光透过率极低和吸收带的边缘很陡,该吸收带可随铬的含量和复合铬酸盐离子的形成,而从光谱短波的紫色区移向波长较长的(到520nm)区域。

铬元素符号Cr,银白色金属,在元素周期表中属ⅥB族,铬的原子序数24,原子量51.996,体心立方晶体,常见化合价为+3、+6和+2。
1797年法国化学家沃克兰(L.N.Vauquelin)在西伯利亚红铅矿(铬铅矿)中发现一种新元素,次年用碳还原,得金属铬。
因为铬能够生成美丽多色的化合物,根据希腊字chroma(颜色)命名为chromium。
化学性质铬能慢慢地溶于稀盐酸、稀硫酸,而生成蓝色溶液。
与空气接触则很快变成绿色,是因为被空气中的氧气氧化成绿色的Cr2O3的缘故。
Cr + 2HCl= CrCl2 + H2↑4CrCl2 + 4HCl + O2= 4CrCl3+ 2H2O铬与浓硫酸反应,则生成二氧化硫和硫酸铬(Ⅲ)。
2Cr + 6H2SO4 =Cr2(SO4)3+ 3SO2↑ + 6H2O但铬不溶于浓硝酸,因为表面生成紧密的氧化物薄膜而呈钝态。
在高温下,铬能与卤素、硫、氮、碳等直接化合。
铬与稀硫酸反应。
Cr + H2SO4 = CrSO4 + H2↑物理性质铬是重要的合金元素。
铬以金属铬和铬铁形式加入钢与合金中。
银白色金属,质极硬,耐腐蚀。
密度7.20克/cm3。
可溶于强碱溶液。
铬具有很高的耐腐蚀性,在空气中,即便是在赤热的状态下,氧化也很慢。
不溶于水。
镀在金属上可起保护作用。
历史简介铬是由法国化学家Nicholas Louis Vauquelin在巴黎于1798年发现的。
他被一种鲜红色的矿石吸引住了,其是于1766年在西伯利亚的金矿开采的,而且曾被归类于西伯利亚红铅。
知道它是铬铅矿,是铬酸铅的一种形式。
Vauquelin分析了它并确认它是一种铅矿石。
之后他将其溶解进了酸中,沉淀出铅,过滤掉之后,他把注意力集中到了留下的液剂上,他成功的从中独立出了铬。
因着迷于它在溶液中能产生的颜色的范围,他把它命名为chromium (铬),基于希腊词语chroma(颜色)。
他之后发现翡翠的绿色也是因为铬。

着色玻璃2001年第1期中国玻璃善色玻璃玻璃着色剂的种类很多,太部分是过渡元素离子.许多着色剂产生与盐和溶液颜色相同的色彩,其它颜色可以通过胶体形成得到,其中有一,二种被视为克分子溶液.在所有场合,重要的是要了解玻璃的组成及诸如氧化还原状态等其它一些因素或其它着色剂对由一种着色剂产生的颜色会有多大的影响.氧化铁着色铁对玻璃的着色格外引入注目,一是其使用广泛,二是它为化学氧化还原现象及玻璃组成的影响提供了一个范例.氧化铁(FeO)和三氧化二铁(Fe~O3)各自通过位于被4,5或6个氧离子环绕的部位中的Fe和Fe”隔离离子进行着色的.Fe’会产生一个约为lOOOnm的固定吸收带,它不仅吸收红外线,而且吸收红色光和黄色光.含有呈亚铁态铁的玻璃具蓝色.可以说,这样的玻璃是一种”还原玻璃”,因为制诹这样的玻璃要使用一种象焦炭或有机物质这样的还原剂(电子给予体).F3’在约为38Ohm的渡带中吸收很少,从而导致产生一种淡黄色.在无特殊添加荆制备的玻璃中有’/一/,的铁呈亚铁态,由此产生淡绿色,根据原料的纯度,这种颜色会有深浅变化.我们的先辈,根据经验发现某些组分如山毛榉能大大缓解着色性.这是一种氧化锰载体,Mn(h通过下述氧化还原”反应将二价铁转变为三价铁: M++4Fe+甘Mn’+4F这种方向明显向右的平衡反应表明:M离子没有Fe”离子稳定,换言之,其电子亲和力更强.这种”化学脱色”技术在过去广为使用.有时在古老的窗户上可以看到谈紫色的窗玻璃,这是因在原始玻璃中使用锰, 随后玻璃长年累月地暴露在太阳的紫外辐射下(暴晒现象),Mn’氧化为Mn”态造成的.长期以来,使用氧化砷,氧化锑或氧化铈各自的”氧化还原偶”As”/AP,Sb”/Sb3或Ce”/Ce”进行化学脱色来制取”特白”的杯和瓶.在所有场合,出现的少量的铁几乎全部呈Fe”态,它可能使特厚玻璃产生一种黄色.为使之避免,少量加进两种经合适计量的着色剂氧化钴(蓝色)和氧化硒(玫红色)],从而在总体上形成一种互补色.这种颜色的补偿叫做”物理脱色”.变价离子着色还有其它一些离子着色剂,其化合价和吸收带髓玻璃的氧化还原状态变化.表1中, 用于着色和脱色的氧化还原偶以对氧化类电子亲和力的降序排列,换言之,按还原类电子稳定性的降序排列,或按氧化类电子稳定性的升序排列.氧化态§还原态(2550,370nm)黄色cr6§Cr3绿色中国玻璃2001年第1期(6.4,450am和5.9,950rma)(4,490nm)紫色MnMn淡黄色(0.04,430nm)(700,240rim)(紫外)Ce”Ce(紫外)(100.314rma)黄一粟色V”,r3绿色(3,780nm)蓝色Cu2§Cu无色无色As”As”无色无色Ssb”无色(1.3,380nm)黄色Fe”Fe蓝色(9.1,1050rim)无色Sn”Sn”无色括号内数据表示在吸收带最大值下(Bamford数据)由1%(重量)氧化物导致的lem厚玻璃的光密度和波长.光密度:一logl0(传递能量的分数).该谱系具有重要的实用结果6首先,它是脱色本身的基础:高偶的存在促进了低偶的氧化态.该原理同样适用于着色.例如,经验表明,加人微量的铬和MnO:较易从Mn”中获得一种紫色.同样,低偶的存在有助于高偶的还原态.例如,要获得cI’,就需使用氧化铁含量较低的原料.该谱系的第二个结果是,不能将由一种氧化类导致的颜色和一种由低序列的还原类导致的颜色混合.因此.不能期待用产生的蓝色来增强Cu产生的蓝色.不变价离子着色有两种大家熟悉的其作用与氧化状态无关的离子着色剂:钴和镍.在所有由简单离子在可见光谱中产生的吸收带中,co2产生的吸收带最为强烈(47.7,59Ohm).因此,通常用其来制造蓝玻.N在钠钙玻璃中产生的茶色同样较强(14.8,45Ohm).其特点是对碱离子的类型特别敏感.用钾代替钠,可转换为紫色,而用锂代替则产生黄色.这些颜色的变换与Ni离子的配位数变化有关:环绕有6个氧离子,K则环绕有4个氧离子.在co场合,要产生相同的配位数变化,需用无碱硼酸盐玻璃来代替钠钙玻璃,这时Cd的配位数将为6,颜色则呈玫红色.稀土金属着色至此为止,所有着色都产生自跃迁的金属离子.然而,同样还存在能对玻璃着色的稀土金属离子.钕(Nd”),镨(P一)和铒(E)分别产生蓝一紫色,绿色和玫红色.所有吸收带具有三个特征:窄带,很少受玻璃组成影响,强度较低(Nd导致的光密度仅为c0光密度的l/50).使用稀土金属作为着色剂的主要缺点是其吸收率低,成本高.化合物或离子配位化合物着色在窗玻璃,甚至在浇注玻璃,包装玻璃中,最古老的一种着色是琥珀色.无疑,在经过一段很长的时阃才明白琥珀色必须在硫和铁同时存在的情况下才能形成.因为这两种元素作为添加荆或杂质总是在玻璃中存在. 因此.只要简单地向玻璃混合料中引人任何还原剂(煤,金属,有机物质)就能获得这种颜色.一旦关联性建立,就可对硫化物(硫的还原形式)的主要作用作出评估.令人惊异的是实验表明,铁的活性类是Fe(在还原性玻璃中仅呈很小的浓度)而不是F.从而推出了一个由3个氧离子和1个s离子进行四面体配位的Fe”组成的生色团.颜色有可能产生于含有这两种离子的配位化合物,但同样有可能Fe的作用是氧化s2一和形成可能是生色团的”过硫化物”s2离子:2S2一+3Fe~oS2+3Fe在所有场台.琥珀色是由通过平衡反应2001年第1期中国玻璃41生成的化合物造成的概念与大家熟悉的其特征之一完全吻合:即:快速冷却(钢化)的琥珀色玻璃比相同的退火玻璃颜色要浅.因此可以认为,温度降低时,平衡右移,而这是在同样降低的速度下进行的.与缓慢冷却相比,快速冷却将平衡”冻结”在更靠左侧.在建筑平板玻璃和某些汽车玻璃中看到的茶色是添加硒获得的,其色彩同样取决于含铁量,与氧化还原状态也少有关系.因此可以认为茶色是用硒代替硫的相似琥珀色.但Schreiber提出,这种场合的生色团是一种聚硒化物Se.z一,是用Fe还原se产生的:2Fb+xSe苗Sex一+2Fx是聚硒化物链中的原子数.此外,还存在另一种”硫一三价铁”相似琥珀色.这种琥珀色稍星桔黄色,是用钼代替铁获得的.鉴于其成本高昂,收益性也就不明显了.还有一些组合有两种不同阳离子的离子着色配位化合物.例如用铈和钛化合物可制取非常有效的抗紫外玻璃.但这种玻璃带有轻微的黄色.用铁和钛可以获得与传统琥珀色相似的强烈着色.此外,还有产生青绿色的铈一铜配位化合物和产生粟色的铈一铅配位化台物.克分子和胶体溶液着色前面涉及的物理脱色中,提到用硒进行玫红着色.事实上,往低铁含量但非还原性的玻璃(特白玻璃的情况)中加人元素硒可在钠钙玻璃中获得一种玫红色.确切地讲玫红一桔黄色.这种颜色用于制杯业,以及用于制镜的浮法玻璃上.前面谈到了玫红色,淡紫色,紫红色,没有谈到红色和宝石红.所有可见光谱(红色端除外)中的吸收类型是由一种金属或一种半导体微粒子的胶态悬浮产生的.被吸收的能的极限值,亦即颜色,根据目前业已成熟的理论,取决于粒子的尺寸和传导率.幸好我们的祖先没有等待,他们首先发现了铜红(罗马彩绘玻璃时代).金红的发现则是更近的事了,它是1680年左右,两个炼金术士工作的成果.一个叫Cassius,他从氯化金和氯化锡中获得一种紫红色,提出将其混合在玻璃中.第二个叫KunckeI,他通过加人两种金属的化舍物获得了宝石红,同时又术得不加人还原物质保证锡以Sn:态存在.这两种红宝石玻璃的一个特性是在600~C左右时开始显色,也就是说,成形后在使用金的场合,还原和沉淀反应可写成下式:Au¨+Sn¨—fAu.)n+SIl4这样在不使用锔的情况下就能获得一种铜红,但有sn存在更为有益,因此通常都采用(其作用可通过下述事实表示:只要将浮法玻璃的锡面与铜盐甚至气态铜盐接触,就能看到宝石红显色).不过,对导致铜红的粒子是否是金属铜还不能确定,它可能是一种低氧化物cu扣.通过半导体(硒化镉)粒子的胶质沉淀可获得一种发亮的无色彩差异的红色.同祥,采用硫化镉会产生一种黄色.这两种颜色是借助于金属锌形成的.金属锌在这里起着保证硫或硒以s2一或Se一形式出现的还原剂,可以写为:nCd+nSe+nZn-*(CdSe)n+nZn在红宝石玻璃中,显色更为容易.看来,zl1”对离子s一和Sen的活性度同样起着缓冲作用c事实上,已经知道zn2对s’有亲合性,下述事实也揭示了这一点,即传统的琥珀色比古有百分之几ZnO的玻璃中的颜色要浅得多).黑色玻璃黑色玻璃是一种简单通过着色剂组合的不透明玻璃,其吸收带位于整个可见光谱范42中国玻璃2001年第1期围p壬例如使用铬—锰或钴—镍—铬系着色剂.同样可以制取完全不透明的Fe_.s”琥珀色玻璃.乳白色玻璃在某些杯,瓶甚至有时在平板玻璃中看到的乳色通常是氧化钙和氧化钠微晶体沉淀而成的.为使玻璃中引人大约5%的氟化物. 往钠钙玻璃混合料中加入萤石,一旦组成改变,在成形冷却过程中就会产生沉淀.过滤功能玻璃不改变玻璃的透射光谱只是为了获得同样具有功能目的的颜色,上面提到了在镜片中加入钕和在车灯中加入硫化辐(其防眩作用仍值得怀疑).通常,追求的是对紫外或近红外辐射进行或多或少的吸收.长期以来,镜片和包装玻璃业已开发出用不吸收可见光的ce4和Ce3来对紫外光线进行强劲的吸收现在问题是要将其用于汽车玻璃中,至少在专年I】上已经谈及.通常,一种可以采纳的广泛用作肪紫外保护工具的着色是由Fe—s琥珀生色团提供的着色.实际上只有Fe2才能吸收红外辐射,此类离子在lO00nm左右吸收非常有效.但超出红外,对可见光谱的吸收导致产生一种蓝色.问题的关键是要最大限度地吸收太阳辐射的能量并保证有”足够.的可见光透射.就建筑玻璃而言,建筑师可对这种自然光的级别进行选择.但对汽车玻璃则需要调整.在这两种场合,一旦玻璃的透明度得以确定. “选择性”则取决于Fe”/Fe”的比.就这一观点讲,向玻璃混合料中引入一种还原剂来提高该比,制取蓝色而不是绿色的玻璃是有益的.然而,不能使这种还原过度,其理由是:第一,超过约为0.5%的FeO/(Fe20,4- FeO)比,玻璃渡中存在的硫酸盐将还原为硫态,在玻璃中产生我们所看到的琥珀色;第二,硫酸盐的损耗减慢了氧化硅的溶解,并使传统浮法熔窑的熔化制度紊乱.在滤热功能方面,如在放映机里为保护膜片免受灯热的影响.使用磷酸盐玻璃来解决这个问题.实际上,这种环境的变换使吸收光谱向低频移动,遗憾的是这种方法不能搬迁到汽车和建筑玻璃上来.陈金生译自法国(j瘦璃)2000年第3期(上接34页)产,需要更换的调节闸板则可从容地换下,而不需要闸下安全闸板截断玻璃液.从而避免了严重影响浮法玻璃生产厂的产量而造成较大的经济损失.5.主要技术参数调节闸板的调节范围:以流槽底平面为设计基准,调节闸板可上调600ram,下调50mm.升降速度分为两档:快速:1.2mm/s,慢速0.6ram/s6.结束语本设备通过针对性的改进设计以后.取得了良好的使用效果.已成功用于洛阳一线和浙玻二线.。

2003年中国化工学会无机盐学术年会铬渣治理与综合利用粱爱琴,匡少平,白卵娟(青岛科技大学化学与分子工程学院。
山东青岛266042)摘要:介绍了铬渣的各种无害化处理方法。
即采用不同的还原方法使铬渣中的六价铬转变为无毒的三价铬,达到解毒目的。
在无害化处理的基础上,阐述了对铬渣进行综合利用的途径。
关键词:锫渣f戈害化f综合利用R含铬固体废渣是最危险的固体废弃物,它会对周围生态环境造成持续性的污染。
铬渣中的有害成分主要是可溶性铬酸钠、酸溶性铬酸钙等六价铬离子。
c一+的化台物具有很强的氧化性,对人体健康的危害极大:cr‘+对人体的消化道和皮肤具有刺激性,能引起接触性皮炎、皮肤溃疡,还可导致过敏、肺癌等疾病,Cr“作为潜在致癌物的斜率因子为42.Okg·d/mt【”。
铬化合物气溶胶能引起黏膜损坏,鼻中隔出血、腐烂以至鼻中隔穿孔和支气管炎、气喘等疾病。
长期接触铬化合物可引起慢性中毒,因此铬渣是一种烈性毒物。
cr”对人体的最小中毒董为1lOpg/m’,我国规定居住区大气中cr”最大溶许浓度为0.0015mg/mⅡ”。
铬渣是金属铬和铬盐生产过程中排放的废渣。
通常,每生产lt金属铬排放15t铬渣。
每生产1t铬盐可排放3~3.5t铬渣‘”。
一般铬渣的化学成分如表1、表2所示Ⅲ。
表1金属铬冶炼渣的主要化学成分目前,我国近百家铬渣排放单位已累计堆存铬渣300万t以上,其中,六价铬的含量(以cr:O,计质量份数)为2.37蝌“,即含六价铬1.62%。
任意排放、堆存铬渣,不但占用大量土地资源,丽且铬渣经雨水淋漓,含铬污水四处溢流、下渗,对土壤、地下水、河道造成污染。
铬渣对环境造成的危害已越来越引起人们的广泛注意,重视铬渣污染,开展其污染治理和综合利用就成为一项势在必行的任务。
1铬渣的无害化处理铬渣内含有的Cr”是强致癌物质,是造成环境污染的主要原因,因此,在铬渣中加入适量的还原剂,在一定条件下,六价铬被还原为三价铬(三价铬是人体和生物所必须的一种痕量金属元素),称为铬渣的无害化处理(5]。



稀土元素对玻璃的着色在用于玻璃着色的14种稀土元素中。
人们仅使用了三种,即铈、镨和钕。
限制使用的有铒、钬和钐。
在可见与非可见区具有窄带吸收的光镨,是含钕和镨玻璃的典型特性,这是任何其它着色离子都能做到的。
正如巳指出的那样,?窄带吸收是由于电子在离子内层轨道上跃迁所引起的,这些电子因为相邻离子和原子的作用而受到外层轨道的保护。
因此在该情况中基质玻璃成分对色度的影响很小。
虽然由于成分(主要是碱)的变化,而使吸收带的极大真出现较少的变化(加强或减弱),但实际上这并不影响着色过程。
上述情况的原因在于稳定的三价离子,因此,用稀土氧化物对玻璃着色的特点是具有良好的再现性,而且熔炼条件对着色没什么影响。
钕在可见光镨区对黄光具有特征吸收,即在光波长为590nm的区域出现了一条暗带(图2-3)。
在可见光镨的其它部分也有一系列的吸收带。
总的着色与照明情况有关,其色调为紫蓝色或红紫色。
钕的着色效能极低,因此为了得到弱粉色的色调,钕的用量不能低于3—4%。
图2—3组成为6Si02·CaO·NaaO(重量)SiO。
CaO,1396Na20)加入10氢氧化钕所熔炼玻璃的光谱透过串。
试样厚度为2mm。
谱可把玻璃着成浅绿色(图2-4)。
它在可见光谱区波长为430—490nm的区域内具有特征吸收带。
谱的化合物也具有较小的着色效能,因此,错的使用量要达到10%左右,而且,在该情况下所使用的着色剂原料中杂质(特别是钕)的影响是很明显的.由于成本高,着色效能低和颜色没什么独特之处,因而只是在特殊场合下才使用这些化学元素。
铬对玻璃的着色在普通成分的玻璃中,铬总是以两种氧化价态存在,即Cra+和Cro+,其中三事,价离子通常占优势。
在还原的熔炼条件下,当有能把六价铬还原成三价铬的As。
或bb:O。
存在时,尤其是在碱含量低的玻璃中,Cro+的含量能降到最小值;这些玻璃可以认为是只被Crs+离子着色的玻璃。
它们的颜色为浅蓝绿色,透过极大值在550—560nm处,在可见区具有特征的吸收带,其位置在光谱紫色区的450nm处和波长为650nm的红色区域。

精密退火炉和研磨加工设备,有一套物化性能测试装置。
这类玻璃除具有耐辐射性能外,其它性能指标与对应的无色光学玻璃完全相同。
这些参数是:①折射率Ne,②中部色散Np,—N。
⑧—批毛坯折射率的一致性,,④光学均匀性,⑤双折射,⑥衰减系数,⑦条纹度,⑧气泡度。
3.工厂自备或就近建有测定玻璃耐辐射性能的钴。
辐射源,或工业探伤用的x—射线装置,4,有完整的各种类型和牌号的无色光学玻璃配方。
这种配方在各个国家都有一定的保密性,因此,从文献中难于得到完整,系统的资料,5.有一套光学玻璃熔炼与退火的工艺曲线,6.有高纯度的玻璃原料。
在具备上述条件之后,即可着手制造耐辐射光学玻璃。
按照一般原则,当玻璃成分中有铈,锑和砷共存时,玻璃就要产生辐照着色现象。
因此,在制造这一类型的玻璃时,首先要从炉料配方中去掉澄清剂氧化砷和氧化锑。
根据对耐辐射性能的要求,添加0.25—1.5%的氧化铈。
必须指出,氧化铈的含量愈高,玻璃耐辐射的剂量也愈高。
然而,铈含量越高,玻璃的颜色必然要加深,光吸收率也将愈高,结果会导致玻璃的报废。
因此,在研制耐辐射光学玻璃的过程中,必须恰当地调整配方,既要使玻璃达到规定的耐辐射性能,又要把铈含量保持在最低限度。
这是研制耐辐射玻璃必须遵守的一般原则,按照这一原则,能够生产出7096以上牌号的耐辐光学玻璃。
据国外文献报导,在研制耐辐射玻璃的实践中,还发现了一项特殊的规律。
按照这一规律,当恰当地选抒铈与砷或铈与锑的重量比例时,即使两者共存,玻璃也不会产生辐照着色现象。
这是一项重要的发现,在耐辐射玻璃研究方面有着非常现实的意义,因为要想保证玻璃的良好澄清和充分均化,不添加氧化砷或氧化锑作为澄清剂是很难实现的。
这一发现还必须在实践中不断的加以证实。
实践证明,目前仅在重冕类型玻璃中铈与锑共存时才不产生辐照着色现象。
在工艺方面,耐辐射光学玻璃的生产流程与普通无色光学玻璃相同,所不同的是熔化温度要比普通光学玻璃高20℃左右,其目的在于保证无澄清剂的玻璃能够较好地澄清。
熔制玻璃时加入少量玻璃着色剂,可制得各种有色玻璃。
氧化铜(Ⅱ)或氧化铬(Ⅲ)产生绿色;氧化钴(Ⅱ)产生蓝色;二氧化锰产生紫色;二氧化锡或氟化钙产生乳白色;铀化合物产生黄绿荧光;胶态硒产生红玉色;胶态金产生红、红紫或蓝色;氧化亚铜产生红、绿或蓝色;亚铁化合物产生绿色,量多时为黑色;铁(Ⅲ)化合物产生黄色。
制玻璃时,由于原料中含有亚铁的杂质,常使玻璃带绿色,可加入少量二氧化锰或硒,使之变成无色玻璃。
玻璃的丝网印刷玻璃丝网印刷,就是利用丝网印版,使用玻璃釉料,在玻璃制品上进行装饰性印刷。
玻璃釉料也称玻璃油墨、玻璃印料,它是由着色料、连结料混合搅拌而成的糊状印料。
着色料由无机颜料、低熔点助熔剂(铅玻璃粉)组成;连结料在玻璃丝印行业中俗称为利板油。
印刷后的玻璃制品,要放火炉中,以520~600℃的温度进行烧制,印刷到玻璃表面上的釉料才能固结在玻璃上,形成绚丽多彩的装饰图案。
如果将丝印与其它加工方法并用的话,会得到更理想的效果。
例如利用抛光、雕刻、腐蚀等方法在印刷前或印刷后对玻璃表面进行加工处理,能够加倍地提高印刷效果。
1.玻璃制品蚀刻丝印长期以来,玻璃制品的蚀刻装饰,是在玻璃表层热涂蜡层及其它增固材料,作为抗蚀层,然后再在涂层上用针、小刀等刻出图案纹样,露出玻璃表面,然后在此部位上着氟氢酸进行腐蚀。
此工艺延续至今还有厂家应用,但其加工方法费时、费力、效率低下。
丝印蚀刻工艺,使玻璃制品的蚀刻装饰变得简便、省时、省力。
玻璃的蚀刻丝印,有热印及冷印两种方法。
热塑性蚀刻丝印,是将石蜡、沥青、硬脂酸等所配制的粘合剂,加入少量的抗蚀粉调制成抗蚀印料,通过热印丝网版,按设计图样,把印料刮印至玻璃表面,形成抗蚀膜的。
抗蚀膜上露出玻璃的部分,即是需要蚀刻的图案。
蚀刻采用氯氟酸进行,蚀刻后要用开水冲洗掉印在玻璃上的抗蚀层。
玻璃丝印蚀刻,也可以采用冷印方法进行。
抗蚀印料可使用特制的沥青漆加抗蚀粉,也可购买市售的抗依油墨。
印刷完成后,待抗蚀膜完全干燥,便可进行氢氟酸腐蚀了。
金属离子掺杂石英玻璃颜色石英玻璃是一种常见的无色透明物质,但通过掺杂一定比例的金属离子,可以使石英玻璃呈现出丰富多彩的颜色。
金属离子掺杂石英玻璃的颜色是由金属离子的种类和浓度决定的,下面我们将分别探讨几种常见的金属离子对石英玻璃颜色的影响。
1. 铁离子(Fe3+)铁离子是一种常见的金属离子,它在石英玻璃中的掺杂可以使其呈现出黄色或棕色。
这是因为铁离子吸收了蓝色和紫色光线,剩下的光线就呈现出黄色或棕色的颜色。
2. 铜离子(Cu+)铜离子的掺杂可以使石英玻璃呈现出蓝色或绿色。
铜离子吸收了红色和黄色光线,剩下的光线就呈现出蓝色或绿色的颜色。
3. 铬离子(Cr3+)铬离子的掺杂可以使石英玻璃呈现出红色。
铬离子吸收了绿色和蓝色光线,剩下的光线就呈现出红色的颜色。
4. 钴离子(Co2+)钴离子的掺杂可以使石英玻璃呈现出粉红色或紫色。
钴离子吸收了绿色和黄色光线,剩下的光线就呈现出粉红色或紫色的颜色。
5. 锰离子(Mn2+)锰离子的掺杂可以使石英玻璃呈现出粉红色或红色。
锰离子吸收了绿色和蓝色光线,剩下的光线就呈现出粉红色或红色的颜色。
除了以上几种金属离子外,还有其他金属离子的掺杂也可以使石英玻璃呈现出不同的颜色,如钛离子(Ti4+)可以使石英玻璃呈现出黄色或蓝色,镉离子(Cd2+)可以使石英玻璃呈现出黄色或橙色等。
金属离子掺杂石英玻璃的颜色不仅仅是单一金属离子的作用,还与其他因素,如离子浓度、掺杂方式等有关。
不同金属离子的浓度和掺杂方式会对石英玻璃的颜色产生不同的影响。
金属离子掺杂石英玻璃的颜色不仅仅具有装饰性质,还有一些实际应用。
例如,黄色的石英玻璃可以用于制作太阳镜,因为它可以减少太阳光的强度;红色的石英玻璃可以用于制作红外线滤光器,因为它可以吸收红外线;蓝色的石英玻璃可以用于制作紫外线滤光器,因为它可以吸收紫外线。
金属离子的掺杂可以使石英玻璃呈现出丰富多彩的颜色。
不同金属离子的掺杂会导致石英玻璃呈现出不同的颜色,这些颜色不仅仅具有装饰性质,还有一些实际应用。
镀铬玻璃压条改色方案
经典色彩方案:
1. 银色:使用铬玻璃压条镀铬后,保持原色不变,展现出经典的银色质感。
2. 金色:在银色的基础上,施加一层金色镀铬,使铬玻璃压条呈现出高贵典雅的金色光泽。
3. 红色:将铬玻璃压条镀上一层红色涂料,创造出热情奔放的红色效果,为整体空间增添活力和激情。
4. 蓝色:在铬玻璃压条上覆盖一层蓝色涂料,使其呈现出清新、宁静的蓝色光泽,营造出舒适宜人的空间氛围。
5. 绿色:使用绿色涂料对铬玻璃压条进行上色,营造出浓郁的自然氛围,为室内添加一抹清新的绿意。
6. 黑色:在铬玻璃压条上施加一层黑色镀铬,营造出神秘、高贵的黑色效果,增加整体空间的优雅和深邃感。
7. 褐色:将铬玻璃压条涂刷成褐色,创造出温馨、自然的效果,为室内增添一份质朴和温暖。
8. 玫瑰金色:在镀铬的基础上,加入一层玫瑰金色镀膜,给铬玻璃压条带来浪漫而奢华的光泽。
请注意:该改色方案仅供参考,实际效果可能会受到镀铬和上色技术、光线等因素的影响。
建议在选择改色方案时请咨询专业技术人员或进行实地测试,以确保满足您预期的效果。
试论铬渣污染的利用技术与治理问题试论铬渣污染的利用技术与治理问题【摘要】铬化工行业里的铬渣处理问题已经被世界公认为环境管理中的难点问题,国家对铬渣的治理非常关注和重视。
基于此本文主要对铬渣污染的利用技术与治理问题进行了探讨。
【关键词】铬渣污染;利用;治理铬渣污染的治理问题和如何能够综合利用问题是目前一项急需完成的任务,非常之艰巨。
铬渣中具体的有害成分主要包括酸溶性铬酸钙、可溶性铬酸钠等六价铬离子,这些物质加大了铬渣处理的难度,成为了化工行业最棘手的问题。
由于铬渣里有害成分非常多,大多具有强致癌性,如果运移不当,很可能会随着自然灾害如水土流失和自然现象的变化如地下水流动等原因运移到其他地方,会使污染范围不断扩大,导致严重的环境污染问题,对社会造成不可挽回的危害。
1回收铬渣替代其他成分生产钙镁磷肥由于铬渣和蛇纹石的成分有很大的相似之处,而蛇纹石是生产钙镁磷肥所要用到的主要溶剂,因此可以通过调整生产过程中的配料比例,将铬渣综合利用,代替蛇纹石来生产钙镁磷肥。
具体调配方法可以将硅石、白云石、磷矿石、焦炭和铬渣按一定的比例混合,先用高温熔融,进行水淬,然后将其干燥,粉碎后即可得到钙镁磷肥。
本法可以有效的转化大量铬渣,产品的含磷量低,导致成本过高,而且销量也有限。
2玻璃生产可将铬渣作为着色剂从而降低成本玻璃的生产也可以适当引用铬渣来作为生产原料。
由于玻璃是通过熔融冷却进行无规则的排列,最后形成的一种非晶态固体。
在玻璃的熔制过程中,需要加入一些含有铬离子的矿物质,从而形成含有铬离子的玻璃。
玻璃呈现绿色需要在高温熔制过程中将六价铬转化成三价铬。
玻璃生产中需要用到白云石和石灰石等原料,而铬渣中含有的氧化镁、氧化钙等可以代替这些高成本的原料,从而有利于玻璃生产过程中降低生产原材料的使用量和生产费用。
除此之外,用铬渣做玻璃着色剂还可以彻底的进行解毒,具有很强的稳定性,节约大量的能源。
但是,这种方法虽然大大提高了玻璃的生产效率,但是对铬渣的消耗量却不大。
在玻璃中以几种氧化价态存在的离子着色剂对玻璃的着色这类着色剂以两种或两种以—仁氧化价态出现,通常会共存于玻璃中,它们的重量比是导致不同颜色的原因。
熔炼时,在熔炼的温度和时间、炉子气氛、存在的氧化剂和还原剂等诸因素的影响下,氧化价态要发生变化。
如果玻璃中离子的氧化价态在可见光谱区呈现不同的吸收,或者引起着色强度的改变,以及在可见光谱区只有一种离子引起吸收的话,那么,着色离子平衡状态的移动会引起玻
图2—8组成为8SiOa·CaO.NaaO(75.3苏(重量)SiOa,11.7笫CaO,13笫NaaO)加l笫KaCra07在强氧化条件下熔炼的(2),加2笫AsaOa在强还原条件下熔炼的(1)玻动的光谱透过率。
试样厚度为21hill。
铬对玻璃的着色(图2-8)在普通成分的玻璃中,铬总是以两种氧化价态存在,即Cra+和Cro+,其中三事,价离子通常占优势。
在还原的熔炼条件下,当有能把六价铬还原成三价铬的As:()。
或bb:O。
存在时,尤其是在碱含量低的玻璃中,Cro+的含量能降到最小值;这些玻璃可以认为是只被Crs+离子着色的玻璃。
它们的颜色为浅蓝绿色,透过极大值在550—560nm处,在可见区具有特征的吸收带,其位置在光谱紫色区的450nm处和波长为650nm的红色区域。
铬的存在对红外光谱区的透过率一般不产生任何影响,而在紫外区的透过率,在很大程度上由少量的Cre+离子所决定,它们即使有十万分之几,也能引起对紫外光的特征吸收。
在氧化条件·F熔炼玻璃(特别是碱含量高的玻璃和铅玻璃)时,六价铬能比三价铬占有明显的优势。
Cr”一般能生成二价阴离子(CrO:)真—,它能使玻璃引起黄绿色或黄色着色。
铅玻璃的橙色或红色色调是由所形成的复合铬酸盐阴离子(Cr:Ooz+:)Q—而引起的。
x值愈高,则红色愈强。
含Cr9+玻璃的光谱透过曲线的特点,在于紫外区的光透过率极低和吸收带的边缘很陡,该吸收带可随铬的含量和复合铬酸盐离子的形成,而从光谱短波的紫色区移向波长较长的(到520nm)区域。
Cr”的存在对光潜红色区和红外区的透过率没什么影响。
在普通成分的钙—钠玻璃中,最多可以使60%的铬保持在最高的氧化状态,从而能得到绿黄色着色。
用铬着色的玻璃对红光特征性透过的原因是,当被着成绿色玻璃的着色剂浓度高或玻璃层的厚度大时,如果利用低色温的光源进行观察,则能呈现出红色色调。
因此,单独用铬着色的玻璃不能在光信号设各中使用。
铬的;荷色极为有效,当玻璃中含有0.1%的Cr20。
时便能看出浓厚的色彩。
但是,铬的化合物在玻璃中的溶解魔不高。
当Cr,
O。
的浓度大于1.5—2%和玻璃熔体冷却时,会析出碧绿、绿色的Cr。
O。
薄片,并形成铬金星玻璃。
铬的着色常常用来得到绿色,在严格遵守工艺规程的条件卜,可以获得良好的着色再现性。
在铬的化合物中最常用的是重铬酸钾,因为它有下列优点:稳定,用它可引入百分率相当高的铬,在玻璃中比铬的氧化物或水化物更容易溶解。
在很多玻璃厂还成功地使用了铬酸钡,有时与K。
Cr:O,结合起来使用。
市上的重铬酸钾中,K。
Cr。
O,的含量一般不超过98%,杂质当中往往有千分之几的硫酸钾,铁含量(1;·c:O。
)不超过0.02%,其它着色金属氧化物(CuO,NiO,CoO,Mn:O:)只有痕量。
生产绿色的瓶子时,用含铬的矿料进行着色很经济,因为其中铁(Fc。
O真)的高含量在该情况中并无妨碍。
含铬矿渣(生产铬铁台金的废料,其中约含有5.5%的Cr,O,和0.6%的Fe。
Oa),也是生产有色瓶子的廉价着色剂.(二)锰对玻璃的着色(图2—9)锰在玻璃中有二价离子和三价离子两种状态。
只含Mn”的玻璃液几乎是无色的,但由于这种玻璃在冷却时巳被氧化因而最终的着色为黄色或褐色,其吸收带在408—425nm的范围内。
Mne+的存在对紫外区和红外区的透过没有影响。
Mn”的着色强度不高。
当还原剂的剂量适当时,可熔炼出MnO 含量约20%的玻璃。
虽然成为褐色色调,但是该玻璃在可见光谱长波区的透过率可达到80%左右。
当还原剂量过剩时,会产生深褐色着色,但是,这种颜色不仅是由Mn”引起,同时也是因为硫化着色而产生的
图2—9组成为8sioa!CaO·NaaO(TS.3形(重量)Si02,11.7笫CaO、13笫NaaO)加2缔KMnO‘所熔炼的玻璃门)和加]0舞MnO在真中中熔炼帅钙—钓—砖酸挂玻璃‘2)的光谱透过率试样厚度为2mm。
Mn”司·把玻璃着成深紫色。
吸收光谱在波长490—500n出处呈现出强吸收极大值,而在670—710am处则有微弱的吸收峰。
由于Ma“的存在,会使玻璃在紫外区的透过率有一定程度的下降,然而Mn”对光谱红外区的透过率几乎没影响,只有在Mns+的浓度高时,在波长约为1gm的区域透过率开始有少许的下降。
在适度氧化条件下熔炼的玻璃,MhZ+和MⅡ‘+之间会达到平衡,但这种平衡在很大程度上要向Mn:+的方向移动。
在锰的总量中,约有0.1%以较高的氧化价态存在。
正是这一部分成了玻璃深紫色着色的原因。
熔炼时的氧化还原条件对着色有很大的影响。
在炉子气体的作用下,Mn“很容易被还原,因此,坩埚的上层为较浅的颜色。
吹制玻璃时,颜色有时也要发生变化,甚至在制品冷却时,由于氧化作用而使着色的减弱显著加剧。
除氧化还原条件外,基质玻璃的成分无疑地要影响色调,不过影响不大。
钾玻璃在光谱的红
色和紫色区具有很高的光透过率,而对绿光却有强烈的吸收:钠玻璃在光谱的红色和黄色区有很高的过率。
在难熔的硼硅酸盐玻璃和酸性玻璃中,很难获得紫色着色,因为熔炼的高温促使了由于高氧化价态的分解,而生成不着色的Mn”离子。
正如巳指出的,着色氧化物的引入量约为0.]%就要引起本身的着色。
为了得到强烈的着色,必须使用2—3%MnO:。
如果熔炼不是在良好的氧化气氛中进行,那么锰的着色能力就要降低,因此MnO。
的加入量必须提高到5—6%,甚至有时氧化锰的引入量达到20%才能获得强着色。
用锰着色的再现性是难于实现的,特别是在获得较弱的色调时,锰的含量往往不太高?但这会促使Mn2+的主成。
在玻璃工业中,至今仍用软锰矿给玻璃着色和脱色,但必须注意所用软锰矿的MnO。
、Fe。
O。
含量和粒度组成。
为了制取高质量的有色玻璃和用于脱色,软锰矿中MnO:的含最不得低于84%。
天然软锰矿中Fe:Os的含量波动在0.2—15%的范围内,用于脱色时不得超过0。
5%。
通常,优质软锰矿的Fe:O,含量都很低。
对含有极少数大于0.5mm颗粒的软锰矿进行细瞎,是一个重要的因素。
大的颗粒在玻璃液中不易溶解,而存在大于lmm的颗粒时,有生成黑点的危险,这种黑点将残留在玻璃中。
!?优质软锰矿约含有4%的SiO。
和2%的A1。
O。
作为其基本杂质,但是它们不影响着色。
除Fe,O。
之外,所含的其它着色氧化物在数量上是微不足道的。
使用合成的软锰矿也能得到良好的结果。
为了改善以锰着色的玻璃色调的再现性,高锰酸钾的使用巳得到了推广.褐色啤酒瓶的着色,可使用次等的软锰矿。
锰的化合物是比较弱的着色剂,这是因为玻璃中的锰只
宥一小部分处于着色的主价形式。
因此,同基质玻璃成分相比较,玻璃熔炼的氧化还原条件对着色强度具有相当大的影响.。