酶的国际系统分类法
- 格式:docx
- 大小:20.00 KB
- 文档页数:1





酶学研究简史:酶(enzyme)希腊语原意:in yeast,生物体内催化化学反应的物质,细胞中的球蛋白多数为酶。
1783年:Spallamzan发现鸟的胃液能消化肉。
1814年:Kirchhoff发现稀酸对淀粉的加水分解作用。
并发现麦芽抽提液加入淀粉后能生成麦芽糖,即麦芽抽提液中必定有能水解淀粉的水溶性物质→ferment (酵素)。
1830年:Kuhle开始使用Enzyme这一术语。
1833年:Payen & Persoz 从麦芽抽提液得到了ferment,称diastase,即现在的amylase。
1835年:Berzelius提出ferment起的是催化作用。
1857年:Pasteur认为发酵分几个阶段进行,每一步都有特定的酶参与,但酶只在活体细胞中才能起作用。
1894年:Bertrand发现了水解酶以外的酶。
1897年:Buchner兄弟以“没有酵母的酒精发酵”证明了酶可以离开细胞起作用。
1910年:Halden & Young 发现酶是蛋白质与耐热性低分子量化合物(cofactor)的复合物,提出蛋白质只是担体。
1913年:米氏方程建立。
1926年:Sumner得到了Urease的结晶,随后,Northrop结晶化了Pepsin,Trypsin等蛋白酶,结晶中测定不到cofactor。
1929年:Warburg发现呼吸链诸酶中的血红素。
1936年:维生素与辅酶关系的阐明。
1959年:Sutherland cAMP的发现→酶与激素的关系。
1970年:Restriction enzyme的发现→基因工程。
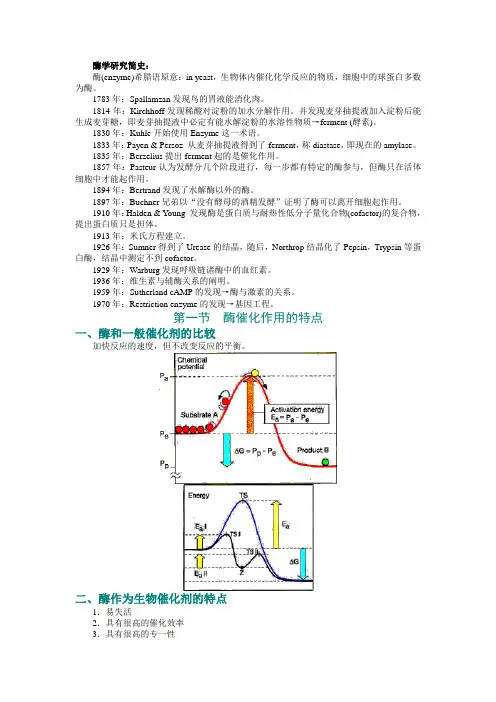
第一节酶催化作用的特点一、酶和一般催化剂的比较加快反应的速度,但不改变反应的平衡。
二、酶作为生物催化剂的特点1.易失活2.具有很高的催化效率3.具有很高的专一性4.酶的活性受到调节控制调节酶的浓度通过激素调节酶的活性反馈抑制调节酶的活性抑制剂和激活剂调节酶的活性其他调节方式如别构调节第三节酶的命名法一、习惯命名法二、国际系统命名法三、国际系统分类法及酶的编号每种酶的号由4个数字组成,中间用“.”隔开,分别代表大类.亚类.亚亚类.序号,如:EC1.2.3.2是黄嘌啉:氧化还原酶的编号。


第三章酶学I 主要内容一、酶的组成分类1.酶的化学本质是蛋白质,可以分为简单蛋白和结合蛋白。
2.简单蛋白质酶类:这些酶的活性仅仅由它们的蛋白质结构决定。
3.结合蛋白质酶类:这些酶的活性取决于酶蛋白和辅因子两部分。
辅因子主要包括无机离子和有机小分子两种物质,其中有机小分子又根据其与酶蛋白结合的紧密程度不同分为辅酶和辅基。
在结合蛋白质酶类分子中,酶促反应的专一性主要由酶蛋白质的结构决定,催化性质则主要由辅因子化学结构所决定。
二、酶的催化特性1.高效性:酶的催化效率非常高,酶促反应的速度与化学催化剂催化的反应速度高1010倍左右。
2.专一性:每一种酶只能作用于某一类或某一种物质。
根据专一性的程度可分为绝对、相对专一性和立体结构专一性三种类型。
3.温和性:酶一般是在体温、近中性的pH及有水的环境下进行,作用条件较为温和。
4.酶活性的可调节性:细胞内酶活性可以受底物浓度、产物浓度等许多因素的影响。
三、酶的命名和分类1.命名法:习惯命名法和系统命名法。
2.国际系统分类和编号:根据国际系统分类法的原则,所有的酶促反应按反应性质分为六大类,用1,2,3,4,5,6的编号来表示。
1-氧化还原酶类;2-转移酶类;3-水解酶类;4-裂合酶类;5-异构酶类;6-合成酶类。
如:Ecl.1.1.27 乳酸:NAD+氧化还原酶。
四、酶活力(或酶活性)、比活力表示法用反应初速度表示酶活力。
酶活力单位:U;酶的比活力:U/mg蛋白质五、酶促反应动力学1.底物浓度对酶促反应速度的影响。
米氏常数(Km):当酶反应速度达到最大反应速度一半时的底物浓度。
它是酶的特征性常数之一,只与酶的种类有关,而与底物浓度无关;米氏常数(Km)的测定主要采用双倒数作图法。
2.温度对酶反应速度的影响:最适温度:酶反应速度最大的环境温度,它是酶的条件性特征常数,只在一定情况下才有意义。
3.pH对酶促反应速度的影响:最适pH:酶反应速度最大的介质pH值。
4.酶浓度对酶反应速度的影响:当底物浓度远远大于酶浓度时,反应速度与酶浓度成正比。


酶化学1.全酶由酶蛋白和辅助因子组成,在催化反应时,二者所起的作用不同,其中酶蛋白决定酶的专一性和高效率,辅助因子起传递电子、原子或化学基团的作用2.辅助因子包括辅酶、辅基和金属离子等,其中辅基域酶蛋白紧密结合,需要用化学方法处理,辅酶与酶蛋白结合疏松,可用透析法除去3.酶是由活细胞产生的,具有催化能力的生物催化剂4.酶活力的调节包括酶量的调节和酶活性的调节5.T.R.Cech和S.Altman因各自发现了核酶而共同获得1989年的诺贝尔奖6.1986年,R.A.Lerner和P.G.Schultz等发现了具有催化活性的抗体,称为抗体酶7.根据国际系统分类法,所有的酶按所催化的化学反应的性质可分为六大类,即氧化还原酶类、转移酶类、水解酶类、裂合酶类、异构酶类和合成酶8.根据酶的专一性程度不同,酶的专一性可划分为绝对专一性、相对专一性和立体专一性9.关于酶作用专一性提出的假说有锁钥学说、酶与底物结合的三点附着学说和诱导契合假说等几种10.酶的活性中心包括结合部位和催化部位两个功能部位,其中结合部位直接与底物结合,决定酶的专一性,催化部位是发生化学变化的部位,决定催化反应的性质11.酶活力是指酶催化化学反应的能力,一般用一定条件下,酶催化某一化学反应的反应速度表示12.通常讨论酶促反应的反应速度时,指的是反应的初速度,即底物消耗量<5%时测得的反应速率13.常用的化学修饰剂DFP可以修饰Ser残基,TPCK常用于修饰酶胰凝乳蛋白酶活性中心的His残基,TLCK经常用于修饰酶胰蛋白酶活性中心的His残基,碘代乙酸修饰Cys14.酶反应的温度系数Q10一般为1-215.调节酶包括别构酶和共价调节酶等16.解释别构酶作用机制的假说有序变模型和齐变模型两种,其中齐变模型不能解释负协同效应17.固定化酶的优点包括稳定性好、可反复使用、易于与反应液分离18.固定化酶的理化性质会发生改变,如Km增大、Vmax减小等19.同工酶是指能催化同一种化学反应,但酶蛋白本身的分子结构、组成、理化性质等不同的一组酶,如乳酸脱氢酶同工酶20.pH影响酶活力的原因可能有以下几方面:①影响底物分子的解离状态②影响酶分子的解离状态③影响中间复合物的解离状态21.温度对酶活力影响有以下两方面:一方面温度升高,可使反应速度加快,另一方面温度太高,会使酶蛋白变性而失活22.脲酶只作用于尿素,而不作用于其他任何底物,因此它具有绝对专一性;甘油激酶可以催化甘油磷酸化,仅生成甘油-1-磷酸一种底物,因此它具有立体专一性23.酶促动力学的双倒数作图,得到的直线在横轴上的截距为-1/Km,纵轴上的截距为1/Vmax24.磺胺类药物可以抑制二氢叶酸合成酶,从而抑制细菌生长繁殖25.如果加入足够量的底物,即使有竞争性抑制剂存在,酶催化的最大反应速度V max是可以达到的(对)26.酶反应的专一性取决于其辅助因子的结构(错)27.酶影响它所催化反应的平衡(错)28.酶促反应的米氏常数与所催化反应的底物无关(错)29.同一种辅酶与酶蛋白之间可有共价和非共价两种不同类型的结合方式(错)30.在测定酶活力时,必须使酶的浓度大大地高于底物浓度(错)31.酶最适pH只取决于酶蛋白本身结构(错)32.某一酶反应的最适pH和最适温度都是恒定的,是酶的特征常数(错)33.酶促反应浓度与酶浓度成正比(对)34.大部分酶在生理pH时活性最高(对)35.同工酶是指能催化同一个反应,有相同控制特征的一组酶(错)36.某些酶的Km值可因某些结构上与底物相似的代谢物存在而改变(对)37.根据米氏方程,转换数Kcat值越大的酶反应速度越大(错)38.米氏常数Km值是一个与酶浓度无关的特征常数,但表观Km值受酶浓度的影响(错)39.对一个正协同别构酶而言,当增加正调节物浓度时,协同性增加(对)40.酶反应最适pH不仅取决于酶分子的解离情况,同时也取决于底物分子的解离情况(对)41.寡聚酶一般是指由多个相同亚基组成的酶分子(错)42.酶的Km值是酶的特征常数,不随测定的pH和温度而改变(错)43.米氏常数Km是与反应系统的酶浓度无关的一个常数(对)44.酶的最适pH与酶的等电点是两个不同的概念,但两者之间有相关性,两个数值通常比较接近或相同(错)45.国际酶学委员会规定,一个酶单位为1 min能催化1 μmol分子浓度的底物转变为产物的酶量(错)46.酶促反应的初速度与底物浓度无关(错)47.不是所有的蛋白质都是酶,但只有蛋白质才可以充当酶的作用(错)48.酶的Km值是指达到Vmax所需的底物浓度的一半(错)49.辅基是酶的组成部分,总是位于酶的活性部位(对)50.酶原激活是酶蛋白构象发生变化的结果(对)51.脂肪酸合成与脂肪酸分解都是由多酶体系催化完成的(对)52.正协同效应使酶促反应速度对底物浓度变化越来越敏感(对)53.在结构上与底物无关的各种代谢物有可能改变一些酶的Km值(对)54.非竞争性抑制作用可通过提高酶浓度的方式来解除抑制作用(错)55.当[S]≤[E]时酶促反应的速度与底物浓度无关(错)56.别构酶的动力学曲线为S形(错)57.如果加入足够的底物,即使存在非竞争抑制剂,酶催化反应也能达到正常的Vmax (错)58.同工酶是指功能和结构相同的一类酶(错)59.His残基常常参与构成酶的活性中心(对)60.酶的催化机制完全可以用酶与底物的“锁钥学说"阐明(错)61.Ribozyme(核酶)只能以RNA为底物进行催化反应(错)62.酶活力的降低一定是因为酶失活作用引起的(错)63.在酶的活性中心,只有带电荷的氨基酸残基直接参与酶的催化(错)64.同工酶各自对同一底物的米氏常数相同或相似(错)65.由于酶反应的速度较快,因而酶反应的温度系数高于一般化学反应的温度系数(错)66.抑制剂对酶的抑制作用是酶蛋白变性的结果(错)67.别构酶都是寡聚酶(错)68.在酶的催化反应中,His残基的咪唑基既可起酸催化作用,也可起碱催化作用(对)69.pH通过影响酶活性中心氨基酸的解离状态来影响酶的反应速度(对)70.米氏方程同样适合别构酶(错)71.在一定条件下,米氏常数可用来判断酶与底物的亲和力(对)72.Km值由酶和底物的相互关系决定(对)73.别构活化中酶的构象应从T-R平衡转向R态(对)74.酶反应的Vmax由底物浓度决定(错)75.酶的竞争性抑制剂不影响酶促反应的最大速度,但降低了米氏常数(错)76.对于酶的催化活性来说,酶蛋白的一级结构是必需的,而与酶蛋白的构象关系不大(错)77.酶的化学本质大部分是蛋白质(对)78.酶促反应的能量效应是降低反应的活化能(对)1.下列关于酶的说法不正确的是()A.酶在结合底物时表现很高专一性B.酶的催化活性可以改变C.酶能提高正向反应和逆向反应的速率D.酶结合底物的作用力一定是疏水作用答案:D2.酶催化反应需要()A.结合调节蛋白B.活性部位残基被共价修饰C.选择性结合具有高亲和性的反应过渡态D.底物具有高亲和性答案:C3.国际酶学委员会划分六大类酶的依据是(A)A.酶催化反应B.酶的结构C.酶的底物D.酶的性质4.酶-底物复合物是()A.酶催化过程中的短暂性结构B.经过相互诱导契合形成的结构C.一种可以被分离纯化的结构D.一种彼此紧密结合的结构答案:AC5.下列有关反应速率说法不正确的是(C)A.反应速率是反应趋向平衡的速率B.酶能加速反应C.反应速率对温度不敏感D.反应速率受反应物和产物之间的能障控制1.以下哪一点不是酶作为生物催化剂的特点:(A )A.分子小B.高效性C.可调节D.专一性2.根据2018年的最新分类方法,酶主要包括几大类?(C )A.7B.8C.6D.53.可逆抑制作用主要包括:()A.反竞争性抑制B.别构抑制C.非竞争性抑制D.竞争性抑制答案:ACD4.测定米氏常数,可以帮助我们:()A.判断反应级数B.区分同工酶C.寻找酶的天然底物D.判断代谢途径方向答案:ABCD5.酶的可逆抑制可以通过透析的方法解除。

西北大学生物化学试题2004-2005注意:请将答案写在答题纸上一、名词解释(每词2分,共20分)装增色效应蛋白质的变性与复性抗体酶结构域活性中心变旋现象DNA的融解温度别构效应比活力第二信使学说二、填空题(每空0.5分,共20分)1.根据国际系统分类法,所有的酶按所催化的化学反应的性质可分为六类氧化还原酶、转移酶、水解酶、裂合酶、异构酶和连接酶2.将分子量分别为a(90000)、b(45000)、c(110000)的三种蛋白质混合溶液进行凝胶过滤层析,它们被洗脱下来的先后顺序是___cab_______。
3.与酶催化的高效率有关的因素有底物与酶的邻近与定向效应、底物的契合与诱导形变、酸碱催化、共价催化、金属离子催化等。
4.维持蛋白质的一级结构的化学键有__肽键_____和____二硫键___;维持二级结构靠____氢__键;维持三级结构和四级结构靠____次级键_____键,其中包括___范德华力___、____疏水相互作用____、____离子键____和____氢键_____。
5.在20种氨基酸中,酸性氨基酸有____天冬氨酸_____和___谷氨酸_____2种,具有羟基的氨基酸是___丝氨酸_____和____苏氨酸_____,能形成二硫键的氨基酸是____半胱氨酸______。
6.DNA在水溶解中热变性之后,如果将溶液迅速冷却,则DNA保持__单链__状态;若使溶液缓慢冷却,则DNA重新形成_双链_。
7.胰凝乳蛋白酶的活性中心主要含有天冬氨酸、组氨酸、和丝氨酸基,三者构成一个氢键体系,使其中的上的组氨酸成为强烈的亲核基团,此系统称为催化三联体系统。
8.叶酸以其还原性产物起辅酶的作用,它有DHFA和订线THFA两种还原形式,后者的功能作为一碳单位载体。
9.给动物食用3H标记的___胸腺嘧啶____,可使DNA带有放射性,而RNA不带放射性。
10.肌红蛋白的含铁量为0.34%,其最小分子量是___1647066___;血红蛋白的含铁量也是0.34%,但每分子含有4个铁原子,血红蛋白的分子量是__658824___。
第四章酶酶是一类具有高效率、高度专一性、活性可调节的高分子生物催化剂。
1957巴斯德提出酒精发酵是酵母细胞活动的结果。
1 分子Glc→2分子乙醇+2分子CO2 从Glc开始,经过12种酶催化,12步反应,生成乙醇。
1897 Buchner兄弟证明发酵与细胞的活动无关,不含细胞的酵母汁也能进行乙醇发酵。
1913 Michaelis和Menten提出米氏学说—酶促动力学原理。
1926 Sumner首次从刀豆中提出脲酶结晶,并证明具有蛋白质性质。
1969 化学合成核糖核酸酶。
1967-1970 从E.coli中发现第I、第II类限制性核酸内切酶。
1986 Cech发现四膜虫细胞大核期间26S rRNA前体具有自我剪接功能。
ribozyme ,deoxyribozymeE.coRI5’——GAA TTC——3’3’——CTTAAG——5’限制作用修饰作用5’——GAATTC——3’5’——GAA TTC——3’3’——CTTAAG——5’ 3’——CTTAAG——5’第一节酶学概论一、酶的生物学意义大肠杆菌生命周期20分钟,生物体内化学反应变得容易和迅速进行的根本原因是体内普通存在生物催化剂—酶。
没有酶,生长、发育、运动等等生命活动就无法继续。
限制性核酸内切酶(限制-修饰)二、酶的概念及其作用特点1、酶是一种生物催化剂酶是一类具有高效率、高度专一性、活性可调节的高分子生物催化剂。
生物催化剂:酶(enzyme),核(糖)酶(ribozyme),脱氧核(糖)酶(deoxyribozyme)2、酶催化反应的特点(1)、催化效率高酶催化反应速度是相应的无催化反应的108-1020倍,并且至少高出非酶催化反应速度几个数量级。
(2)、专一性高酶对反应的底物和产物都有极高的专一性,几乎没有副反应发生。
(3)、反应条件温和温度低于100℃,正常大气压,中性pH环境。
(4)、活性可调节根据据生物体的需要,许多酶的活性可受多种调节机制的灵活调节,包括:别构调节、酶的共价修饰、酶的合成、活化与降解等。