2021届高考化学微专题训练(八) 化学平衡图像分析与绘制
- 格式:pdf
- 大小:25.17 MB
- 文档页数:13


微专题训练(八)A化学平衡图像分析与绘制1.(1)室温下,往恒容的反应器中加入固定物质的量的SO2和NO,通入O3充分混合。
反应相同时间后,各组分的物质的量随n(O3)∶n(NO)的变化如图W8-1。
图W8-1①n(NO2)随n(O3)∶n(NO)的变化先增加后减少,原因是。
②臭氧的量对反应SO2(g)+O3(g)SO3(g)+O2(g)的影响不大,试用过渡态理论解释可能原因:。
(2)尿素的制备:2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(g)ΔH<0。
一定条件下,往10 L恒容密闭容器中充入2 mol NH3和1 mol CO2。
①该反应10 min 后达到平衡,测得容器中气体密度为4.8 g·L-1,平衡常数K=。
②如图W8-2是该条件下,系统中尿素的物质的量随反应时间的变化趋势,当反应时间达到3 min 时,迅速将体系升温,请在图中画出3~10 min 内容器中尿素的物质的量的变化趋势曲线。
图W8-22.氢气因热值高、来源广、产物无污染,常被人们看作一种理想的“绿色能源”,氢气的制取是氢能源利用领域的研究热点。
(1)从可持续发展考虑,太阳能光解水制氢是获取H2的最好途径,但迄今仍然存在诸多问题,如光催化剂大多仅在紫外光区稳定有效,能够在可见光区使用的光催化剂不但催化活性低,而且几乎都存在光腐蚀现象,需使用牺牲剂进行抑制,能量转化效率低等,这些都阻碍了光解水的实际应用,需设计课题进一步研究解决。
下列设想符合研究方向的是。
A.将研究方向专注于紫外光区,无需考虑可见光区B.研究光腐蚀机理,寻找高稳定性、不产生光腐蚀的制氢材料C.研制具有特殊结构的新型光催化剂,开发低成本、高性能光催化材料D.研究新的光解水的催化机制,使利用红外光进行光解水制氢成为可能(2)利用废弃的H2S的热分解可生产H2:2H2S(g)2H2(g)+S2(g)。
现将0.30 mol H2S(g)通入到压强为p的恒压密闭容器中,在不同温度下测得H2S的平衡转化率如图W8-3所示:图W8-3①温度为T4℃时,初始体积为1 L,t min后,反应达到平衡,该温度下的平衡常数K=。
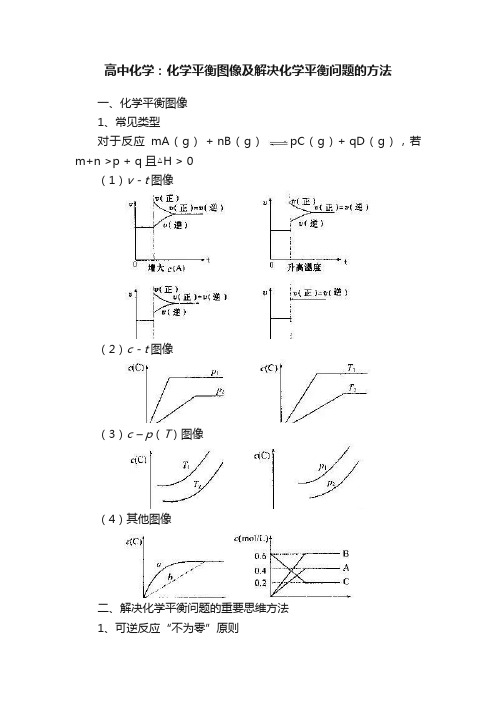
高中化学:化学平衡图像及解决化学平衡问题的方法一、化学平衡图像1、常见类型对于反应mA(g) + nB(g)pC(g)+ qD(g),若m+n >p + q 且△H > 0(1)v - t图像(2)c - t图像(3)c – p(T)图像(4)其他图像二、解决化学平衡问题的重要思维方法1、可逆反应“不为零”原则可逆性是化学平衡的前提,达到平衡时应是反应物和生成物共存的状态,每种物质的量不为零。
化学平衡的定量问题一般可用极限分析法推断,即假设反应不可逆,则最多生成产物多少,有无反应物剩余,过量物质余多少。
这样的极值点是不可能达到的,故可以用确定某些范围或在某范围中选择合适的用量。
2、“一边倒”原则:可逆反应,在条件相同时(等温等容),若达到等同平衡,其初始状态必须能互变,从极限角度看,就是各物质的物质的量要相当。
3、“不可混同”原则:不要将平衡的移动和速率的变化混同起来,平衡正向移动不一定是v(正)加快,v(逆)减慢;不要将平衡移动和浓度变化混同起来,平衡正向移动反应物不一定减少。
不要将平衡移动和反应物的转化率高低混同起来,平衡正向移动反应物转化率不一定提高。
4、“过渡态”原则:对于气体参加的可逆反应,在温度恒定的条件下,涉及体积与压强以及与平衡移动有关判断的问题时,可设计一些等效平衡的中间状态来进行求解。
这样能降低思维难度,具有变难为易、变抽象为直观的作用。
例1、对于达到平衡的可逆反应X + Y W + Z,当增大压强时,反应速率的变化如下图所示,则X、Y、W、Z四种物质的聚集状态是下列的()A. W、Z为气体,X、Y中有一种是气体B. X、Y、Z是气体,W是非气体C. Z、W中有一种是气体,X、Y均为非气体D. X、Y是气体,Z、W中有一种是气体解析:由图像可知,在增大压强的时刻,正、逆反应速率均增大且平衡逆向移动。
因此,方程式左边的系数之和小于右边的系数之和,故A正确。
答案:A例2、T℃时,A气体与B气体反应生成C气体。



化学平衡常见图像分析集团标准化办公室:[VV986T-J682P28-JP266L8-68PNN]化学平衡常见图像分析化学平衡图像问题的综合性强,思维难度大,是许多学生感到困难的题型之一。
化学平衡图像题的特征是以图像的形式将一些相关量之间的关系通过形象直观的曲线表示出来,把习题中的化学原理抽象为数学问题,旨在考查学生对曲线的数学意义和化学意义之间对应关系的分析、理解和运用能力。
一、化学平衡常见图像及其分析图像I:图像分析:(1)若a、b无断点,则平衡移动肯定是改变某一物质的浓度导致。
(2)若a、b有断点,则平衡移动可能是由于以下原因所导致:①同时不同程度地改变反应物(或生成物)的浓度;②改变反应体系的压强;③改变反应体系的温度。
(3)若平衡无移动,则可能是由于以下原因所导致:①反应前后气体分子个数不变;②使用了催化剂。
(4)若在的上方,即平衡向正反应方向移动;若在的上方,即平衡向逆反应方向移动。
图像II:图像分析:(1)由曲线的拐点作垂直于时间轴(t线)的垂线,其交点即为该条件下达到平衡的时间。
(2)由达到平衡的时间长短,推断与、与的相对大小(对于此图像:、)。
(3)由两平衡时,不同p、T下的量的变化可判断纵坐标y代表的物理量。
图像III:图像分析:(1)固定温度T(或压强p),即作横坐标轴的垂线,观察分析图中所示各物理量随压强p(或温度T)的变化结果。
(2)关键是准确判断所作垂线与原温度(或压强)曲线的交点的纵坐标。
(3)y可以是某物质的质量分数、转化率、浓度、浓度比值、体积分数、物质的量分数等。
图像IV:图像分析:(1)温度为点为化学平衡点。
(2)温度段是随温度(T)升高,反应速率加快,产物的浓度增大或反应物的转化率增大。
(3)温度段是随温度升高平衡向吸热反应方向移动的结果。
二、解答化学平衡图像问题的技巧在解答化学平衡图像问题时,要注意技巧性方法的应用。
1、“先拐先平,数值大”:在含量—时间曲线中,先出现拐点的,则先达到化学平衡状态,说明该曲线的温度较高或压强较大;2、“定一议二”:在含量—温度(或压强)曲线中,图像中有三个变量,先确定一个量不变,再讨论另外两个量的关系(因为化学平衡移动原理只适用于外界“单因素”的改变,导致的平衡移动的分析),即确定横坐标所示的量后,讨论纵坐标与曲线的关系或确定纵坐标所示的量后(通常作一条横坐标的垂线),讨论横坐标与曲线的关系。
2021届高考化学易错题练习化学平衡图像【错题纠正】例题1、合成氨工业涉及固体燃料的气化,需要研究CO 2与CO 之间的转化。
为了弄清其规律,让一定量的CO 2与足量碳在体积可变的密闭容器中反应:C(s)+CO 2(g)2CO(g)ΔH ,测得压强、温度对CO 、CO 2的平衡组成的影响如图所示:回答下列问题:(1)p 1、p 2、p 3的大小关系是________,欲提高C 与CO 2反应中CO 2的平衡转化率,应采取的措施为_____________。
图中a 、b 、c 三点对应的平衡常数大小关系是____________。
(2)900 ℃、1.013 MPa 时,1 mol CO 2与足量碳反应达平衡后容器的体积为V ,CO 2的转化率为________,该反应的平衡常数K =________。
【解析】(1)正反应是气体体积增大的反应,增大压强,CO 的含量降低,根据图像可知,在温度相等时p 1对应的CO 含量最高,则p 1、p 2、p 3的大小关系是p 1<p 2<p 3。
升高温度CO 的含量升高,说明正反应是吸热反应,所以欲提高C 与CO 2反应中CO 2的平衡转化率,应采取的措施为升高温度、降低压强。
平衡常数只与温度有关系,升高温度平衡右移,平衡常数增大,则图中a 、b 、c 三点对应的平衡常数大小关系是K a =K b <K c 。
(2)900 ℃、1.013 MPa 时CO 的含量是80%,则C(s)+CO(g) 2CO(g)起始量(mol) 1 0转化量(mol) x 2x平衡量(mol) 1-x 2x因此2x 1+x=0.8,解得x =23, 则CO 2的转化率为66.7%,反应的平衡常数K =⎝⎛⎭⎫43V 213V =163V。
【答案】(1)p1<p2<p3升高温度、降低压强K a=K b<K c(2)66.7%16 3V例题2、(1)活性炭还原NO2的反应为2NO2(g)+2C(s) N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量活性炭发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:①A、B、C三点中NO2的转化率最高的是__________(填“A”“B”或“C”)点。