工业中碳酸钠含量的测定 ppt课件
- 格式:ppt
- 大小:69.50 KB
- 文档页数:17





工业碳酸钠含量的测定流程图英文回答:The determination process of industrial sodiumcarbonate content can be divided into several steps:1. Sample preparation: Take a representative sample of the industrial sodium carbonate and ensure it is properly mixed and homogenized.2. Weighing: Accurately weigh a portion of the sample, typically around 2-3 grams, using an analytical balance.3. Dissolution: Transfer the weighed sample into a beaker or flask and add a suitable solvent, such asdistilled water. Stir the mixture to ensure complete dissolution of the sodium carbonate.4. Titration: Prepare a standard solution of an acid, such as hydrochloric acid (HCl), with a known concentration.Add a few drops of an indicator, such as phenolphthalein, to the dissolved sample. Slowly add the acid solution from a burette to the sample until the color of the indicator changes, indicating the neutralization of sodium carbonate.5. Calculation: From the volume of acid solution usedin the titration, calculate the amount of sodium carbonate present in the sample using the stoichiometry of the reaction between sodium carbonate and the acid.6. Repeat: Perform the above steps in duplicate or triplicate to ensure the accuracy and precision of the results.中文回答:工业碳酸钠含量的测定流程可以分为以下几个步骤:1. 样品制备,取工业碳酸钠的代表性样品,并确保样品充分混合和均匀。


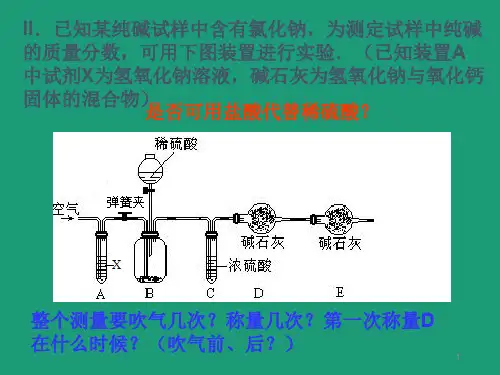



碳酸钠的制备及含量测定实验前准备工作:1、网上搜索碳酸钠制备的方法及含量测定的具体操作;2、图书馆查阅资料确定具体实施制备及含量测定方案;3、小组讨论、计算实验药品的用量及操作中需要注意的细节。
本实验以NaCl 和NH 4HCO 3为原料制备Na 2CO 3,反应方程式为:NaCl+NH 4HCO 3=NaHCO 3+NH 4Cl2NaHCO 3Na 2CO 3+CO 2↑+H 2O沙浴、电热炉1、采用双指示剂法:第一步加入酚酞指示剂,逐滴加入标准盐酸溶液,待溶液至近乎无色(极浅的粉红色)时,达到第一个滴定终点,此时测定的是中和其中的Na2CO3至NaHCO3,之后加入甲基橙指示剂,滴定至橙色时,达到第二个滴定终点,此时为将全部NaHCO3(原始的NaHCO3与Na2CO3转化来的NaHCO3)滴定至H2CO3。
2、电导滴定法:含量测定:电导滴定原理电导率电阻率离子导电离子数目在滴定过程中,离子浓度不断变化,电导率也不断变化,利用电导变化的转折点,确定滴定终点。
离子浓度电导率电导滴定具体操作采用电导滴定,称取0.2650g 自己制备的精确配置100ml后,取两次25ml溶液于150ml的锥形瓶中(或烧杯中)每加入1.00mlHCl溶液测定一次电导率计入到下列表格中,作k(电导率)—图象,图中的拐点处即为滴定为NaHCO3时所用HCl 的体积,计算的含量。
实验时具体的注意事项:1、碳酸钠的制备装置的选取和搭建;2、加热装置的选取,和具体的操作;3、酸式滴定管的使用(快滴、慢滴、半滴)操作;4、移液管的使用方法;5、滴定终点颜色的判断和数据处理。
移液管及滴定管的使用:1、使用前;2、吸液;加液;3、调节液面;4、放出溶液(滴定)。
①调节。
②测量。
③测量结束后。
组别1234567891011 K(电导率)*10μs/cm280275272268265262260257255253251VHCl1.002.003.004.005.006.007.008.009.0010.0011.00组别1213141516171819202122 K(电导率)*10μs/cm250249248247246245246246245243247V HCl 12.0013.0014.0015.0016.0017.0018.0019.0020.0021.0022.00制表:作图:分析:1、拐点之前为:Na+CO=+HClNaClNaHCO3232、拐点之后为:+=+NaHCO+CONaClHClOH322注意:理论上,还应该有第二个拐点即碳酸钠与盐酸完全反应之后只加入盐酸时。
碳酸钠含量检测方法
1. 酸碱滴定法:这是一种常用的碳酸钠含量检测方法。
其原理是利用碳酸钠与酸反应生成二氧化碳的性质,通过滴定酸的用量来计算碳酸钠的含量。
具体操作是将待测样品溶解在水中,加入已知浓度的酸溶液,用酚酞作为指示剂,当溶液由红色变为无色时,即为滴定终点。
根据酸的用量和浓度,可以计算出碳酸钠的含量。
2. 重量法:该方法基于碳酸钠与氯化钙反应生成碳酸钙沉淀的原理。
将待测样品溶解在水中,加入过量的氯化钙溶液,使碳酸钠完全反应生成碳酸钙沉淀。
过滤沉淀,并将其干燥、称重。
根据沉淀的质量和化学计量关系,可以计算出碳酸钠的含量。
3. 电位滴定法:电位滴定法是一种基于电位变化来确定滴定终点的方法。
在碳酸钠含量检测中,通常使用盐酸作为滴定剂,用玻璃电极作为指示电极,检测溶液的电位变化。
当滴定剂与碳酸钠反应达到等当点时,电位会发生突跃,通过记录滴定过程中的电位变化,可以确定等当点,从而计算出碳酸钠的含量。
4. 原子吸收光谱法:原子吸收光谱法是一种基于原子吸收光谱原理的分析方法。
将待测样品溶解在水中,通过原子吸收光谱仪测定碳酸钠的特征吸收峰的强度,根据标准曲线或内标法,可以计算出碳酸钠的含量。
需要注意的是,不同的检测方法适用于不同的样品类型和检测要求。
在选择检测方法时,需要考虑样品的性质、检测精度、实验条件等因素。
同时,为了获得准确可靠的检测结果,需要严格按照操作规程进行实验操作,并进行适当的质量控制和验证。