实验23磺基水杨酸铁(Ⅲ)配合物的组成及K稳的测定
- 格式:doc
- 大小:35.50 KB
- 文档页数:3


实验八、磺基水杨酸合铁(III)配合物的制备及稳定常数的测定一、实验目的1、初步了解分光光度法测定溶液中配合物的组成和稳定常数的原理和方法。
2、学习有关实验数据的处理方法。
3、学习使用分光光度计。
二、实验原理在给定条件下,某中心离子M与配位体L反应,生成配离子(或配合物)MLn(略去电荷符号):M(aq)+nL(aq)== MLn若M与L都是无色的,而只有MLn有色,则根据朗伯-比尔定律可知溶液的吸光度A与配离子或配合物的浓度c成正比。
本实验采用浓比递变法测定系列溶液的吸光度,从而求出该配离子(或配合物)的组成和稳定常数。
配制一系列含有中心离子M与配位体L的溶液,是M与L的总浓度(mol·dm-3)保持一定,而M与L的摩尔分数做系列改变。
例如,是溶液中L的摩尔分数依次为0、0.1、0.2、0.3、……0.9、1.0,而M的摩尔分数依次作相应递减。
在一定波长的单色光中分别测定该系列溶液的吸光度。
有色配离子(配合物)的浓度越大,溶液颜色越深,其吸光度越大。
当M和L恰好全部形成配离子时(不考虑配离子的解离),MLn的浓度为最大,吸光度也最大。
若以MLn溶液的吸光度A 为纵坐标、溶液中配位体的摩尔分数为横坐标作图,所得曲线出现一个高峰,它所对应的吸光度为A1。
如果延长曲线两侧的直线线段部分,相交于一点,此点所对应的吸光度为A0,即为吸光度的极大值。
这两点所对应的配位体的摩尔分数即为MLn的组成。
若点所对应的配位体的摩尔分数为0.5,则中心离子的摩尔分数为0.5所以配位体的物质的量配位体的摩尔分数 0.5中心离子的物质的量═中心离子的摩尔分数═ 0.5 ═ 1由此可知,该配离子(或配合物)的组成为ML型。
由于配离子(或配合物)有一部分解离,则其浓度比未解离时的要稍小些,吸光度最大处所实际测得的最大吸收光度A1也比小于由曲线两侧延长所得点处即组成全部为ML配合物的吸光度A0。
因而配离子(或配合物)ML的解离度α为α =(A0–A1)/ A0配离子(或配合物)ML的稳定常数K f与解离度α的关系如下:ML = M(aq) + L(aq)平衡时浓度/(mol.dm-3) c0 - c0α c0α c0αC eq(ML)/cθ 1-αK f = { C eq(M)/cθ}{ ceq(L)/cθ} = c0α 2Fe3+ 与磺基水杨酸(可缩写为H3ssa)酸根离子能形成稳定的螯合物、螯合物的组成随PH值不同而有差异。

磺基水杨酸合铁(Ⅲ)配合物的组成及稳定常数的测定嘿,朋友们!今天咱来聊聊磺基水杨酸合铁(Ⅲ)配合物的组成及稳定常数的测定。
这可真是个有趣的玩意儿啊!你想想看,就像搭积木一样,各种分子凑在一起,形成了特别的组合。
磺基水杨酸和铁(Ⅲ),它们俩碰到一块儿,会产生什么样奇妙的反应呢?这就需要我们去探索啦!要测定这个组成和稳定常数,那可不是一件随随便便就能搞定的事儿。
得像侦探破案一样,仔细地观察、分析。
首先得准备好各种试剂和仪器,这就好比战士上战场得有趁手的兵器呀!然后呢,通过一系列的实验操作,一点一点地揭开它们的神秘面纱。
在这个过程中,可不能马虎大意哟!稍有不慎,可能就会得出错误的结果。
这就好像走钢丝,得小心翼翼,保持平衡。
要是不小心手抖了一下,或者加错了试剂,那可就糟糕啦!咱可以把这个过程想象成一场冒险,每一步都充满了未知和挑战。
比如说,在调节溶液酸碱度的时候,就像是在给一个小脾气的娃娃哄开心,得掌握好那个度。
太酸了不行,太碱了也不行,得刚刚好才行呢!还有啊,观察实验现象的时候可得瞪大了眼睛。
那一点点细微的变化,都可能是重要的线索。
就像在茫茫人海中寻找一个特别的人,得有敏锐的观察力。
当我们通过努力,终于测定出磺基水杨酸合铁(Ⅲ)配合物的组成及稳定常数时,那种成就感,哇,简直无法形容!就好像登山者终于登上了山顶,看到了那壮丽的景色。
总之呢,这个测定的过程充满了乐趣和挑战。
需要我们有耐心、细心,还要有那么一点点的好奇心。
朋友们,你们准备好了吗?快来和我一起踏上这场奇妙的科学之旅吧!相信你们一定会爱上这个过程的,就像我一样!别犹豫啦,赶紧行动起来吧!。

实验六 磺基水杨酸铁(Ⅲ)配离子的组成和稳定常数的测定一、实验目的1.采用浓度连续变更法测量配合物的组成和配位化合物的稳定常数。
2.学习分光光度计的使用及实验数据的处理方法。
二、实验原理磺基水杨酸与Fe 3+离子可形成稳定的配合物:起始浓度/mol·dm -3 c 0 0 平衡浓度/ mol·dm -3 c-c α c α c α()n eq Leq eqc c c K ⋅=MML (表观)不稳 或()eq neq Leqc c c K MLM⋅=(表观)稳97.21010⋅=(表观)稳稳K K当pH=2~3时,生成1:1型紫红色螯合物ML ,其表观稳定常数:2MLM 1ααc c c c K eq eqL eq -=⋅=稳 121-DDD =αα配合物的解离度:—朗伯比尔定律:有色溶液的吸光度D 与溶液的浓度成正比()1 c b D ⋅⋅=ε当温度、液层厚度及溶液性质一定时,()1式可写成:()2 kc D =以吸光度D 为纵坐标,以配体的物质的量分数为横坐标作图。
n n ML L M +LM ML n n +三、实验内容1.溶液的配制(1)配制3dm mol 0010.0-⋅ +3Fe溶液:准确吸取35.00cm 3dmmol 0100.0-⋅()()244SO Fe NH 溶液于350cm 容量瓶中,用3dmmol 0100.0-⋅4HClO 溶液稀释至刻度,摇匀备用。
(2)配制3dm mol 0010.0-⋅磺基水杨酸溶液:准确吸取35.00cm 3dm mol 0100.0-⋅磺基水杨酸溶液于350cm 容量瓶中,用3dm mol 0100.0-⋅4HClO 溶液稀释至刻度,摇匀备用。
2.浓度连续变更法配制配离子溶液及吸光度的测定(1)按下表配制溶液于310.00cm 比色管中,注意比色管编号,用3dm mol 0100.0-⋅4HClO 溶液稀释至310.00cm 刻度线,摇匀。

磺基水杨酸合铁配合物组成及其稳定常数测定实验七铁(III)离子与磺基水杨酸配合物的组成和稳定常数的测定一、实验目的1.了解采用分光光度法测定配合物组成和稳定常数的原理和方法。
2.学习用图解法处理实验数据的方法。
3.进一步学习分光光度计使用方法,了解其工作原理。
4. 进一步练习吸量管、容量瓶的使用二、实验原理磺基水杨酸(简式为H3R)可以与Fe3+ 形成稳定的配合物。
配合物的组成随溶液pH值的不同而改变。
在pH=2~3、4~9、9~11时,磺基水杨酸与Fe3+能分别形成三种不同颜色、不同组成的配离子。
本实验是测定pH=2~3时所形成的红褐色磺基水杨酸合铁(Ⅲ)配离子的组成及其稳定常数。
实验中通过加入一定量的HClO4溶液来控制溶液的pH值。
由于所测溶液中磺基水杨酸是无色的,Fe3+溶液的浓度很小,也可认为是无色的,只有磺基水杨酸合铁(Ⅲ)配离子(MRn)是有色的。
根据朗伯—比耳定律A=εbc可知,当波长λ、溶液的温度T及比色皿的厚度b均一定时,溶液的吸光度A只与有色配离子的浓度c成正比。
通过对溶液吸光度的测定,可以求出配离子的组成。
用光度法测定配离子组成,通常有摩尔比法、等摩尔连续变化法、斜率法和平衡移动法等,每种方法都有一定的适用范围,本实验采用等摩尔连续变化法,通过分光光度计测定配位化合物的组成。
具体操作时,取用摩尔浓度相等的金属离子溶液和配位体溶液,按照不同的体积比(即摩尔数之比)配成一系列溶液,测定其吸光度值。
以吸光度值A 为纵坐标,体积分数(,即摩尔分数。
式中:V M为金属离子溶液的体积,V L为配位体溶液的体积)为横坐标作图得如图1所示的曲线,将曲线两边的直线部分延长相交于B点,B点对应的吸光度值A B 最大。
由B点对应的摩尔分数值,可计算配离子中金属离子与配位体的摩尔数之比,即可求得配离子MLn 中配位体的数目n 。
图 1 配位体摩尔分数-吸光度图在图1中,在B点最大吸收处对应的摩尔分数值为0.5,则:即:金属离子与配位体摩尔数之比为1︰1。

实验22 磺基水杨酸合铁(III )配 合物的组成及其稳定常数的测定一、实验目的1.掌握等摩尔连续变化法测定配合物组成及其稳定常数的原理和方法。
2.学习分光光度计的使用。
3. 进一步巩固溶液的配制、液体的移取等操作。
二、实验原理在溶液中,磺基水杨酸(,简写为H 3R )与Fe 3+可以形成稳定的配合物,因溶液pH 值的不同,形成配合物的组成也不同。
在pH10左右,可生成1׃3的配合物,呈黄色。
在pH 为4~10之间生成红色的1׃2配合物。
在pH <4时,它形成1׃1的配合物,呈紫红色(也有称红褐色),配位反应为:Fe 3+ ++ 2H +本实验通过加入一定量的HClO 4溶液来控制溶液的pH 值,测定pH <2.5时所形成的紫红色的磺基水杨酸合铁(III )配离子的组成及稳定常数。
目前测定配合物组成及稳定常数的方法很多,其中分光光度法是常用的方法之一。
其基本原理如下:当一束波长一定的单色光通过有色溶液时,光的一部分被溶液吸收,另一部分透过溶液。
对光的吸收和透过程度,通常有两种表示方法:一种是用透光率T 表示,即透过光的强度I t 与入射光强度I 0之比,即 0I I T t=另一种是用吸光度A (又称消光度,光密度)来表示,它是透光率的负对数,即tI I T A 0lglg =−= A 值越大,表示单色光被有色溶液吸收的程度越大,反之A 值小,光被有色溶液吸收的程度小。
朗伯-比尔定律指出:当一束单色光通过溶液时,溶液的吸光度与溶液的浓度c 和液层厚度l 的乘积成正比,即A = εcl式中:ε为摩尔吸光系数,在一定波长下,它是有色物质的一个特征常数。
在用分光光度法测定溶液中配合物的组成时,通常有摩尔比法、等摩尔连续变化法、斜率法和平衡移动法等,每种方法都有一定的适用范围,本实验采用等摩尔连续变化法。
由于所测溶液中,磺基水杨酸是无色的,Fe 3+溶液的浓度很稀,也可认为是无色的,只有磺基水杨酸合铁配离子(MR n )是有色的,因此溶液的吸光度只与配离子的浓度成正比。
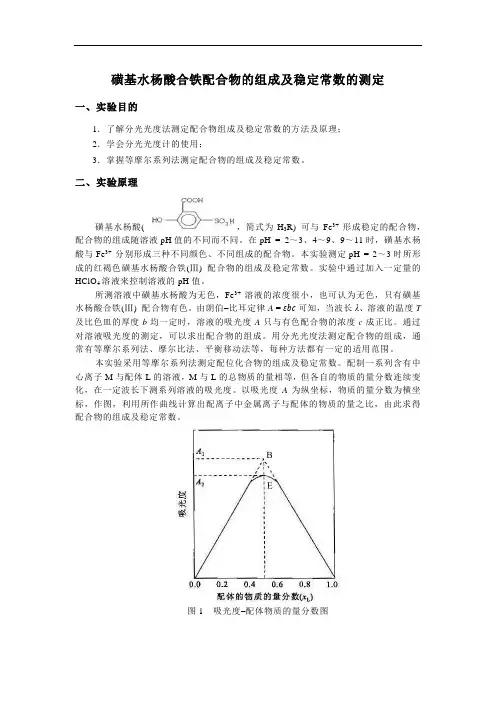
磺基水杨酸合铁配合物的组成及稳定常数的测定一、实验目的1.了解分光光度法测定配合物组成及稳定常数的方法及原理;2.学会分光光度计的使用;3.掌握等摩尔系列法测定配合物的组成及稳定常数。
二、实验原理磺基水杨酸( ,简式为H3R) 可与Fe3+ 形成稳定的配合物,配合物的组成随溶液pH值的不同而不同。
在pH = 2~3、4~9、9~11时,磺基水杨酸与Fe3+ 分别形成三种不同颜色、不同组成的配合物。
本实验测定pH = 2~3时所形成的红褐色磺基水杨酸合铁(Ⅲ) 配合物的组成及稳定常数。
实验中通过加入一定量的HClO4溶液来控制溶液的pH值。
所测溶液中磺基水杨酸为无色,Fe3+ 溶液的浓度很小,也可认为无色,只有磺基水杨酸合铁(Ⅲ) 配合物有色。
由朗伯–比耳定律A = εbc可知,当波长λ、溶液的温度T 及比色皿的厚度b均一定时,溶液的吸光度A只与有色配合物的浓度c成正比。
通过对溶液吸光度的测定,可以求出配合物的组成。
用分光光度法测定配合物的组成,通常有等摩尔系列法、摩尔比法、平衡移动法等,每种方法都有一定的适用范围。
本实验采用等摩尔系列法测定配位化合物的组成及稳定常数。
配制一系列含有中心离子M与配体L的溶液,M与L的总物质的量相等,但各自的物质的量分数连续变化,在一定波长下测系列溶液的吸光度。
以吸光度A为纵坐标,物质的量分数为横坐标,作图,利用所作曲线计算出配离子中金属离子与配体的物质的量之比,由此求得配合物的组成及稳定常数。
图1吸光度–配体物质的量分数图具体操作时,取用物质的量浓度相同的金属离子溶液和配体溶液,按照不同的体积比(即物质的量之比) 配成一系列溶液,测定其吸光度值。
以吸光度值 A 为纵坐标,体积分数(,即物质的量分数。
式中:V M为金属离子溶液的体积,V L为配体溶液的体积) 为横坐标作图,得到吸光度–配体物质的量分数图(如图1所示),将曲线两边的直线部分延长相交于B点,B点对应的吸光度值A1 最大。

《工程化学实验》备课笔记磺基水杨酸合铁(Ⅲ)配合物的组成及稳定常数的测定实验目的1.掌握用比色法测定配合物的组成和配离子的稳定常数的原理和方法。
2.进一步学习分光光度计的使用及有关实验数据的处理方法。
实验原理磺基水杨酸( ,简式为H3R)的一级电离常数K1θ=3×10-3与Fe3+可以形成稳定的配合物,因溶液的pH不同,形在配合物的组成也不同。
磺基水杨酸溶液是无色的,Fe3+的浓度很稀时也可以认为是无色的,它们在pH 值为2~3时,生成紫红色的螯合物(有一个配位体),反应可表示如下:pH值为4~9时,生成红色螯合物(有2个配位体);pH值为9~11.5时,生成黄色螯合物(有3个配位体);pH>12时,有色螯合物,被破坏而生成Fe(OH)3沉淀。
测定配合物的组成常用光度计,其前提条件是溶液中的中心离子和配位体都为无色,只有它们所形成的配合物有色.本实验是在pH值为2~3的条件下,用光度法测定上述配合物的组成和稳定常数的,如前所述,测定的前提条件是基本满足的;实验中用高氯酸(HClO4)来控制溶液的pH值和作空白溶液(其优点主要是ClO4—不易与金属离子配合)。
由朗伯—比尔定律可知,所测溶液的吸光度在液层厚度一定时,只与配离子的浓度成正比。
通过对溶液吸光度的测定,可以求出该配离子的组成。
下面介绍一种常用的测定方法:等摩尔系列法:即用一定波长的单色光,测定一系列变化组分的溶液的吸光度(中心离子M和配体R的总摩尔数保持不变,而M和R的摩尔分数连续变化)。
显然,在这一系列的溶液中,有一些溶液中金属离子是过量的,而另一些溶液中配体是过量的;在这两部分溶液中,配离子的浓度都不可能达到最大值;只有当溶液离子与配体的摩尔数之比与配离子的组成一致时;配离子的浓度才能最大。
由于中心离子和配体基本无色,只有配离子有色,所以配离子的浓度越大,溶液颜色越深,其吸光度也就越大,若以吸光度对配体的摩尔分数作图,则从图上最大吸收峰处可以求得配合物的组成n值,如图所示,根据最大吸收处:等摩尔系列法由此可知该配合物的组成(MR)。



磺基水杨酸合铁(Ⅲ)配合物的组成及稳定常数的测定【摘要】磺基水杨酸(SO3HHOCOOH简化为H3R),与Fe3+可以形成稳定的配合物,配合物的组成随溶液的pH值的不同而改变。
在pH=2~3时,pH=4~9时,pH=9~11.5时,磺基水杨酸与Fe3+能分别形成不同颜色且具有不同组成的配离子。
等摩尔连续变化法是配制一系列溶液,保持溶液中度、离子强度、温度和金属离子与配体的总物质的量不变改变金属离子cM和配体的摩尔分数使之连续化,在最大吸收波长处测定各溶液的吸光度,以吸光度A配体的摩尔分数xR作图,根据两边线性部分的延线相交之点所对应的配体摩尔分数值,即可求出配合的组成比可以认为相交之点Amax为配合物以n完全配位而不离解的吸光度,而实验测得值为A,两者之差就是由配合物离解所造成的.由此可求K稳,相应计算同摩尔比法.【关键字】分光广度法等摩尔连续变化法伯朗-比尔定律配合物配位数【实验目的】1、了解光度法测配合物配位数和稳定常数的一种原理和方法;2、测定pH<2.5时,磺基水杨酸合铁(Ⅲ)配合物的组成及稳定常数;3、学习分光光度计的应用;4、巩固溶液配制及作图法处理数据的方法。
【实验原理】1、伯朗-比尔定律当具有一定波长的单色光通过有色溶液时,一部分光被溶液吸收,另一部分光透过溶液。
I o一定时,I a越大,I t就越小。
一般将透过光强度I t与入射光强度I0之比叫透光度,以T表示:T越大,溶液透光程度越大,对光的吸收程度越小。
一般用A表示有色溶液对光的吸收程度,A越大,T越大,对于同一溶液而言,其吸光度与浓度c和液层厚度d成正比,即伯朗-比尔定律,若入射光波长、比色皿(溶液)的厚度d一定时,吸光度只与溶液的浓度c成正比。
通常测定某一物的一系列已知浓度的吸光度,以A为纵标,c为横标,绘出A-c标准曲线,则其斜率为k = εd,如果测定该物未知浓度c i溶液的吸光度为A i,则由A i/k或从标准曲线就可以求出c i来。
磺基水杨酸合铁(Ⅲ)配合物的组成及稳定常数的测定磺基水杨酸合铁(III)配合物的组成及稳定常数的测定,听起来就像是一道化学题目,让人感到有些头疼。
我们可以用一种轻松幽默的方式来解决这个问题。
我们需要了解什么是磺基水杨酸合铁(III)配合物。
简单来说,它就是一种由铁离子和磺基水杨酸组成的化合物。
这个名字听起来有点复杂,但是只要我们用一些日常俚语和成语俗语来解释一下,就会变得容易理解了。
磺基水杨酸合铁(III)配合物,就像是一个“团队合作”。
在这个团队里,铁离子是一个“领袖”,它负责带领其他成员一起工作。
而磺基水杨酸则是一个“辅助者”,它可以帮助领袖更好地完成任务。
这个团队的目标是“共同进步”,也就是说,只有当每个人都尽自己的最大努力时,整个团队才能取得成功。
现在我们已经了解了磺基水杨酸合铁(III)配合物的基本概念,接下来就是要测定它的组成和稳定常数了。
这就像是要找到这个团队的“优势和劣势”,以便更好地发挥它们的作用。
我们需要进行实验,测量出磺基水杨酸合铁(III)配合物中铁离子和磺基水杨酸的质量分数。
这个过程需要非常精确,因为任何一个小小的误差都可能导致结果不准确。
接着,我们需要计算出磺基水杨酸合铁(III)配合物的摩尔质量。
这就像是要知道每个成员的“体重”,这样才能知道整个团队的总质量。
我们需要根据实验数据计算出磺基水杨酸合铁(III)配合物的稳定常数。
这个常数反映了这个团队的“凝聚力”,也就是说,只有当团队成员之间的协作紧密时,整个团队才能保持稳定。
通过以上步骤,我们就可以得出磺基水杨酸合铁(III)配合物的组成及稳定常数了。
虽然这个过程看起来有些枯燥无味,但是只要我们用心去做,就能得到令人满意的结果。
磺基水杨酸合铁(III)配合物的组成及稳定常数的测定并不是一件难事。
只要我们用一些日常俚语和成语俗语来解释一下,就会变得容易理解了。
不要被题目吓倒哦!。
实验23 磺基水杨酸铁(Ⅲ)配合物的组成及K稳的测定[实验目的]1、了解分光光度计测定配合物组成及K稳的原理和方法。
2、测定PH<2.5时磺基水杨酸铁(Ⅲ)的组成及K稳。
3、练习使用分光光度计。
[实验原理]磺基水杨酸(HO SO3H,简式H3R)与Fe3+可形成稳定的配合物,因溶液PH值不同,其组成也不相同。
本实验测PH<2.5时所形成红褐色磺基水杨酸铁(Ⅲ)配离子的组成及K稳。
实验中用HClO4溶液来控制PH值。
1、分光光度法测定配合物组成的基本原理:①用透光率T表示:即透光的强度I t与入射光强度I0之比。
T=I t/I0②用吸光度D表示(又称消光度、光密度),它是透光率的负对数:D=-lgT=lgI0/I tD值大表示光被有色溶液吸收的程度大:反之亦然。
2、朗伯—比尔定律D=ε c L即:一束单色光通过有色溶液时,有色溶液的吸光度与溶液的浓度c和液层厚度L乘积成正比(ε为消光系数,λ0一定时,ε为特征常数)。
3、可行性论证所测溶液中,H3R为无色,Fe3+溶液的浓度很稀,也可认为无色,只有MR x是有色的(磺基水杨酸铁(Ⅲ)配离子为有色)。
因此,溶液的吸光度D只与配离子浓度成正比。
通过对溶液吸光度的测定,可以求出该配离子的组成。
4、配离子组成的求得(分光光度法求时,常用的两种方法):①等摩尔系列法(连续变化法,本实验采用此法):保持(n M+n R)不变的前提下,使M和R的摩尔分数连续变化而配制一系列溶液,显然,这些溶液中必有一种物质过量,配离子浓度不可能达最大。
只有当溶液中M与R的物质的量之比与配离子组成一致时,C MRx才最大。
MR x的浓度增大,溶液颜色加深,D增大。
若x值,如图1:=n R/n总=0.5=n M/n总=0.5x值=x R/x M=1(图1)中心离子摩尔分数由图1可以看出x=1,该配合物组成为MR,最大吸光度A点可以认为是M和R全部形成配合物时的吸光度,其值为D1,由于部分离解,其浓度要稍小一些,所以实测吸光度为B点,其值为D2,因此配离子的离解度〆可表示为:〆=(D1-D2)/D1再由1:1组成关系,即可求出表观稳定常数Kˊ,M + R == MR平衡时c〆c〆c-c〆Kˊ=[MR]/([M][R])=(1-〆)/c〆2(式中C为相应于A点的金属离子M的浓度)考虑弱酸的电离平衡,对Kˊ加以校正,校正后得K稳:lgK稳=lg Kˊ+lgθ(θ为酸效应系数)(对于H3R,PH=2时,lgθ=10.2)应该指出:该法应用于研究络合比高或离解度较大的络合物,得不到准确的结果。
实验23磺基水杨酸铁()配合物的组成及K稳的测定实验目的:1. 合成磺基水杨酸铁配合物并通过实验方法确认其组成;2. 通过外推法求出配合物的稳定常数Ks。
实验原理:磺基水杨酸铁是一种含有磺酸根(SO42-)的钩环络合物。
磺酸根可以形成配位键,使得该配合物的络合度比另一种水杨酸铁配合物提高了很多。
因此,磺基水杨酸铁比水杨酸铁更稳定。
Ks是配合物稳定常数。
因为化学反应在达到平衡时,反应物和生成物的浓度不再发生变化,所以可以通过反应物和生成物的浓度比来求取Ks。
实验步骤:配合物的制备1. 在500 mL的圆底烧瓶中加入1.23 g的水杨酸铁,并加入足够的70%的硫酸(约10 mL)。
2. 小心地将这个混合物加入到100 mL的1%的磺酸水溶液中,并迅速搅拌2-3分钟,使沉淀形成。
3. 用冷的磺酸水溶液反复冲洗沉淀,直到纯净的磺基水杨酸铁沉淀形成。
将磺基水杨酸铁沉淀用磷酸水溶液(1 M)洗涤。
4. 将磺基水杨酸铁放在烘箱中烘干,并称取干燥后的产物的重量。
测定Ks1. 在100 mL锥形瓶中加入1.00 g的干燥磺基水杨酸铁。
加入50 mL磷酸缓冲液(pH 3.2)和5 mL1 M的钠硫酸钠溶液。
2. 在10 mL的烧杯中取1.00 g的异硫氰酸钾,加入50 mL的50%乙醇溶液中,并将其加入到含有磺基水杨酸铁的锥形瓶中。
3. 紧急封上瓶塞,并充分混合。
用盐酸调节pH至3.2。
4. 在室温下放置该混合物约2小时,然后过滤。
5. 在滤液中测定顶点吸收波长处的吸光度,用外推法求出稳定常数Ks。
实验结果:合成得到的磺基水杨酸铁的产物重量为1.25 g。
将1.00 g的干燥磺基水杨酸铁加入到50 mL磷酸缓冲液(pH 3.2)和5 mL1 M的钠硫酸钠溶液中,得到的混合物稳定常数Ks为3.0x10^6。
结论:通过本实验,成功合成了磺基水杨酸铁,并测定了其稳定常数Ks。
经计算得到的Ks 值表明,该配合物比较稳定。
磺基水杨酸合铁(Ⅲ)的组成和K 稳的测定(分光光度法)一、实验目的1.初步了解分光光度法测定溶液中配合物的组成和稳定常数的原理和方法。
2.学习有关实验数据的处理方法。
3.练习使用分光光度计。
二、实验原理当一束具有一定波长的单色光通过一定宽度的有色溶液时,有色物质对光的吸收程度(用吸光度A 表示)与有色物质的浓度、液层宽度成正比:A =Kbc这就是朗伯-比耳定律。
式中c 为有色物质浓度;b 为液层宽度;K 为比例常数,其数值与入射光的波长、有色物质的性质和温度有关。
当有色物质成分明确,其相对分子质量已知的情况下,可用ε代替K ,ε称摩尔吸光系数,在数值上等于单位摩尔浓度在单位光程中所测得的溶液的吸光度:A =εbc磺基水杨酸与Fe 3+形成的配合物的组成和颜色因pH 不同而异。
当溶液的pH <4时,形成紫红色的配合物;pH 在4~10 间生成红色的配合物;pH 在10左右时,生成黄色配合物。
本实验用等物质的量系列法测定pH=2时磺基水杨酸与Fe 3+形成的配合物的组成和稳定常数。
等物质的量系列法就是在保持每份溶液中金属离子的浓度(c M )与配体的浓度(c R )之和不变(即总的物质的量不变)的前提下,改变这两种溶液的相对量,配制一系列溶液并测定每份溶液的吸光度。
若以不同的物质的量比RM M n n n 与对应的吸光度A 作图得物质的量比-吸光度曲线,曲线上与吸光度极大值相对应的物质的量比就是该有色配合物中金属离子与配体的组成之比。
图1表示一个典型的低稳定性的配合物MR 的物质的量比与吸光度曲线,将两边直线部分延长相交于B ,B 点位于50%处,即金属离子与配体的物质的量比为1:1。
从图可见,当物质完全以MR 形式存在时,在B 点MR 的浓度最大,对应的吸光度为A 1,但由于配合物一部分离解,实验测得的最大吸光度对应于E 点的A 2。
若配合物的解离度为α,则图1物质的量比—吸光度曲线α =121A A A - l:l 型配合物的标准稳定常数K 可由下列平衡关系导出:M + MR起始浓度 0 0 c平衡浓度 cα cα c (1-α)21ααc c c c K R M MR -=⋅=式中,c MR 、、c M 、c R 为离解平衡时的各物质浓度,c 是溶液内MR 的起始浓度,即当RM M n n n +=50%时,其值相当于溶液中金属离子或配位体的起始浓度的一半。
实验23 磺基水杨酸铁(Ⅲ)配合物的组成及K稳的测定
[实验目的]
1、了解分光光度计测定配合物组成及K稳的原理和方法。
2、测定PH<2.5时磺基水杨酸铁(Ⅲ)的组成及K稳。
3、练习使用分光光度计。
[实验原理]
磺基水杨酸(HO SO3H,简式H3R)与Fe3+可形成稳定的配合物,因溶液PH值不同,其组成也不相同。
本实验测PH<2.5时所形成红褐色磺基水杨酸铁(Ⅲ)配离子的组成及K稳。
实验中用HClO4溶液来控制PH值。
1、分光光度法测定配合物组成的基本原理:
①用透光率T表示:即透光的强度I t与入射光强度I0之比。
T=I t/I0
②用吸光度D表示(又称消光度、光密度),它是透光率的负对数:D=-lgT=lgI0/I t
D值大表示光被有色溶液吸收的程度大:反之亦然。
2、朗伯—比尔定律D=ε c L
即:一束单色光通过有色溶液时,有色溶液的吸光度与溶液的浓度c和液层厚度L乘
积成正比(ε为消光系数,λ0一定时,ε为特征常数)。
3、可行性论证
所测溶液中,H3R为无色,Fe3+溶液的浓度很稀,也可认为无色,只有MR x是有色的
(磺基水杨酸铁(Ⅲ)配离子为有色)。
因此,溶液的吸光度D只与配离子浓度成正
比。
通过对溶液吸光度的测定,可以求出该配离子的组成。
4、配离子组成的求得(分光光度法求时,常用的两种方法):
①等摩尔系列法(连续变化法,本实验采用此法):保持(n M+n R)不变的前提下,
使M和R的摩尔分数连续变化而配制一系列溶液,显然,这些溶液中必有一种
物质过量,配离子浓度不可能达最大。
只有当溶液中M与R的物质的量之比与
配离子组成一致时,C MRx才最大。
MR x的浓度增大,溶液颜色加深,D增大。
若
x值,如图1:
=n R/n总=0.5
=n M/n总=0.5
x值=x R/x M=1
(图1)中心离子摩尔分数
由图1可以看出x=1,该配合物组成为MR,最大吸光度A点可以认为是M和R
全部形成配合物时的吸光度,其值为D1,由于部分离解,其浓度要稍小一些,所
以实测吸光度为B点,其值为D2,因此配离子的离解度〆可表示为:
〆=(D1-D2)/D1
再由1:1组成关系,即可求出表观稳定常数Kˊ,
M + R == MR
平衡时c〆c〆c-c〆
Kˊ=[MR]/([M][R])=(1-〆)/c〆2
(式中C为相应于A点的金属离子M的浓度)
考虑弱酸的电离平衡,对Kˊ加以校正,校正后得K稳:
lgK稳=lg Kˊ+lgθ(θ为酸效应系数)(对于H3R,PH=2时,lgθ=10.2)
应该指出:该法应用于研究络合比高或离解度较大的络合物,得不到准确的结果。
②摩尔比法(简介)
固定一种组分(通常为M)的浓度,改变R的浓度得一系列[R]/[M]比值不同的
溶液,并配相应空白液作参比,测其吸光度D,以D为纵坐标,[R]/[M]为横坐
标作图。
当[R]增大时,D增大,当M全部络合后,[R]增大,D不再变化,如图2
(图2)
外推得一交点,从交点向横坐标作垂线,对应的[R]/[M]比值即为络合物的络合
比(对离解小的络合物,结果较好)
[注意事项]
1、配溶液用HClO4,不用H2O,注意测PH值。
2、注意测试顺序从小浓度到大浓度。
3、注意保护分光光度计。
实验24 硫酸亚铁铵的制备
[实验目的]
1、了解制备金属盐类(简单盐和复盐)的一种基本方法。
2、练习无机制备中的一些基本操作。
[实验原理]
铁屑与稀硫酸作用生成硫酸亚铁,溶液经浓缩后冷却至室温,即可得到浅绿色的FeSO4·7H2O晶体。
硫酸亚铁有FeSO4·7H2O,FeSO4·4H2O和FeSO4·H2O三种水合物,它们在溶液中可以互相转变,其转变温度为:
FeSO4·7H2O 57℃
FeSO4·4H2O
65℃
FeSO4·H2O
由此可见,为了防止溶解度较小的白色FeSO4·H2O析出,在金属与酸作用及在溶液浓缩过程中温度不宜过高,且在蒸发浓缩时,应保持溶液呈较强的酸性(PH<1,以防止FeSO4在弱酸性溶液中被氧化生成黄色的碱式盐Fe(OH)SO4。
将等物质的量的FeSO4和(NH4)2SO4溶液混合,可以制得溶解度较小的硫酸亚铁铵复盐(NH4)2SO4·FeSO4·6H2O,它比一般的亚铁盐稳定,在空气中不易被氧化。
[注意事项]
1、配制(NH4)2SO4饱和溶液时,必须用无氧蒸馏水,以防其中的O2将Fe2+氧化为Fe3+
而变黄,得不到好的产品。
2、注意控制酸度为强酸性,PH<2。
3、为了得到较好的晶体,在蒸发浓缩时,不宜用玻棒过分地搅动,即尽量保持结晶膜的
存在。