蔗糖磷酸合成酶(Sucrose phosphate synthase,SPS)试剂盒使用说明
- 格式:pdf
- 大小:68.46 KB
- 文档页数:3
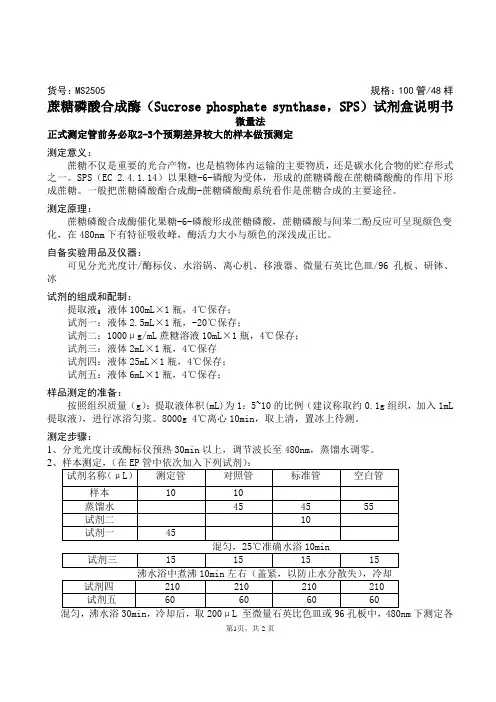
货号:MS2505 规格:100管/48样蔗糖磷酸合成酶(Sucrose phosphate synthase,SPS)试剂盒说明书微量法正式测定管前务必取2-3个预期差异较大的样本做预测定测定意义:蔗糖不仅是重要的光合产物,也是植物体内运输的主要物质,还是碳水化合物的贮存形式之一。
SPS(EC 2.4.1.14)以果糖-6-磷酸为受体,形成的蔗糖磷酸在蔗糖磷酸酶的作用下形成蔗糖。
一般把蔗糖磷酸酯合成酶-蔗糖磷酸酶系统看作是蔗糖合成的主要途径。
测定原理:蔗糖磷酸合成酶催化果糖-6-磷酸形成蔗糖磷酸,蔗糖磷酸与间苯二酚反应可呈现颜色变化,在480nm下有特征吸收峰,酶活力大小与颜色的深浅成正比。
自备实验用品及仪器:可见分光光度计/酶标仪、水浴锅、离心机、移液器、微量石英比色皿/96孔板、研钵、冰试剂的组成和配制:提取液:液体100mL×1瓶,4℃保存;试剂一:液体2.5mL×1瓶,-20℃保存;试剂二:1000μg/mL蔗糖溶液10mL×1瓶,4℃保存;试剂三:液体2mL×1瓶,4℃保存试剂四:液体25mL×1瓶,4℃保存;试剂五:液体6mL×1瓶,4℃保存;样品测定的准备:按照组织质量(g):提取液体积(mL)为1:5~10的比例(建议称取约0.1g组织,加入1mL 提取液),进行冰浴匀浆。
8000g 4℃离心10min,取上清,置冰上待测。
测定步骤:1、分光光度计或酶标仪预热30min以上,调节波长至480nm,蒸馏水调零。
2下测定各第1页,共2页管吸光值。
标准管和空白管只要做一管。
每个测定管需要设一个对照管。
SPS活力单位的计算:1、按照蛋白浓度计算单位定义:每mg组织蛋白每分钟催化产生1μg 蔗糖定义为一个酶活力单位。
SPS活性(μg /min/mg prot)= C标准管×V1×(A测定管-A对照管)÷(A标准管-A空白管)÷(V1×Cpr)÷T=100×(A测定管-A对照管)÷(A标准管-A空白管)÷Cpr2、按照样本鲜重计算单位定义:每g组织每分钟催化产生1μg 蔗糖定义为一个酶活力单位。

蔗糖合成和分解的生理学机制蔗糖是一种重要的糖类,在植物体内起着储备能量的作用。
其合成和分解的生理学机制是经过长期研究探索的。
本文将从植物体内蔗糖合成和分解的途径、调节机制以及相关生理过程等方面对此进行论述。
一、蔗糖的合成途径植物体内蔗糖的合成途径主要有两种:第一种是通过光合作用中产生的三碳糖物质(三磷酸甘油)和五碳糖物质(核糖酸)经过反应合成;第二种是由葡萄糖和果糖两种单糖物质经过反应合成。
在光合作用过程中,蔗糖的合成是一个复杂的过程,涉及到多种酶类、物质和能量等。
首先,光合作用形成的三碳糖物质经过一系列反应步骤,在叶绿体内被转化为六碳糖物质(葡萄糖-6-磷酸)。
然后,在细胞色素质内,葡萄糖-6-磷酸被磷酸化成为葡萄糖-1-磷酸。
接着,葡萄糖-1-磷酸经过一系列反应步骤被转化为UDP 葡糖,然后与果糖合成蔗糖。
另一方面,在非光合作用时,外源性葡萄糖和果糖也可以合成蔗糖。
这个过程涉及到蔗糖合成的关键酶Sucrose Phosphate Synthase (SPS)和Sucrose Phosphate Phosphatase (SPP)等多个酶类的参与。
除了光合作用和非光合作用合成蔗糖外,还有植物体内提供能量的一些物质(例如阳离子等)均可参与蔗糖的合成过程。
二、蔗糖分解的途径蔗糖在植物体内被分解为葡萄糖和果糖两种单糖,这种过程被称为蔗糖的水解过程。
蔗糖的分解途径多样,但其中最主要的途径包括4种主要酶的参与:Sucrose Synthase (SUS)、Invertase (INV)、Sucrose Phosphatase (SPP)和Sucrose Phosphate Synthase (SPS)。
在蔗糖分解过程中,SUS是首先起作用的酶。
它将水分子加入蔗糖分子中的缺口,产生葡萄糖和果糖分子。
INV则能将蔗糖分子中的阴离子和阳离子反转,产生两种单糖物质。
SPP和SPS在蔗糖分解过程中的作用相对较小,但也起着关键作用。

核农学报2023,37(12):2349~2360Journal of Nuclear Agricultural Sciences金柑磷酸蔗糖磷酸酶的基因克隆、表达与蛋白结构分析龙凌云黄秋岚黄秋伟檀小辉李慧敏刘功德单彬毛立彦 *(广西壮族自治区亚热带作物研究所/农业农村部亚热带果品蔬菜质量安全控制重点实验室/广西亚热带特色水果质量安全控制重点实验室,广西南宁530001)摘要:磷酸蔗糖磷酸酶(SPP)是植物蔗糖生物合成最后一步催化反应的关键酶,对调控植物生长发育不同时期的蔗糖合成过程有重要作用。
为探索金柑(Fortunella crassifiolia Swingle)SPP基因及其编码蛋白的序列特征及其在果实发育过程的表达特性,本研究以四倍体品种脆蜜金柑(F. crassifiolia Swingle cv. Cuimi)为试验材料,采用反转录PCR和cDNA末端快速克隆(RACE)方法从金柑果肉中克隆SPP基因,对其进行生物信息学和原核表达分析,并检测果实发育不同时期该基因在果肉中的表达量。
结果表明,FcSPP基因的cDNA序列全长1 638 bp,最长开放阅读框(ORF)为1 191 bp,编码396个氨基酸,理论等电点为6.57,为稳定的亲水性蛋白,二级结构主要由α-螺旋和无规则卷曲组成。
FcSPP蛋白含有S6PP和S6PP_C保守结构域,属于植物磷酸蔗糖磷酸酶家族成员。
系统进化分析结果显示,FcSPP蛋白与甜橙SPP同源性最高,在进化树上与拟南芥等双子叶植物SPP划归为一类。
此外,本研究构建了FcSPP基因的原核表达载体,诱导表达获得纯化的FcSPP蛋白,分子量鉴定为45.96 kDa。
定量分析结果表明,脆蜜金柑果实发育4个时期FcSPP基因相对表达量呈逐步上升趋势,果实膨大期、成熟期的果肉组织中该基因表达量显著高于初果期和生长期(P<0.05)。
本研究为解析金柑果实蔗糖生物合成的分子机制及调控蔗糖生物合成相关基因的研究提供了理论基础。

蔗糖代谢通路及其在工业应用中的作用蔗糖是一种重要的能源来源,不仅在人类食品生产中广泛使用,而且在工业生产中也有多种应用。
蔗糖代谢通路是指植物将光合产物转化为蔗糖的过程,在有机化学合成中也有着重要的应用。
本文将探讨蔗糖代谢通路的基本原理、应用以及发展前景。
一、蔗糖代谢通路的基本原理蔗糖代谢通路是一种复杂多样的生物转化过程,包括蔗糖的合成、降解、运输和调节等环节。
光合作用是蔗糖代谢的主要来源,光合作用产生的光合产物通过光合产物转运系统运输到叶鞘或根部。
在叶鞘或根部中,所得的光合产物被转化为蔗糖或淀粉,以存储或运输到其他部位。
蔗糖代谢通路中的关键酶主要有:1. 蔗糖合成酶(Sucrose synthase,SuSy):催化蔗糖分子的合成,将蔗糖合成为葡萄糖和果糖的组合物。
2. 蔗糖磷酸酶(Sucrose phosphate synthase,SPS):催化蔗糖-6-磷酸的合成,是蔗糖合成路径的限速酶,其活性和叶绿素含量、强度和光照质量等相关。
3. 蔗糖酶(Sucrase,SUC):催化蔗糖在水中被水解成为葡萄糖和果糖。
二、蔗糖代谢通路在工业应用中的作用1. 食品制造蔗糖是人们常见的糖类成分之一,被广泛应用于食品制造业。
蔗糖以其独特的甜味及具有润滑作用而广泛用于糖果制造、饮料、面包、脆饼干、糕点等食品中。
在生产糖果时,不同种类的糖的混合比例对糖果口感有着极大的影响。
而蔗糖代谢通路的糖分合成和分解过程,为蔗糖生产和改良提供了理论基础和方法途径。
2. 酵母生产蔗糖代谢通路在酵母发酵过程中也扮演着重要的角色。
酵母发酵液中蔗糖浓度的控制,常常直接影响发酵液体积、产气率、发酵时间以及生产过程中酒精、二氧化碳等物质的量和质的产生。
因此,蔗糖代谢通路与酵母的生产密切相关。
3. 医学保健植物蔗糖代谢通路对人体的健康有着很大的影响。
人体内能够改善肝脓肿和胰腺癌等疾病的胰岛素分泌,具有降低胆固醇、消除自由基的功效;而肠道中的多糖酶能够分解蔗糖,帮助人类吸收多糖,并产生有益的短链脂肪酸、腺苷酸等物质,对于保持肠道健康也有着重要的保健作用。

蔗糖合成酶(SS)和蔗糖磷酸合成酶(SPS)活性测定蔗糖是重要的光合产物,为植物体内运输的主要物质,又是碳水化合物的暂贮形式之一。
蔗糖合成酶(SS)、蔗糖磷酸合成酶(SPS)是植物体内催化其合成的两种酶。
这两种酶在生物体内的功能有所不同。
蔗糖合成酶(SS)以游离果糖为受体,蔗糖磷酸合成酶(SPS)以果糖-6-磷酸为受体。
后者形成的蔗糖磷酸,在蔗糖磷酸合成酶的作用下形成蔗糖。
一般把蔗糖磷酸酯合成酶-蔗糖磷酸酶系统看作是蔗糖合成的主要途径,而把蔗糖合成酶看作是蔗糖分解或形成核苷酸葡萄糖的系统。
UDPG是合成蔗糖的葡萄糖供体,故催化UDPG合成的UDPG焦磷酸化酶活力的高低与蔗糖合成的速率有十分密切的关系。
蔗糖的合成(二条途径):1、蔗糖合成酶(非光合组织)UDPG+果糖→蔗糖+UDP2、磷酸蔗糖合成酶(光合组织)UDPG+F-6-P→磷酸蔗糖+UDP磷酸蔗糖+H2O→蔗糖+Pi一、仪器设备1、冷冻离心机2、恒温水浴3、分光光度计4、研钵一套5、磁力搅拌器6、天平(感量0.01mg)7、移液管:0.1ml、0.5ml、1ml、5ml各一支8、试管:10ml具塞试管10支9、5ml两瓶:一个10、冰箱二、试剂1、提取缓冲液(200mmol/L hepes-NoaH缓冲液,含5mmol/LMgCl2,0.1%DTT,0.05%Triton-X100,0.05%(W/V)BSA,2%PVP,1mmol/LEDTA,1mmol/LEGTA,10mmol/L抗坏血酸钠,10mmol/L半胱氨酸-盐酸和2%甘油,pH=7.5)2、透析缓冲液(20 mmol/LHepes-NaOH,内含0.25 mmol/LMgCl2, 1 mmol/LEDTA, 1 mmol/LEGTA, 0.01%DTT, 0.05% BSA, 0.2%甘油, pH7.5)3、转化酶提取液(200mmol/L磷酸钾缓冲液,5mmol/LMgC12,0.1%B-疏基乙醇,0.05%Triton-X100,0.05%BSA,2%PVP,pH=7.5)4、转化酶透析液(20mmol/L磷酸钾缓冲液,0.25mmol/LMgC12,0.01%B-琉基乙醇,0.05%BSA,PH=7.5)5、SS合成方向酶反应液:hepes-NaOH缓冲液 (PH=8.5),5mmol/LDTT,5mmol/LNaF,100mmol/L 果糖,15mmol/LUDPG6、SS分解方向酶反应液:80mmol/LMes缓冲液(P H =5.5),5mmol/LNaF,100mmol/L蔗糖,5mmol/LUDP7、SPS酶反应液:50mmol/Lhepes-NooH缓冲液(PH=7.5),15mmol/LMgC12,1mmol/LEDTA,5mmol/LNaF,16mmol/LUDPG,4mmol/LF-6-P,20mmol/LG-6-P8、0.1%间苯二酚:称取0.1g间苯二酚溶解并定溶于100ml95%乙醇中,棕色瓶保存。

不同甜高粱品种蔗糖合成酶、蔗糖磷酸合成酶活性与糖分积累的关系作者:李春阳胡瑞芳张馨月来源:《江苏农业科学》2016年第11期摘要:以12个品种的甜高粱为材料,测定其叶片和茎秆在4个主要生长时期的可溶性糖含量以及蔗糖合成酶(sucrose syhthase,简称SS)和蔗糖磷酸合成酶(sucrose phosphate synthase,简称SPS)的活性变化,对2种酶的活性以及酶活性与可溶性糖含量之间的相关性进行分析,以了解甜高粱体内蔗糖合成酶和蔗糖磷酸合成酶对糖积累的影响。
结果表明:在整个生长时期中,可溶性总糖含量不断提高,成熟期达到最大值。
同一时期,茎秆中的2种酶活力大于叶片中的酶活力,在前期,2种酶活力差异不明显,但在生长后期,相同部位的SS活性要大于SPS活性。
叶片中可溶性糖含量与SS活性呈极显著正相关(r=0.913,P关键词:甜高粱;蔗糖合成酶(SS);蔗糖磷酸合成酶(SPS );酶活力;糖分积累中图分类号:S514.01 文献标志码: A文章编号:1002-1302(2016)11-0139-03甜高粱[Sorghum bicolor(L.) Moench]别称糖高粱,属于禾本科高粱属,是普通粒用高粱的一个变种[1],具有光合效率高、糖分积累快、生物量大、适应性广、抗逆性强等优点[2-3]。
近年来,甜高粱已成为世界上的一种新型的饲料、糖料和能源作物[4],引起了许多国家的广泛重视,受到积极研究并大力推广[5]。
研究甜高粱茎秆中可溶性糖含量及其相关酶活性的变化对高粱的改良、利用和开发具有很重要的意义。
在高等植物中,参与糖代谢相关的酶主要有蔗糖合成酶(sucrose synthase,简称SS)和蔗糖磷酸合成酶(sucrose phosphate synthase,简称SPS )等,二者含量的变化直接影响糖的合成[6]。
SPS活性影响光合产物在淀粉与蔗糖之间的分配,主要调节蔗糖的合成[7]。

蔗糖是重要的光合产物,是植物体内运输的主要物质,优势碳水化合物的暂贮形式之一。
蔗糖合成酶(SS)、蔗糖磷酸合成酶(SPS)是植物体内催化蔗糖合成的两种酶。
对这两种酶活性的测定,可以了解植物组织合成蔗糖能力的高低。
【实验原理】蔗糖合成酶催化游离果糖与葡萄糖工体UDPG反应生成蔗糖。
UDPG+果糖---蔗糖+UDP这是一个可逆反应,平衡常数为1.3-2.0。
该酶在分解方向的Km值相对较高(30-150mmol/L),细胞中高的蔗糖浓度有利于反应向分解方向进行。
蔗糖合成酶活性测定既可在合成方向进行测定(外加底物UDPG和果糖,测产物蔗糖的量表示酶活性),也可以在分解方向进行测定(外加蔗糖和UPD,测定果糖含量表示酶活性)。
蔗糖磷酸合成酶(SPS)催化UDPG与果糖-6-磷酸(F6P)结合形成磷酸蔗糖:UPDG+F6P---蔗糖-6-P+UDP+H+6-磷酸蔗糖可以经磷酸蔗糖酶(SPP)水解后形成蔗糖。
实际上最近有证据证明SPS 和SPP可以在体内形成一个复合体,因此使得SPS催化的反应基本上是不可逆的。
酶活性测定是外加UDPG和F6P,测定产物蔗糖的量表示酶活性。
一般把SPS-SPP系统看作是蔗糖合成的主要途径,而把蔗糖合成酶看作是催化蔗糖分解的。
果糖是酮糖,可与间苯二酚混合加热反应生成红色产物,在一定范围内糖的含量与反应液颜色成正比。
蔗糖在含有盐酸的间苯二酚中水解成葡萄糖和果糖,也能生成红色产物,在480nm处可比色测定。
【实验材料】植物茎【仪器设备及设备】冷冻离心机,恒温水浴,分光光度计,研钵一套,磁力搅拌器,天平(感量0.01mg),0.1、0.5、1、5ml移液管各1个,10ml具塞试管10支,5ml量瓶一个,冰箱【试剂药品】1.提取缓冲液:100mmol/L Tris-HCl(PH7.0)缓冲液,内含5mmol/LMgCl 2,2mmol/LEDTA-Na 2,2%乙二醇,0.2%牛血清蛋白(BSP),2%PVP,5mmol/LDTT。

甘蔗的蔗糖合成与糖代谢途径甘蔗作为一种经济作物,被广泛种植和利用。
其主要产品之一就是蔗糖。
甘蔗中的蔗糖合成与糖代谢途径是许多研究者关注的重点。
本文将就甘蔗蔗糖的合成与糖代谢途径进行探讨。
首先,我们来了解一下甘蔗中蔗糖的合成过程。
甘蔗中蔗糖的合成主要是通过光合作用和炭水化合物的代谢来完成的。
在光合作用中,甘蔗通过叶绿素吸收太阳光能,将二氧化碳和水转化为葡萄糖。
葡萄糖是合成蔗糖的原料之一。
在甘蔗中,蔗糖合成的关键酶是蔗糖磷酸合成酶(Sucrose phosphate synthase,SPS)。
SPS是一种亲合Krebs磷酸途径和蔗糖磷酸代谢的酶,它促进了蔗糖的合成。
蔗糖磷酸合成酶可以催化果糖-6-磷酸和UDP葡萄糖之间的反应,产生葡萄糖-6-磷酸和蔗糖-6-磷酸。
而蔗糖-6-磷酸经过一系列的反应,最终生成了蔗糖。
此外,甘蔗中还有一种重要的酶——蔗糖合成酶(Sucrose synthase,SuSy)。
蔗糖合成酶与SPS协同作用,参与蔗糖的合成过程。
它能够催化UDP葡萄糖和蔗糖-6-磷酸之间的反应,形成蔗糖和UDP,其中UDP是可再生的。
蔗糖合成酶在甘蔗中起到了重要的调控作用,它能够影响蔗糖的合成速率和分布。
在甘蔗的糖代谢途径中,除了蔗糖合成过程外,还存在着蔗糖分解的途径。
当甘蔗需要能量时,蔗糖会被分解成葡萄糖和果糖。
这个过程主要依赖于蔗糖酶(invertase)、果糖苷酶(fructosidase)和酵素蔗糖磷酸水解酶(sucrose phosphorylase)等。
这些酶能够将蔗糖分解成其组成的单糖,以供能量代谢。
此外,在甘蔗中还存在着糖原的合成和分解过程。
当甘蔗中储存的蔗糖过多时,它会被转化成糖原,以减少过多的蔗糖对植物的影响。
糖原是由葡萄糖组成的多糖,在植物细胞内起储存能量的作用。
总结来说,甘蔗的蔗糖合成与糖代谢途径是一个复杂的过程,涉及到多种酶的协同作用。
蔗糖合成的关键酶包括蔗糖磷酸合成酶(SPS)和蔗糖合成酶(SuSy),它们通过调节蔗糖的合成速率和分布来影响甘蔗的生长和发育。

作物学报ACTA AGRONOMICA SINICA 2018, 44(2): 197 207/ISSN 0496-3490; CN 11-1809/S; CODEN TSHPA9E-mail: xbzw@ DOI: 10.3724/SP.J.1006.2018.00197甘蓝型油菜蔗糖磷酸合酶(SPS)基因家族成员鉴定及表达分析张莉**荐红举**杨博张翱翔张超杨鸿张立源刘列钊徐新福卢坤李加纳*西南大学农学与生物科技学院, 重庆 400715摘要: 蔗糖磷酸合酶(sucrose phosphate synthase, SPS)是调控植物蔗糖合成的限速酶, 对光合产物的转运和积累有重要影响。
利用拟南芥SPS蛋白保守结构域在甘蓝型油菜基因组数据库鉴定出11个甘蓝型油菜SPS基因家族成员,根据系统进化分析将其分成A、B和C共3个亚家族。
基因结构预测表明, SPSC-1有5个外显子, 其他SPS基因均有11~15个外显子。
顺式作用元件分析表明, 油菜SPS基因除含基本的启动子保守元件外, 还含有许多与逆境和激素响应相关的顺式作用元件。
实时荧光定量PCR结果表明, BnSPSA1在花中表达量最高, BnSPSA2在各组织中均有不同程度的表达, BnSPSB只在叶、蕾和花中表达, BnSPSC在叶中表达量最高, 在蕾和花中有少量表达而在其他组织中基本不表达, 说明SPS基因在甘蓝型油菜中的表达具有明显的组织特异性; BnSPSA1和BnSPSC在高生物产量油菜叶片中的表达高于低生物产量油菜, BnSPSB则在低生物产量油菜中的表达量更高, 说明SPS基因与油菜生物产量密切相关。
本研究为油菜SPS基因的功能研究和利用奠定了基础。
关键词:甘蓝型油菜; 蔗糖磷酸合酶; 全基因组鉴定; 表达分析Genome-wide Analysis and Expression Profiling of SPS Gene Family in Bras-sica nupus L.ZHANG Li**, JIAN Hong-Ju**, YANG Bo, ZHANG Ao-Xiang, ZHANG Chao, YANG Hong, ZHANG Li-Yuan, LIU Lie-Zhao, XU Xin-Fu, LU Kun, and LI Jia-Na*College of Agronomy and Biotechnology, Southwest University, Chongqing 400715, ChinaAbstract: Sucrose phosphate synthase (SPS) is the rate-limiting enzyme that controls the sucrose biosynthesis in plants and has great influence on transportation and accumulation of photosynthate. In this study, we identified 11 members of the SPS gene family in the oilseed rape (Brassica nupus L.) genome. These SPS genes were classed into clusters A, B, and C according to gene structure and phylogenetic relationship. Gene structure prediction indicated that BnSPS genes were highly conserved, in which BnSPSC-1 consisted five exons and others consisted 11–15 exons. Promoter cis-element analysis indicated that BnSPS genes had not only essential responsive elements but also some types of elements potentially responsive to stresses or hormone responses. The qRT-PCR assay showed tissue-specific expressions of BnSPS genes with rich expressions of BnSPSA1 in flower, BnSPSBin leaf, bud and flower, BnSPSC in leaf, and BnSPSA2 in various tissues. The relative expression levels of BnSPSA1 and BnSPSC were higher in high-biomass rapeseed varieties than in low-biomass rapeseed varieties, whereas, that of BnSPSB was higher in low-biomass rapeseed varieties, suggesting that SPS genes are closely ralated to biological yield of rapeseed. This study provides basic information for functional study and utilization of BnSPS genes.本研究由国家自然科学基金项目(U1302266), 国家科技支撑计划项目(2013BAD01B03-12), 国家现代农业产业技术体系建设专项(CARS-13), 重庆市社会事业与民生保障科技创新专项(cstc2016shms-ztzx80020)和重庆市研究生科研创新项目(CYS16082)资助。

第六章同化物的运输、分配及信号的传导(一)名词解释源(source) 即代谢源,是产生或提供同化物的器官或组织,如功能叶、萌发种子的子叶或胚乳。
库(sink) 即代谢库,是指消耗或积累同化物的器官或组织,如根、茎、果实、种子等。
共质体运输(symplastic transport) 物质在共质体中的运输称为共质体运输。
质外体运输(apoplastic transport) 物质在质外体中的运输称为质外体运输。
P蛋白(P-protein)即韧皮蛋白,位于筛管的内壁,当韧皮部组织受到损伤时,P-蛋白在筛孔周围累积并形成凝胶,堵塞筛孔以维持其他部位筛管的正压力,同时减少韧皮部内运输的同化物的外流。
转移细胞(transfer cells)在共质体-质外体交替运输过程中起转运过渡作用的特化细胞。
它的细胞壁及质膜内突生长,形成许多折叠片层,扩大了质膜的表面积,从而增加溶质内外转运的面积,能有效地促进囊泡的吞并,加速物质的分泌或吸收。
比集转运速率(specific mass transfer rate, SMTR) 单位时间单位韧皮部或筛管横切面积上所运转的干物质的数量。
韧皮部装载(phloem loading) 同化物从合成部位通过共质体或质外体胞间运输,进入筛管的过程。
韧皮部卸出(phloem unloading) 同化物从筛管分子-伴胞复合体进入库细胞的过程。
空种皮技术(empty seed coat technique,empty-ovule technique) 切除部分豆荚壳和远种脐端的半粒种子,并去除另半粒种子的胚性组织,制成空种皮杯。
短时间内,空种皮杯内韧皮部汁液的收集量与种子实际生长量相仿,此法适用于研究豆科植物的同化物运输。
源库单位(source-sink unit) 在同化物供求上有对应关系的源与库合称为源-库单位。
源强和库强源强(source strength)是指源器官同化物形成和输出的能力;库强 (sink strength) 是指库器官接纳和转化同化物的能力。

蔗糖磷酸合成酶(SPS)基因克隆与表达研究进展作者:路海博孙元元汤海港张蕴薇来源:《热带农业科学》2014年第11期摘要蔗糖是植物中重要的代谢产物,它直接或间接参与多种生理生化反应,研究其含量的变化规律对提高植物生物学产量和增强植物抗逆性具有重要的指导意义。
蔗糖磷酸合成酶(SPS)是蔗糖代谢的关键酶之一,它催化蔗糖代谢中的限速反应,SPS基因在分子水平编码调控SPS。
研究SPS基因克隆与表达规律是从分子水平揭示蔗糖代谢的基础。
本文综述了近年来SPS基因克隆和表达研究进展,并展望了SPS基因的研究前景和应用前景。
关键词蔗糖;蔗糖磷酸合成酶基因;克隆;表达分类号 Q943.2蔗糖是高等植物光合作用的主要产物[1],是碳运输的主要形式,也是“库”代谢的主要基质,蔗糖转移效率[2]直接决定植物生长快慢;蔗糖参与植物渗透调节,环境胁迫下植物会大量合成蔗糖,提高细胞液浓度,阻止细胞质过度失水;蔗糖通过反馈作用调节一些酶的活性,也可作为信号因子诱导或阻碍某些基因的表达。
与蔗糖代谢相关的酶[3-4]有蔗糖磷酸合成酶(sucrose phosphate synthetase, SPS)、蔗糖合成酶(sucrose synthetase, SuSy)和转化酶(invertase, INV)。
在这3种蔗糖代谢酶中,SPS是最重要的限速酶,它直接调控植物中蔗糖和淀粉的合成与分配,是催化蔗糖合成的主要酶[5]。
植物体内蔗糖的积累与SPS活性正相关。
已有研究表明,蔗糖是甜高粱[6]茎秆中糖分积累的主要形式,约占总含糖量的85%。
甜高粱茎秆蔗糖含量与叶SPS蛋白质的表达相关系数为0.895,与茎秆SPS蛋白质的表达相关系数为0.781。
比较高梁和甜高粱,随着高粱的生长发育,SPS-A在茎秆中的表达不断增强,与蔗糖积累增加趋势一致。
在生长后期,甜高粱茎秆中SPS-A表达量明显高于普通高粱,这可能就是甜高粱蔗糖丰富积累的关键,表明高粱茎秆蔗糖积累[7]与SPS-A在茎秆中的表达相关。
甘蔗蔗糖磷酸合成酶SPSⅢ基因表达分析黄诚梅;杨翠芳;魏源文;邓智年;吴凯朝;曹辉庆;李杨瑞【期刊名称】《江苏农业科学》【年(卷),期】2018(046)002【摘要】为探讨蔗糖磷酸合成酶(sucrose phosphate synthase,简称SPS)对甘蔗糖分代谢的重要影响,以4个甘蔗品种桂糖28号(GT28)、果蔗Badila、新台糖20号(ROC20)、新台糖22号的+1、0叶(最高可见肥厚带的第1张完全展开叶为+1叶,自下而上位于+1叶之上的为0叶)、幼嫩叶鞘、幼茎等部位为材料,采用半定量RT-PCR技术分析甘蔗蔗糖磷酸合成酶基因(简称SPSⅢ)在工艺成熟期不同部位中的表达情况.结果表明,在工艺成熟期间,SPSⅢ在4个甘蔗基因型的+1、0叶、幼嫩叶鞘和幼茎中均有表达,表达量因基因型及测定部位与时期不同而不同;在工艺成熟初期,以GT28的4个部位较其他3个品种的低,而在果蔗Badila的4个部位中表达较稳定,在ROC20中以嫩叶鞘表达最高,而在ROC22中以幼茎表达最高,在工艺成熟中期,SPSⅢ在4个甘蔗基因型中的+1、0叶、幼嫩叶鞘和幼茎中的表达较初期没有明显差异;在工艺成熟后期,SPSⅢ在4个甘蔗基因型中的+1、0叶、幼嫩叶鞘和幼茎中的表达较前2个时期迅速提高,均达到了较高的表达水平.【总页数】4页(P17-20)【作者】黄诚梅;杨翠芳;魏源文;邓智年;吴凯朝;曹辉庆;李杨瑞【作者单位】广西作物遗传改良生物技术重点开放实验室,广西南宁530007;广西作物遗传改良生物技术重点开放实验室,广西南宁530007;中国农业科学院甘蔗研究中心/农业部广西甘蔗生物技术与遗传改良重点实验室,广西南宁530007;广西作物遗传改良生物技术重点开放实验室,广西南宁530007;中国农业科学院甘蔗研究中心/农业部广西甘蔗生物技术与遗传改良重点实验室,广西南宁530007;中国农业科学院甘蔗研究中心/农业部广西甘蔗生物技术与遗传改良重点实验室,广西南宁530007;广西作物遗传改良生物技术重点开放实验室,广西南宁530007;广西作物遗传改良生物技术重点开放实验室,广西南宁530007;中国农业科学院甘蔗研究中心/农业部广西甘蔗生物技术与遗传改良重点实验室,广西南宁530007【正文语种】中文【中图分类】S566.101【相关文献】1.甘蔗蔗糖磷酸合成酶基因SPS IV电子克隆及生物信息学分析2.甘蔗脱毒健康种苗蔗糖磷酸合成酶基因差异表达分析3.甘蔗脱毒健康种苗蔗糖磷酸合成酶基因差异表达分析4.甘蔗DⅢ家族蔗糖磷酸合成酶基因SofSPSDⅢ克隆及其hpRNA载体构建5.甘蔗DⅢ家族蔗糖磷酸合成酶基因SofSPSDⅢ克隆及其hpRNA载体构建因版权原因,仅展示原文概要,查看原文内容请购买。
植物蔗糖合成的分子机制植物蔗糖是一种由植物合成并用作能量和储存碳的重要的二糖。
它由葡萄糖和果糖的缩合反应得到。
植物蔗糖的合成分子机制是一个复杂的过程,涉及多个酶的参与。
首先,葡萄糖-1-磷酸(G1P)是植物合成蔗糖的出发物质,它可以通过磷酸葡萄糖同途径(PGI)的反应获得。
在PGI中,葡萄糖-6-磷酸(G6P)经过金属离子和金属酶的催化作用形成葡萄糖-1,6-磷酸(G1,6P)。
接着,G1,6P通过磷酸去羧化作用由磷酸解磷酸葡萄糖异构酶(PGI)转化为葡萄糖-1-磷酸。
此外,还有一些其他的酶也能催化G6P转化为G1,6P,如类似PGI的酶磷酸异构酶(PGI2)。
其次,蔗糖的合成是由两个酶,即蔗糖磷酸合成酶(SPS)和蔗糖合成酶(SUS)参与的。
蔗糖磷酸合成酶 (SPS)是一种重要的限速酶,它将G1P和尿酸三磷酸(UTP)连接起来形成UDP葡萄糖(UDP-Glc),同时生成无机磷酸 (Pi)。
接着,UDP-Glc通过蔗糖合成酶 (SUS)的作用与果糖缩合,生成蔗糖和UDP。
蔗糖合成酶 (SUS)是一种可逆酶,它催化反应的方向决定了蔗糖是否被合成或降解。
当蔗糖浓度较高时,反应会往蔗糖合成方向进行;而当蔗糖浓度较低时,反应会往蔗糖降解方向进行。
此外,蔗糖的合成还受到其他因素的调控。
例如,植物光合作用的光能将被转化为化学能,通过光合有助于提供合成蔗糖所需的高能量原料。
另外,一些基因调控也能影响植物蔗糖的合成,如座子元件的结合,转录因子的启动以及一系列酶的表达。
总的来说,植物蔗糖的合成分子机制是一个复杂且精细调控的过程。
它涉及到多个酶的参与,如PGI、PGI2、SPS和SUS;同时光合作用和基因调控也对蔗糖的合成起着重要的调控作用。
该分子机制不仅有助于我们理解植物的养分代谢和能量平衡,还为农业生产和植物生物工程的相关应用提供了理论基础。
蔗糖磷酸合成酶研究的新进展
周平;叶冰莹;陈由强;陈如凯
【期刊名称】《生物技术通讯》
【年(卷),期】2006(17)6
【摘要】蔗糖磷酸合成酶(sucrose phosphate synthase,SPS)是高等植物体内控制蔗糖合成的调节和磷酸化修饰在酶水平调节蔗糖合成.本文简要介绍SPS家族的成员、SPS蛋白上的3个磷酸化位点,以及SPS的生物学功能、SPS与磷酸蔗糖磷酸酶的关系等.
【总页数】3页(P1001-1003)
【作者】周平;叶冰莹;陈由强;陈如凯
【作者单位】福建师范大学,生命科学学院,福建,福州,350007;农业部甘蔗生理生态与遗传改良重点开放实验室,福建,福州,350002;福建师范大学,生命科学学院,福建,福州,350007;福建师范大学,生命科学学院,福建,福州,350007;农业部甘蔗生理生态与遗传改良重点开放实验室,福建,福州,350002;农业部甘蔗生理生态与遗传改良重点开放实验室,福建,福州,350002
【正文语种】中文
【中图分类】Q559;Q946
【相关文献】
1.干旱胁迫下菊芋蔗糖磷酸合成酶及转化酶活性变化规律研究 [J], 刘素英;赵孟良;王丽慧;孙雪梅;李屹;李莉
2.蔗糖磷酸合成酶基因在作物上的应用研究进展 [J], 陈志彤;王俊宏;陈恩;黄毅斌;林永生
3.蔗糖磷酸合成酶(SPS)基因克隆与表达研究进展 [J], 路海博;孙元元;汤海港;张蕴薇
4.异源表达番茄蔗糖磷酸合成酶基因SlSPS促进拟南芥株型增大研究 [J], 刘雅慧;朱龙英;杨学东;朱为民;张辉;张迎迎
5.甘蔗蔗糖磷酸合成酶研究进展 [J], 刘洪博;陆鑫;毛钧;苏火生;林秀琴;徐超华;李旭娟;蔡青
因版权原因,仅展示原文概要,查看原文内容请购买。
甘蔗蔗糖磷酸合成酶研究进展刘洪博;陆鑫;毛钧;苏火生;林秀琴;徐超华;李旭娟;蔡青【期刊名称】《湖南农业大学学报:自然科学版》【年(卷),期】2013(0)S1【摘要】甘蔗是世界上重要的糖料作物,是食品加工的主要原料,而蔗糖磷酸合成酶(sucrose phosphate synthase,SPS)是甘蔗体内蔗糖合成的关键酶之一,对甘蔗中蔗糖的合成、积累和抗逆性起着重要的作用。
介绍蔗糖磷酸合成酶在甘蔗蔗糖代谢中的作用和SPS家族基因的克隆、分类、表达活性和功能,分析SPS基因在甘蔗不同种中的单核苷酸位点突变、插入、缺失和氨基酸变异情况,期望为甘蔗蔗糖磷酸合成酶的进一步研究提供参考。
【总页数】6页(P31-36)【关键词】甘蔗;蔗糖磷酸合成酶;研究进展【作者】刘洪博;陆鑫;毛钧;苏火生;林秀琴;徐超华;李旭娟;蔡青【作者单位】云南省农业科学院甘蔗研究所;云南省甘蔗遗传改良重点实验室;云南省农业科学院生物技术与种质资源研究所【正文语种】中文【中图分类】S566.1【相关文献】1.甘蔗蔗糖磷酸合成酶基因SPS IV电子克隆及生物信息学分析 [J], 吴小斌;端木卜文;齐永文;卢颖林;李奇伟2.甘蔗蔗糖磷酸合成酶SPSⅢ基因表达分析 [J], 黄诚梅;杨翠芳;魏源文;邓智年;吴凯朝;曹辉庆;李杨瑞3.甘蔗脱毒健康种苗蔗糖磷酸合成酶基因差异表达分析 [J], 王俊刚;赵婷婷;杨本鹏;王文治;冯翠莲;曾军;熊国如;张树珍;4.甘蔗蔗糖磷酸合成酶磷酸化位点的突变及相应表达载体的构建 [J], 胡巍;张积森;叶冰莹;陈由强;陈如凯5.蔗糖代谢中蔗糖磷酸合成酶(SPS)的研究进展 [J], 刘凌霄;沈法富;卢合全;韩庆点;刘云国因版权原因,仅展示原文概要,查看原文内容请购买。
蔗糖磷酸合成酶(Sucrose phosphate synthase,SPS)试剂盒使用说明
分光光度法货号:BC0600
规格:50管/24样
产品内容:
提取液:液体60mL×1瓶,4℃保存;
试剂一:液体4mL×1瓶,-20℃保存;
试剂二:1000μg/mL蔗糖溶液10mL×1瓶,4℃保存;
试剂三:液体3mL×1瓶,4℃保存;
试剂四:液体40mL×1瓶,4℃保存;
试剂五:液体10mL×1瓶,4℃保存;
产品简介:
蔗糖不仅是重要的光合产物,也是植物体内运输的主要物质,还是碳水化合物的贮存形式之一。
蔗糖磷酸合成酶(SPS)以果糖-6-磷酸为受体,形成的蔗糖磷酸在蔗糖磷酸酶的作用下形成蔗糖。
一般把蔗糖磷酸酯合成酶-蔗糖磷酸酶系统看作是蔗糖合成的主要途径。
蔗糖磷酸合成酶催化果糖-6-磷酸形成蔗糖磷酸,蔗糖磷酸与间苯二酚反应可呈现颜色变化,在480nm下有特征吸收峰,酶活力大小与颜色的深浅成正比。
试验中所需的仪器和试剂:
可见分光光度计、水浴锅、台式离心机、可调式移液器、1mL玻璃比色皿、研钵、冰、蒸馏水
操作步骤:
一、测定样品提取:
按照组织质量(g):提取液体积(mL)为1:5~10的比例(建议称取约0.1g组织,加入1mL 提取液),进行冰浴匀浆。
8000g4℃离心10min,取上清,置冰上待测。
二、测定操作表:
按下表操作:
试剂名称(μL)测定管对照管标准管空白管
样本3030//
蒸馏水150150180
试剂二//30
试剂一150
混匀,25℃准确水浴10min
试剂三50505050
沸水浴中煮沸10min左右(盖紧盖子,以防止水分散失),冷却
试剂四700700700700
试剂五200200200200
混匀,沸水浴30min,冷却后,在480nm下测定各管吸光值。
标准管和空白管只要做一管。
每一个测定管需要设一个对照管。
SPS活力单位的计算:
1、按照蛋白浓度计算
单位定义:每mg组织蛋白每分钟催化产生1µg蔗糖定义为一个酶活力单位。
SPS活性(μg/min/mg prot)={C标准管×V1×(A测定管-A对照管)÷(A标准管-A空白管)}÷(V1×Cpr)÷T=100×(A测定管-A对照管)÷(A标准管-A空白管)÷Cpr
2、按照样本鲜重计算
单位定义:每g组织每分钟催化产生1µg蔗糖定义为一个酶活力单位。
SPS活性(μg/min/g鲜重)={C标准管×V1×(A测定管-A对照管)÷(A标准管-A空白管)}÷(W×V1÷V2)÷T=100×(A测定管-A对照管)÷(A标准管-A空白管)÷W
C标准管:标准管浓度,1000µg/mL;V1:加入反应体系中样本体积,0.03mL;V2:加入提取液体积,1mL;Cpr:样本蛋白质浓度,mg/mL;W:样本鲜重,g;T:反应时间:10min。