氨基酸的常见化学反应教程文件
- 格式:doc
- 大小:26.50 KB
- 文档页数:3


有机化学基础知识氨基酸的合成和反应有机化学基础知识——氨基酸的合成和反应氨基酸是构成蛋白质的基本单元,对于理解生命活动的基础过程和分子结构具有重要意义。
本文将介绍氨基酸的合成和反应,帮助读者进一步了解有机化学中的氨基酸相关知识。
一、氨基酸的合成氨基酸可以通过多种途径合成,其中最主要的方法有以下几种:1. 斯特莱克合成法斯特莱克合成法是合成α-氨基酸的一种常用方法。
这种方法以碳酸和胺为原料,在存在催化剂的条件下,发生酰胺的羰基活化,得到氨基酸。
2. 格布斯合成法格布斯合成法是一种通过氨基酸的脱水缩合反应合成新的氨基酸的方法。
该方法通过两个不同的氨基酸分子间的羧基和氨基的反应,生成新的氨基酸,反应需要在酸性条件下进行。
3. 氨基化合物的合成此外,还可以通过合成氨基化合物,再将其转化为氨基酸。
例如,通过胺与酸酐反应生成酰化胺,再通过水解反应将酰化胺转化为相应的氨基酸。
二、氨基酸的反应氨基酸在有机化学中具有丰富的反应性,主要表现在以下几个方面:1. 缩合反应氨基酸的缩合反应是指多个氨基酸在酸性或碱性条件下,通过酯键或酰胺键的形成缩合为多肽。
这种反应在生物体内形成蛋白质的过程中尤为重要。
2. 氨化反应氨基酸可以与氨基化合物反应,发生氨化反应生成新的氨基酸衍生物。
这种反应可通过调整反应条件和反应物的选择,实现氨基酸结构的改变和扩展。
3. 酸碱性反应氨基酸中的氨基和羧基具有酸碱特性,可发生与酸或碱的反应,形成相应的盐类。
当氨基酸在碱性溶液中时,氨基接受H+生成氨离子,氨离子极易溶解于水中。
4. 氧化还原反应氨基酸中的羧基和氨基都可以参与氧化还原反应。
例如,氨基酸的羧基可以被氧化生成相应的羧酸,而氨基则可以被还原生成相应的胺。
三、氨基酸的应用氨基酸作为生物体内重要的生物分子,在医药、食品、化妆品等领域具有广泛的应用价值。
1. 医药领域氨基酸作为药物的原料,可以合成多种药物,如抗生素、抗肿瘤药物等。
此外,氨基酸还可以作为体外代谢工程和靶向药物传递的载体。

化学反应中的氨基酸的酸碱中和反应化学反应是化学领域中不可或缺的研究内容,其中氨基酸的酸碱中和反应更是广泛应用于生物化学、医学等领域。
本文将着重介绍氨基酸的酸碱中和反应过程以及其在生物化学中的应用。
一、氨基酸的结构与性质在化学领域中,氨基酸是指含有羧基(COOH)和胺基(NH2)的有机化合物。
根据侧链不同,氨基酸可以分为20种,其中人体中常见的氨基酸有丝氨酸、半胱氨酸、甘氨酸、赖氨酸等。
与一般有机化合物不同,氨基酸具有明显的酸碱性质。
当氨基酸在溶液中时,可根据其的羧基和胺基上的游离质子(即H+)含量分为三类:酸性氨基酸、碱性氨基酸和中性氨基酸。
二、氨基酸的酸碱中和反应过程当氨基酸分子中的游离质子数等于负离子数时,氨基酸表现出中性性质。
例如,丝氨酸(Ser)分子式为HO2CCH(NH2)CH2OH,当其处于中性状态时,其游离质子数等于负离子数,即:HO2CCH(NH2)CH2OH ⇌ H+ + O2CCH(NH2)CH2OH-当氨基酸处于酸性条件下,即游离质子(H+)的浓度高于胺基(NH2)的浓度时,氨基酸表现出酸性性质。
此时,质子(H+)会与胺基(NH2)中的自由电子形成NH3+,羧基(COO-)中的电子会往外挤,形成COOH。
例如,在酸性环境下,丝氨酸会发生如下的反应:HO2CCH(NH2)CH2OH ⇌ H+ + HO2CCH(NH3+)CH2OHHO2CCH(NH3+)CH2OH ⇌ HO2CCH(NH2)CH2OH + H+当氨基酸处于碱性条件下,即游离质子(H+)的浓度小于或等于胺基(NH2)的浓度时,氨基酸表现出碱性性质。
此时,胺基(NH2)会接受水分子中的质子(H+),形成NH3+。
例如,在碱性环境下,丝氨酸会发生如下的反应:HO2CCH(NH2)CH2OH ⇌ HO2CCH(NH)CH2OH- + H+HO2CCH(NH)CH2OH- + H2O ⇌ HO2CCH(NH3+)CH2OH三、氨基酸的酸碱中和反应在生物化学中的应用人体内有许多重要的物质,例如各种酶、激素和细胞膜等都是由氨基酸组成的。

氨基酸脱水缩合化学反应式
氨基酸脱水缩合反应是生物体内构建蛋白质的重要过程。
在这个过程中,两个氨基酸分子通过脱水反应结合成肽键,形成多肽链。
这个化学反应式可以用以下方式表示:
氨基酸1 + 氨基酸2 → 肽键 + H2O
在这个反应中,两个氨基酸分子之间的羧基和氨基发生反应,生成一个肽键,并释放出一个水分子。
这一反应在生物体内发生的同时,也可以通过实验室合成。
合成多肽链的方法有多种,例如固相合成和液相合成等。
无论是在生物体内还是实验室中,氨基酸脱水缩合反应都是蛋白质合成的基础。
氨基酸脱水缩合反应具有重要的生物学意义。
生物体内的蛋白质合成依赖于这个反应,通过不同的氨基酸组合,可以合成出各种不同功能的蛋白质。
蛋白质作为生物体内最基本的大分子,参与了许多重要的生命活动,如酶的催化作用、结构的维持和信号传导等。
因此,氨基酸脱水缩合反应对于生物体的正常功能发挥至关重要。
除了在生物体内合成蛋白质,氨基酸脱水缩合反应还可以用于合成药物和高分子材料。
通过合成不同的氨基酸序列,可以获得具有特定功能的多肽药物,如抗菌肽和抗肿瘤肽等。
此外,氨基酸脱水缩合反应还可以用于制备具有特定功能的高分子材料,如聚酰胺和聚酯等。
氨基酸脱水缩合反应是生物体内合成蛋白质的基础过程,也是合成药物和高分子材料的重要手段。
通过这个化学反应,我们可以合成出具有特定功能的蛋白质、药物和材料,推动生物科学和化学科学的发展。
氨基酸脱水缩合反应的研究将为我们深入了解生命的奥秘和开发新型功能材料提供重要的理论和实践基础。


氨基酸的四个重要化学反应原理及应用氨基酸是构成蛋白质的基本组成单元,对于生物体的生长和代谢至关重要。
在生物体内,氨基酸参与了许多重要的化学反应,这些反应不仅在生物体内起着关键作用,也在医学和生物化学领域有着广泛的应用。
本文将介绍氨基酸的四个重要化学反应原理及其在生物体内和医学领域中的应用。
一、酸碱中和反应酸碱中和反应是氨基酸在生物体内起着关键作用的一种重要化学反应。
氨基酸分子中的氨基和羧基均可与其他分子中的酸性或碱性基团进行中和反应,形成盐和水。
这种反应对于维持生物体内部的酸碱平衡至关重要。
当氨基酸在胃部被蛋白酶分解而产生的羧基和氨基离子进入肠道时,它们会与肠道中的盐酸进行中和反应,使酸碱平衡得以维持。
酸碱中和反应也在体外试管实验中被广泛应用,例如在酶反应体系中调节pH值,以促进酶的活性。
二、氨基酸脱羧反应氨基酸脱羧反应指的是氨基酸分子中的羧基被氨基所脱去的过程。
这种反应在生物体内参与了许多重要的代谢途径,例如氨基酸的降解和合成。
在氨基酸的降解过程中,氨基酸通过脱羧反应生成相应的醛、酮或其他代谢产物,参与能量产生或其他生物化学途径。
在生物体内的代谢途径研究中,氨基酸脱羧反应也被广泛地应用。
在肝脏中,氨基酸脱羧反应参与了尿素循环的代谢途径,调节体内氮代谢平衡。
三、氧化还原反应氨基酸分子中的氨基和羧基均可参与氧化还原反应,这些反应对于氨基酸的功能和代谢至关重要。
在肝脏中,氨基酸的氨基可被氧化为酮酸,而氨基酸的羧基可被还原为醇,这些反应参与了氨基酸的代谢途径。
氨基酸分子中的硫氢基还可参与氧化还原反应,形成二硫键或参与其他重要的生物化学反应。
在医学领域,氨基酸的氧化还原反应被广泛地应用于氨基酸代谢异常的诊断和治疗。
四、氨基酸的缩合反应氨基酸的缩合反应是指两个或多个氨基酸分子通过缩合作用形成肽键的过程。
这种反应在蛋白质的合成过程中起着关键作用,通过氨基酸的缩合反应,氨基酸分子可以串联成长链状的多肽或蛋白质分子。

合成氨基酸的反应汇总一、Strecker氨基酸合成反应氰化钠,醛酮和胺进行缩合得到α -氨基腈,水解得到α -氨基酸的反应。
由于氰化钠毒性太大,而且溶解度不好,常用氰基磷酸二乙酯和丙酮氰醇作为氰源。
二、U. Schollkopf法合成手性氨基酸U.Schollkopf用L-Val和Gly缩合制得环二肽,再与Meerwein盐(Et30+BF4-)作用得甲基醚,经丁基锂脱质子得甘氨酸负离子,然后烷基化,酸水解,得手性α -氨基酸. 此法所得氨基酸的ee值可达95%以上。
制备反应如下图。
三、Evans氨基酸合成手性恶唑啉酮的不对称Aldol反应是Evans手性辅基的经典反应。
有多个小组尝试将Evans手性辅基应用于氨基酸合成. Evans和Vedras的小组独立报道了用Evans辅基的a-氨基化反应制备氨基酸的工作。
随后Hruby小组开展了大量工作,合成了多种结构的βγ-内旋转受阻α-氨基酸。
四、Bouveault-Locquin氨基酸合成反应丙二酸酯经过亚硝酸化-脱羧得到α-酮肟酯,接着还原生成氨基酸的反应。
五、Darapski氨基酸合成六、W.Oppolzer法手性辅基多数以天然产物为手性源,Oppolzer法的樟脑磺酸衍生物是一个典型,还有几个小组发展了基于樟脑衍生物的方法.樟脑内磺酞胺衍生物是多用途手性辅基,在许多工艺中用于手性拆分和不对称合成,应用于氨基酸不对称合成的方法见Scheme 4.七、Myers手性烷基化反应(Myers Asymmetric Alkylation)甘氨酸合成子的氨基大多以席夫碱保护,少数以叔酞胺、极少以叔胺形式存在。
唯独Myers法的氨基是游离的,并且辅基包含的手性中心不在环上。
Myers 法首次是作为不对称合成梭酸的一般方法报道的,该法采用(+)一和(-)-伪麻黄碱为手性辅基,制得酞胺,然后在拨基a一位烷基化,得到手性梭酸.该方法突出点是氨基不需保护,还适合制备亚胺基酸。

氨基酸的活化反应是一个复杂的过程,涉及多个步骤和反应物。
以下是这个过程的一个大致概述,但请注意,具体的反应方程式可能因不同的氨基酸和反应条件而有所变化。
首先,氨基酸与ATP(腺苷三磷酸)在特定的氨酰-tRNA合成酶的催化下发生反应,形成氨酰-AMP-酶复合物,并释放出焦磷酸(PPi)。
这个过程可以表示为:
氨基酸 + ATP → 氨酰-AMP-酶复合物 + PPi
接着,氨酰-AMP-酶复合物与特定的tRNA结合,将氨基酸转移到tRNA上,形成氨酰-tRNA。
这个过程可以表示为:
氨酰-AMP-酶复合物 + tRNA → 氨酰-tRNA + AMP + 酶
这样,氨基酸就被活化并连接到了tRNA上,为后续的蛋白质合成过程做好了准备。
需要注意的是,具体的反应方程式可能会因不同的氨基酸、tRNA和反应条件而有所变化。
此外,氨酰-tRNA合成酶在这个过程中起着关键的作用,它能够识别并结合正确的tRNA和氨基酸,确保合成正确的氨酰-tRNA。
重难点七氨基酸的结构和性质【要点解读】一、氨基酸的结构与反应规律1.氨基酸的结构与通性(1)通式(α—氨基酸):,R可以是烃基,也可以是其他有机基团。
分子中一定含有的官能团:—NH2(氨基)、—COOH(羧基)。
(2)同分异构体:与分子式相同的硝基化合物互为同分异构体。
如H2N—CH2—COOH(氨基乙酸)的同分异构体是CH3CH2NO2(硝基乙烷)。
(3)通性:①与强酸、强碱均能发生反应,具有两性。
氨基酸分子中的氨基能结合H+,其有碱性;而羧基能电离出H+,其有酸性。
与酸反应的化学方程式:与碱反应的化学方程式:②成肽反应:2.氨基酸分子缩合反应的规律(1)两分子间缩合:(2)分子间或分子内缩合成环:(3)缩聚生成多肽或蛋白质:注意:氨基酸缩合机理为:脱去一分子水后形成肽键(),肽键可简写为“—CONH—”,不能写为“—CNHO—”。
二、人体必需的氨基酸人体必需氨基酸,指人体不能合成或合成速度远不适应机体的需要,必需由食物蛋白供给,这些氨基酸称为必需氨基酸.共有赖氨酸、色氨酸、苯丙氨酸、蛋氨酸、苏氨酸、异亮氨酸、亮氨酸、缬氨酸8种,另一种说法把组氨酸(婴儿体内不能合成,需从食物中获取)也列为必需氨基酸总共为9种.8种人体必须氨基酸的简单记忆方法:“甲携来一本亮色书”就是甲硫氨酸、缬氨酸、赖氨酸、异亮氨酸、苯丙氨酸、亮氨酸、色氨酸、苏氨酸.【重难点指数】★★★【重难点考向一】氨基酸的结构与性质【例1】L-多巴是一种有机物,它可用于帕金森综合症的治疗,其结构简式如下:这种药物的研制是基于获得2000年诺贝尔生理学或医学奖和获得2001年诺贝尔化学奖的研究成果.下列关于L-多巴酸碱性的叙述正确的是( )A.既没有酸性,又没有碱性B.既具有酸性,又具有碱性C.只有酸性,没有碱性D.只有碱性,没有酸性【名师点睛】物质的结构决定性质,根据有机物的结构来分析其性质,则有机物结构中的羧基显酸性,-OH与苯环相连时具有酸性,氨基显碱性。
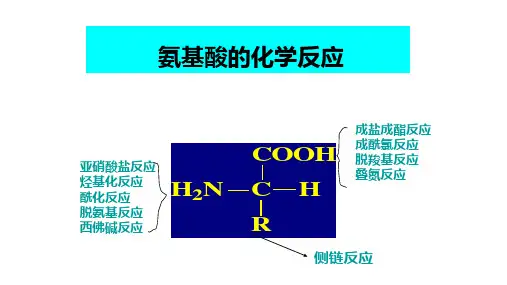
第四节氨基酸的化学反应一、α-氨基参加的反应与亚硝酸的反应测量氮气的体积可计算氨基酸的含量。
与酰化试剂的反应可用于氨基的保护。
烃基化反应可用于测定多肽链的氮末端氨基酸。
形成西佛碱的反应为转氨基反应的中间步骤。
脱氨基反应为氨基酸分解反应的重要中间步骤。
二、α-羧基参加的反应成盐和成酯反应可用于羧基的保护。
成酰氯反应可用于羧基的活化。
脱羧基反应是生成胺类的重要反应。
叠氮反应可用于羧基的活化。
三、α-氨基和α-羧基共同参加的反应(一)与茚三酮的反应常用于氨基酸的定性或定量检测。
(二)成肽反应四、侧链R 基参加的反应酪氨酸可发生碘化、硝化、重氮反应,后者可用于检测酪氨酸。
组氨酸可发生重氮反应。
精氨酸可与环己二酮发生缩合反应,曾被用于氨基酸序列分析。
色氨酸可被N-溴代琥珀酰亚胺氧化,生成有色化合物,可用于色氨酸定量测定。
半胱氨酸可生成烷基衍生物,可用于巯基的保护。
巯基可与重金属生成盐,使蛋白质失活。
巯基在空气中可被氧化,金属离子对此有催化作用。
胱氨酸的二硫键可被还原为两个巯基。
也可以被过甲酸氧化成两个磺酸基。
第五节氨基酸的光学活性和光谱性质一、氨基酸的光学活性和立体化学氨基酸的不对称碳原子可用D-或L-表_________示,其比旋值可用于氨基酸的鉴别。
二、氨基酸的光谱性质芳香族氨基酸的紫外吸收光谱如下图所示。
这一性质可用于蛋白质的定量测定。
三、氨基酸的核磁共振(NMR)在外加磁场的作用下,原子核的自旋方向达到一致,可以和一定频率的外加磁场共振而形成吸收峰,同一种原子核在分子中的位置不同,因其外围的电子云对核的屏蔽作用引起的吸收峰位置移动(化学位移)也不同,由吸收峰的位置可以推断原子处于哪一个基团,在1H NMR谱中,当相邻基团上有n 个质子时,该基团的质子吸收峰将分裂成n+1 个峰。
第六节氨基酸混合物的分析分离一、分配层析法的一般原理逆流分溶符合二项式的展开式,但对于纸层析和柱层析来说,有关的计算无实际意义。
LOGO《生物化学》生物医药系蒋丹北京联合大学生物化学工程学院1、与水合茚三酮的反应2、与甲醛的反应 3、与2,4-二硝基氟苯的反应 4、与异硫氰酸苯酯反应5、与亚硝酸的反应6、与荧光胺的反应氨基酸的化学反应1、与茚三酮反应——显色反应例外:Pro 黄色(440nm );Asn 棕色aa 定性定量氨基酸与茚三酮反应非常灵敏,几微克氨基酸就能显色,生成的蓝紫色化合物在570nm 有最大吸收。
茚三酮反应的应用▪定量:A 570nm 与氨基酸含量在一定范围内成正比▪定性:层析或电泳时显色▪注:多肽和蛋白质也能发生此反应,但灵敏度较差。
1、与水合茚三酮反应——显色反应2、与甲醛的反应氨基酸水溶液因氨基与羧基形成内盐,因此不能用酸碱滴定方法测定氨基酸含量。
但若加入甲醛溶液则氨基酸中的氨基作为亲核试剂与甲醛中的羰基发生加成反应,+解离释放出H+,生成N,N促使氨基酸分子上的-NH-二羟甲基氨基酸,使溶液酸性增加,就可以酚酞作指示剂用NaOH来滴定。
滴定终点由12左右降到9左右,可以用酚酞为指示剂,用标准氢氧化钠滴定。
酚酞是一种弱有机酸,在pH<8.2的溶液里为无色的内酯式结构,当pH>8.2时为红色的醌式结构。
氨基酸甲醛滴定的应用测定游离氨基的含量,判断蛋白质水解或合成进度☐如样品为一种已知的氨基酸,从甲醛滴定的结果可算出氨基氮的含量。
☐如样品是多种氨基酸的混合物,如蛋白水解液,则滴定结果不能作为氨基酸的定量依据。
但此法简便快速,常用来测定蛋白质的水解程度。
随水解程度的增加滴定值也增加,滴定值不再增加时,表示水解作用已完全。
NO 2F O 2N + H 2N—CH—COOHRNO 2O 2N HN—CH—COOH R+ HF弱碱性DNP -氨基酸(黄色)DNFB Sanger 法测定N末端氨基酸基础多肽N-端氨基酸的α-氨基也能与DNFB 反应,生成DNP-多肽。
经酸水解时,肽键被切开,只有DNP 基仍连在N 端氨基酸上,形成黄色的DNP-氨基酸。
氨基酸的常见化学反应⏹ -氨基的反应⏹亚硝酸反应⏹范围:可用于Aa定量和蛋白质水解程度的测定(Van slyke法)⏹注意:生成的氮气只有一半来自于Aa,ε氨基酸也可反应,速度较慢.⏹与酰化试剂的反应⏹Aa+酰氯,酸酐-→Aa被酰基化⏹丹磺酰氯用于多肽链末端Aa的标记和微量Aa的定量测量.⏹烃基化反应⏹Aa的氨基的一个氢原子可被羟基(包括环烃及其衍生物)取代.⏹与2,4-二硝基氟苯(DNFB,FDNB)反应⏹最早Sanger用来鉴定多肽或蛋白质的氨基末端的Aa⏹与苯异硫氰酸酯(PITC)的反应⏹Edman用于鉴定多肽或蛋白质的N末端Aa.在多肽和蛋白质的Aa顺序分析方面占有重要地位( Edman降解法)⏹形成西佛碱反应⏹Aa的α-NH2能与醛类化合物反应生成弱碱,即西佛碱(schiff ‘sbase)⏹前述甲醛滴定:甲醛与H2N—CH2-COO-结合,有效地减低了后者的浓度,所以对于加入任何量的碱,[H2N—CH2-COO- ]/ [+H3N—CH2-COO—]的比值总要比不存在甲醛的情况下小得多.加入甲醛的甘氨酸溶液用标准盐酸滴定时,滴定曲线B并不发生改变。
⏹脱氨基反应⏹Aa在生物体内经Aa氧化酶催化即脱去α—NH2而转变成酮酸⏹α-COOH参加的反应⏹成盐和成酯反应⏹Aa + 碱-→盐⏹Aa + NaOH -→氨基酸钠盐(重金属盐不溶于水)⏹Aa-COOH + 醇-→酯⏹Aa+ EtOH ---→氨基酸乙酯的盐酸盐⏹当Aa的COOH变成甲酯,乙酯或钠盐后,COOH的化学反应性能被掩蔽或者说COOH被保护,NH2的化学性能得到了加强或活化,易与酰基结合.Aa酯是制备Aa的酰氨or酰肼的中间物⏹⏹成酰氯反应⏹当氨基酸的氨基用适当的保护基保护以后,其羧基可与二氯亚砜作用生成酰氯⏹用于多肽人工合成中的羧基激活⏹叠氮反应⏹氨基酸的氨基通过酰化保护后,羧基经酯化转变为甲酯,然后与肼和亚硝酸变成叠氮化合物⏹用于多肽人工合成中的羧基激活⏹脱羧基反应⏹α—氨基和α—羧基共同参与的反应⏹与茚三酮反应⏹茚三酮在弱酸性溶液中与α—氨基酸共热,引起氨基酸氧化脱氨、脱羧反应,最后茚三酮与反应产物中的氨和还原茚三酮发生作用生成紫色物质⏹Pro与hyPro(羟脯氨酸)不释放氨,而直接生成黄色化合物⏹定性,定量测定各种Aa,蛋白质⏹测定CO2 的量,从而可计算参加反应的Aa的量⏹成肽反应⏹一个Aa的NH2+另一个Aa的COOH可以缩合成肽,形成的键称肽键⏹侧链R基参加的反应⏹R功能基:⏹羟基,酚基,巯基(二硫键),吲哚基,咪唑基,胍基,甲硫基,非α—NH2,非α—COOH⏹酪氨酸的酚基在3和5位上容易发生亲电取代反应⏹二碘酪氨酸或一硝基酪氨酸和二硝基酪氨酸⏹酪氨酸的酚基可以与重氮化合物(对氨基苯磺酸的重氮盐)生成桔黄色的化合物。
6)氨基酸的生物化学反应 α-酮酸的还原氨化ONH 2H 2/NiNH 3HO 2CHCH 2CH 2CCOOH O+NH 3+HO 2CHCH 2CH 2-NH 3+Enzymesα-Ketoglutaric acidAmmoniaL-Glutamic acid酶可以催化亚胺生成,然后将亚胺还原成胺。
α-羰基戊二酸可从食物的消化降解得到。
转氨化反应(Transamination )例如L-丙氨酸可从丙酮酸的转氨化反应得到:CH 3CCOOHHO 2CHCH 2CH 2-NH 3+Pyruvic acidL-Glutamic acid O +EnzymesHO 2CHCH 2CH 2CCOOHOCH 3CCHOO -NH 3+α-Ketoglutaric acidL-Alanine+反应机理:Step 1: 生成亚胺-OOCCH 2CH 2NH 3++COCOO -CH 3CH-OOCCH 2CH 2CCOO -CH 3NL-GlutamatePyruvate ImineStep2:酶催化质子转移C-OOCCH 2CH 2-OOCC-CH 3Imine from step 1H C-OOCCH 2CH 2-OOCCCOO -CH 3NRearranged imineHStep 3:重排的亚胺的水解C-OOCCH 2CH 2CCOO -3NRearranged imineH H 2OC-OOCCH 2CH 2O+H 2NCOO -CH 3-Ketoglutarate L-Alanine苯丙氨酸转化CH 2CHCOO -NH 3+CH 2-NH 3+CH 2-NH 3+OO EnzymeEnzymeHOL-PhenylalanineArene oxide intermediateL-TyrosineCH 2CHCOO -NH 3+CH 2CCOOHOEnzymeL-PhenylalaninePhenylpyruvic acid苯丙氨酸可以按照不同的消化途径转化。
氨基酸的常见化学反应
⏹ -氨基的反应
⏹亚硝酸反应
⏹范围:可用于Aa定量和蛋白质水解程度的测定(Van slyke法)
⏹注意:生成的氮气只有一半来自于Aa,ε氨基酸也可反应,速度较
慢.
⏹与酰化试剂的反应
⏹Aa+酰氯,酸酐-→Aa被酰基化
⏹丹磺酰氯用于多肽链末端Aa的标记和微量Aa的定量测量.
⏹烃基化反应
⏹Aa的氨基的一个氢原子可被羟基(包括环烃及其衍生物)取代.
⏹与2,4-二硝基氟苯(DNFB,FDNB)反应
⏹最早Sanger用来鉴定多肽或蛋白质的氨基末端的Aa
⏹与苯异硫氰酸酯(PITC)的反应
⏹Edman用于鉴定多肽或蛋白质的N末端Aa.在多肽和蛋
白质的Aa顺序分析方面占有重要地位(Edman降解法)
⏹形成西佛碱反应
⏹Aa的α-NH2能与醛类化合物反应生成弱碱,即西佛碱(schiff ‘s
base)
⏹前述甲醛滴定:甲醛与H2N-CH2-COO-结合,有效地减低了后者的
浓度,所以对于加入任何量的碱, [H2N-CH2-COO- ]/
[+H3N-CH2-COO- ]的比值总要比不存在甲醛的情况下小得多。
加入
甲醛的甘氨酸溶液用标准盐酸滴定时,滴定曲线B并不发生改变。
⏹脱氨基反应
⏹Aa在生物体内经Aa氧化酶催化即脱去α-NH2而转变成酮酸
⏹α-COOH参加的反应
⏹成盐和成酯反应
⏹Aa + 碱-→盐
⏹Aa + NaOH -→氨基酸钠盐(重金属盐不溶于水)
⏹Aa-COOH + 醇-→酯
⏹Aa+ EtOH ---→氨基酸乙酯的盐酸盐
⏹当Aa的COOH变成甲酯,乙酯或钠盐后,COOH的化学反
应性能被掩蔽或者说COOH被保护,NH2的化学性能得到
了加强或活化,易与酰基结合。
Aa酯是制备Aa的酰氨or
酰肼的中间物
⏹
⏹成酰氯反应
⏹当氨基酸的氨基用适当的保护基保护以后,其羧基可与二氯亚砜作
用生成酰氯
⏹用于多肽人工合成中的羧基激活
⏹叠氮反应
⏹氨基酸的氨基通过酰化保护后,羧基经酯化转变为甲酯,然后与肼
和亚硝酸变成叠氮化合物
⏹用于多肽人工合成中的羧基激活
⏹脱羧基反应
⏹α-氨基和α-羧基共同参与的反应
⏹与茚三酮反应
⏹茚三酮在弱酸性溶液中与α-氨基酸共热,引起氨基酸氧化脱氨、脱
羧反应,最后茚三酮与反应产物中的氨和还原茚三酮发生作用生成
紫色物质
⏹Pro与hyPro(羟脯氨酸)不释放氨,而直接生成黄色化合物
⏹定性,定量测定各种Aa,蛋白质
⏹测定CO2 的量,从而可计算参加反应的Aa的量
⏹成肽反应
⏹一个Aa的NH2+另一个Aa的COOH可以缩合成肽,形成的键称肽
键
⏹侧链R基参加的反应
⏹R功能基:
⏹羟基,酚基,巯基(二硫键),吲哚基,咪唑基,胍基,甲硫基,非
α-NH2,非α-COOH
⏹酪氨酸的酚基在3和5位上容易发生亲电取代反应
⏹二碘酪氨酸或一硝基酪氨酸和二硝基酪氨酸
⏹酪氨酸的酚基可以与重氮化合物(对氨基苯磺酸的重氮盐)生成桔
黄色的化合物。
——Pauly反应
⏹组氨酸的咪唑基可以发生类似反应但产物颜色为棕红色。
⏹精氨酸的侧链胍基在硼酸钠缓冲液(pH 8-9, 25-35︒C)中,与1.2-环已二酮
反应,生成缩合物。
该缩合物在羟胺缓冲液中,重新生成Arg
⏹色氨酸的侧链吲哚基在温和条件下可被N-溴代琥珀酰亚胺
(N-bromosuccinimide)氧化。
此反应可用于分光光度法测定蛋白质中色氨
酸的含量,并能在色氨酸和酪氨酸残基处选择性化学断裂肽键。
⏹蛋氨酸侧链上的甲硫基是一个很强的亲核基团,与烃化试剂如甲基碘容易形
成锍盐(sulfonium salt)
⏹此反应可被硫基试剂逆转。
在逆转反应中,原有的甲基和新加入的
甲基除去的机会是相等的,因此当用14C标记的甲基碘处理时,获
得的蛋氨酸将有50%是同位素标记的。
⏹半胱氨酸侧链上的巯基(-SH)有很强的反应活性,可参与很多反应
⏹二硫键的形成和打开
⏹2R-SH + 1/2 O2-→R-S-S-R + H2O ;Cu2+,Fe2+ ,
Co2+和Mn2+存在下,巯基的空气氧化将显著提高。
⏹胱氨酸中的二硫键在稳定蛋白质的构象上起很大的作用。
氧
化剂和还原剂都可打开二硫键。
过甲酸可以定量地打开二硫
键,生成磺基丙氨酸(cysteic acid)残基。
还原剂如巯基化
合物(R-SH)也能打开二硫键,生成半胱氨酸残基及相
应的二硫化物
⏹二硫苏糖醇(dithiothreitol,缩写为DTT),与胱氨酸中的二
硫键反应形成一个含分子内二硫键的稳定六元环
⏹巯基能和各种金属离子形成稳定程度不等的络合物e.g. 对氯汞苯甲
酸(p-chloromercuribenzoic acid)
⏹由于许多蛋白质,如SH酶,其活性中心涉及-SH基,当遇
到重金属离子而生成硫醇盐时,将导致酶的失活,因此制备
这类蛋白质时应避免进入重金属离子
⏹半胱氨酸可与二硫硝基苯甲酸(dithionitrobenzoic acid,缩写为
DTNB)或称Ellman氏试剂发生硫醇-二硫化物交换反应
⏹反应中1分子的半胱氨酸引起1分子的硝基苯甲酸的释放。
它在pH8.0时,在412nm波长处有强烈的光吸收,因此可利
用比色法定量测定-SH基。