电位分析法2_膜电极
- 格式:doc
- 大小:221.00 KB
- 文档页数:11




电位分析法一、概论:电位分析法是通过化学电池的电流为零的一类方法二、电位分析法指示电极分类1、第一类电极:金属及其离子溶液2、第二类电极:金属及其难溶盐(或络合离子)3、第三类电极:金属与具有两种共同阴离子的难溶盐或难解离的络合离子4、第零类电极:惰性金属Pt 、Au 、C 等三、参比电极与盐桥1、参比电极1标准氢电极:在任何温度下电位值都为零,但一般不使用,因为操作麻烦又贵。
2甘汞电极和银-氯化银电极:电极电位可从P362查表获得甘汞电极:)/(|)(),(22L xmol KCl s Cl Hg l Hg 银-氯化银电极:)/(|)(),(L xmol KCl s AgCl s Ag 2、盐桥1作用:联通电路,消除或减小液接电位2使用条件:不含被测离子、正负电子迁移率基本相等、离子浓度尽可能大,减少液接电位。
四、离子选择电极1、膜电电位E 膜=in Dd out D E E E ++=l in l out a a nF RT k ln '±(d E :扩散电位,D E :界面电位,a :活度)2、离子选择电极电位:l out ISE a nF RT const E ln '±=(负离子➕,正离子➖)l out ISE SCEBattery a nFRT K E E E ln ±=-=(负离子➖,正离子➕)ISE :离子选择电极,SCE :参比电极3、离子选择电极类型及其相应机理1玻璃电极:玻璃在纯水或稀酸中浸泡时,玻璃中的+Na 与溶液里的+H 发生交换,在玻璃表面形成水化胶层。
此时玻璃的结构为:内外水化胶层+中间干玻璃层;干玻璃层靠+Na 导电,而水化胶层靠+H 扩散导电。
2晶体膜电极A 、氟离子单晶电极:敏感膜为3LaF 的单晶薄片,氟离子能扩散进入膜相的缺陷空穴,膜中的氟离子也可以进入溶液,因而在两相界面上产生了膜电位。
B 、硫、卤素离子电极。




1.导线;
2. KCl 饱和溶液;
3. Hg 2Cl 2;
4.多孔物质;
5.胶帽;
6.导线;
7. Hg ;
8.纤维
化学修饰电极
水浸泡后,表面的Na+与水中的
表面形成水合硅胶层。
玻璃电极使用前,必须在水溶液中
玻璃膜电位的形成
玻璃电极在水中浸泡后,生成三层结构,即中间的干玻璃
层和两边的水化硅胶层:
水化硅胶层厚度:0.01~10 μm。
在水化层,玻璃上的Na+与
溶液中H+发生离子交换而产生相界电位。
溶液中H+经水化层扩散至干玻璃层,干玻璃层的阳离子向外
扩散以补偿溶出的离子,离子的相对移动产生扩散电位。
两个相界电位和两个扩散电位两者之和构成膜电位。
玻璃电极放入待测溶液,平衡后:
/ a2’);ϕ外= k2+0.059 lg(a1 / a1’)。
+ 0.059 pF
之间使用,pH高
交换,pH较低时,
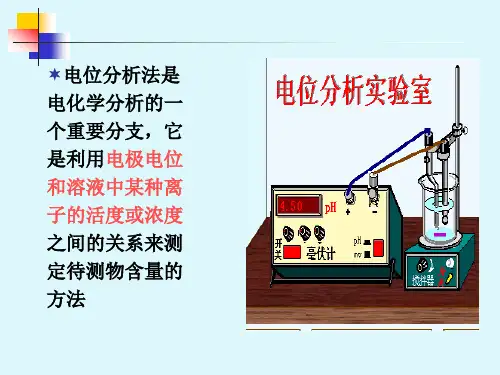
电位分析是通过在零电流条件下测定两电极间的电位差(电池电动势)所进行的分
装置:参比电极、指示电极
(2)标准加入法
,C x)得到:ϕx 测定溶液(V
x
,C s测得:ϕ1
加入V
s
结合能斯特方程得到:。
仪器分析1.生色团:能吸收紫外、可见光的基团或结构系统定义为生色团2.助色团:助色团是指带有非键电子对的基团,如-OH、 -OR、 -NHR、-SH、- Cl、-Br、-I等,它们本身不能吸收大于200nm的光,但是当它们与生色团相连时,会使生色团的吸收峰向长波方向移动,并且增加其吸光度。
3.红移:向长波方向移动4.蓝移:向短波方向移动5.激发电位:原子的外层电子由低能级激发到高能级时所需要的能量称为激发电位.。
6.共振线:由电子激发态与电子基态能级之间的跃迁所产生的谱线7.自吸效应:激发态原子发出的辐射被其基态原子所吸收,从而使谱线强度下降的效应。
8.灵敏度:仪器或分析方法灵敏度是指区别具有微小浓度差异分析物能力的度量,它取决于两个因素:即校准曲线的斜率和仪器设备的重现性或精密度。
9.参比电极:测定过程中其电极电位保持恒定不变。
10.检测极限D:以特定的分析方法,以适当的置信水平被检出的最低浓度或最小量11.分离度R:相邻两组分色谱峰保留值之差与两组分色谱峰峰底宽度总和之比。
1.光谱分析法:1.原子光谱1.原子发射光谱:由三部分构成: AES光源:电弧,火花,ICP 、分光、检测发射光谱定量分析关系式为:I = a c b 或者 log I = b log c + log a为什么选铁谱?(1)谱线多:在210~660nm范围内有数千条谱线;(2)谱线间距离分配均匀:容易对比,适用面广;(3)定位准确:已准确测量了铁谱每一条谱线的波长。
2.原子吸收光谱:标准曲线法和标准加入法(求坐标轴的CX)空心阴极灯用空气-乙炔火焰;原子化器用空气-乙炔火焰2.分子光谱紫外吸收光谱不饱和脂肪族化合物Π-Π *跃迁(不饱和基团)共轭体系愈大,π→π*跃迁产生的吸收带波长愈长。
乙烯的吸收带位于162nm,丁二烯为217nm,1,3,5-己三烯的吸收带红移至258nmn→π*跃迁(含杂原子的不饱和基团)是四种跃迁中所需能量最小的,它所对应的吸收带位于200~400nm 的近紫外区在n→π*跃迁中:溶剂极性增加,吸收带蓝移。
电位分析法(二)三、离子选择电极(Membrane potential and ISE)和膜电位1. 膜电位及其产生膜电极(Membrane potential and ISE),具有敏感膜且能产生膜电位的电极。
膜电位产生于被分隔两边不同成分的溶液,测量体系为:参比电极1|溶液1|膜|溶液2|参比电极2膜电极特点:仅对溶液中特定离子有选择性响应(离子选择性电极)。
膜电极的关键:选择膜的敏感元件。
敏感元件构成:特殊组分的玻璃、单晶、混晶、液膜、高分子功能膜及生物膜等。
膜电极组成的半电池,没有电极反应;相界间没有发生电子交换过程。
表现为离子在相界上的扩散,造成双电层存在,产生界面电位差。
该类主指离子选择性电极。
•膜电位: = 膜内扩散电位和膜与电解质溶液形成的内外界面的Donnan电位的代数和。
膜电位=扩散电位(膜内) + Donnan电位(膜与溶液之间)(1)扩散电位:液液界面或固体膜内,因不同离子之间或离子相同而浓度不同而发生扩散即扩散电位。
其中,液液界面之间产生的扩散电位也叫液接电位。
特点:这类扩散是自由扩散,正负离子可自由通过界面,没有强制性和选择性。
(2)Donnan电位:选择性渗透膜或离子交换膜,它至少阻止一种离子从一个液相扩散至另一液相或与溶液中的离子发生交换。
这样将使两相界面之间电荷分布不均匀——形成双电层——产生电位差——Donnan 电位。
这类扩散具强制性和选择性。
2. 离子选择性电极ISE 原电极晶体膜均相膜如F-,Cl-,Cu2+非均相膜如硅橡胶膜非晶体膜刚性基质如PH,PNa流动载体带正电荷如NO3-,ClO4-,BF4-带负电荷如Ca2+, Mg2+中性如K+敏化电极气敏电极如CO2, NH4+电极生物电极如酶电极,生物组织电极1)玻璃膜电极玻璃电极构成:是一种特定配方的玻璃吹制成球状的膜电极,这种玻璃的结构为三维固体结构,网格由带有负电性的硅酸根骨架构成,Na+可以在网格中移动或者被其他离子所交换,而带有负电性的硅酸根骨架对H+有较强的选择性。
当玻璃膜浸泡在水中时,由于硅氧结构与氢离子的键合强度远大于其与钠离子的强度(约为1014倍),因此发生如下的离子交换反应:G-Na+ + H+↔G+H+ + Na+电极构造球状玻璃膜(Na2SiO3,0.1mm厚)+[内参比电极(Ag/AgCl)+缓冲液]膜电位产生机理当内外玻璃膜与水溶液接触时,Na2SiO3晶体骨架中的Na+与水中的H+发生交换:G-Na+ + H+====G-H+ + Na+因为平衡常数很大,因此,玻璃膜内外表层中的Na+的位置几乎全部被H+所占据,从而形成所谓的“水化层”。
选择膜的一面与被测溶液接触,另一面与电极的内充液相接触,内充液中含有固定浓度的被测离子。
膜内外被测离子活度的不同而产生电势差,将膜电极和参比电极一起插到被测溶液中,则电池结构为:玻璃膜=水化层+干玻璃层+水化层电极的相=内参比液相+内水化层+干玻璃相+外水化层+试液相膜电位ϕm= ϕ外(外部试液与外水化层之间)+ϕ玻(外水化层与干玻璃之间)- ϕ玻’(干玻璃与内水化层之间)- ϕ内(内水化层与内部试液之间)pH测定的电池组成为:Ag,AgCl ⎢pH溶液(已知浓度) ⎢玻璃膜⎢pH试液⎢⎢KCl(饱和) ⎢Hg2Cl2,Hg内外参比电极的电势值固定,且内充溶液中离子的活度也一定,则电池电动势为:ϕ内= k1 + 0.059lg(a2/a2’ )ϕ外= k2 + 0.059lg(a1/a1’)由于玻璃膜内、外表面的性质基本相同,则k1=k2,a1’ = a2’ϕm = ϕ外- ϕ内= 0.059lg(a1 /a2)由于内参比溶液中的H+活度(a2)是固定的,则:ϕm = K´+0.059lg a1 = K´- 0.059pH试液a1、a2分别表示外部试液和电极内参比溶液的H+活度;a1’、a2’分别表示玻璃膜外、内水合硅胶层表面的H+活度;k1、k2则是由玻璃膜外、内表面性质决定的常数。
玻璃电极特点•不对称电位:当玻璃膜内外溶液H+浓度或pH值相等时,ϕm=0,但实际上ϕm不为0,这说明玻膜内外表面性质是有差异的,如表面的几何形状不同、结构上的微小差异、水化作用的不同等。
消除方法:充分浸泡电极和用标准pH缓冲溶液校正。
•酸差:当用pH玻璃电极测定pH<1的强酸性溶液或高盐度溶液时,电极电位与pH之间不呈线性关系,所测定的值比实际的偏高:因为H+浓度或盐份高,即溶液离子强度增加,导致H2O分子活度下降,即H3O+活度下降,从而使pH测定值增加。
•碱差或钠差:当测定较强碱性溶液pH值时,玻璃膜除对H+响应,也同时对其它离子如Na+响应。
因此pH测定结果偏低。
pH电极的最佳适用范围:pH1~9•当用Li玻璃代替Na玻璃吹制玻璃膜时,pH测定范围可在1~14之间。
•通过改变玻璃膜的结构可制成对K+、Na+、Ag+、Li+等响应的电极。
有H+,Na+,K+,Ag+,Li+的玻璃电极。
•对H+有高度选择性的指示电极,使用范围广,不受氧化剂、还原剂、有色、浑浊或胶态溶液的pH测定;响应快(达到平衡快)、不沾污试液。
缺点:膜太薄,易破损,且不能用于含F-的溶液;电极阻抗高,须配用高阻抗的测量仪表。
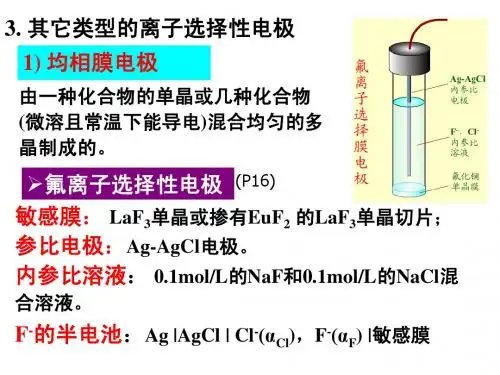
2).晶体膜电极(典型:氟电极)结构:()敏感膜:(氟化镧单晶):掺有EuF2的LaF3单晶切片;内参比电极:管内的Ag-AgCl电极。
内参比溶液:0.1 mol/L NaCl + 0.10 mol/L NaF原理: LaF3的晶格中有空穴,在晶格上的F-可以移入晶格邻近的空穴而导电,对于一定的晶体膜,离子的大小、形状和电荷决定其是否能够进入晶体膜内,故膜电极一般都具有较高的离子选择性。
当氟电极插入到含有F-的溶液中时,F-在晶体膜表面进行交换,如果溶液中的F-活度较高,则溶液中的F-进入晶体。
反之,晶体表面的F-进入溶液。
由此产生的膜电势与溶液中的F-活度的关系,在一定范围内可以用奈斯特方程来表示。
25℃时:ϕ膜= K-0.059lg a F- = K+0.059pF酸度影响:OH-与LaF3反应释放F-,使测定结果偏高;H+与F-反应生成HF或HF2-降低F-活度,使测定偏低。
减小干扰:控制pH5-7。
阳离子干扰:Be2+,Al3+,Fe3+, Th4+,Zr4+等可与F-络合——使测定结果偏低,可通过加络合掩蔽剂(如柠檬酸钠、EDTA、钛铁试剂、磺基水杨酸等)消除其干扰。
基体干扰(以活度代替浓度)消除:标准和待测样品中同时加入惰性电解质----总离子强度调节剂(Total ion strength adjustment buffer, TISAB),控制pH、消除阳离子干扰、控制离子强度。
TISAB组成:KNO3+NaAc+HAc+柠檬酸钾。
3).流动载体膜电极(液膜电极)流动载体可在膜中流动,但不能离开膜,而离子可以自由穿过膜。
界面双电层Dinann扩散机理。
构成:固定膜[活性物质(载体)+溶剂(增塑剂)+基体(微孔支持体)]+液体离子交换剂+内参比流动载体膜:固化PVC膜电极离子交换剂+有机溶剂+ PVC+四氢呋喃→膜特点:稳定,寿命长机理:膜内活性物质(液体离子交换剂)与待测离子发生离子交换,但其本身不离开膜。
这种离子之间的交换将引起相界面电荷分布不均匀,从而形成膜电位。
几种流动载体电极NO3-:(季铵类硝酸盐+邻硝基苯十二烷醚+5%PVC)Ca2+:(二癸基磷酸钙+苯基磷酸二辛酯+微孔膜)K+:(冠醚+邻苯二甲二戊酯+PVC-环已酮)钙电极:构成:内参比电极:Ag-AgCl电极内参比溶液:0.1mol/L CaCl2水溶液内外管之间:0.1mol/L二癸基磷酸钙的苯基磷酸二辛酯溶液多孔膜:载有离子交换剂(二癸基磷酸钙)原理:二癸基磷酸钙极易扩散进入微孔膜,但不溶于水,故不能进入试液溶液,但二癸基磷酸根可以在液膜-试液两相界面间来回迁移,传递钙离子,直至达到平衡。
由于Ca2+在水相(试液和内参比溶液)中的活度与有机相中的活度差异,在两相之间产生相界电势。
钙电极适宜的pH范围是5~11,可测出10-5 mol/L的Ca2+ 。
4).敏化电极敏化电极是指气敏电极、酶电极、细菌电极及生物电极等。
这类电极的结构特点是在原电极上覆盖一层膜或物质,使得电极的选择性提高。
气敏电极端部装有透气膜,气体可通过它进人管内。
管内插入pH 玻璃复合电极,复合电极是将外参比电极(Ag /AgCI )绕在电极周围。
管中充有电解液(中介液)。
试样中的气体通过透气膜进入中介液,引起电解液中离子活度的变化,这种变化由复合电极进行检测。
如 CO2气敏电极,pH 玻璃电极作为指示电极, 中介液为0.01mol/L 的碳酸氢钠。
二氧化碳与水作用生成碳酸,从而影响碳酸氢钠的电离平衡来指示CO2 。
5). 生物膜电极生物膜电极是将生物化学和电分析化学相结合而研制成的电极。
特点:将电位法电极作为基础电极,生物酶膜或生物大分子膜作为敏感膜而实现对底物或生物大分子的分析。
1、酶电极:覆盖于电极表面酶活性物质(起催化作用)与待测物反应生成可被电极反应的物质, 原理:基于用电位法直接测量酶促反应中反应物的消耗或反应物的产生而实现对底物分析的一种分析方法。
它将酶活性物质覆盖在电极表面,这层酶活性物质与被测的有机物或无机物(底物)反应,形成一种能被电极响应的物质。
例,尿素在尿素酶催化下发生下面反应:反应生成的NH 4+可用铵离子电极来测定。
若将尿素酶涂在铵离子电极上则成为尿素电极,此电极插入含有尿液的试液中,可由于尿素分解出来的NH4+的响应而间接测出尿素的含量。
氨基酸测定:上述反应产生的NH 4+可由铵离子电极测定。
四、离子选择性电极的性能参数 1.Nernst 响应、线性范围、检测下限校正曲线:以离子选择电极的电位对响应离子活度的负对数作图。
若这种响应变化服从于Nernst 方程,则称它为 Nernst 响应。
线性范围:CD 段对应的检测离子的活度(或浓度)范围。
级差:CD 段的斜率:即活度相差一数量级时,电势改变的数值,用S 表示。
检测下限:当活度较低时,曲线就逐渐弯曲,GF 与CD 延长线的交点A 所对应的测定离子的活度(或浓度)。
2. 选择性系数(selectivity coefficient)离子选择电极除对某特定离子有响应外,溶液中共存离子对电极电位也有贡献。
电极电位i 为待测离子,j 为共存离子。
Kij 为离子选择性系数,其值越大,表示ISE 测定i 离子抗j 离子的干扰能力越强。
第二项正离子取+,负离子取-。
)lg(303.2/j i zz j jpot ij i i K F z RT k ααϕ∑++'=K ij pot(K ij)称为选择性系数,该值越小,表示i离子抗j离子的干扰能力越大。