端粒和端粒的研究
- 格式:docx
- 大小:30.21 KB
- 文档页数:4

关于端粒及端粒酶的调查报告一:引言2009年10月5日,诺贝尔生理学或医学奖颁发给了美国科学家伊丽莎白·布莱克本、卡罗尔·格雷德和杰克·绍斯塔克,以表彰他们在研究端粒和端粒酶保护染色体的机理方面的贡献。
这篇调查报告将会通过资料查询和逻辑推断等方式论述关于端粒,端粒酶以及它们与肿瘤细胞的相关内容。
二:端粒和端粒酶2.1.1端粒端粒(Telomere)是染色体末端的重复DNA序列,在人细胞中长度约为几千到一两万碱基对,它防止细胞将天然染色体末端识别为染色体断裂,起着保护和稳定染色体的作用。
[1]随着细胞的分裂增殖,端粒会逐渐缩短。
当端粒的长度缩短到一定程度时,细胞的分裂便会停止。
因此,端粒具有调节细胞增殖的作用,是细胞分裂的“时钟”。
端粒的碱基序列具有极高的保守性,但不同物种的端粒仍有差异,例如:四膜虫重复序列为GGGGTT,草履虫为TTGGGG,人类和哺乳动物为TTAGGG.[2]2.1.2端粒的结构端粒通常由富含G的DNA重复序列,以及端粒结合蛋白和端粒相关蛋白组成。
端粒结合蛋白直接保护端粒DNA,端粒相关蛋白通过与端粒结合蛋白的相互作用间接影响端粒的功能。
端粒既可保护染色体不受核酸酶的破坏,又避免了因DNA黏性末端的裸露而发生的染色体融合。
[4][5]2.2.1端粒酶端粒酶(Telomerase),在细胞中负责端粒的延长的一种酶。
在端粒发现之后,人们便开始猜测存在这样一种酶,可以起到延长端粒的作用——因为随着细胞的分裂增殖和染色体的复制,端粒应当越来越短,但是某些细胞(如肿瘤细胞)的端粒长度却能够保持相对不变。
在1997年,Tom Cech实验室的Lingner在Euplotes aediculatus以及酿酒酵母中发现了真正的端粒酶催化亚基。
[3]2.2.2端粒酶的作用机理端粒酶主要依靠两种成分来实现其功能,一种名为端粒酶逆转录酶(TERT)的蛋白酶,另一种是作为模板的一小段RNA序列。

端粒和端粒酶的发现及其生物学意义端粒和端粒酶是细胞生物学中一个重要的发现,它们的存在对于细胞的生命活动和分裂有着至关重要的作用。
本文将介绍端粒和端粒酶的发现过程,以及它们在细胞生物学中的重要作用。
一、端粒的发现1940年代初期,生物学家Hermann Muller发现了X射线可以导致果蝇基因突变,从而引发了对DNA的研究。
在此之后,科学家们开始研究DNA的结构和功能,他们发现DNA是由四种碱基组成的,即腺嘌呤(A)、胸腺嘧啶(T)、鸟嘌呤(G)和胞嘧啶(C)。
然而,随着研究的深入,科学家们发现,在DNA的两端存在着一种特殊的序列,这种序列被称为端粒。
端粒是由一种叫做“重复序列”的DNA组成的,这种DNA序列在不同物种之间有所不同,但它们都具有重复的结构。
在人类中,端粒由TTAGGG序列组成,这个序列在人类基因组中重复了数千次。
二、端粒酶的发现在研究端粒的过程中,科学家们发现,端粒在细胞分裂过程中会逐渐缩短,当端粒缩短到一定程度时,细胞就会停止分裂。
这个现象被称为“Hayflick极限”,它是由于DNA的缩短导致的。
然而,当科学家们研究端粒的缩短机制时,他们发现,端粒缩短的速度并不是恒定的,而是与一种叫做“端粒酶”的酶密切相关。
端粒酶是一种由蛋白质和RNA组成的复合物,它能够将端粒的缩短速度减缓,从而延长细胞的寿命。
端粒酶能够在细胞分裂过程中向DNA的末端添加一些新的端粒序列,从而防止端粒的缩短。
三、端粒和端粒酶的生物学意义端粒和端粒酶的发现对于细胞生物学的研究有着重要的意义。
首先,它们的存在解释了为什么细胞会随着时间的推移而老化。
由于端粒的缩短和端粒酶的缺失,细胞分裂的次数受到了限制,从而导致细胞的寿命变短。
其次,端粒和端粒酶的研究还有助于理解癌症的发生。
癌症细胞具有无限制的增殖能力,这是由于它们能够通过某些机制维持端粒的长度,从而避免了端粒缩短所导致的细胞停止分裂的现象。
此外,端粒和端粒酶的研究还有助于开发抗衰老和抗癌的药物。


端粒研究报告端粒研究报告摘要:端粒是染色体末端的DNA序列,它们在细胞分裂中发挥着关键的结构和功能作用。
端粒的发现与研究对于揭示细胞衰老、增强免疫功能、促进肿瘤发展等方面具有重要意义。
本报告主要介绍了端粒的结构、功能以及与人类健康相关的研究进展。
引言:端粒是由多个重复序列(TTAGGG)组成的DNA序列,在染色体末端形成了一种特殊的结构。
它们的主要功能是防止染色体末端的损伤、保护基因组的稳定性以及参与细胞分裂过程。
端粒的损失或异常会导致染色体重组、融合以及衰老等现象。
近年来,端粒的研究成为了科学家们关注的焦点,对于揭示细胞老化、治疗肿瘤、延缓衰老等方面具有重要意义。
方法:端粒的研究主要通过分子生物学技术、细胞生物学技术以及细胞免疫学技术等手段进行。
在实验室中,科学家们可以通过衡量端粒长度、分析端粒结构以及观察端粒在细胞分裂过程中的变化来研究端粒的功能和机制。
发现与进展:通过研究发现,端粒的长度与细胞衰老、疾病风险以及寿命等方面有着密切的关系。
较短的端粒长度被认为与细胞衰老以及某些疾病的发生相关。
相反,较长的端粒长度则与较低的疾病风险和更长的寿命相关。
此外,端粒也被发现参与了免疫细胞的增殖和活化过程,对于增强免疫功能具有重要作用。
研究还发现,某些肿瘤细胞可以通过激活端粒酶(telomerase)来延长其端粒长度,从而保持其不受限的增殖能力。
结论与展望:端粒的研究为我们了解细胞衰老、疾病发生发展以及寿命的影响因素提供了重要线索。
对于肿瘤治疗和抗衰老疗法的发展也具有重要意义。
然而,端粒研究仍然存在许多未解之谜,需要进一步深入研究和探索。
未来的研究可以聚焦于端粒与细胞衰老之间的相互作用、细胞衰老的调控机制以及开发相关的治疗策略。

端粒与端粒酶的研究解读诺贝尔生理学或医学奖一、本文概述自人类踏入科学研究的领域以来,生命的奥秘一直是科学家们孜孜不倦探索的主题。
作为生命科学的两大支柱之一,医学领域的研究进展对人类生活的影响深远而持久。
每年的诺贝尔生理学或医学奖揭晓,都会引发全球范围内的广泛关注,因为它不仅代表了该领域最前沿的科学成果,更预示了未来医学可能的突破方向。
本文将以诺贝尔生理学或医学奖为背景,深入探讨端粒与端粒酶的研究,解读这一重大科学奖项背后的科学意义和影响。
端粒和端粒酶是生物学中的两个重要概念,它们在细胞生物学、分子生物学和遗传学等领域有着广泛的应用。
端粒是真核生物染色体末端的特殊结构,具有保护染色体末端、防止染色体融合和降解的重要作用。
而端粒酶则是一种特殊的逆转录酶,能够合成端粒DNA,从而维持端粒的长度和稳定性。
近年来,随着对端粒和端粒酶研究的深入,科学家们发现它们在细胞衰老、癌症发生和发展等方面扮演着重要的角色,因此,对端粒与端粒酶的研究不仅具有重要的理论价值,也具有广阔的应用前景。
本文将从端粒与端粒酶的基本概念入手,详细介绍它们在生物学中的重要作用,回顾相关的科学发展历程,并重点解读近年来诺贝尔生理学或医学奖中涉及端粒与端粒酶的重要研究成果。
通过对这些成果的深入分析和解读,我们希望能够更好地理解端粒与端粒酶在生命科学中的地位和价值,同时也为未来的医学研究提供新的思路和方法。
二、端粒与端粒酶的基本概念端粒,也被称为端区或端粒DNA,是真核细胞线性染色体末端的特殊结构。
它们像一顶帽子,保护着染色体的末端,防止其受到损伤或与其他染色体发生融合。
端粒的存在对于维持染色体的完整性和稳定性至关重要。
端粒主要由重复的非编码DNA序列组成,这些序列在染色体末端形成特定的结构,从而起到保护作用。
端粒酶则是一种特殊的逆转录酶,能够合成端粒DNA。
其主要功能是在端粒DNA受到损伤或缩短时,通过添加重复的DNA序列来修复端粒,从而保持染色体的稳定性和长度。


端粒\端粒酶研究及应用进展作者:朱军丁建强冯云来源:《中国医药科学》2012年第07期[摘要] 端粒、端粒酶在维持生命遗传信息稳定、调控细胞生命周期中具有重要作用,端粒酶通过维持端粒的长度,使细胞永生化,为抗衰老提供了光明前景,同时也为肿瘤治疗提供了新的希望。
研究端粒、端粒酶在肿瘤监测中的作用及研发端粒酶抑制剂作为治疗肿瘤的创新药物已成为近年医学研究的热点。
本研究通过查阅相关文献,对端粒、端粒酶研究及应用进展做一综述。
[关键词] 端粒;端粒酶;肿瘤;衰老[中图分类号] Q75 [文献标识码] A [文章编号] 2095-0616(2012)07-59-03端粒及端粒酶的研究已成为近年医学领域研究的热点。
这不仅因为它们具有维持生物遗传信息稳定、调控细胞生命周期的重要功能,还由于端粒及端粒酶的行为异常与多种人类肿瘤及遗传性疾病密切相关。
在这些疾病中端粒可表现出缺失、融合及序列缩短等异常,而这些异常又可能受端粒酶的调控。
1 端粒、端粒酶的发现上世纪初,著名遗传学家McClintock B[1]与Muller HJ[2]发现:染色体的稳定性和完整性是由染色体的末端来维持的。
基于此发现,Muller HJ将其命名为“telomere”,此定义来源于希腊词根“末端”(telos)及“部分”(meros)的组合。
20世纪60年代,Hayflick研究发现:经过体外培养的正常人成纤细胞的复制过程并非细胞的死亡过程,而只是细胞群中的大部分细胞在经历了数次分裂增殖后停滞在了某个特定状态,仅仅是基因表达方式发生了某些改变,细胞群大部分细胞仍保持其代谢活性,由此,Hayflick在世界上首次提出了细胞衰老的表征:即细胞在一定条件下的“有限复制力”。
同时Hayflick还提出了一个大胆的猜测,即细胞内存在某种控制细胞分裂次数的控制器,类似于我们使用的“时钟”。
为验证自己的猜想,Hayflick做了大量的细胞核移植实验验证了自己的猜想,并发现这种“钟”位于细胞核染色体的末端,于是将其命名为端粒[3]。


端粒端粒酶研究进展端粒是染色体末端的一段DNA序列,它起到保护染色体稳定性和完整性的作用。
然而,由于染色体在每次细胞分裂时会缩短一段,当端粒长度过短时,染色体会发生异常,并最终导致细胞老化和死亡。
端粒酶则是一种重要的酶,它能够补充并保持端粒的长度稳定。
近年来,对于端粒和端粒酶的研究取得了许多重要的进展。
首先,科学家们对于端粒和端粒酶的结构和功能进行了深入的研究。
端粒由重复的TTAGGG序列组成,这些序列会通过端粒酶的作用被补充。
端粒酶主要由两个亚基组成:一个叫做端粒酶反转录酶TERT,另外一个则是端粒酶RNA(TERC)。
TERT具有酶的活性,而TERC则是TERT的模板,用于合成新的端粒DNA。
端粒酶通过不断循环地合成新的端粒DNA来补充端粒的长度,从而延长染色体的寿命。
其次,研究表明端粒和端粒酶在癌症中具有重要的作用。
在正常细胞中,端粒的长度会随着细胞的分裂而缩短,从而限制了细胞的生命周期。
然而,在肿瘤细胞中,端粒酶的活性会显著增加,导致细胞端粒的长度不断维持,并且细胞可以无限制地分裂。
这种增强的端粒酶活性对于肿瘤细胞的免疫逃逸、增殖和转移等方面起着重要的作用。
因此,端粒酶已成为癌症治疗的一个重要靶点,研究人员已经开始开发端粒酶抑制剂,以抑制肿瘤的生长和扩散。
此外,最近的研究发现,端粒和端粒酶在衰老过程中也发挥了重要的作用。
随着年龄的增长,端粒长度会逐渐缩短,从而引发细胞衰老和组织功能下降。
研究人员尝试通过增强端粒酶的活性来抑制细胞衰老,以延长寿命和改善老年病的发生率。
实验证据显示,通过增加端粒酶的表达或给予端粒酶活性的药物可以有效地抑制细胞衰老。
这些发现为老年病的治疗和延长寿命提供了新的研究方向。
总之,端粒和端粒酶在细胞衰老、癌症等疾病方面的研究进展迅速。
研究人员们对于端粒和端粒酶的结构和功能有了更深入的了解,并且逐渐揭示了它们在疾病中的重要作用。
未来的研究将继续深入探究端粒和端粒酶的调控机制,并开发出更具针对性的治疗手段,为人类健康的维护做出更大的贡献。

端粒及其端粒酶的研究端粒是真核生物线形染色体末端的一种特殊的异质化结构,在稳定染色体及防止染色体在复制时缩短方面有重要作用。
其行为的异常被认为同细胞衰老及肿瘤的发生发展有密切关系。
端粒酶是一个特殊的具有反转录活性的核糖核蛋白。
近来的研究表明,端粒酶已不仅仅能维持端粒的长度,它更有助于肿瘤的形成。
笔者综述了端粒的缩短所扮演的双重角色,以及端粒酶的激活与肿瘤之间的关系。
细胞的复制期限被认为由最终导致衰老的两个机制决定,一个是累积的DNA损伤,另外一个是端粒的进行性缩短。
但在人类端粒及端粒酶的基础研究中,还存在着许多难点,如:人端粒末端的精细结构,端粒的非端粒酶延伸机制;人端粒酶的具体结构及其基因所在的位置;端粒酶的激活机制及其活性调节等,均有待于回答。
衰老是一种多基因的复合调控过程,表现为染色体端粒长度的改变、DNA损伤(包括单链和双链的断裂)、DNA的甲基化和细胞的氧化损害等。
这些因素的综合作用,才造成了寿命的长短。
人为什么会衰老,以至走向死亡呢?有研究者对导致人体细胞衰老的原因提出了程序假说和错误积累假说。
人类的细胞并不能无限制地重复分裂,在分裂50~60次后便会停止。
细胞不再继续分裂的机体组织,便呈现出衰老和机能低下的状态。
随着细胞重复分裂使端粒缩短到一定的长度,从而使细胞停止了分裂。
这就是程序假说。
细胞分裂的时候,DNA被复制,但是由于X射线、紫外线、活性氧、有害物质的损害,DNA会发生异常变化,于是DNA在复制过程中就会产生错误。
随着错误的积累,生成了异常蛋白质,细胞机能变得低下,于是细胞便不能继续分裂,呈观出了衰老迹象。
这就是所谓错误积累假说。
端粒是真核细胞内染色体末端的DNA重复片断, 由富含G的核酸重复序列和许多蛋白质组成, 不同个体的端粒初始长度差异很大,细胞培养研究表明,当端粒再也无法保护染色体免受伤害时,细胞就会停止分裂,或者变得不稳定。
其功能是完成染色体末端的复制,防止染色体免遭融合、重组和降解。
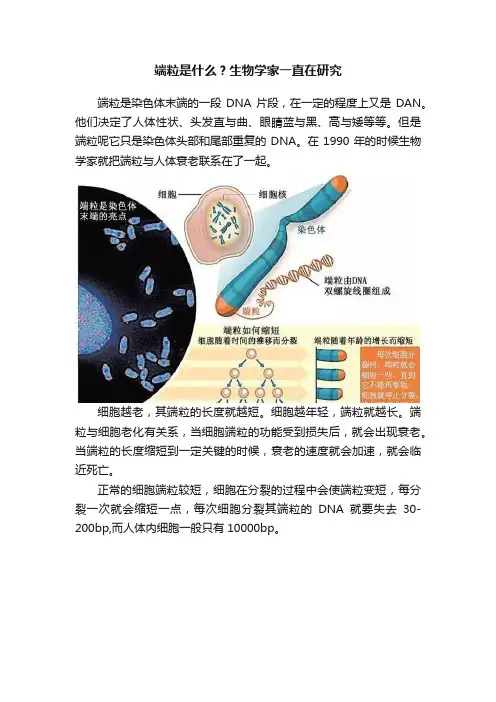
端粒是什么?生物学家一直在研究
端粒是染色体末端的一段DNA片段,在一定的程度上又是DAN。
他们决定了人体性状、头发直与曲、眼睛蓝与黑、高与矮等等。
但是端粒呢它只是染色体头部和尾部重复的DNA。
在1990年的时候生物学家就把端粒与人体衰老联系在了一起。
细胞越老,其端粒的长度就越短。
细胞越年轻,端粒就越长。
端粒与细胞老化有关系,当细胞端粒的功能受到损失后,就会出现衰老。
当端粒的长度缩短到一定关键的时候,衰老的速度就会加速,就会临近死亡。
正常的细胞端粒较短,细胞在分裂的过程中会使端粒变短,每分裂一次就会缩短一点,每次细胞分裂其端粒的DNA就要失去30-200bp,而人体内细胞一般只有10000bp。
通过研究发现,细胞内存在一种酶,这种酶可以合成端粒,端粒的长短由这种酶决定。
细胞内的酶多少可以推测到端粒的长短。
当然在正常的人体细胞内是检测不到端粒酶的,但是在生殖细胞、卵巢、胚胎及胎儿细胞中可以检测到。
恶性肿瘤细胞具有高活性的端粒酶,端粒酶阳性的肿瘤有卵巢癌、淋巴瘤、急性白血病、乳腺癌、结肠癌、肺癌等等。
到今天,科学家们还不敢公布已经找到了人体真正衰老的起因,然而端粒功能的发现的确是为我们开拓了一条新的抗衰之路。
端粒的缩短,引起衰老。
如果端粒长度得不到维持,细胞停止分裂或者死亡。
在某种情况下,濒临衰亡的细胞愈变成永生细胞,即癌细胞。
点个关注呗。
端粒、端粒酶与肿瘤端粒(telomere)、端粒酶(telomerase)与肿瘤的关系是近年来受到国际医学界高度重视的研究热点。
肿瘤细胞尤其是恶性肿瘤细胞常常因获得永生性(immotality)而具有了无限制增殖能力,而肿瘤细胞无限增殖能力的维持则依赖于端粒酶的激活及端粒的稳定。
大量的研究表明,在各种类型的恶性肿瘤中几乎都发现有端粒酶的异常高表达。
1 端粒端粒实质上即真核生物染色体末端的特殊结构,由一段串联重复的富含鸟嘌呤碱基DNA序列及相关蛋白组成。
端粒的重复长度在各物种并不相同,如人类为5~20kb,大鼠为20~100kb,小鼠为100~150kb。
端粒一方面具有稳定染色体末端、防止染色体的异常重组、端-端融合及染色体丢失等作用,另一方面端粒长度维持在一定范围之内又是细胞有丝分裂正常进行的保证。
染色体DNA在沿着5′-3′方向复制过程中,由于DNA聚合酶不能进行全长复制酶的催化活性单位。
1.1 人类酶端粒酶RNA端粒酶RNA为端粒酶的主体结构,含有编码端粒的模板区、端粒酶蛋白结合区等。
hTR 长约450个碱基,模板区序列为5′-CUA ACC CUA AC-3′,逆转录合成人端粒TTAGGG重复结构。
端粒酶RNA不能激活端粒酶,也就是说端粒酶RNA不能调节端粒酶活性。
1.2 端粒酶相关蛋白最近,在哺乳动物小鼠和人端粒酶中分离出端粒酶相关蛋白,并克隆了编码TP1的基因(40)。
TP1蛋白在近N端区与四膜虫的P80有许多相同氨基酸序列,说明TP1存在保守区:在近中间区,有一个A TP/GTP结合位点;在近C端区,有一个WD-40重复序列,WD-40重复序列是已知存在一类称WD-40家庭蛋白中,是一个具有蛋白结合功能的重要结构,提示TP1可能与其它蛋白结合(如:端粒蛋白),帮助端粒酶更好地发挥合成端粒功能。
TP1与端粒酶活性的关系,目前还不很清楚,在检测一些端粒酶阳性的肿瘤细胞和端粒酶阴性的正常组织的TP1mRNA,显示无明显差异。
综述文章编号:1009-0002(2007)04-0667-03端粒及端粒酶的研究进展杨平勋,黄君健军事医学科学院生物工程研究所,北京100850[摘要]端粒是真核细胞染色体末端的特有结构,是由端粒结合蛋白和一段重复序列的端粒DNA组成的一个高度精密的复合体,在维持染色体末端稳定性,避免染色体被核酸酶降解等方面起着重要的作用。
端粒的长度、结构及组织形式受多种端粒结合因子的调控。
由于端粒的重要性,在哺乳动物细胞里,端粒的长度或端粒结构变化与癌症发生及细胞衰老有密切的关系。
由于末端复制问题的存在,随着细胞分裂次数的增加,端粒不断缩短,细胞不可避免的走向衰老或凋亡。
由于在细胞分裂过程中端粒长度的不断缩短与细胞分裂代数增加具有相关性,即端粒长度反应了细胞的分裂次数,因此有人将端粒形象的比喻为生物时钟。
在90%的癌细胞中,端粒酶被重新激活,以此来维持端粒的长度,使细胞走向永生化。
简要综述了端粒、端粒酶及端粒酶结合蛋白的最新研究进展。
[关键词]端粒;端粒酶;端粒结合蛋白[中图分类号]Q26[文献标识码]AAdvancesofTelomereandTelomeraseYANGPing-xun,HUANGJun-jianBeijingInstituteofBiotechnology,Beijing100850,China[Abstract]Telomeresarespecializednucleoproteincomplexesattheendsoflinearchromosomes,consistingofmulti-kilo-baselongarraysofdouble-strandedTTAGGGrepeats,asingle-strandedoverhangofthe3'G-strand,andassociatedpro-teins.Itprotectstheendsoflinearchromosomes.Telomerelength,constructionandorganizationareregulatedbylotsoftelomerebindingproteins.Becauseofthesignificanceoftelomeres,thechangesoftelomeres'lengthorconstructurecancausecellstoentersenescenceorapoptosis.Telomeraseisimportantformaintainingtelomeres,andmostofcancercellshavetelomeraseactivity,so,itcanbeatargetforcurecancer.Thelatestdevelopmentofthetelomere,telomeraseanditsbindingproteinsfunctionwerediscussed.[Keywords]telomereUtelomeraseUtelomere-bindingprotein端粒的发现应归功于20世纪30年代2位遗传学家芭芭拉・麦克林托克和赫尔曼・穆勒的观察结果。
端粒和端粒酶在癌症中的研究进展及意义摘要:端粒是位于染色体末端的DNA串联重复序列,对基因组稳定性和完整性起保护作用。
端粒的长度与细胞周期密切相关。
其长度变化机制分为依赖端粒酶活性和端粒重组两类,氧化应激和铅(Pb)与端粒酶的功能蛋白相结合抑制其活性,致使端粒缩短,硒(Se)与二者具有拮抗作用,延缓衰老。
相关数据表明85%肿瘤细胞与端粒酶活性成正相关,以端粒酶活性作为肿瘤治疗靶标称为当代热点之一。
主要对肺癌、乳腺癌等恶性肿瘤与端粒的相关性进行了综述,以期为端粒和端粒酶在癌症治疗研究提供参考依据。
关键词:端粒;端粒酶;肿瘤20世纪30年代,人们开始了解染色体上的一种特殊结构——端粒。
端粒是存在于真核细胞线状染色体末端的一种特殊结构,与端粒结合蛋白一起构成了特殊的“帽状”结构,维持染色体的完整和细胞活性,其实质为一小段DNA-蛋白质复合体。
端粒与有丝分裂有着密切的联系,细胞每分裂一次,端粒就缩短30~200bp,当缩短到2~4kb,会导致细胞复制功能衰退,引起细胞衰老或死亡,被科学家称为“有丝分裂时钟”和“生命时钟”[1,2]。
端粒的延长和重组机制都是通过端粒酶来催化和介导的,端粒酶在保持端粒稳定、基因组完整、细胞活性和潜在的增殖能力等方面发挥重要作用。
鉴于端粒酶在正常组织体细胞中的活性被抑制,而在肿瘤中则被重新激活,可能参与肿瘤恶性转化的机制,成为医学界研究的重点和热点之一。
2009年美国3位科学家因发现端粒和端粒酶结构及其对染色体末端的保护功能,而获诺贝尔生理学或医学奖。
1端粒和端粒酶1.1端粒的结构和功能端粒是位于染色体末端由一个富含G的DNA串联重复序列[3]和端粒结合蛋白组成,每个重复序列一般为5—7bp[4]。
不同物种其重复序列存在l~2个碱基差异,哺乳动物的端粒重复序列为5’-(TTAGGG)n-3’[5],植物的端粒重复序列为5’一(TTTAGGG)n-3’[6]。
端粒长15~20kb,其重复序列成T环结构,像帽子一样能有效防止染色体间末端重组、融合和染色体退化[7]。
端粒\端粒酶研究及应用进展端粒、端粒酶在维持生命遗传信息稳定、调控细胞生命周期中具有重要作用,端粒酶通过维持端粒的长度,使细胞永生化,为抗衰老提供了光明前景,同时也为肿瘤治疗提供了新的希望。
研究端粒、端粒酶在肿瘤监测中的作用及研发端粒酶抑制剂作为治疗肿瘤的创新药物已成为近年医学研究的热点。
本研究通过查阅相关文献,对端粒、端粒酶研究及应用进展做一综述。
标签:端粒;端粒酶;肿瘤;衰老端粒及端粒酶的研究已成为近年医学领域研究的热点。
这不仅因为它们具有维持生物遗传信息稳定、调控细胞生命周期的重要功能,还由于端粒及端粒酶的行为异常与多种人类肿瘤及遗传性疾病密切相关。
在这些疾病中端粒可表现出缺失、融合及序列缩短等异常,而这些异常又可能受端粒酶的调控。
1端粒、端粒酶的发现上世纪初,著名遗传学家McClintock B[1]与Muller HJ[2]发现:染色体的稳定性和完整性是由染色体的末端来维持的。
基于此发现,Muller HJ将其命名为“telomere”,此定义来源于希腊词根“末端”(telos)及“部分”(meros)的组合。
20世纪60年代,Hayflick研究发现:经过体外培养的正常人成纤细胞的复制过程并非细胞的死亡过程,而只是细胞群中的大部分细胞在经历了数次分裂增殖后停滞在了某个特定状态,仅仅是基因表达方式发生了某些改变,细胞群大部分细胞仍保持其代谢活性,由此,Hayflick在世界上首次提出了细胞衰老的表征:即细胞在一定条件下的“有限复制力”。
同时Hayflick还提出了一个大胆的猜测,即细胞内存在某种控制细胞分裂次数的控制器,类似于我们使用的“时钟”。
为验证自己的猜想,Hayflick做了大量的细胞核移植实验验证了自己的猜想,并发现这种“钟”位于细胞核染色体的末端,于是将其命名为端粒[3]。
20世纪80年代,CW Greider和EH Blackburn 2位科学家在四膜虫的提取物中加入1段单链的末端寡聚核苷酸后,发现端粒的长度增加了,这表明的确存在一种可使端粒延长的酶,根据其特点命名为“端粒酶”(telomerase)[4]。
端粒和端粒酶的研究摘要:自端粒和端粒酶发现以来,就一直成为科技工作者的研究热点。
端粒具有保护染色体的功能,同时也是端粒酶的底物,解决DNA复制的末端隐缩,保证染色体的完全复制。
而端粒酶具有对端粒的延伸作用,使之处于一种不断伸缩的动态平衡中,端粒酶也可以修复断裂的染色体末端。
端粒和端粒酶的存在保证了染色体或基因组的稳定性,与细胞的正常分裂有关。
最近的研究表明端粒和端粒酶与人的衰老、癌症有重要关系。
关键词:端粒端粒酶衰老癌症2009 年10 月5 日,瑞典皇家科学院诺贝尔奖委员会宣布将2009 年度诺贝尔生理学或医学奖(The Nobel Prize in Physiology or Medicine)授予3 位美国科学家伊丽莎白·布莱克本(Elizabeth H.Blackburn),卡萝尔·格雷德(Carol W. Greider)和杰克·绍斯塔克(Jack W. Szostak),以表彰他们―发现端粒和端粒酶是如何保护染色体的‖。
Blackburn 和Szostak 发现端粒的一段特殊DNA序列能使染色体不被降解[1],而Greider 和Blackburn 则找到了帮助端粒合成的分子——端粒酶[2]。
最初端粒和端粒酶的研究只是为了解决染色体复制的难题,但随着研究的深入人们发现了端粒和端粒酶的其他作用——细胞随着端粒的变短而衰老,而当端粒酶的活性足以维护端粒的长度时,细胞将会延迟衰老;在癌细胞得到永生性这一过程中,端粒酶的激活起了非常重要的作用。
1 端粒和端粒酶的发现最早观察染色体末端的科学家始于19世纪末期,Rabl[3]在1885年注意到染色体上所有的末端都处于细胞核的一侧。
20世纪30年代,两个著名的遗传学家McClintock B [4]和Muller HJ [5]发现了染色体的末端可维持染色体的稳定性和完整性。
Muller将它定义为―telomere‖。
James Watson[6]最早就明确指出了这个"末端隐缩问题",并猜想染色体也许可以通过在复制前联体(染色体末端跟末端连起来)的方式来解决末端复制的问题。
30多年前,Hayflick[7]首次提出将体外培养的正常人成纤维细胞的―有限复制力‖作为细胞衰老的表征。
在此过程中,细胞群中的大部分细胞经历了一定次数的分裂后便停止了,但它们并没有死亡,仍保持着代谢活性,只是在基因表达方式上有一定的改变。
于是Hayflick猜测细胞内有一个限制细胞分裂次数的―钟‖,后来通过细胞核移植实验发现,这种―钟‖在细胞核的染色体末端——端粒。
Blackburn和Gall[8]于1978年首次阐明了四膜虫rDNA分子的末端结构,他们发现这种rDNA每条链的末端均含有大量的重复片段,并且这些大量重复的片段多是由富含G、C的脱氧核苷酸形成的简单序列串联而成。
在1985年,CW.Greider和EH.Blackburn发现将一段单链的末端寡聚核苷酸加至四膜虫的提取物中后,端粒的长度延长了,这就说明了确实有这样的一种酶存在[2],并将它命名为―端粒酶‖(telomerase)。
之后,耶鲁大学Morin于1989年在人宫颈癌细胞中也发现了人端粒酶[9]。
2 端粒和端粒酶的结构与功能端粒是存在于真核生物线性染色体末端,由串联重复的短的dsDNA序列及其相关的蛋白所组成的DNA蛋白复合体。
dsDNA中的一条为富G 链,以5'→3' 指向染色体末端,比另一条互补链长8 ~12 个碱基。
端粒既有高度的保守性,又有种属特异性。
如四膜虫重复序列为GGGGTT,草履虫为TTGGGG,人为TTAGGG。
端粒具有两种相关蛋白,一为端粒结合蛋白(telomere binding proteins,TBP)是一类特异结合在端粒DNA上的蛋白质,如发酵母中的蛋白质RAPI,哺乳类动物细胞中的蛋白质TRFI。
二为端粒相关蛋白(telomereassociated proteins TAP),是一类与TBP 结合的蛋白质,如酿酒酵母中的SIR3/SIR4 和RIFI。
它们与端粒结合蛋白质结合,分别发挥建立端粒静止效应和调节端粒长度的作用。
端粒DNA主要功能有:第一,保护染色体末端免于被化学修饰或被核酶降解;第二,防止染色体相互融合;第三,为端粒酶提供底物,解决DNA复制的末端隐缩,保证染色体的完全复制。
众所周知,真核DNA是线性DNA,复制时由于模板DNA起始端为RNA引物先占据,新生链随之延伸;引物RNA脱落后,其空缺处的模板DNA无法再度复制成双链。
因此,每复制一次,末端DNA就缩短若干个端粒重复序列,即出现真核细胞分裂中的―末端复制问题‖。
当端粒缩短到一定程度时即引起细胞衰老,故端粒又称―细胞分裂计时器‖。
端粒、着丝粒和复制原点是染色体保持完整和稳定的三大要素。
同时,端粒又是基因调控的特殊位点,常可抑制位于端粒附近基因的转录活性(称为端粒的位置效应,TPE)。
端粒酶又称端粒末端转移酶(Telomerase),是一种逆转录酶,相对分子质量在200~500 ku,是由蛋白质和RNA构成的核糖核蛋白体。
端粒酶由端粒酶成份(hTR),催化亚单位(hTRT/hEST2)和端粒酶相关蛋白1(TEP1)3个亚单位组成,可调控端粒的复制,其中hTR充当模板,hTRT/hEST2是决定端粒酶活性的限速决定子。
TEP1可能是介导端粒酶与其他分子相互作用的调节亚单位[10]。
端粒酶具有对端粒的延伸作用,在没有端粒酶的细胞中,端粒会逐渐缩短直至损害基因;有端粒酶存在的细胞,则该酶会不断补充新的端粒,使之处于一种不断伸缩的动态平衡中。
正是端粒酶的存在维持了大多数组织的端粒长度,从而抵消了因细胞分裂而导致的端粒DNA的消耗[11]。
端粒酶的另一个功能是修复断裂的染色体末端。
当断裂的染色体末端有富G、T DNA存在时,即使没有完整的端粒重复序列存在,它也能被端粒酶作为引物DNA并为之延伸端粒序列。
因修复断端免遭外切酶对染色体DNA的更多切割,端粒酶在某种意义上讲也维护了基因组的稳定性。
此外,在端粒合成中端粒酶还具有去除错配碱基的纠错作用,不仅可以除去错配碱基,还可除去延伸超过模板范围的碱基。
3 端粒、端粒酶与衰老衰老是生物在生命过程中整个机体形态、结构和功能逐渐衰退的综合现象。
关于衰老的学说有多种,其中端粒学说由Olovnikov[12]于1973年提出,认为在细胞分裂的过程中,端粒起缓冲作用,但是当端粒缩短到一定程度就会失去缓冲作用,从而导致细胞衰老。
Harley等[13]提出了较为完备的端粒——端粒酶假说,认为正常细胞的端粒缩短到一定程度时会启动终止细胞分裂的信号,使细胞进入第一危机期M1(crisis M1)并退出细胞周期而老化。
人体成纤维细胞染色体在复制过程中的极限现象(即Hayflick细胞分裂极限,一般低于50~60次)和染色体端粒不断地缩短的现象,染色体DNA每复制一次,端粒就缩短一截,人体成纤维细胞端粒每年会缩短十几个碱基。
说明染色体末端重复序列TITFAGGG(端粒)在细胞衰老过程中特异地依赖DNA复制而丢失。
当染色体端粒短到一定长度时,细胞的繁殖就不能再继续进行,细胞分裂次数便达到了极限进而导致细胞和整个生物体的死亡。
端粒及端粒酶涉及衰老最有力的证据是Bodnar[14]等证实的。
如果细胞试图要维持其正常分裂,那么就必须阻止端粒的进一步丢失,并且激活端粒酶。
Davis T等[15 ]研究发现,Werner 综合征患者的端粒长度与他们的衰老程度相对应,端粒越短,患者的衰老程度越严重。
如果增强Werner 综合征患者成纤维细胞的端粒酶活性,就可以延长细胞寿命,控制衰老的进程。
端粒长度以及端粒酶基因变异这两个原因将使人类的寿命更长。
正常体细胞中,随着细胞的不断分裂,染色体末端的端粒序列便会不断缩短,端粒长度的缩短可以激发细胞老化。
一种可能是染色体末端端粒DNA序列的丢失释放了端粒结合转录因子,该因子或者激活了衰老诱导基因,或者灭活了细胞周期进行所必需的某些基因。
另一种可能是端粒长度缩短诱导了DNA损伤反应,导致细胞周期受阻,使细胞出现衰老。
4 端粒、端粒酶与肿瘤Shay等总结了近年来各种恶性肿瘤组织、癌旁组织、癌前组织及良性肿瘤组织中的端粒酶活性[16]。
发现90%的恶性肿瘤组织的端粒酶活性呈阳性:而癌旁组织的阳性率只有6%,而且很可能是因为TRAP法很敏感从而使混入其中的极少量恶性肿瘤细胞同时也被检测出来的缘故;良性肿瘤和癌前组织的阳性率分别为14%,而正常组织。
除少数种类外。
其阳性率均为0。
所以端粒酶活性显然是恶性肿瘤的一种标志。
端粒——端粒酶假说认为:当端粒酶活性的缺乏,端粒的长度便缩短到一定程度时,细胞进入危机期M1。
如果细胞此时被病毒转染,或者某些抑癌基因如:P53、Rb等发生突变,则细胞越过M1期继续分裂,端粒继续缩短而到达另一个关节点M2,此时染色体出现各种异常形态,大量细胞死亡。
但有极少数细胞在此阶段激活端粒酶,染色体形态得到稳定,从而逃避M2危机,成为无限增殖的―永生化细胞‖。
(immortalized cells),即肿瘤细胞。
恶性肿瘤发生的端粒酶理论[ 17 ]认为,端粒酶的激活是恶性肿瘤发生学上的一个共同途径,端粒酶与恶性肿瘤之间的相关性,使它在肿瘤的治疗上有望成为行之有效的新的靶目标。
端粒酶主要存在于恶性肿瘤,而在大多数正常组织中没有活性或活性极低,同时端粒酶在恶性肿瘤中发生,尤其在肿瘤的发展中起着关键的作用,通过各种方法抑制端粒酶的活性,可以有效地抑制大多数肿瘤的生长,而对大多数正常细胞没有大的影响。
最近对缺失端粒酶的小鼠研究表明[18 ] ,端粒的缩短在肿瘤发生和发展过程中扮演着双重角色。
当端粒缩短到临界长度时,可引起染色体与基因组的不稳定,从而诱发肿瘤的形成。
相反,由于端粒的缩短,又可启动DNA损伤信号,进而抑制肿瘤的发生。
5 结语不可否认端粒和端粒酶的发现能获得诺贝尔奖,是因为它跟衰老和癌症的潜在关系获得了更多公众的关注。
但是迄今为止它只是衰老和癌症的相关者,勉强算得上指示者,还远不是引起者。
其他问题如端粒酶是怎样激活的?同一种肿瘤为何有的表达有的则不表达端粒酶?无端粒酶表达的细胞是如何逃避衰老而成为无限增殖细胞?尽管如此,我们相信科学的足够发展终将揭开这些问题的神秘面纱。
参考文献1.Szostak J W,Bla ckburn E H.Cloning yeast telomeres on linear plasmid vectors [J].Cell,1982,29(1):245-255.2.Grieder C,Blackburn E.Identification of a specific telomere terminal transferase activity in Tetrahymena extracts [J].Cell,1985,43:405-13.3.Rabl,C Uber Zelltheilung Morphologisches Jahrbuch 1885,10:214-330.4.McClintock B.The stability of broken end of chromosome in Zea mays [J].Genetics,1941 ,41:234-282.5.Muller HJ.The Remaking of chromosomes [J].The collecting net. Woods Hole,1938,13:181-198.6.Watson,J.D.Origin of concatemeric T7 DNA [J].Nature: New biology,1972,239:197-201.7.Hayflick L.The limited in vitro lifetime of human diploid cell strains [J].Exp.Cell Res,1965,37:614-636.8.Blackburn EH,Gall J G.A tandemly repeated sequence at the termini of the extrachromosomal ribosomal RNA genes in Tetrahymena[J].J Mol Bio.1978;120:33-53.9.Morin GB,et al.The human telomere terminal transferase of Tetrahymena is a ri-bonucleoprotien that synthesizes TTAGGG repeats.Cell,1989,59:521-529.10.Takakura M,kyo S,Kanaya T,et al.Cloning of human telomerase catalytic subunit gene promoter and identification of proximal core promoter sequences essential for transcriptional activation in immortalized and cancer cell[J].cancer Res,1998,59:551-557.11.Blackburn EH.Switching and signaling at the telomere [J].Cell,2001,106 (6):661 - 673.12.Olovnikov A M.A theory of marginotomy.The incomplete copying of template margin in enzymic synthesis of polynucleotides and biological significance of the phenomenon [J].J Theor Biol,1973,41(1):181-190.13.马永红,党荣理,任立松等.端粒酶的研究进展[J].生物技术通报,2008,1:75-78.14.Bodnar A G,Ouellette M,Frolkis M,et al.Extension of life-span by introduction of telomerase into normal human cells [J].Science,1998,279(5349):349-352.15.Davis T,Singhrao SK,Wyllie FS,et al.Telomere – based proliferative lifespan barriers in Werner - syndrome fibrob -lasts involve both p53 - dependent and p53 – independent mechanisms[J ].J Cell Sci,2003,116(Pt 7) :1349 - 1357.16.Shay JW,Baccheti S.Eur J Cancer,1997,33:787-791.17.RhyuM S.Telomeres,telomerase,and immo rtality[J].J N atlCancer In2 st,1995,87:884.18.Gonzalez E,Samper E,Fllers JM,et al.Telomerase2deficientmice with short telomeres are resistant to skin tumorigenesis[J].Nat Genet,2000,26 (13) :114-117.。