活动粗盐的提取全解
- 格式:ppt
- 大小:164.50 KB
- 文档页数:10


粗盐提纯知识点总结一、粗盐的提纯目的1.提高盐的纯度粗盐中含有各种杂质,如泥沙、有机物、金属离子等,需要通过提纯过程将这些杂质除去,以提高盐的纯度。
2.去除水分粗盐中含有大量水分,需要去除水分,以提高盐的质量和稳定性。
3.改善颗粒结构粗盐颗粒结构不均匀,经过提纯处理后,可以改善盐的颗粒结构,使得盐更加均匀细腻。
4.达到食品级标准通过提纯处理,可以使粗盐达到食品级标准,符合食品卫生安全要求。
二、粗盐的提纯方法1.溶解结晶法溶解结晶法是最常用的盐提纯方法之一。
将粗盐溶解于水中,然后通过蒸发结晶的方式,使盐结晶析出,经过过滤、干燥等步骤,最终得到纯净的盐产品。
2.蒸发法蒸发法是通过将粗盐溶解于水中,然后通过自然蒸发或加热蒸发的方式,使盐结晶析出,最终得到纯净的盐产品。
3.离子交换法离子交换法是通过将粗盐溶解于水中,然后利用离子交换树脂吸附盐中的杂质离子,最终得到纯净的盐产品。
4.电解法电解法是利用电解设备,将粗盐溶解于水中,然后通过电解的方式使盐中的杂质离子沉积在电极上,最终得到纯净的盐产品。
5.膜分离法膜分离法是利用特殊的膜技术,将粗盐溶液通过膜分离设备,将盐中的杂质和水分分离出去,最终得到纯净的盐产品。
6.气固法气固法是将粗盐在高温下蒸发,然后通过气态分离的方式,将盐中的杂质和水分排除,最终得到纯净的盐产品。
以上这些方法可以单独使用,也可以组合使用,根据不同的盐矿资源和生产工艺,选择适合的提纯方法,以获得高品质的盐产品。
三、粗盐提纯过程1.粗盐的净化将粗盐进行洗涤、过滤等步骤,去除掉盐中的泥沙、有机物等杂质,使盐变得更加干净。
2.溶解将净化后的粗盐溶解于水中,形成盐水溶液。
3.蒸发结晶将盐水溶液进行蒸发结晶,使盐结晶析出。
4.分离和干燥通过离心、过滤等手段,将盐结晶和溶液分离开来,然后对盐结晶进行干燥处理,最终得到干净纯净的盐产品。
本文对粗盐提纯的目的、方法和过程进行了详细的介绍,希望能够帮助读者更加全面地了解盐的提纯过程。


粗盐提纯的步骤及现象
一、加水溶解粗盐。
二、静置沉淀。
三、将上层清液倒入漏斗过滤。
四、将滤液置于蒸发皿中,加热蒸发。
食盐的主要成份是NaCl,粗盐是指NaCl含杂质,可溶性杂质多为氯化镁,氯化钙等,不溶性的有泥沙等。
粗盐提纯的主要操作可分为两部分:一是过滤,目的是使不溶性固体杂质与NaCl分离,二是结晶,目的是使NaCl与溶解度为陡峭形的可溶性杂质分离。
实验前后分别称量粗盐和提纯后盐的目的是计算粗盐的产率。
制作过滤装置时要注意三个要点:
1、滤纸边缘低于漏斗边缘。
2、漏斗尖嘴处紧贴烧杯内。
3、用玻璃棒引流并贴在三层滤纸处。
在蒸发滤液的过程中,要用玻璃棒搅拌,目的是防止由于溶液局部温度过高,造成液体飞溅,在滤液接近蒸干时,应停止加热,利用蒸发皿的余热蒸干,这样做的理由是若持续加热会出现固体飞溅的状况。
这是简单处理,得到的盐晶体还需进一步提纯(粗盐中一般含有很多杂质离子化合物以及卤素单质或化合物)。
粗盐中含有Mg2+、Ca2+、SO42-。
去除杂质步骤:
1、溶解。
2、加入过量BaCl2(去除硫酸根离子)。
3、加入过量NaOH(去除镁离子)。
4、加入过量Na2CO3(去除钙离子)。
5、过滤。
6、往滤液中加入过量HCl(除去过量药物)。
7、蒸发。

粗盐提纯知识点一、概述粗盐是指海水或地下水中含有的盐类物质,经过简单的加工处理而得到的一种原始的盐类产品。
粗盐中含有大量的杂质和微量元素,需要进行提纯才能达到食品级别的标准。
本文将介绍粗盐提纯的知识点。
二、粗盐提纯方法1. 溶解法将粗盐溶解在水中,利用溶液中不同离子间的电化学性质和晶体生长条件的差异,使其形成晶体,再通过过滤、离心等方法分离出晶体,即可得到纯净的食用盐。
2. 结晶法将粗盐溶解在热水中,然后放置静置冷却结晶。
在结晶过程中,不同离子之间会形成不同形状和大小的结晶体,在适当条件下进行分离即可获得纯净食用盐。
3. 蒸发法将粗盐溶解在水中后进行蒸发处理,使其逐渐浓缩并结晶。
通过控制蒸发速度和温度等条件可以获得不同品质和颜色的食用盐。
三、粗盐提纯过程中需要注意的事项1. 水质要求高,不应含有过多的杂质和微生物。
2. 加工设备应保持清洁卫生,防止污染。
3. 粗盐溶解时应控制温度和搅拌速度,避免过度溶解和结晶不完整。
4. 结晶过程中要注意控制温度和结晶速度,避免形成大块的结晶体。
5. 提纯后的食用盐应进行包装密封,防止污染和潮湿。
四、粗盐提纯后的营养价值1. 食用盐是人体必需的一种无机物质,可以维持人体正常的水电解质平衡。
2. 食用盐中含有丰富的氯离子和钠离子,可以促进胃液分泌,帮助消化食物。
3. 食用盐中还含有一些微量元素如碘、锌等对人体健康有重要作用。
五、粗盐提纯后的适宜人群1. 普通健康人群:适量食用食用盐可以维持身体正常的水电解质平衡,促进消化。
2. 高血压患者:应减少食用盐的摄入量,以防止血压升高。
3. 肾病患者:应根据医生建议控制食用盐的摄入量。
4. 孕妇和儿童:应注意适量食用含碘盐,以保证身体健康发育。
六、结语粗盐提纯是一项重要的加工技术,可以将原始的海水或地下水中提取出纯净的食用盐。
在提纯过程中需要注意控制水质、温度等因素,获得高品质的食用盐。
食用盐对人体健康有重要作用,但需要注意适量摄入。

粗盐提纯考点梳理一、背景介绍在日常生活中,粗盐是我们经常使用的一种食盐。
然而,粗盐中含有杂质,质量较低。
为了提高粗盐的质量,人们常常需要对其进行提纯处理。
粗盐提纯是通过去除杂质,使得盐的纯度更高,从而提高其品质和可用性。
二、提纯过程1. 去除杂质粗盐中的杂质主要包括泥土、石头、植物残渣等。
首先,需要将粗盐放入水中搅拌,使杂质与水分离。
然后,通过过滤的方式去除悬浮在水中的杂质颗粒。
最后,通过蒸发水分的方式,将溶解在水中的杂质去除。
2. 结晶过程经过去除杂质的处理,得到的是盐水溶液。
为了得到纯净的盐,需要将盐水溶液进行结晶。
可以通过加热或者自然蒸发的方式进行结晶。
在结晶过程中,纯净的盐晶体会逐渐形成并沉淀到底部。
然后,将盐晶体进行分离,即可得到提纯后的粗盐。
三、提纯方法1. 湖盐提纯法湖盐是指从地下或地表的湖泊中提取的盐。
湖盐提纯法是通过将湖盐溶解在水中,去除其中的杂质,再进行结晶分离的方式进行提纯。
这种方法适用于湖盐中杂质含量较低的情况。
2. 海盐提纯法海盐是指从海水中提取的盐。
海盐提纯法是通过将海水进行蒸发,使得其中的盐结晶并沉淀到底部,然后将盐晶体进行分离,得到提纯后的盐。
这种方法适用于海盐中杂质含量较低的情况。
3. 溶解结晶提纯法溶解结晶提纯法是将粗盐溶解在水中,然后通过逐渐蒸发水分的方式进行结晶分离,得到提纯后的盐。
这种方法适用于粗盐中杂质含量较高的情况。
四、注意事项1. 提纯过程中需要注意保持卫生,避免外界的污染。
2. 结晶过程中要控制温度和湿度,以确保盐晶体的纯度和质量。
3. 在提纯过程中,可以根据需要进行多次结晶分离,以提高盐的纯度。
粗盐提纯是通过去除杂质,使得盐的纯度更高的过程。
常见的提纯方法包括湖盐提纯法、海盐提纯法和溶解结晶提纯法。
在进行提纯过程中,需要注意卫生、控制温湿度,并可以进行多次结晶分离以提高盐的纯度。
通过提纯处理,粗盐可以得到提高,从而提高其品质和可用性。
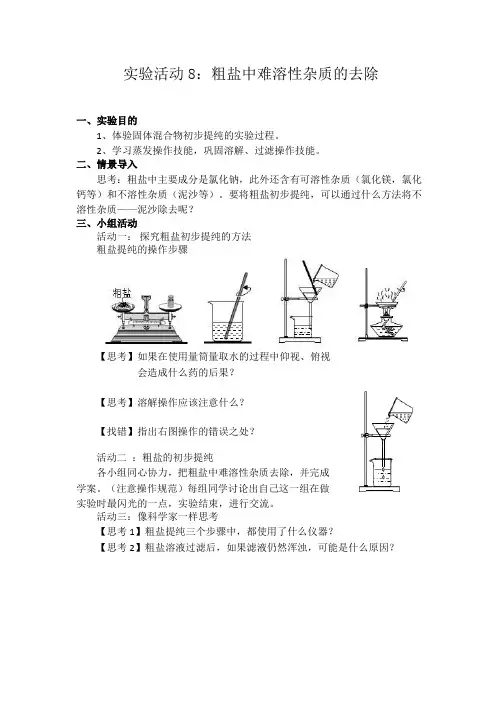
实验活动8:粗盐中难溶性杂质的去除
一、实验目的
1、体验固体混合物初步提纯的实验过程。
2、学习蒸发操作技能,巩固溶解、过滤操作技能。
二、情景导入
思考:粗盐中主要成分是氯化钠,此外还含有可溶性杂质(氯化镁,氯化钙等)和不溶性杂质(泥沙等)。
要将粗盐初步提纯,可以通过什么方法将不溶性杂质——泥沙除去呢?
三、小组活动
活动一:探究粗盐初步提纯的方法
粗盐提纯的操作步骤
【思考】如果在使用量筒量取水的过程中仰视、俯视
会造成什么药的后果?
【思考】溶解操作应该注意什么?
【找错】指出右图操作的错误之处?
活动二:粗盐的初步提纯
各小组同心协力,把粗盐中难溶性杂质去除,并完成
学案。
(注意操作规范)每组同学讨论出自己这一组在做
实验时最闪光的一点,实验结束,进行交流。
活动三:像科学家一样思考
【思考1】粗盐提纯三个步骤中,都使用了什么仪器?
【思考2】粗盐溶液过滤后,如果滤液仍然浑浊,可能是什么原因?
【思考3】本实验提取得到的精盐是否是纯净物?是否可能还含有其他杂质?说出你判断的理由?
请同学们思考:如果我们想进一步除去粗盐中的可溶性物质(MgCl2、CaCl2等),你有什么办法吗?。


粗盐提纯实验的具体步骤及常见问题解决办法粗盐提纯具体步骤(含过滤蒸发)一、实验目的1.掌握溶解、过滤、蒸发等实验的操作技能.2.理解过滤法分离混合物的化学原理.3.体会过滤的原理在生活生产等社会实际中的应用.二、实验仪器和药品药品:粗盐,水器材:托盘天平,量筒,烧杯,玻璃棒,药匙,漏斗,铁架台(带铁圈),蒸发皿,酒精灯,坩埚钳,胶头滴管,滤纸,剪刀,火柴,纸片三、实验原理粗盐中含有泥沙等不溶性杂质,以及可溶性杂质如:等.不溶性杂质可以用溶解、过滤的方法除去,然后蒸发水分得到较纯净的精盐.四、实验操作 1.溶解用托盘天平称取5克粗盐(精确到0.1克).用量筒量取10毫升水倒入烧杯里.用药匙取一匙粗盐加入水中,观察发生的现象.用玻璃棒搅拌,并观察发生的现象(玻璃棒的搅拌对粗盐的溶解起什么作用?).接着再加入粗盐,边加边用玻璃棒搅拌,一直加到粗盐不再溶解时为止.观察溶液是否浑浊.在天平上称量剩下的粗盐,计算在10毫升水中大约溶解了多少克粗盐.2.过滤按照化学实验基本操作6所述方法进行过滤.仔细观察滤纸上的剩余物及滤液的颜色.滤液仍浑浊时,应该再过滤一次.如果经两次过滤滤液仍浑浊,则应检查实验装置并分析原因,例如,滤纸破损,过滤时漏斗里的液面高于滤纸边缘,仪器不干净等.找出原因后,要重新操作.3.蒸发把得到的澄清滤液倒入蒸发皿.把蒸发皿放在铁架台的铁圈上,用酒精灯加热.同时用玻璃棒不断搅拌滤液.等到蒸发皿中出现较多量固体时,停止加热.利用蒸发皿的余热使滤液蒸干.4.用玻璃棒把固体转移到纸上,称量后,回收到教师指定的容器.比较提纯前后食盐的状态并计算精盐的产率.五、实验总结过滤操作中的问题探析过滤是最常用的分离液体和固体的实验操作.现行的初中化学教材中仅粗浅地介绍了过滤的操作要点,而实际操作过程中,往往会遇到许多细节性的问题.笔者结合教学实际,就过滤操作中经常遇到的问题谈一下自已的解决办法,仅供参考.(一)、怎样选择漏斗和滤纸?漏斗的大小主要取决于要过滤的沉淀的量或析出固体的量,而不是看液体的体积.沉淀量或固体量较多,则所选用的漏斗就大,反之亦然.漏斗的圆锥角应为60°.管径粗细适宜,太粗难以保持水柱,太细则水流速度慢,过滤需要的时间过长.管径末端应稍微倾斜.滤纸的选择依据所做的实验来定.滤纸分定性滤纸和定量滤纸.定性滤纸在过滤操作中主要用于研究物质的物理性质和化学性质;定量滤纸主要用于物质的定量分析.在中学实验中,过滤操作常用于定性实验,所以大多用定性滤纸.选好的滤纸放入漏斗后,纸的边缘要比漏斗边缘低5毫米左右为宜.(二)、怎样组装过滤器? 首先,将选好的滤纸对折两次,第二次对折要与第一次对折的折缝不完全重合.当这样的滤纸放入漏斗(顶角60°)中,其尖角与漏斗壁间有一定的间隙,但其上部却能完好贴在漏斗壁上.这样装成的过滤器比所有表面都贴在漏斗上的过滤器的过滤速度更快.对折时,不要把滤纸顶角的折缝压得过扁,以免削弱尖端的强度.然后剪去三层纸那边的两层的小角,以便在湿润后,滤纸的上部能紧密地贴在漏斗壁上.其次,将叠好的滤纸放入合适的漏斗中,用洗瓶的水湿润滤纸,用手指把滤纸上部1/3处轻轻压紧在漏斗壁上.把水注入漏斗时,漏斗颈应充满水,或用手指堵住漏斗颈末端,使其充水至漏斗顶角稍上部为止.漏斗颈保持有连续的水柱,会产生向下的引力,加速了过滤过程.(三)、怎样正确地进行过滤?在过滤时,玻璃棒与盛有过滤液的烧杯嘴部相对着;玻璃棒末端和漏斗中滤纸的三层部分相接近,但不能触及滤纸;要保持垂直(笔者认为玻璃棒斜立易导致过滤液外溢);漏斗的颈部尖端紧靠接收滤液烧杯嘴部的内壁.每次转移的液体不可超过滤纸高度的三分之二,防止滤液不通过滤纸而由壁间流出.对于残留在烧杯里的液体和固体物质应该用溶剂或蒸馏水按少量多次的原则进行润冲,将洗液全部转移到漏斗中进行过滤.(四)、怎样正确洗涤沉淀物?如果需要洗涤沉淀物,则应立即进行洗涤,否则沉淀物在滤纸上放置过久会开裂或结块,不易润洗.可用原溶剂、蒸馏水或其它适当的洗涤剂进行润洗.换一个洁净的空烧杯以代替原来接受滤液的烧杯,这样可以避免因沉淀穿透滤纸而要重新过滤大体积的液体.每次洗液用量以能浸没所收集的沉淀物为宜.洗涤时,用少量洗液小心沿四周从上而下冲洗,将沉淀冲到漏斗底部,不可使液体流速过猛,否则会使沉淀冲出过滤器.也不可用玻璃棒搅拌漏斗内的物质,以免划破滤纸,前功尽弃.一般洗2到3次左右,可基本洗净(五)、怎样检验沉淀物是否洗净?可根据沉淀物上可能检出的杂质类别,在最后一次洗出液中加入适宜的试剂,来检验洗涤程度.如过滤Na2SO4、BaCl2两溶液恰好完全反应后的混合物时,要检验沉淀物是否洗净,应选择AgNO3溶液.若在最后一次洗出液中加入AgNO3溶液无沉淀(AgCl)生成,则说明沉淀已洗净.(六)、过滤时,滤液过多而超出滤纸边缘或滤纸被划破怎么办?可用少量原溶剂冲洗漏斗和滤纸2到3次,原滤液连同洗液重新进行过滤.(七)、分离沉淀和液体是否必需用过滤操作?否.当分离的沉淀量很少时,可盛物于离心试管内,用离心机进行常温下沉淀分离.用吸管吸取沉淀上清液.根据需要可进行洗涤后再离心分离.只有当沉淀量较多时,才适宜用过滤法分离(八)、过滤操作是否还有其他方式?有.要使过滤速度快,且方便洗涤,可用布氏漏斗进行减压抽滤,这使得过滤和洗涤费时少,而且便于洗涤;当过滤需要在一定温度下进行时应选用保温漏斗进行过滤。


高一化学粗盐提纯的知识点盐,是我们日常生活中必不可少的调味品之一。
而粗盐,作为盐的一种形式,存在于我们的餐桌上。
然而,粗盐并不适合直接食用,它需要经过提纯处理才能达到食用标准。
本文将为大家介绍高一化学中有关盐的知识点,包括盐的提纯过程、原理以及相关的实验操作。
首先,我们来了解一下盐的提纯过程。
盐的提纯主要通过溶解、过滤、结晶三个步骤来实现。
第一步是溶解。
将粗盐加入适量的水中,并充分搅拌使盐溶解于水中。
在这个过程中,需要注意的是控制好溶解的温度,以避免产生不必要的反应。
第二步是过滤。
在溶解完成后,使用滤纸或滤筒进行过滤,将溶液中的杂质分离出来。
这一步的目的是去除溶解过程中可能残留的固体杂质,使溶液更加纯净。
第三步是结晶。
将过滤后的溶液缓慢加热,使其水分逐渐蒸发。
通过降低溶液的温度,可以促使盐结晶析出。
这一步骤需要注意加热的温度和速度,过高的温度可能导致盐结晶不纯。
以上便是盐的提纯过程,下面我们来了解一下盐的提纯原理。
盐的提纯原理主要涉及到物质的溶解度差异。
在溶解过程中,不同物质的溶解度是不同的。
我们利用这一差异,通过溶解、过滤、结晶等步骤,将溶液中的杂质去除,使得溶液中只剩下纯净的盐。
最后,我们了解一下实验操作中需要注意的一些细节。
首先是溶解过程中的温度控制。
盐的溶解度随温度的变化而变化,因此需要根据具体实验条件来控制溶解的温度,以保证溶解过程的顺利进行。
其次是过滤操作。
过滤时可以使用滤纸或滤筒,根据实际需要选择合适的过滤方式。
过滤时需要注意过滤液的流速,过快的流速可能导致过滤效果不理想。
最后是结晶操作。
加热结晶时要控制好加热温度和速度,避免过高的温度导致盐结晶不纯。
在结晶时,可以通过搅拌或震荡溶液来促进结晶的进行。
综上所述,高一化学中学习和掌握盐的提纯知识是非常重要的。
通过了解盐的提纯过程、原理以及相关的实验操作,我们可以更好地理解盐的性质和应用,同时也培养了我们的实验操作能力。
希望本文能够对大家在学习化学中有所帮助,让大家更好地理解和应用盐的相关知识。
实验2 粗食盐的提纯一、实验目的1.了解提纯氯化钠的原理和方法。
2.掌握称量、加热、溶解、过滤、蒸发浓缩、结晶、干燥等基本操作。
SO-、Ca2+、Mg2+离子的鉴定方法。
3.学习溶液中24二、实验原理SO-、Ca2+、Mg2+和K+等可溶性杂粗食盐中含有泥沙等不溶性杂质及24质。
将粗食盐溶于水后,用过滤方法可除去不溶性杂质。
可溶性杂质2SO-、Ca2+、Mg2+离子可通过加沉淀剂使之生成沉淀而除去,K+离子4由于含量较少,在最后的浓缩结晶过程中将处于不饱和状态留在母液中,从而与析出的氯化钠晶体分离。
除杂过程中有关的离子反应方程式如下:SO-= BaSO4(s)Ba2++24CO-= CaCO3(s)Ca2++23CO-= Mg2(OH)2CO3(s)2Mg2++2OH-+23CO-= BaCO3(s)Ba2++232CO-+2H+= CO2(g)+H2O3三、仪器和试剂仪器:台秤,烧杯(100 mL)2个,量筒,玻棒,酒精灯,洗瓶,普通漏斗,漏斗架,表面皿,蒸发皿,铁三脚架,石棉网,泥三角,布氏漏斗,抽滤瓶,水泵。
药品:粗食盐(NaCl),BaCl2(1 mol·L-1),NaOH(2 mol·L-1),Na2CO3(饱和),HCl(6 mol·L-1),HAc(6 mol·L-1),(NH4)2C2O4(饱和),镁试剂。
其它:pH试纸、滤纸。
四、实验内容1.粗食盐的提纯(1)称量和溶解用台秤称取8.0 g粗食盐,放入100 mL烧杯中,量取水30 mL,倒入烧杯,用酒精灯加热。
搅拌溶液使氯化钠晶体溶解。
溶液中不溶性杂质若量多,需先过滤除去,若量少可留待下一步过滤时一并除去。
SO-离子将食盐溶液加热至沸,用小火维持微沸。
边搅拌,(2)除去24SO-全都变成边逐滴加入1.0 mol·L-1BaCl2溶液约2 mL,至溶液中的24BaSO4沉淀。
取下烧杯静置,待溶液中的沉淀沉降后,沿烧杯壁往上SO-离层清液中滴几滴6mo1·L-1HCl和2滴1mo1·L-1BaCl2溶液,检查24SO-沉淀完全,继续加热5 min,子是否除尽。