电镀铬溶液成分分析
- 格式:doc
- 大小:29.50 KB
- 文档页数:2

电镀添加剂之电镀液分析电镀添加剂在使用过程中经常需要分析镀液,一般的电镀厂没有自己的化验室,我们公司可以为客户分析化验电镀添加剂镀液,电镀厂就能随时掌控电镀槽镀液的情况。
常见电镀液的分析方法一、酸性镀锌(硫酸盐镀锌)1、锌测定:取镀液10ml于100容量瓶中,加水至刻度,取此稀释液5ml,加水30ml,逐滴滴加1:1NH3·H2O调至微浑浊,加入1:4三乙醇胺10ml,pH=10缓冲溶液5ml,EBT指示剂少许,用0.05mol/lEDTA标准液滴定至兰色。
CZnSO4·7H2O=M×V×288/n (g/l)M——EDTA标准液浓度,mol/lV——消耗EDTA标准液体积,mln——吸取镀液毫升数。
2、铝的测定取镀液1ml于250ml锥形瓶中,加水50mL,加入0.05mol/lEDTA标准液40ml,pH=5的缓冲溶液15ml,煮沸2min,冷却,加XO2滴,用0.05mol/l标准锌溶液滴定至紫红色,体积不记。
加NH4F1.5g,加热近沸腾,冷却,补加XO1~2滴,用0.05mol/l标准锌溶液滴定至紫红色为终点。
CAl2(SO4)3·18H2O=MV×666.4/2 (g/l)M——锌标准溶液浓度,mol/lV——EDTA标准溶液体积,ml666.4——Al2(SO4)3·18H2O分子量3、氯化物测定取镀液10ml于100容量瓶中,加水至刻度,取此稀释液5ml于250ml锥形瓶中,加水100mL,1ml5%K2CrO4指示剂,以0.1mol/lAgNO3标液滴定至白色沉淀中有红色沉淀为终点。
CnaCl=MV×58.5/0.5 (g/l)M——AgNO3标液浓度mol/lV——AgNO3消耗标准液体积,ml试剂:5%K2CrO4指示剂:5gK2CrO4溶于95ml水中;0.1mol/lAgNO3标准溶液二、钾盐镀锌(氯化钾镀锌添加剂)1、锌测定:同“一中1”2、NaCl测定:同“一中2”3、H3BO3测定取500ml镀液,预先调pH=5左右。

电镀铬液的管理方法保证铬槽溶液配比浓度正确、稳定一致,是获得结构紧凑的镀铬层、提高铬层质量的重要环节。
因此,首先要做到铬液的各种化学成分纯,且配比要精确。
1、镀铬溶液的成分镀铬溶液的基本成分是铬酐和硫酸,按铬酐浓度可分为低、中、高浓度3种,凹版镀铬采用的都是中浓度镀铬液,即铬酐浓度为180~250g/L的镀液。
铬酐含量为250g/L、硫酸根含量为2.5g/L的镀液称为标准镀铬液,多用于镀硬铬。
多数制版公司的镀铬液组成成分如下:①铬酐(CrO3),含量为190~250g/L。
②硫酸(H2SO4),含量为1.9~2.5g/L。
铬酐与硫酸的比值为:CrO3∶H2SO4=100∶1,实际生产条件不同,比值会在100∶(0.8~1.2)波动。
2、镀铬溶液的配制①将计算量的铬酐放入槽中,加入总体积三分之二的去离子水,加热至50~60℃,边加热边搅拌溶液,然后稀释至总体积。
因工业用铬酐含有0.4%左右的硫酸根,应取样分析后,再添加化学纯硫酸至工艺规范,搅拌均匀。
②在镀铬过程中,阴极反应如下:2H++2e→H2↑Cr2O7-2 +8H++6e→Cr2O3+4H2O③配置镀铬液所用的铬酐等原材料一定要纯,每批材料要稳定。
有些公司由于原材料不纯、不稳定,出了问题很难找出原因。
有的公司选用俄罗斯的铬酐,纯度较高;有的公司选用新疆产的铬酐,质量也不错。
铬酐含硫酸量不同,会使硫酸的用量配比有出入,应掌握其规律。
3、生产注意事项①注意铬酐浓度的影响一般镀液的铬酐浓度在190~250g/L范围内变化,随着铬酐浓度升高,镀液导电率提高,覆盖能力亦有提高,而阴极电流效率降低。
加入某些添加剂后,浓度影响降到次要位置。
通常镀液浓度可由比重法测定,铬酐含量与波美度的关系如表3所示。
②注意硫酸浓度的影响在镀铬过程中,硫酸起着催化剂的作用,溶解碱式铬酸盐胶膜,使铬能顺利析出。
硫酸浓度对铬层质量影响很大,重要的是铬酐和硫酸的比值,而不是硫酸的绝对含量。

普通镀铬液中铬酐及三价铬含量分析—.实睑目的1.掌握摩尔盐标淮溶液配制与标定。
2.掌握镀铬溶液中铬酐含量及三价铬含量测定方法。
二、实验原理镀铬溶液中的铬主要是以六价铭状态存在,呈Cr 2O 72-形式,在酸性溶液中,以P.A 酸作指示剂,用摩尔盐标准溶液进行滴定,当溶液由紫红色转变为绿色时,即表示终点到达,其反应如下式所示:Cr 2O 72-+6Fe 2++14H +=2Cr 3++6Fe 2++7H 2O分析Cr 3+时应先用氧化剂,如Na 2O 2或(NH 4)2S 2O 8等,将Cr 3+氧化成Cr 2O 42-或Cr 2O 72-离子,然后再在强酸性介质中,用摩尔盐标准溶液滴定至终点。
氧化Cr 3+时,若在强碱性介质中,反应式为:2CrO 2-+3Na 2O 2+2H 2O=Cr 2O 42-+6Na ++4OH -若在强酸性介质中用(NH 4)2S 2O 8氧化,反应式为:2Cr 3++3S 2O 82-+7H 2O=(Ag +催化)=Cr 2O 72-+6SO 42-+14H +三、实验仪器及试剂(1)仪器:电子天平、台秤、500mL 容量瓶、25mL 移液管、量筒、500mL 锥形瓶、滴定管。
(2)试剂:K 2Cr 2O 7(分析纯、基准物)、(NH 4)2Fe (SO 42-)2▪6H 2O (分析纯)P.A 酸指示剂(0.2g 邻苯氨基苯甲酸溶于100mL0.2%的无水碳酸钠溶液中)、H 2SO 4(ρ=1.84g▪cm -3)、(NH 4)2S 2O 8、1%AgNO 3。
四、实验步骤1.0.1mol▪L -1摩尔盐[(NH 4)2Fe(SO4)2▪6H 2O]标准液配制与标定(1)配制:称取(NH 4)2Fe(SO4)2▪6H 2O 约20g ,溶于冷的250mL 5:95的稀H 2SO 4溶液中。
溶解后,以5:95的稀H 2SO 4溶液稀样至500mL 。
(2)标定:取分析纯的K 2Cr 2O 7于105〜110℃烘箱内干燥2h ,置于干燥器中冷却20~25min 。

电镀液配方分析电镀液配方分析密度包括质量密度和相对密度。
质量密度是指物质单位体积的质量。
它与物体的体积和质量之间的关系可以用下式表示:Ρ=(2-3-1)式中ρ—质量密度(g/cm3或kg/dm3)m—物质的质量(g或kg)v—物质的体积(cm3或dm3,其单位与质量单位相对应)。
相对密度是指在共同的特定条件下,第一物质的质量密度ρ1与第二物质的质量密度ρ2之比,常用d表示:d=(2-3-2)因此,只要知道了物质的质量密度就可根据式(2-3-2)求得。
同时,也可根据式(2-3-1),求算物质的质量或体积。
这样对一些液体试剂,尤其是有腐蚀性的试剂,如在电镀中常用的浓硝酸、浓硫酸、浓盐酸等,因称量的质量和起质量密度,计算出相应体积,然后再量取一定体积的该试剂。
这样操作简捷快速,可减少对设备的腐蚀。
[例1]要配制25g/L的硫酸溶液50L,问应量取质量密度为1.84g/cm3、质量分数浓度为98%的浓硫酸多少体积?解:要求欲量取的体积,首先计算所需浓硫酸的质量m,m=25g/L×50L×1/0.98=1275.5g 根据式(2-3-1),v===693.2cm3l只要用量筒量取693.2ml浓硫酸,用水稀释至50L即可。
由上可知,要进行质量与体积的折算,首先需知液体的质量密度,而液体的质量密度可以由密度计直接测得。
质量密度测量密度计是一个封闭严密的玻璃管,管的上端一段细长,中间一段胶粗,下端有一个装着水银或者铅粒的玻璃泡。
因为其重心靠近下端,所以能竖直地浮在液体内。
上部的细长筒内附有纸做的刻度尺,液面所对应的标尺上的数字就是该溶液的质量密度和相应的波美度值。
把密度计放在密度不同的液体内,它沉入的深度不同。
液体的密度越大,密度计沉入的深度越小,这种下沉深度的大小与密度有一定的反比关系,因而密度计上的刻度可直接指示液体密度,使用起来很方便。
在生产中,有时用波美度(O Be’)来表示密度。

电镀铬溶液成分分析电镀铬溶液成分分析项目a 、铬酸酐 CrO 3b 、硫酸 H 2SO 4c 、三价铬 Cr 3+4、电镀铬溶液成分分析方法4.1铬酸酐的测定—硫酸亚铁铵滴定法4.1.1分析原理在硫酸溶液中,以邻苯氨基苯甲酸为指示剂,用硫酸亚铁铵还原滴定六价铬。
2H 2CrO 4+6H 2SO 4+6FeSO 4=Cr 2(SO 4)3+3Fe 2(SO 4)3+8H 2O4.1.2分析用试剂a 、1∶1硫酸溶液(硫酸符合GB/T625规定);b 、邻苯氨基苯甲酸指示剂0.2%(配制见5.1);c 、硫酸亚铁铵标准溶液~0.1N(配制见5.2)。
4.1.3分析方法a 、移取镀液0.5ml 放入250ml 锥形瓶中,加水100ml 。
b 、加入1∶1硫酸溶液15ml ,冷却后加邻苯氨基苯甲酸指示剂3滴,以硫酸亚铁铵标准溶液滴定至紫红色转为亮绿色为终点。
计算镀液中铬酸酐含量G1 G1=100010005.03.33·V N g/l 式中:N —硫酸亚铁铵标准溶液的当量浓度V —耗用的硫酸亚铁铵标准溶液的量,ml33.3 —铬酸酐的当量硫酸的测定—硫酸钡重量法4.2.1分析原理硫酸根与氯化钡生成不溶于水的硫酸钡溶液,从而定量地测定镀液中硫酸根含量。
同时用乙醇将六价铬还原成三价铬,以防止六价铬与氯化钡生成铬酸钡沉淀影响测定结果。
BaCl 2+H 2SO 4=BaSO 4+2HCl2H 2CrO 4+6HCl+3C 2H 5OH=2CrCl 3+3CH 3CHO+8H 2O4.2.2分析用试试剂a 、氯化钡溶液 10% 过滤后b 、乙醇混合液(乙醇:盐酸:乙酸 1:1:1)c 、2∶98盐酸溶液(盐酸符合GB/T622规定)4.2.3分析方法移取镀液5ml ,放入400ml 高型烧杯中,加水至150ml ,乙醇混合液30ml 后,煮沸后,趁热慢慢滴加10%氯化钡溶液10ml ,在不停的搅拌下沸腾5min ,静置过夜。
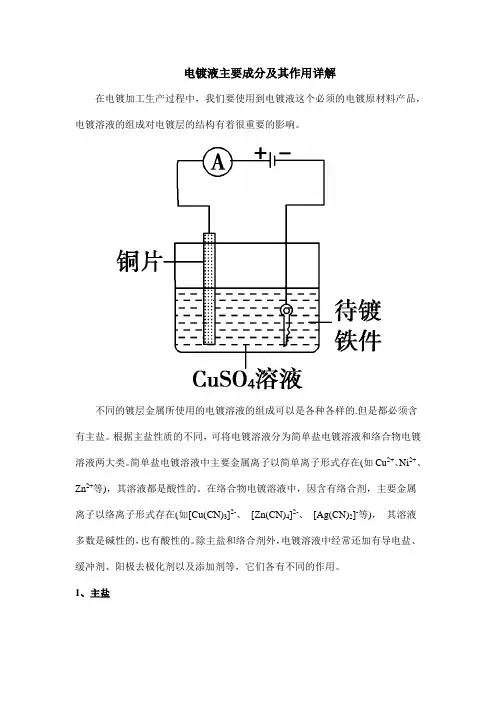
电镀液主要成分及其作用详解在电镀加工生产过程中,我们要使用到电镀液这个必须的电镀原材料产品,电镀溶液的组成对电镀层的结构有着很重要的影响。
不同的镀层金属所使用的电镀溶液的组成可以是各种各样的.但是都必须含有主盐。
根据主盐性质的不同,可将电镀溶液分为简单盐电镀溶液和络合物电镀溶液两大类。
简单盐电镀溶液中主要金属离子以简单离子形式存在(如Cu2+、Ni2+、Zn2+等),其溶液都是酸性的。
在络合物电镀溶液中,因含有络合剂,主要金属离子以络离子形式存在(如[Cu(CN)3]2-、[Zn(CN)4]2-、[Ag(CN)2]-等),其溶液多数是碱性的,也有酸性的。
除主盐和络合剂外,电镀溶液中经常还加有导电盐、缓冲剂、阳极去极化剂以及添加剂等,它们各有不同的作用。
1、主盐主盐能够在阴极上沉积出所要求的镀层金属的盐。
主盐浓度高,溶液的导电性和电流效率一般都较高,可使用较大的电流密度,加快了沉积速度。
在光亮电镀时,镀层的光亮度和整平性也较好。
但是,主盐浓度升高会使阴极极化下降,出现镀层结晶较粗,镀液的分散能力下降,而且镀液的带出损失较大,成本较高,同时还增加了废水处理的负担。
主盐浓度低,则采用的阴极电流密度较低.沉积速度较慢,但其分散能力和覆盖能力均较浓溶液好。
因此,主盐浓度要有一个适当的范围,并与溶液中其他成分的浓度维持一个适当的比值。
有时,由于使用要求不同,即使同一类型的镀液,其主盐含量范围也不同。
对于电镀形状复杂的零件或用于预镀、冲击镀时,要求较高的分散能力,一般多采用主盐浓度低的电镀溶液。
而快速电镀的溶液,则要求主盐含量高。
2、导电盐导电盐能提高溶液的电导率,而对放电金属离子不起络合作用的物质。
这类物质包括酸、碱和盐,由于它们的主要作用是用来提高溶液的导电性,习惯上通称为导电盐。
如酸性镀铜溶液中的H2SO4,氯化物镀锌溶液中的KCl、NaCl 及氰化物镀铜溶液中的NaOH和NaCO3等。
导电盐的含量升高,槽电压下降,镀液的深镀能力得到改善,在多数情况下,镀液的分散能力也有所提高。

铁管镀铬成份分析(1)铬酐铬酐的水溶液是铬酸,是铬镀层的惟一来源。
实践证明,铬酐的浓度可以在很宽的范围内变动。
例如,当温度在45~50°C,阴极电流密度I0A/dm2时,铬酐浓度在50~500g/L范围内变动,甚至高达800g/L 时,均可获得光亮镀铬层。
但这并不表示铬酐浓度可以随意改变,一般生产中采用的铬酐浓度为I50~400g/L之间。
铬酐的浓度对镀液的电导率起决定作用,图4-19所示为铬酐浓度与镀液电导率的关系。
可知在每一个温度下都有一个相应于最高电导率的铬酐浓度;镀液温度升高,电导率最大值随铬酐浓度增加向稍高的方向移动。
因此,单就电导率而言,宜采用铬酐浓度较高的镀铬液。
(2)催化剂除硫酸根外,氟化物、氟硅酸盐、氟硼酸盐以及这些阴离子的混合物常常作为镀铬的催化剂。
当催化剂含量过低时,得不到镀层或得到的镀层很少,主要是棕色氧化物。
若催化剂过量时,会造成覆盖能力差、电流效率下降,并可能导致局部或全部没有镀层。
目前应用较广泛的催化剂为硫酸。
硫酸的含量取决于铬酐与硫酸的比值,一般控制在Cr03:So4=(80~100):1,最佳值为100:1。
当So42-含量过高时,对胶体膜的溶解作用强,基体露出的面积大,真实电流密度小,阴极极化小,得到的镀层不均匀,有时发花,特别是凹处还可能露出基体金属。
(3)三价铬镀铬液中Cr6+离子在阴极还原产生Cr3+,与此同时在阳极_上重新被氧化,三价铬浓度很快达成平衡,平衡浓度取决于阴、阳极面积比。
Cr3+离子是阴极形成胶体膜的主要成分,只有当镀液中含有一定量的Cr3+时,铬的沉积才能正常进行。
因此,新配制的镀液必须采取适当的措施保证含有一定量的Cr3+。
①采用大面积阴极进行电解处理。
②添加还原剂将Cr6+还原为Cr3+,可以用作还原剂的有酒精、草酸、冰糖等,其中较为常用的是酒精(98%),用量为0.5mL/L。
在加入酒精时,由于反应放热,应边搅拌边加入,否则会使铬酸溅出。


镀铬溶液的化验方法镀铬溶液的化验方法◆铬酐的测定一、原理在硫酸溶液中六价铬被亚铁还原为三价铬:2H2CrO4+6H2SO4+6FeSO4=Cr2(SO4)3十3Fe2(SO4)3十8H2O以苯基代邻氨基苯甲酸指示反应终点。
二、试剂1、1:1硫酸:量取50毫升分析纯硫酸(比重1.84),缓缓倒入50毫升水中,摇匀。
2、苯基代邻氨基苯甲酸指示剂:称取0.27克苯基代邻氨基苯甲酸溶于5毫升5%碳酸钠溶液中,用水稀释至250毫升。
3.标准硫酸亚铁铰溶液:称取硫酸亚铁铰40克溶于500毫升5:95的稀硫酸中,溶解完毕后,如有浑浊,应过滤。
用5:95硫酸稀释至1升,使用前标定。
标定方法:用移液管吸标准0.lmol重铬酸钾溶液25毫升于500毫升锥形瓶中,加水175毫升及浓硫酸10毫升,冷却。
加入苯基代邻氨基苯甲酸指示剂8滴,溶液呈紫红色,用配制好的0.lmol硫酸亚铁铰溶液滴定至紫红色转为绿色为终点。
M=25×0.1000/V式中:M——标准硫酸亚铁铰溶液的摩尔浓度V——耗用标准硫酸亚铁铰溶液的毫升数三、分析方法:用移液管吸镀液5毫升于100毫升容量瓶中,加水稀释至刻度并摇匀,用移液管吸此溶液5毫升于250毫升锥形瓶中,加水75毫升1:1硫酸10毫升,再加苯基代邻氨基苯甲酸指示剂3滴,以标准0.lmol硫酸亚铁铵溶液滴定至紫红色变绿色为终点。
四、计算:Ccro3=(M×V×0.0333×1000)/0.25 (g/L)式中:M——标准硫酸亚铁铵溶液的摩尔浓度V——耗用标准硫酸亚铁铵溶液的毫升数◆三价铬价铬的测定一、原理三价铬在酸性溶液中,在硝酸银接触下,以过硫酸铰氧化成六价铬:Cr2(SO4)3十3(NH4)2 S2O8十8H2O=2H2CrO4十3(NH4)2SO4十6H2SO4然后测定总铬量,从总铬量中减去六价铅量,即得三价铬量。
过量的过硫酸铰经煮沸后完全分解。
2(NH4)2S2O8+2H2O===2(NH4)2SO4+2H2SO4+O2↑二、试剂1、1:1硫酸:配制方法同前。

化学镀铬工艺配方化学镀铬是一种常用的金属表面处理工艺,通过在金属表面生成一层致密、均匀的铬层,可以提高金属的硬度、耐磨性和耐腐蚀性。
以下是一种常见的化学镀铬工艺配方及其操作流程:一、工艺配方:1.酸性电镀液配方:-硫酸:500-600g/L-硫酸铜:20-30g/L-铬酸:25-35g/L-氯化锌:20-30g/L-氯化铵:25-35g/L-二乙基胺:20-30g/L2.中性电镀液配方:-硫酸:500-600g/L-硫酸铜:20-30g/L-铬酸:25-35g/L-氯化锌:20-30g/L-氯化铵:25-35g/L-中性镀铬添加剂:适量二、操作流程:1.去油洗净:将待处理的金属材料浸入去油剂中,去除表面的油污和杂质,然后用水冲洗干净。
2.酸性清洗:将金属材料浸入酸性清洗液中,去除表面的氧化层和其他污染物,然后用水冲洗干净。
3.硫酸铜液处理:将金属材料浸入硫酸铜液中,用电解的方式在表面镀铜层,这一步旨在提高镀铬层的平整度和附着力。
4.中性清洗:将金属材料浸入中性清洗液中,去除表面的铜沉积物,然后用水冲洗干净。
5.化学镀铬:将处理好的金属材料浸入化学镀铬液中,通过电解的方式在金属表面生成一层致密、均匀的铬层。
操作时需控制好温度、电流密度和镀铬时间,以确保铬层的质量和厚度。
6.清洗和抛光:将镀好铬的金属材料从电镀液中取出,用水清洗干净,然后进行抛光处理,使金属表面更加光滑。
7.脱脂处理:将金属材料浸入脱脂剂中,去除抛光过程中产生的脂肪和污渍,然后用水冲洗干净。
8.喷涂保护剂:为了增加镀铬层的耐腐蚀性和光泽度,可以在金属表面喷涂一层保护剂,并经过适当的烘烤处理。
以上是一种常用的化学镀铬工艺配方及其操作流程,具体的配方和操作参数根据不同的金属材料和要求可能会有所不同,需要根据实际情况进行调整和优化。
同时,在操作过程中需要注意安全措施,合理使用化学品并保持良好的通风环境,以避免对人体和环境造成伤害。

化学沉镍溶液分析1、次磷酸钠的测定准确吸取2.00mL 镀液于250mL 碘量瓶中,加入20-30mL 水,准确加入0.1mol/L 碘标准溶液25.00mL,迅速加入1:1盐酸25mL 盖好瓶塞(此时最好用水封防止吸出的碘挥发)在暗处放置30min 后打开塞子,用水冲洗瓶盖周围及瓶内壁.以0.1mol/L 硫代硫酸钠标准溶液滴定至浅黄色(滴定时不应剧烈振动),加入1%淀粉3mL .继续滴定至蓝色消失为终点. 计算:(C 1V 1-C 2V 2)*106/1000次磷酸钠(g/L)= 2 *2/1000式中 C 2 碘标准溶液的摩尔浓度V 2 碘标准溶液的体积C 1 标准硫代硫酸钠的摩尔浓度 V 1 耗用标准硫代硫酸钠的体积 2、氯化铵的测定用移液管吸取镀液1mL 置250mL 锥形瓶中,加水60-70mL,加饱和铬酸钾指示4滴,用0.1mol/L 标准硝酸银溶液滴定至由黄色变为砖红色为终点 计算:C*V*10-3*1/2*53.5氯化铵NH 4CL (g/L)=1*10-3式中C 标准硝酸银溶液摩尔浓度V 耗用标准硝酸银溶液的毫升数 53.5 氯化铵的分子量 3、硫酸镍的测定用移液管吸取镀液5mL 。
置于250mL 容量瓶中加水60-70mL 加PH=10的缓冲液10mL 加紫脲酸胺指示剂至淡黄色。
用0.1mol/L 标准EDTA 溶液滴定由黄色变为紫红色为终点。
(指示剂过量时,终点不明显) 计算:C*V*10-3*58.69镍Ni(g/L)=5*10-3C*V*10-3*280.8硫酸镍NiSO 4.7H 2O(g/L)=5*10-3式中:C 标准EDTA 溶液的摩尔浓度 V 耗用标准EDTA 溶液的毫升数 58.69 镍的分子量280.8 硫酸镍的分子量酸铜溶液的分析1、硫酸铜的测定用移液管吸取镀液1mL .置于250mL 锥形瓶中.加水60-70mL,加PH=10缓冲液10mL 至淡蓝色,PAN 4-5滴,用0.1mol/LEDTA 滴定至绿色为终点 计算:C*V*10-3*249.7硫酸铜CuSO 4.5H 2O(g/L)=1*10-3式中:C 标准EDTA 溶液的摩尔浓度 V 耗用标准EDTA 溶液的毫升数249.7 硫酸铜的分子量 2、、硫酸的测定用移液管吸取镀液1mL 。
电镀液成分检测电镀液的成分分析主要是化学分析法,即容量分析法。
有些镀种或工艺也采用比色分析法,对于电子电镀特别是微电子电镀,由于对微量元素或杂质成分敏感,在需要的时候需要用到各种物理分析法以确定微量元素的或杂质的成分。
以下主要是介绍了电镀液成分测定的相关方法和所用数据:1、锌的测定:试剂:①1:1HCHO(1 体积水与1 体积甲醛混合)②pH=10 缓冲溶液:54gNH4Cl 溶于水,加入350mlNH3〃H2O(比重0.89)加水稀释至1 升。
③EBT 指示剂:0.5g 铬黑T 加NaCl50g 研磨后,置于光口瓶密封④0.05mol/lEDTA 标准液配制:称取EDTA(A〃R)20g,以水加热溶解后,冷却,稀释至一升。
标定:称取纯金属锌0.4g 左右(小数点后四位)小数点后四位)于150ml 小烧杯中,以10ml1:1HCl 溶解,加热使溶解完全,冷却,移入100ml 容量瓶中,每次用10ml 左右纯水洗涤烧杯和玻璃棒,三次,全部转移至容量瓶中,加水稀释至标线,摇匀。
用移液管吸取20ml 该锌标液于250ml 锥形瓶中,加水50ml,以1:1NH3〃H2O 调至微浑浊,加入10ml pH=10 缓冲溶液及EBT 指示剂少许,摇匀,以配制好的0.05mol/lEDTA标准液滴定至由红色变为兰色为终点。
平行测定三次,取平均值。
M=G×200/(65.38V)M——EDTA 标准液浓度,mol/lG——锌质量,gV——消耗EDTA 标准液体积,ml测定方法:用移液管吸取镀液1ml 于250ml 锥形瓶中,加水50ml,pH=10 缓冲溶液5ml 及EBT 指示剂少许此时溶液应呈红色,加1:1HCHO5ml,用0.05mol/lEDTA 标准液滴定至兰色。
CZn2+ g/l=MV×65.38/nM——EDTA 标准液浓度,mol/lV——消耗EDTA 标准液体积,mln——吸取镀液毫升数2、游离NaCN 测定方法:吸取镀液2ml 于250ml 锥形瓶中,加水50ml,10%碘化钾2ml,以0.1mol/lAgNO3 标液滴定至有浑浊为终点。
1.氯化钾镀锌溶液分析成分:氯化锌、氯化钾及硼酸。
1.1 氯化锌的测定1.1.1 方法摘要在pH =10的溶液中,锌与EDTA 生成稳定的络合物,以铬黑T 指示。
Zn 2+ + HIn 2— → ZnIn — + H +铬黑T 锌-铬黑T(蓝色) (红色)ZnIn — + H 2Y 2— → ZnY 2— + HIn 2— + H +锌-铬黑T EDTA 锌-EDTA 铬黑T(红色) (蓝色)1.1.2 试剂1.1.2.1 氨-氯化铵缓冲溶液(pH =10)溶解54g NH 4Cl 于水中,加入350mL 浓氨水,加水稀释至1L 。
1.1.2.2 铬黑T 指示液(5g/L )称取0.5g 铬黑T 和2.0g 盐酸羟胺,溶于乙醇,用乙醇稀释至100mL 。
(或:0.5g 铬黑T 溶于75mL 三乙醇胺,加25mL 无水乙醇,混匀。
)1.1.2.3 氨水(10%)取10mL 氨水,加90mL 水,可配成100mL 溶液。
1.1.2.4 锌标准溶液(0.05mol/L )准确称取锌粒(含量≥99.9%)6.4~6.6g ,称准至0.0002g ,微热溶于(1+1)盐酸中,于容量瓶中稀释至2000mL ,摇匀。
其浓度按下式计算:式中 c Zn 2+——锌标准溶液之物质的量浓度,mol/L ;m ——称取锌粒之质量,g 。
1.1.2.5 EDTA 标准溶液(0.05mol/L )(1)配制称取20g 乙二胺四乙酸二钠,加热溶于1000mL 水中,冷却,摇匀。
(2)标定用移液管量取25.00mL 锌标准溶液(0.05mol/L ),加70mL 水,5滴铬黑T 指示液(5g/L ),用氨水溶液(10%)中和至溶液由紫红色恰变为橙色,加10mL 氨-氯化铵缓冲溶液(pH =10),用配制好的EDTA 标准溶液滴定至溶液由紫色变为纯蓝色。
同时作空白试验。
(3)计算乙二胺四乙酸二钠标准溶液浓度按下式计算:)(L mol m c Zn /238.652⨯=+式中:c (EDTA )——乙二胺四乙酸二钠标准溶液之物质的量浓度,mol/L ;V 1 ——乙二胺四乙酸二钠溶液之用量,mL ;V 2 ——空白试验乙二胺四乙酸二钠溶液之用量,mL 。
电镀槽液化验分析方法氰化铜镀液分析方法A、游离氰化钠含量分析:1、取镀液10ML;2、加50ML纯水;3、加10ML 10%典化钾;4、用0.1mol硝酸银滴定至混蚀为终点。
游离氰化钠含量(g/L)=0.1mol硝酸银滴定毫升数×0.981B、氰化铜含量分析:1、取镀液2ML;2、加100ML纯水;3、加1克过硫酸铵;4、加热至清澈;5、加10ML1:1的氨水;6、加PAN指示剂数滴;7、用0.1mol EDTA溶液滴定至绿色终点。
氰化铜含量(g/L)=0.1mol EDTA滴定毫升数×4.48焦铜镀液分析方法1、取镀液1ML,加180ML纯水;2、加热至40~50摄氏度;3、加PAN指示剂3滴;4、用0.05mol EDTA溶液滴定至绿色为终点。
焦铜含量(g/L)=0.05mol EDTA溶液滴定毫升×8.876焦钾含量(g/L)=Be×11.8-焦铜×1.1硫酸铜镀液分析方法A、硫酸铜含量分析:1、取镀液2ML;2、加纯水100ML;3、加10ML PH值为10的氨缓冲溶液,加PAN指示剂数滴;4、用0.1mol EDTA溶液滴定至绿色为终点。
硫酸铜含量(g/L)=0.1mol EDTA溶液滴定毫升数×12.49。
B、硫酸含量分析:1、取镀液2ML;2、加纯水100ML;3、加1滴甲基橙指示剂;4、用1mol 氢氧化钠滴定至黄色为终点。
硫酸含量(ML/L)=1mol氢氧化钠滴定毫升数×13.3×1.84(g/L)C、氯离子含量分析:1、取镀液25毫升;2、加25亳升纯水,加热至50摄氏度;3、加1~2亳升(1:1)硝酸;4、加1~2滴硝酸银溶液使试液混浊;5、用0.005mol硝酸汞滴定至澄清为终点。
氯离子含量(g/L)=0.005mol硝酸汞滴定毫升数×14.2镍镀液分析方法A、总镍含量分析方法:1、取镀液1ML,加纯水100ML;2、加10ML(1:1)氯水3、加0.2克紫尿酸铵指示剂;4、用0.1mol EDTA溶液滴定至紫色为终点。
电镀药水分析方法1电镀液分析方法盐酸(HCl含量):试剂:1N氢氧化钠标准滴定溶液酚酞指示剂步骤:1)用移液管精确吸取5ml溶液于250ml锥形瓶中;2)加入100ml DI水;3)加入1-2滴酚酞指示剂;4)用1N NaOH滴定,溶液由无色突变为浅红色时即为终点;5)记录所消耗的NaOH溶液的体积,用下式计算盐酸(HCl)含量: HCl %(V/V)= V NaOH ×N NaOH×2.1硫酸(H2SO4含量):试剂:0.1N氢氧化钠标准滴定溶液酚酞指示剂步骤:1)用移液管精确吸取5ml溶液于250ml锥形瓶中;2)加入100ml DI水;3)加入1-2滴酚酞指示剂;4)用1N NaOH滴定,溶液由无色突变为浅红色时即为终点;5)记录所消耗的NaOH溶液的体积,用下式计算盐酸(H2SO4)含量: H2SO4 %(V/V)= V NaOH ×N NaOH×1.05盐酸(HCl含量):试剂:1N氢氧化钠标准滴定溶液酚酞指示剂步骤:1)用移液管精确吸取1ml溶液于250ml锥形瓶中;2)加入100ml DI水;3)加入1-2滴酚酞指示剂;4)用1.0N NaOH滴定,溶液由无色突变为浅红色时即为终点;5)记录所消耗的NaOH溶液的体积,用下式计算盐酸(HCl)含量: HCl %(V/V)= V NaOH ×N NaOH×10.5氨基磺酸镍镍离子试剂:0.05N EDTA 标准滴定溶液MX(紫尿酸胺)指示剂氨水步骤:1)用移液管精确吸取1ml镀液于250ml锥形瓶中;2)加入100ml DI水;3)加入10ml氨水;4)加入0.2gMX指示剂;5)用0.05N EDTA滴定,溶液由褐色至蓝紫色时即为终点;6)记录所消耗的EDTA溶液的体积,用下式计算Ni含量:Ni(g/L)= V EDTA×C EDTA×58.7H3BO3试剂:0.1N氢氧化钠标准滴定溶液甘露醇BCP(溴甲酚紫)指示剂步骤:1)用移液管精确吸取1ml镀液于250ml锥形瓶中;2)加入20ml DI水;3)加入5g甘露醇;4)加入BCP指示剂4滴;5)用0.1N NaOH滴定,溶液由黄绿色变为蓝色时即为终点;6)记录所消耗的NaOH溶液的体积,用下式计算HBO3含量;H3BO3(g/L)= V NaOH×C NaOH×61.8NiCl2·6H2O(氯化镍)试剂:0.1N硝酸银标准滴定溶液2%铬酸钾指示剂步骤:1)用移液管精确吸取2ml镀液于250ml锥形瓶中;2)加入50ml DI水;3)加入2%铬酸钾指示剂1ml;4)用0.1N AgNO3滴定,溶液由亮黄色变为土黄色时即为终点;5)记录所消耗的AgNO3溶液的体积,用下式计算阳极活化剂含量:NiCl2·6H2O(g/l)V×N×59.5(二价锡)试剂:0.1N碘酸钾标准滴定溶液淀粉指示剂浓盐酸步骤:1)用移液管精确吸取2ml电镀溶液于250ml锥形瓶中;2)加入50ml DI水;3)加入50ml浓盐酸;4)加入1-2ml淀粉指示剂;5)用0.1N碘酸钾滴定,溶液由无色突变为蓝色时即为终点;6)记录所消耗的碘酸钾溶液的体积,用下式计算二价锡含量:Sn2+(g/L )= V KIO3× N KIO3×11.9×2.5铅离子的分析方法试剂:0.05M EDTA0.05M 硫酸锌30%双氧水20%三乙醇胺缓冲溶液(54g氯化铵溶于350ml浓氨水溶液中用去离子水配成1L溶液)铬黑T指示剂(1g和400g氯化钠混合)步骤:1)用移液管精确吸取5ml电镀溶液于250ml锥形瓶中;2)加入100ml DI水;3)精确量取0.05M EDTA 25ml;4)加2ml 双氧水;5)加5ml三乙醇胺;6)加20ml 缓冲溶液;7)加少许铬黑T;8)用0.05M 硫酸锌溶液从蓝色滴定到紫色为终点Pb2+ = (25-滴定量)×2.072 g/L= (V EDTA×C EDTA)-(V Zn×C Zn)×41.44常用标准溶液配制和标定以下所用一般试剂纯度为分析纯,基准试剂要求为优级纯。
镀铬溶液的组成1.目前,工业上广泛采用的还是铬酸酐溶液,如果在其中加入外来阴离子,可获得良好的铬镀层。
但由于铬酸酐公害严重,加上电流效率低,分散能差等缺点很难克服。
因此,国内外已试验成功了其他的镀铬工艺,例如三价铬镀铬工艺:等阴离被称为“环保铬” ( Envirochrome)工艺盒液为浓度很低的三价铬溶液。
三价铬镀铬的优点恰好是六价铬镀铬难以克服的缺点。
但六价铬镀铬所获得的加厚铬镀层的质量,却也是三价铬镀铬难以达到的缺点,曹人法相互取代。
2.此,防护-装饰性镀铬工艺,三价铬镀铬可逐步代替铬酸酐镀铬,但功能性镀硬铬、耐磨、加厚、松孔的铬镀层结构和性能是三价铬镀层较难涌过鹤三价铬镀铬工艺的电镀过程原理与一般电镀过程原理相似。
但六价铬镀铬过程原理有其特殊性。
镀铬溶液成分非常简单,主要成分是铬酸酐,再加入少量的所谓催化剂的硫酸、氟硅酸盐等阴离子,采用不溶性的铅及铅合金阳极便可进行镀铬。
镀铬时铬酸酐中的铬是以六价形式存在,铬酸酐易溶在铬酸酐电镀液中,所获得的结晶组织主要取能好(决于外来阴离子、温度、电流密度以及铬酸酐的浓度等。
例如,在不同温度及电流密度下能获借型的结晶组织,而且镀层颜色和性能也不同。
3.色镀层:当温度很低,电流密度很高时产,而当温度为30C时,任何电流密度都可以产。
这种镀层的性质是脆性很大,近似于玻璃,无受范性能,硬度较高,不能用在机械摩擦上。
网状裂纹,镀层组织则为粗大的: A网状裂纹,镀层组织则为粗大的立当温度与电流密【电镀设备厂】度在适当的范围所获流密度按铬镀层质量要求而定,可获得光亮,力学性能好,硬度高,耐磨性子的铬镀层,可用在需有反射性能的部件上。
镀层结晶组织比灰色镀层细致,为体心立方体品格,即型铬。
由型铬组成的铬镀层很稳定。
白色镀层:当温度很高(例如在65℃或(上),电流密度较低时,所得到的铬镀层韧性和受范性良好,即使受到较大的变形也不致脱落,较低,在薄镀层上没有裂纹。
这类乳防护-装饰铬或气密性镀方晶格,结晶也是o型铬。
电镀铬溶液成分分析项目
a 、铬酸酐 CrO 3
b 、硫酸 H 2SO 4
c 、三价铬 Cr 3+
4、电镀铬溶液成分分析方法
4.1铬酸酐的测定—硫酸亚铁铵滴定法
4.1.1分析原理
在硫酸溶液中,以邻苯氨基苯甲酸为指示剂,用硫酸亚铁铵还原滴定六价铬。
2H 2CrO 4+6H 2SO 4+6FeSO 4=Cr 2(SO 4)3+3Fe 2(SO 4)3+8H 2O
4.1.2分析用试剂
a 、1∶1硫酸溶液(硫酸符合GB/T625规定);
b 、邻苯氨基苯甲酸指示剂0.2%(配制见5.1);
c 、硫酸亚铁铵标准溶液 ~0.1N(配制见5.2)。
4.1.3分析方法
a 、移取镀液0.5ml 放入250ml 锥形瓶中,加水100ml 。
b 、加入1∶1硫酸溶液15ml ,冷却后加邻苯氨基苯甲酸指示剂3滴,以硫酸亚铁铵标准溶液滴定至紫红色转为亮绿色为终点。
计算镀液中铬酸酐含量G1 G1=10001000
5.03.33·⨯⨯⨯V N g/l 式中:N —硫酸亚铁铵标准溶液的当量浓度
V —耗用的硫酸亚铁铵标准溶液的量,ml
33.3 —铬酸酐的当量
硫酸的测定—硫酸钡重量法
4.2.1分析原理
硫酸根与氯化钡生成不溶于水的硫酸钡溶液,从而定量地测定镀液中硫酸根含量。
同时用乙醇将六价铬还原成三价铬,以防止六价铬与氯化钡生成铬酸钡沉淀影响测定结果。
BaCl 2+H 2SO 4=BaSO 4+2HCl
2H 2CrO 4+6HCl+3C 2H 5OH=2CrCl 3+3CH 3CHO+8H 2O
4.2.2分析用试试剂
a 、氯化钡溶液 10% 过滤后
b 、乙醇混合液 (乙醇:盐酸:乙酸 1:1:1)
c 、2∶98盐酸溶液(盐酸符合GB/T622规定)
4.2.3分析方法
移取镀液5ml ,放入400ml 高型烧杯中,加水至150ml ,乙醇混合液30ml 后,煮沸后,趁热慢慢滴加10%氯化钡溶液10ml ,在不停的搅拌下沸腾5min ,静置过夜。
然后用2∶98热盐酸溶液清洗沉淀数次,再用热水洗至无氯离子。
将滤纸和沉淀物移至已称重的恒重瓷坩埚中干燥灰化,以900℃高温烧至恒重,一小时。
称重:提前一天秤重恒重瓷坩埚,放入干燥器内,第二天称重后减去前一天恒重瓷坩埚的重量
计算镀液中硫酸含量G2 G2=10005
4202.0W ⨯⨯ g/l 式中:W —硫酸钡沉淀重量,g
5—移取稀释液换算成原镀液的体积,ml
0.4202 —硫酸钡换算成硫酸的系数
注意事项
a 、灼烧硫酸钡沉淀应在800~900℃内进行,温度太高会使沉淀分解;
b 、灼烧后如沉淀还有黄色,说明六价铬还原不完全,生成铬酸钡沉淀,试验应重做,减少取样量或酌量多加乙醇混合液;
c 、乙醇混合液中的冰乙酸是防止硫酸根与三价铬Cr 3+生成共价化合物,酸度也不能过高,以免硫酸根生成硫酸氢根。
这都会使硫酸钡沉淀不完全,影响测定结果。
三价铬的测定—硫酸亚铁铵滴定法
4.3.1分析原理
三价铬在硝酸银存在的酸性溶液中,以过硫酸铵氧化成六价铬,测定总铬量。
然后从总铬量中减去六价铬量即可得三价铬含量。
4.3.3分析方法
移取镀液0.5ml 放入500ml 锥形瓶中,加水100ml 、1∶1硫酸溶液15ml 、1%硝酸银溶液10ml 和10%过硫酸铵溶液20ml ,加热煮沸至冒大气泡2~3min 后滴加1∶1盐酸溶液至不再出现白色氧化银沉淀后再滴2滴,然后再煮沸3~5mm 。
待冷却后加邻苯氨基苯甲酸指示剂3滴,以硫酸亚铁铵标准溶液滴至溶液由紫红色转为亮绿色为终点。
记录消耗的硫酸亚铁铵标准溶液量V 。
4.3.4计算镀液中三价铬含量G3 G3=10001000
5.003.17··)(0⨯⨯- N V V g/l 式中:V —测定镀液中铬酸酐含量时,滴定消耗的硫酸亚铁铵标准溶液的量,ml
N —硫酸亚铁铵溶液的当量浓度
17.3 —铬的当量
0.5—移取镀液的量,ml。