2022年高考化学考点专题复习:元素周期表 元素周期律 刷题练习题(含答案解析)
- 格式:docx
- 大小:428.63 KB
- 文档页数:20
2022届高考化学一轮复习实战训练5-2元素周期表和元素周期律【含答案】
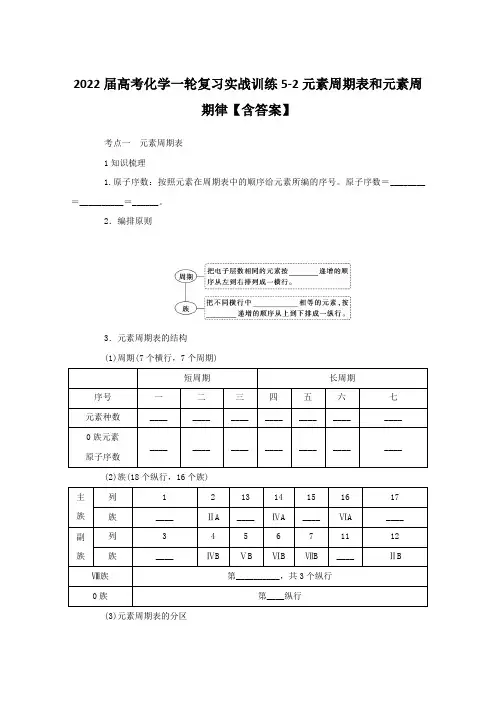
考点一 元素周期表
1知识梳理
1.原子序数:按照元素在周期表中的顺序给元素所编的序号。原子序数=________=__________=______。
2.编排原则
3.元素周期表的结构
(1)周期(7个横行,7个周期)
短周期 长周期
序号 一 二 三 四 五 六 七
元素种数 ____ ____ ____ ____ ____ ____ ____
0族元素
原子序数 ____ ____ ____ ____ ____ ____ ____
(2)族(18个纵行,16个族)
主族 列 1 2 13 14 15 16 17
族 ____ ⅡA ____ ⅣA ____ ⅥA ____
副族 列 3 4 5 6 7 11 12
族 ____ ⅣB ⅤB ⅥB ⅦB ____ ⅡB
Ⅷ族 第__________,共3个纵行
0族 第____纵行
(3)元素周期表的分区 族
周期 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
1
2
3
4
5
6
7 ①分界线:如上图所示,沿着元素周期表中__________与____________的交界处画一条斜线,即为________和____________的分界线(氢元素除外)。
②分界线附近的元素,既能表现出一定的______,又能表现出一定的__________。
4.元素周期表中的特殊位置
(1)过渡元素:元素周期表中部从____族到____族10个纵列共六十多种元素,这些元素都是金属元素。
(2)镧系:元素周期表第____周期中,57号元素镧到71号元素镥共____种元素。
(3)锕系:元素周期表第____周期中,89号元素锕到103号元素铹共____种元素。
(4)超铀元素:在锕系元素中92号元素铀(U)以后的各种元素。
[思考]
(1)甲、乙是元素周期表中同一周期的ⅡA族和ⅦA族元素,原子序数分别为m、n,则m和n的关系为____________________。

主题13:元素周期律和元素周期表
命题一 元素周期表的应用
12022年全国Ⅰ卷,12短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物可用作制冷剂,Y的原子半径是所有短周期主族元素中最大的。由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生。下列说法不正确...的是 。
的简单氢化物的热稳定性比W的强
的简单离子与X的具有相同的电子层结构
与Z形成化合物的水溶液可使蓝色石蕊试纸变红
与X属于同一主族,与Y属于同一周期
【解析】四种元素都是短周期主族元素,W的简单氢化物可用作制冷剂,则W为N元素。Y的原子半径是所有短周期主族元素中最大的,则Y为Na元素。一种盐与稀盐酸反应既有黄色沉淀生成又有刺激性气体产生,则该盐为硫代硫酸钠,故X为O元素,Z为S元素。A项,O元素的非金属性强于N元素,所以水的热稳定性强于氨气,正确;B项,Y的简单离子为Na,X的简单离子为O2-,Na与O2-具有相同的电子层结构,正确;C项,硫化钠溶液显碱性,不能使蓝色石蕊试纸变红,错误;D项,O元素与S元素都属于第ⅥA族,S元素与Na元素都在第三周期,正确。 【答案】C
22022年全国Ⅱ卷,9a、b、c、d为原子序数依次增大的短周期主族元素,a原子核外电子总数与b原子次外层的电子数相同;c所在的周期数与族数相同;d与a同族。下列叙述正确的是 。
A原子半径:d>c>b>a
种元素中b的金属性最强
的氧化物的水化物是强碱
单质的氧化性比a单质的氧化性强
【解析】a原子核外电子总数与b原子次外层的电子数相同,b原子次外层的电子数为2或8,若b原子次外层的电子数为2,则a为He元素,不是主族元素,不符合题意;因此b原子次外层的电子数为8,b为第三周期元素,a为O元素;d与a同族,则d为S元素;c所在的周期数与族数相同,则c为Al元素,b为Na元素或Mg元素。A项,原子半径a
【答案】B

高考化学综合题专题复习【元素周期律】专题解析附答案
一、元素周期律练习题(含详细答案解析)
1.Ⅰ.某化合物A由两种元素组成,可以发生如下的转化。
已知:标准状况下,气体B的密度是氢气的8倍。请回答:
(1)组成A的元素有_________,A的化学式是_________
(2)请写出A与NaOH溶液反应的化学方程式_________
(3)A可用于金属的冶炼,请写出A与Fe2O3的化学反应方程式_________
Ⅱ.某实验小组做了如下实验:
请回答:
(1)写出硬质管中发生反应的化学方程式:_________
(2)有同学认为乙醇的催化氧化反应产物中含有乙酸,请设计实验检验产物成分:_____。
【答案】Al、C Al4C3 Al4C3+4NaOH+4H2O=3CH4↑+4NaAlO2
Al4C3+4Fe2O3=2Al2O3+8Fe+3CO2↑ CH3CH2OH+CuO=CH3CHO+Cu+H2O 将产生的气体分别通入两份新制氢氧化铜悬浊液中,标为A、B,对B进行加热,若A沉淀溶解,B出现砖红色沉淀,则既有乙酸也有乙醛;若A沉淀溶解,B无砖红色沉淀,则只有乙酸;若A沉淀不溶解,B出现砖红色沉淀,则只有乙醛
【解析】
【分析】
Ⅰ.已知标准状况下,气体B的密度是氢气的8倍,则气体B的摩尔质量为16g/mol,应为CH4气体,则A中含有C元素,同时A能与氢氧化钠溶液反应,则A中含有Al元素,A为Al4C3,C为NaAlO2,NaAlO2溶液中通入过量二氧化碳得到D为氢氧化铝固体,进一步灼烧得到E为氧化铝,据此分析解答;
Ⅱ.(1)乙醇被CuO氧化,反应生成乙醛、铜单质和水;
(2)根据乙酸和乙醛与新制氢氧化铜悬浊液反应现象的不同分析比较。
【详解】
Ⅰ. (1)由以上分析知,组成A的元素有Al、C,A的化学式是Al4C3,故答案为:Al、C;Al4C3;

元素周期律
1.下列说法正确的是( )
A.元素周期表里,主族元素所在的族序数等于原子核外电子数
B.F是最活泼非金属,Li是最活泼金属
C.元素周期表有7个主族,7个副族,1个0族,1个VIII族,共16纵行
D.X2+的核外电子数目为18,则X在第四周期第IIA族
【答案】D
【解析】A项,主族元素的族序数=最外层电子数,不等于原子核外电子数,故A错误;B项,F为最活泼的非金属性,但同主族从上到下金属性增强,则Li不是最活泼的金属,故B错误;C项,周期表中8、9、10三个纵行为Ⅷ族,则元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共18个纵行,故C错误;D项,X2+的核外电子数目为18,则质子数为18+2=20,为Ca元素,原子结构中含4个电子层、最外层电子数为2,则X在第四周期第ⅧA族,故D正确;故选D。
2.某些含硒(Se)药物能增强人体免疫力。Se 与S元属素于同主族元素,Se位于S的下一周期,下列说法错误的是( )
A.氢化物的稳定性:H2S> H2Se
B.晒元素位于第四周期VIA族
C.Se2-的结构示意图为
D.最高价氧化物对应水化物的酸性:H2SO4
【答案】D
【解析】A项,同主族元素从上到下非金属性减弱,非金属性:S>Se,则简单氢化物稳定性:H2S>H2Se,故A正确;B项,Se 与S元属素于同主族元素,Se位于S的下一周期,晒元素位于第四周期VIA族,故B正确;C项,Se原子的核外电子总数为34,最外层得到2个电子形成Se2-,结构示意图为,故C正确;D项,元素的非金属性越强,最高价氧化物对应水化物的酸性越强,非金属性:S>Se,,则最高价氧化物对应水化物的酸性:H2SO4>H2SeO4,故D错误;故选D。
3.(2020·江苏化学卷)下列关于Na、Mg、Cl、Br元素及其化合物的说法正确的是( )
A.NaOH的碱性比Mg(OH)2的强 B.Cl2得到电子的能力比Br2的弱

202215
- 1 - 元素周期表 元素周期律
(时间:45分钟 满分:100分)
一、选择题(本题共10小题,每小题5分,共50分.每小题只有一个选项符合题目要求)
1.下列关于113号元素(Nh)、115号元素(Mc)、117号元素(Ts)和118号元素(Og)的说法正确的是( )。
A.113号元素的氧化物为两性氧化物
B。115号元素位于第六周期第ⅤA族
C.117号元素的某种原子,核内含176个中子,此原子是 117176Ts
D。118号元素的原子最外层有8个电子
答案:D
解析:A项,同主族元素从上到下金属性逐渐增强,113号元素的金属性远远强于铝元素的,其氧化物不是两性氧化物;B项,115号元素位于第七周期第ⅤA族;C项,117号元素的某种原子,核内含176个中子,此原子是 117293Ts;D项,118号元素位于第七周期0族,原子最外层有8个电子。
2.(2020全国Ⅰ改编)1934年约里奥—居里夫妇在核反应中用α粒子(即氦核 24He)轰击金属原子 𝑍𝑍X,得到核素 𝑍+2 30Y,开创了人造放射性核素的先河:
𝑍𝑍X+24HeY+01n
其中元素X、Y的最外层电子数之和为8。下列叙述正确的是( ).
A.𝑍𝑍X的相对原子质量为26 202215
- 2 - B。X、Y均可形成三氯化物
C.X的原子半径小于Y的原子半径
D。Y仅有一种含氧酸
答案:B
解析:依据题给的反应过程,可确定W=27。根据X、Y的最外层电子数之和为8,Y原子的质子数比X原子的质子数多2,可以得出X原子最外层电子数为3,Y原子最外层电子数为5,可以判定X为铝元素,Y为磷元素。由上述分析可知A项错误;Al、P两元素均可形成三氯化物AlCl3和PCl3,B项正确;Al、P两元素位于同一周期且原子序数P大于Al,故原子半径Al大于P,C项错误;磷元素的常见含氧酸有H3PO4、H3PO2、HPO2,D项错误。
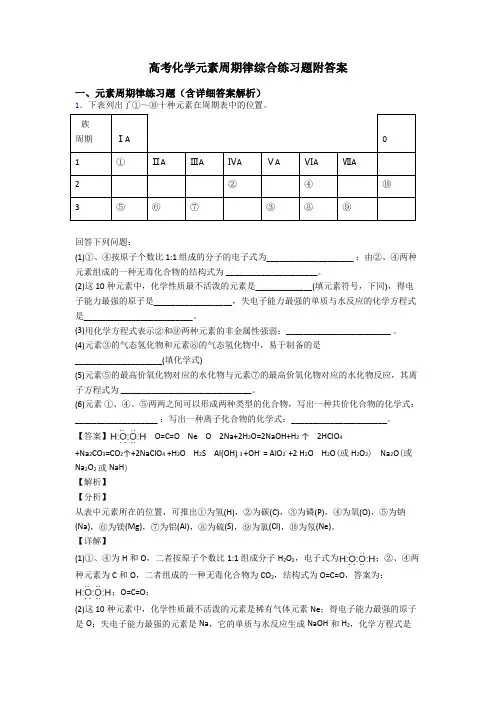
高考化学元素周期律综合练习题附答案
一、元素周期律练习题(含详细答案解析)
1.下表列出了①~⑩十种元素在周期表中的位置。
族
周期
ⅠA
0
1 ① ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
2
② ④ ⑩
3 ⑤ ⑥ ⑦ ③ ⑧ ⑨
回答下列问题:
(1)①、④按原子个数比1:1 组成的分子的电子式为____________________ ;由②、④两种元素组成的一种无毒化合物的结构式为 _____________________。
(2)这10种元素中,化学性质最不活泼的元素是_____________(填元素符号,下同),得电子能力最强的原子是__________________,失电子能力最强的单质与水反应的化学方程式是_________________________。
(3)用化学方程式表示②和⑨两种元素的非金属性强弱:________________________ 。
(4)元素③的气态氢化物和元素⑧的气态氢化物中,易于制备的是
____________________(填化学式)
(5)元素⑤的最高价氧化物对应的水化物与元素⑦的最高价氧化物对应的水化物反应,其离子方程式为 ______________________________。
(6)元素 ①、④、⑤两两之间可以形成两种类型的化合物,写出一种共价化合物的化学式:___________________ ;写出一种离子化合物的化学式:______________________。
【答案】 O=C=O Ne O 2Na+2H2O=2NaOH+H2 ↑ 2HClO4
+Na2CO3=CO2↑+2NaClO4 +H2O H2S Al(OH) 3 +OH- = AlO2- +2 H2O H2O(或H2O2) Na2O(或Na2O2或NaH)

高考化学复习《元素周期律》专项综合练习附答案
一、元素周期律练习题(含详细答案解析)
1.有四种短周期元素,它们的结构、性质等信息如下表所述:
元素 结构、性质等信息
A 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂
B B与A同周期,其最高价氧化物的水化物呈两性
C 元素的气态氢化物极易溶于水,可用作制冷剂
D 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂
请根据表中信息填写:
(1)A原子的核外电子排布式________________.
(2)B元素在周期表中的位置____________________;离子半径:B________A(填“大于”或“小于”).
(3)C原子的电子排布图是_______________________,其原子核外有___个未成对电子,能量最高的电子为___轨道上的电子,其轨道呈___________形.
(4)B的最高价氧化物对应的水化物与A的最高价氧化物对应的水化物反应的化学方程式为_______________________________,与D的氢化物的水化物反应的化学方程式为_____________________________.
【答案】1s22s22p63s1 第三周期第ⅢA族 小于 3 2p
哑铃 Al(OH)3+NaOH═NaAlO2+2H2O 3HCl+Al(OH)3═AlCl3+3H2O
【解析】
【分析】
A是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂,所以A为Na元素;B与A同周期,其最高价氧化物的水化物呈两性,则B为Al元素;C元素的气态氢化物极易溶于水,可用作制冷剂,则C为N元素;D是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂,则D为Cl元素,据此回答;

第 1 页 共 9 页 高中化学《元素周期律、元素周期表的推断》练习题(附答案解析)
学校:___________姓名:___________班级:___________
一、单选题
1.X、Y、Z、W为四种短周期主族元素,它们在周期表中的相对位置如图所示。Z元素原子核外K层与M层电子数相等。下列说法中正确的 ( )
X Y
Z W
A.Y元素最高价氧化物对应的水化物化学式为H3YO4
B.原子半径由小到大的顺序为:X
C.与同浓度的盐酸反应,Z比W更剧烈
D.W的金属性比Z的强
2.短周期元素X、Y、Z、W、Q在元素周期表的位置如表所示,其中X元素的原子内层电子数是最外层电子数的一半,则下列说法正确的是( )
X Y
Z W Q
A.钠与W可能形成Na2W2化合物
B.由Z与Y组成的物质在熔融时能导电
C.W得电子能力比Q强
D.X有多种同素异形体,而Y不存在同素异形体
3.15号元素在元素周期表中的位置是( )
A.第2周期VA族 B.第3周期VA族
C.第3周期VIA族 D.第2周期IVA
4.X、Y、Z三种元素的原子,其最外层电子排布分别为ns1、3s23p1和2s22p4,由这三种元素组成的化合物的化学式可能是( )
A.XYZ2 B.X2YZ3 C.X2YZ2 D.XYZ3
5.下列各组原子结构示意图所表示的元素有相似的化学性质的一对是( )
A. B. 第 2 页 共 9 页 C. D.
6.下列关于元素的说法正确的是( )
A.随着人工合成的同位素种类不断增加,许多元素的相对原子质量也会随之变化
B.第ⅠA族都是金属元素
C.短周期主族元素的族序数一定等于原子的最外层电子数
D.周期表中非金属元素均位于过渡元素右侧
7.已知X2+、Y+、Z2-、W-四种离子均具有相同的电子层结构。下列关于X、Y、Z、W四种元素的描述,正确的是( )
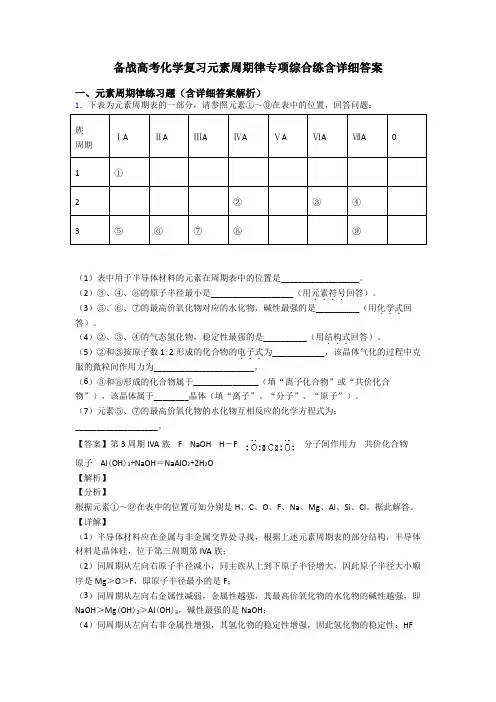
备战高考化学复习元素周期律专项综合练含详细答案
一、元素周期律练习题(含详细答案解析)
1.下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,回答问题:
族
周期 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
1 ①
2 ② ③ ④
3 ⑤ ⑥ ⑦ ⑧ ⑨
(1)表中用于半导体材料的元素在周期表中的位置是__________________。
(2)③、④、⑧的原子半径最小是___________________(用元素符号....回答)。
(3)⑤、⑥、⑦的最高价氧化物对应的水化物,碱性最强的是__________(用化学式...回答)。
(4)②、③、④的气态氢化物,稳定性最强的是__________(用结构式...回答)。
(5)②和③按原子数1:2形成的化合物的电子式...为____________,该晶体气化的过程中克服的微粒间作用力为_______________________。
(6)③和⑧形成的化合物属于_______________(填“离子化合物”或“共价化合物”),该晶体属于________晶体(填“离子”、“分子”、“原子”)。
(7)元素⑤、⑦的最高价氧化物的水化物互相反应的化学方程式为:___________________。
【答案】第3周期IVA族 F NaOH H-F 分子间作用力 共价化合物
原子 Al(OH)3+NaOH=NaAlO2+2H2O
【解析】
【分析】
根据元素①~⑨在表中的位置可知分别是H、C、O、F、Na、Mg、Al、Si、Cl。据此解答。
【详解】
(1)半导体材料应在金属与非金属交界处寻找,根据上述元素周期表的部分结构,半导体材料是晶体硅,位于第三周期第IVA族;
(2)同周期从左向右原子半径减小,同主族从上到下原子半径增大,因此原子半径大小顺序是Mg>O>F,即原子半径最小的是F;

高考化学元素周期律综合练习题含答案解析
一、元素周期律练习题(含详细答案解析)
1.已知元素X、Y均为短周期元素,X元素的一种核素常用于测文物的年代,Y元素原子半径是所有原子中最小的,元素X、Y可形成两种常见化合物M和N,已知M可以使高锰酸钾酸性溶液褪色,M分子中所含X元素的质量是Y元素质量的6倍,且M的相对分子质量为56。N是一种常用溶剂,它的实验式XY。回答下列问题:
(1)符合条件的M的有 ______种。
(2)任意写一种不带支链的M的结构简式__________。
(3)若在N与液溴的混合液中加入铁粉可以发生反应(在如图装置a容器中反应),则:
①写出a容器中发生的所有反应的化学方程式:_____________。
②d容器中NaOH溶液的作用是_____________。
(4)在碘水中加入N振荡静置后的现象是__________。
(5)等质量M、N完全燃烧时消耗O2的物质的量较多的是________(填“M”或“N”)。
【答案】3 CH2=CH-CH2-CH3 2Fe+3Br2=2FeBr3、+Br23FeBr
+HBr 吸收HBr和Br2,防止污染环境 溶液分层,下层无色,上层紫红色
M
【解析】
【分析】
短周期元素X元素的一种核素常用于测文物的年代,则X为碳(C);Y元素原子半径是所有原子中最小的,则Y为氢(H)。元素X、Y可形成两种常见化合物M和N,已知M可以使高锰酸钾酸性溶液褪色,M分子中所含X元素的质量是Y元素质量的6倍,且M的相对分子质量为56,则M为分子式C4H8的烯烃;N是一种常用溶剂,它的实验式XY,则N为苯(C6H6)。
【详解】
由以上分析可知,M是分子式为C4H8的烯烃,N是分子式为C6H6的苯。
(1)符合条件的M有CH2=CHCH2CH3、CH3CH=CHCH3、(CH3)2C=CH2,共3种。答案为:3;

高考化学综合题专练∶元素周期律附答案
一、元素周期律练习题(含详细答案解析)
1.已知元素X、Y均为短周期元素,X元素的一种核素常用于测文物的年代,Y元素原子半径是所有原子中最小的,元素X、Y可形成两种常见化合物M和N,已知M可以使高锰酸钾酸性溶液褪色,M分子中所含X元素的质量是Y元素质量的6倍,且M的相对分子质量为56。N是一种常用溶剂,它的实验式XY。回答下列问题:
(1)符合条件的M的有 ______种。
(2)任意写一种不带支链的M的结构简式__________。
(3)若在N与液溴的混合液中加入铁粉可以发生反应(在如图装置a容器中反应),则:
①写出a容器中发生的所有反应的化学方程式:_____________。
②d容器中NaOH溶液的作用是_____________。
(4)在碘水中加入N振荡静置后的现象是__________。
(5)等质量M、N完全燃烧时消耗O2的物质的量较多的是________(填“M”或“N”)。
【答案】3 CH2=CH-CH2-CH3 2Fe+3Br2=2FeBr3、+Br23FeBr
+HBr 吸收HBr和Br2,防止污染环境 溶液分层,下层无色,上层紫红色
M
【解析】
【分析】
短周期元素X元素的一种核素常用于测文物的年代,则X为碳(C);Y元素原子半径是所有原子中最小的,则Y为氢(H)。元素X、Y可形成两种常见化合物M和N,已知M可以使高锰酸钾酸性溶液褪色,M分子中所含X元素的质量是Y元素质量的6倍,且M的相对分子质量为56,则M为分子式C4H8的烯烃;N是一种常用溶剂,它的实验式XY,则N为苯(C6H6)。
【详解】
由以上分析可知,M是分子式为C4H8的烯烃,N是分子式为C6H6的苯。
(1)符合条件的M有CH2=CHCH2CH3、CH3CH=CHCH3、(CH3)2C=CH2,共3种。答案为:3;
备战高考化学复习元素周期律专项综合练附答案
一、元素周期律练习题(含详细答案解析)
1.下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,回答问题:
族
周期 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
1 ①
2 ② ③ ④
3 ⑤ ⑥ ⑦ ⑧ ⑨
(1)表中用于半导体材料的元素在周期表中的位置是__________________。
(2)③、④、⑧的原子半径最小是___________________(用元素符号....回答)。
(3)⑤、⑥、⑦的最高价氧化物对应的水化物,碱性最强的是__________(用化学式...回答)。
(4)②、③、④的气态氢化物,稳定性最强的是__________(用结构式...回答)。
(5)②和③按原子数1:2形成的化合物的电子式...为____________,该晶体气化的过程中克服的微粒间作用力为_______________________。
(6)③和⑧形成的化合物属于_______________(填“离子化合物”或“共价化合物”),该晶体属于________晶体(填“离子”、“分子”、“原子”)。
(7)元素⑤、⑦的最高价氧化物的水化物互相反应的化学方程式为:___________________。
【答案】第3周期IVA族 F NaOH H-F 分子间作用力 共价化合物
原子 Al(OH)3+NaOH=NaAlO2+2H2O
【解析】
【分析】
根据元素①~⑨在表中的位置可知分别是H、C、O、F、Na、Mg、Al、Si、Cl。据此解答。
【详解】
(1)半导体材料应在金属与非金属交界处寻找,根据上述元素周期表的部分结构,半导体材料是晶体硅,位于第三周期第IVA族;
(2)同周期从左向右原子半径减小,同主族从上到下原子半径增大,因此原子半径大小顺序是Mg>O>F,即原子半径最小的是F;
- 1 - 专题十一 原子结构 元素周期律
考点1 原子结构 原子核外电子排布
1.[2021安徽滁州调研]2017年5月9日,我国科学技术名词审定委员会等单位正式发布115号等4种人工合成的新元素的名称、元素符号,115号元素名称为“镆”,符号为Mc。下列有关说法正确的是( )
A.Mc的最低负化合价为-3
B.Mc的最高价氧化物的化学式为Mc2O5
C.115288Mc的中子数为115
D.通过化学反应可使 115288Mc转化为 115290Mc
2.[2021北京海淀区期中]下列叙述正确的是( )
A.第ⅠA族元素钫的两种核素:221Fr比223Fr少2个质子
B.第三周期金属元素的离子半径:r(Na+)
C.第ⅦA族元素从上到下,单质与氢气化合越来越容易
D.通常可在周期表的过渡元素中寻找化学反应的催化剂
3.[8分]部分短周期主族元素的性质或原子结构如表所示:
元素 元素性质或原子结构
X 周期序数=主族序数=原子序数
Y 原子最外层电子数为a,次外层电子数为b
Z 原子L层电子数为a+b,M层电子数为a-b
M 单质在自然界中的硬度最大
N 位于第三周期,最外层电子数是电子层数的2倍
(1)写出X、Y、Z、N四种元素的名称:
X ,Y ,Z ,N 。
(2)由X、Y、Z、M、N五种元素两两组成的分子中,许多分子含有的电子数相等,写出符合下列要求的分子式: - 2 - ①含10e-且呈正四面体结构的分子 ;
②含14e-的双原子分子 ;
③含16e-且能使溴水褪色的分子 ;
④含18e-且常温下呈液态的分子 。
考点2 化学键 分子间作用力
4.[新情境]北京大学和中国科学院的化学工作者已成功研制出碱金属与C60形成的K3C60,实验测知该物质属于离子化合物,具有良好的超导性。下列有关分析正确的是( )
高考化学易错题专题复习-元素周期律练习题及答案
一、元素周期律练习题(含详细答案解析)
1.已知元素X、Y均为短周期元素,X元素的一种核素常用于测文物的年代,Y元素原子半径是所有原子中最小的,元素X、Y可形成两种常见化合物M和N,已知M可以使高锰酸钾酸性溶液褪色,M分子中所含X元素的质量是Y元素质量的6倍,且M的相对分子质量为56。N是一种常用溶剂,它的实验式XY。回答下列问题:
(1)符合条件的M的有 ______种。
(2)任意写一种不带支链的M的结构简式__________。
(3)若在N与液溴的混合液中加入铁粉可以发生反应(在如图装置a容器中反应),则:
①写出a容器中发生的所有反应的化学方程式:_____________。
②d容器中NaOH溶液的作用是_____________。
(4)在碘水中加入N振荡静置后的现象是__________。
(5)等质量M、N完全燃烧时消耗O2的物质的量较多的是________(填“M”或“N”)。
【答案】3 CH2=CH-CH2-CH3 2Fe+3Br2=2FeBr3、+Br23FeBr
+HBr 吸收HBr和Br2,防止污染环境 溶液分层,下层无色,上层紫红色
M
【解析】
【分析】
短周期元素X元素的一种核素常用于测文物的年代,则X为碳(C);Y元素原子半径是所有原子中最小的,则Y为氢(H)。元素X、Y可形成两种常见化合物M和N,已知M可以使高锰酸钾酸性溶液褪色,M分子中所含X元素的质量是Y元素质量的6倍,且M的相对分子质量为56,则M为分子式C4H8的烯烃;N是一种常用溶剂,它的实验式XY,则N为苯(C6H6)。
【详解】
由以上分析可知,M是分子式为C4H8的烯烃,N是分子式为C6H6的苯。
(1)符合条件的M有CH2=CHCH2CH3、CH3CH=CHCH3、(CH3)2C=CH2,共3种。答案为:3;
备战高考化学复习元素周期律专项综合练附详细答案
一、元素周期律练习题(含详细答案解析)
1.A、B、C、D、E 均为短周期主族元素,其原子序数依次增大。其中 A 元素 原子核内只有 1 个质子;A 与 C,B 与 D 分别同主族; B、D 两元素原子序数 之和是 A、C 两元素原子序数之和的 2 倍。请回答下列问题:
(1)由上述元素组成的下列物质中属于非电解质的是________(填字母编号)。
a.A2B b.E2 c.DB2 d.C2DB3
(2)B元素在元素周期表中的位置为________;化合物 C2B2 中含有的化学键类型是________;化合物C2B中两种离子的半径大小关系为________<________(填离子符 号)。
(3)实验室中欲选用下列装置制取并收集纯净干燥的 E2气体。
①实验中应选用的装置为________(按由左到右的连接顺序填写);
②装置A中发生反应的化学方程式为________。
【答案】c 第2周期ⅥA族 离子键、共价键 Na+ O2- AFEB MnO2+4HCl(浓)ΔMnCl2+Cl2↑+2H2O
【解析】
【分析】
A、B、C、D、E均为短周期主族元素,其原子序数依次增大。其中A元素原子核内只有1个质子,则A为H;A与C,B与D分别同主族;B、D两元素原子序数之和是A、C两元素原子序数之和的2倍,C应为Na,设B的原子序数为x,D的原子序数为x+8,则2×(1+11)=x+x+8,解得x=8,则B为O,D为S,E为Cl。
【详解】
(1)H2O、Na2SO3均为化合物,均可发生电离,属于电解质,Cl2是单质,既不是电解质也不是非电解质,而SO2本身不能电离,属于非电解质,则只有c为非电解质,故答案为:c;
(2)B为O,位于第2周期ⅥA族,化合物C2B2为Na2O2,含离子键、共价键;C2B为Na2O,其中离子具有相同电子排布,原子序数大离子半径小,离子半径为O2->Na+,故答案为:第2周期ⅥA族;离子键、共价键;Na+;O2-; (3)①用装置A制取并收集纯净干燥的Cl2气体,选择浓盐酸与二氧化锰加热制备;用装置F中的饱和食盐水除杂;用装置E中的浓硫酸干燥;最后用B装置进行收集及尾气处理,则仪器连接顺序为AFEB,故答案为:AFEB;
高考化学【元素周期律】推断专题练习80题Word版含答案及解析 第(1)页 高考化学【元素周期律】推断专题练习80题
1、W、X、Y、Z为原子序数依次增大的短周期主族元素,W和Y同族,X和Z同族,X的简单离子和Y的简单离子具有相同的电子层结构,W和X、Z均能形成共价化合物,W和X、Y分别形成的化合物溶于水均呈碱性。下列说法错误的是
A. 4种元素中Y的金属性最强
B. 最高价氧化物对应的水化物的酸性:Z>X
C. 简单阳离子氧化性:W>Y
D. W和Y形成的化合物与水反应能生成一种还原性气体
【答案】B
【解析】W和X、Z均能形成共价化合物,则W、X、Z很可能均为非金属元素,考虑到W原子序数最小,可推断W为H元素;W和X、Y分别形成的化合物溶于水均呈碱性,X为非金属,可推测化合物中有NH3,则X为N元素,又X和Z同族,Z为P元素;W和Y同族,X的简单离子和Y的简单离子具有相同的电子层结构,可推知Y为Na元素。综上推测满足题干信息,因而推测合理,W为H,X为N,Y为Na,Z为P。
A. 4种元素中只有Y是金属元素,即Na,因而金属性最强,A正确;
B.元素的非金属性越强则最高价氧化物对应的水化物酸性越强,非金属性:N(X)>P(Z),因而最高价氧化物对应的水化物的酸性:Z
C.元素的金属性越强,对应简单阳离子氧化性越弱,金属性Na(Y)>H(W),因而简单阳离子氧化性:W>Y,C正确;D.W和Y形成的化合物为NaH,NaH与水反应生成氢氧化钠和氢气,氢气为还原性气体,D正确。
2、短周期主族元素W、X、Y、Z的原子序数依次增加,K、L、M均是由这些元素组成的二元化合物,甲、乙分别是元素X、Y的单质,甲是常见的固体,乙是常见的气体。K是无色气体,是主要的大气污染物之一,0.05mol/L丙溶液的pH为l,上述物质的转化关系如图所示。下列说法正确的是
A. 原子半径:WY>X
C. 化合物XYZ中只含共价键 D. K、L、M中沸点最高的是M
第 1 页 共 20 页 2022年高考化学考点专题复习:元素周期表 元素周期律 刷题练习题
一、选择题(共16题)
1.下列有关P、S、Cl的性质的叙述错误的是
A.原子半径:Cl
C.电负性:P
2.“鱼浮灵”是水产养殖的迅速增氧剂,其主要成分的结构式如图所示。元素X、Y、Z均为短周期主族元素,原子序数依次增大。下列说法错误的是
A.单质沸点:X>Y B.Z2Y2、Z2Y所含化学键类型完全相同
C.原子半径:Z>X>Y D.简单氢化物稳定性:X
3.如图是元素周期表前四周期的一部分,下列有关说法正确的是
X
W Y R
Z
A.电负性:W>X
B.第一电离能:W
C.五种元素形成的单质中,Z形成的单质沸点最高
D.R与其同主族下一周期元素的原子序数相差18
4.WXYZ、、、为原子序数依次增大的短周期主族元素,W的核外电子总数与其周期数相同,X的价电子层中的未成对电子有3个,Y的最外层电子数为其内层电子数的3倍,W与Z可形成原子个数比为2∶1的18e分子。下列说法错误的是
A.原子半径:XYW
第 2 页 共 20 页 B.简单氢化物的还原性:ZY
C.W与Y可形成含有非极性键的化合物
D.同周期中第一电离能小于X的元素有4种
5.类推的思维方法在化学学习与研究中有时会产生错误结论,因此类推的结论最终要经过实验的检验,才能决定其正确与否。下列几种类推结论中,正确的是
A.由3Al(OH)是两性氢氧化物,可推出与Al同族的铊形成的3Tl(OH)也是两性氢氧化物
B.由铁放置在空气中一段时间后就会生锈,可推出更活泼的钠不能稳定存在于空气中
C.由“232Fe+3Cl2FeCl”反应可推出“232Fe+3I2FeI”反应也能发生
D.由钠与氧气反应能生成22NaO,可推出碱金属都能与氧气反应生成金属过氧化物
6.下列有关元素周期表、周期律的叙述正确的是
A.最外层电子数为1的主族元素都极易失电子,都具有很强的金属性
B.同一周期主族元素对应的离子半径从左到右依次减小
C.半导体芯片的元素可在周期表中金属与非金属的分界处寻找
D.Cl的非金属性强于S,则含氧酸酸性:ClS
7.已知主族元素X、Y处于同周期,电负性XY,下列说法中一定错误的是
A.最高化合价:XY
B.最简单气态氢化物的稳定性:YX
C.含氧酸的酸性:XY
D.X和Y形成的化合物中,X显负价,Y显正价
8.下列物质中酸性最强的是
A.H2CO3 B.H2SiO3 C.H2SO4 D.HClO4
9.五种短周期元素X、Y、Z、W、Q原子序数依次增大,W在短周期元素中原子半径最大,X、W同族,Z、Q同族,X、Y两种元素的最高正化合价和最低负化合价代数和均为0,Q元素有一种单质为淡黄色的固体。下列叙述正确的是
A.Z、W两种元素简单离子的半径大小: Z< W
B.Q、Y元素的最高价氧化物的水化物的酸性: Q <Y
C.X、Z、W形成的化合物既含有离子键也含有共价键
D.X与Z形成的化合物中各原子均满足最外层8电子稳定结构
10.海洋中的水資源、化学资源和生物资源具有十分巨大的开发潜力。海水中O、H、Cl、Na、Mg、S、
第 3 页 共 20 页 Ca、K、Br、Sr、C、B、F等13种元素的总含量超过99%。以传统海水制盐工业为基础可制取镁、钾、溴及其它化工产品。工业冶炼金属钾的反应为850Na(l)+KCl(l)K(g)+NaCl(l)℃。下列有关说法不正确...的
A.单质的沸点:Na>K
B.元素的金属性:Na>K
C.单质与水反应的剧烈程度:K>Na
D.最高价氧化物对应的水化物的碱性:KOH>NaOH
11.短周期主族元素X、Y、Z、W的原子序数依次增大,基态X原子核外未成对电子数为3,基态Y原子核外s轨道的电子数与p轨道的电子数相同,Z元素在短周期中金属性最强,基态W原子核外最高能级含有5个电子。下列说法正确的是
A.原子半径:WZX
B.化合物ZW中阴阳离子最外层均满足8电子稳定结构
C.基态原子的第一电离能:XY
D.2XY与2WY分子的空间结构相同
12.由短周期主族元素形成的某化合物的结构为MXZY,其中X、Y、Z与氢元素形成的简单氢化物中均含10电子。下列叙述中错误的是
A.第一电离能:Y>X>Z B.简单离子半径:Y>X>M
C.该化合物的阴离子呈直线结构 D.氢化物的键角:X>Y>Z
13.下列关于物质性质的比较,错误的是
A.酸性强弱:HClO4>HBrO4>HIO4 B.氢化物的稳定性:PH3
C.离子半径大小:Na+>S2->O2- D.碱性强弱:Al(OH)3
14.下列有关物质性质的比较,错误..的是
A.氧化性强弱:22FCl
B.酸性强弱:244HSOHClO
C.碱性强弱:2NaOHMg(OH)
D.热稳定性强弱:233NaCONaHCO
第 4 页 共 20 页 15.a、b、c、d是四种短周期元素,a、b、d同周期;c、d同主族;a的原子结构示意图为,b与c形成的化合物的化学式为b3c,且b、c离子有相同的电子层结构。下列说法中错误的是
A.原子序数:a>b>c
B.原子半径:a>d>c
C.最高价含氧酸的酸性:c>d>a
D.a与c形成化合物的化学式为ac
16.原子序数依次增大的X、Y、Z、W、Q五种短周期主族元素中,X元素原子的最外层有三个未成对电子,且第一电离能比Y大,Z元素的简单离子半径在同周期中最小,Y、W位于同一主族。下列说法错误的是
A.X、Y两种元素都位于元素周期表p区
B.简单离子半径:Y>Z
C.W元素的最高价氧化物对应的水化物是强酸
D.基态Q原子核外所有s电子云轮廓图都是球形,且大小相同
二、综合题(共6题)
17.下图为元素周期表的一部分,请参照N元素的位置,回答下列问题:
∶
N
∶ ∶ ∶ ∶
请回答下列问题:
(1)写出第4周期、与∶同族元素的名称:___________。
(2)∶的单质被称为“21世纪的能源金属”,可用于制造电池和储存氢气,其氢化物可以与水反应生成氢气。其氢化物电子式为___________;写出该氢化物与水反应的化学方程式_____________________。
(3)镓(Ga)与∶同主族,写出镓的氧化物与NaOH反应的化学方程式为____________。
(4)∶元素的非金属性比∶______(填“强”或“弱”),列举一个化学事实加以说明_______________________________________________。
(5)N元素存在N2和N4等同素异形体。已知N4为正四面体结构,N—N键能为167 kJ·mol-1;N≡N键能为942
kJ·mol-1。写出N4(g)转化为N2(g)的热化学方程式:______________________________________。
第 5 页 共 20 页 18.X∶Y∶Z∶W为原子序数依次增大的四种短周期元素,其中X元素原子的核外电子总数等于其电子层数,
X与Y∶W可分别形成YX3和XW型共价化合物,YX3极易溶于水, Z元素是地壳中含量最高的金属元素,W 的原子半径是第三周期中最小的。
∶1)写出YX4+的电子式_______∶
∶2)写出Z与W所形成的盐与 YX3的水溶液反应的离子方程式________________∶
∶3)室温下,pH∶3的XW溶液与pH∶5的YX4W溶液中由水电离出的c(H+)的比为___∶
∶4)已知X单质和Y单质反应生成YX3的反应是可逆反应,ΔH<0, 将X∶Y的两种单质以等物质的量充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应。下列说法正确的是_____________________∶
a.达到化学平衡时,任何一种物质表示的正反应速率与逆反应速率相等
b.反应过程中,Y单质的体积分数始终为50%
c.达到化学平衡时,X∶Y两种单质在混合气体中的物质的量之比为1∶1
d.达到化学平衡的过程中混合气体的平均相对分子质量减小
∶5)有人设想寻求合适的催化剂和电极材料,以Y2∶X2为电极反应物,以XW∶YX4W 为电解质溶液制备新型燃料电池。请写出该电池的正极反应式_____________∶
∶6)汽车尾气中含有CO∶NO∶NO2等有毒气体,对汽车加装尾气净化装置,用含铂等过渡元素的催化剂催化,可使有毒气体相互反应转化成无毒气体。
已知∶N2(g)∶2O2(g)∶2NO2(g) ΔH1∶∶68 kJ·mol-1
2C(s)∶O2(g)∶2CO(g) ΔH2∶∶221 kJ·mol-1
C(s)∶O2(g)∶CO2 (g) ΔH3∶∶393.5 kJ·mol-1
CO与NO2反应的热化学方程式为____________________,反应一定条件下可逆,温度不同(T2∶T1二者均大于常温)、其他条件相同,下列图像正确的是______∶
19.氨的催化氧化是工业制硝酸的重要反应,500°C,其反应方程式为:4NH3(g) +5O2(g)∶4NO(g)+6H2O(g)+Q,完成下列填空:
(1)如果要提高上述反应的反应速率,可以采取的措施是___________________
第 6 页 共 20 页 a.减压 b.增加NH3的浓度 c.升温 d.将水液化移走
(2)在500∶时,在2L密闭容器中加入10mol NH3、10mol O2,上述可逆反应达到平衡,过程如图所示,在a时刻改变反应条件,重新达到平衡,该改变的条件可能是____________,比较b时刻与c时刻反应氨的转化率大小(填“>”或“<”)b____c。其它条件不变,c时刻加压后,若平衡正向移动,其原因可能是____________,若在d时刻重新达到平衡,请在图中画出c到d的相关变化图像________。
(3)工业上以氨和空气为原料生产硝酸,请画出硝酸工业的物质流程图________
(4)氨中氮元素原子最外层电子排布的轨道表达式是______________,短周期元素原子所形成的与N3-电子排布相同的离子所对应的原子的半径从大到小的排列顺序为 _______________。其中非金属元素形成的氢化物的稳定性由强到弱为的顺序为(用化学式表示)_____________。
(5)已知NH3与N2H4都是氮的氢化物,N2H4的电子式是 __________________。NH3与N2H4都具有还原性,可以与其它强氧化剂反应,例如在一定条件下,氨可以被双氧水氧化为游离态氮,写出该反应的化学方程式 ______________
20.按要求回答下列问题。
(1)CO2分子的结构式为___________。
(2)Al与NaOH溶液反应的离子反应方程式为___________。
(3)请解释H2O稳定性大于H2S的原因___________。
(4)水能发生自耦电离:+-232HOHO+OH,液氨中3NH能发生类似的电离过程,液氨自耦电离的平衡常数表达式为___________。
(5)lewis酸碱理论认为,凡是能接受电子对的物质都是酸,凡是能给出电子对的物质都是碱,已知--34AlCl+Cl=AlCl可看作是酸碱反应,其中属于lewis酸的物质是___________,结合物质的电子式从物质结构角度说明判断的依据___________。