【推荐精选】2017年中考化学三轮选择题专题 化学方程式的计算精练精析
- 格式:doc
- 大小:470.50 KB
- 文档页数:32

考点12 根据化学方程式的简单计算 一、选择题10.(2017天津市,题号10,分值2)在反应A+3B=2C+3D 中,已知2.3gA 跟4.8gB 恰好完全反应生成4.4gC 。
又知D 的相对分子质量为18,则A 的相对分子质量为( )A .23B .46C .92D .96 【答案】B【解析】此题考查的质量守恒定律的计算应用。
根据质量守恒定律可知:参及反应的A 和B 物质的质量总和等于生成的C 和D 物质的质量总和,因此生成D 的质量为2.3g+4.8g-4.4g=2.7g 。
设A 的相对分子质量为x A + 3B = 2C + 3D2.3g 2.7g x 3×181837.2⨯=xgg2.3 x=46 故B 正确。
(2017天津市,题号15,分值2)下列说法正确的是( ) A .质量相等的氧化镁和硫酸镁中镁元素的质量比为3:1B .质量相等的硫和碳分别在氧气中充分燃烧,硫比碳消耗氧气的质量大C .硫酸铵和氯化钾的混合物中氮元素质量分数为14%,该混合物中硝酸铵的质量分数为40%D.质量和质量分数均相等的氢氧化钠溶液和稀硫酸,充分反应后,向所得溶液中滴加硫酸铜,不会出现蓝色沉淀【答案】AC【解析】此题考查的是化学式的相关计算,元素质量分数的计算。
A.氧化镁中镁元素质量分数为60%,硫酸镁中镁元素的质量分数为20%,所以质量相等的氧化镁和硫酸镁中镁元素的质量比为6:2=3:1;,故正确;B.硫和氧气反应生成二氧化硫,碳和氧气反应生成二氧化碳,根据化学反应方程式计量数比可知,消耗32份质量的O2所需碳、硫的相对质量分别为:12、32,即消耗等量氧气所需碳最少.则燃烧等量的碳和硫时,碳消耗的氧气最多,故错误;C.硫酸铵中氮元素的质量分数为35%,混合物中氮元素质量分数为14%,则混合物中硝酸铵的质量分数为14%比35%等于40%,故正确;D.氢氧化钠溶液和稀硫酸发生中和反应,反应化学质量比是80:98,故质量和质量分数均相等的氢氧化钠溶液和稀硫酸,充分反应后,氢氧化钠过量,向所得溶液中滴加硫酸铜,硫酸铜和氢氧化钠反应生成氢氧化铜蓝色沉淀,故错误,AC正确;8.(2017四川省德阳市,题号18,分值3)向盛有10gCu-Al合金样品的烧杯中加入100g稀硫酸,恰好完全反应,反应结束后,测得烧杯内物质的总质量为109.4g,则合金样品中铜的质量分数是()A. 73% B. 54% C. 46% D. 27%【答案】C【解析】根据反应的化学方程式进行计算,铝和铜加入稀硫酸中只有铝和稀硫酸反应,总质量减少的量就是生成的氢气的质量,再根据氢气的质量和化学方程式求出反应的铝的质量,用合金样品的总质量减去铝的质量就是铜的质量,进而求出合金样品中铜的质量分数。

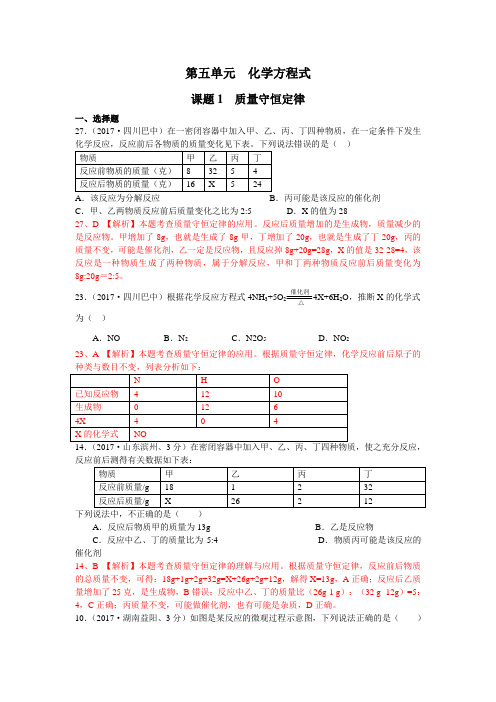
第五单元化学方程式课题1 质量守恒定律一、选择题27.(2017·四川巴中)在一密闭容器中加入甲、乙、丙、丁四种物质,在一定条件下发生).丙可能是该反应的催化剂C.甲、乙两物质反应前后质量变化之比为2:5 D.X的值为2827、D 【解析】本题考查质量守恒定律的应用。
反应后质量增加的是生成物,质量减少的是反应物。
甲增加了8g,也就是生成了8g甲,丁增加了20g,也就是生成了丁20g,丙的质量不变,可能是催化剂,乙一定是反应物,且反应掉8g+20g=28g,X的值是32-28=4,该反应是一种物质生成了两种物质,属于分解反应,甲和丁两种物质反应前后质量变化为8g:20g=2:5。
4X+6H2O,推断X的化学式23.(2017·四川巴中)根据花学反应方程式4NH3+5O2催化剂△为()A.NO B.N2C.N2O5D.NO223、A 【解析】本题考查质量守恒定律的应用。
根据质量守恒定律,化学反应前后原子的14.(2017·山东滨州、3分)在密闭容器中加入甲、乙、丙、丁四种物质,使之充分反应,A.反应后物质甲的质量为13g B.乙是反应物C.反应中乙、丁的质量比为5:4 D.物质丙可能是该反应的催化剂14、B 【解析】本题考查质量守恒定律的理解与应用。
根据质量守恒定律,反应前后物质的总质量不变,可得:18g+1g+2g+32g=X+26g+2g+12g,解得X=13g,A正确;反应后乙质量增加了25克,是生成物,B错误;反应中乙、丁的质量比(26g-1 g):(32 g -12g)=5:4,C正确;丙质量不变,可能做催化剂,也有可能是杂质,D正确。
10.(2017·湖南益阳、3分)如图是某反应的微观过程示意图,下列说法正确的是()A.反应物与生成物均为单质B.该反应中A、B、C的化学计量数之比为1:2:3C.反应后,反应物A有剩余D.反应前后,原子的种类和数量发生了改变C 【解答】由图示可知,该反应为2个A分子与3个B分子发生反应,生成2个C分子,其中有一个A分子没有参加反应,反应的式子表示为:A+3B=2C;由图示可知,反应物是两种单质,生成物是化合物;由分析可知,该反应中A、B、C的化学计量数之比为1:3:2;由图示可知,反应后,反应物A有剩余;由图示可知,反应前后,原子的种类和数量没发生改变。

专题 25 化学方程式一、选择题1.【2017湖南邵阳】下列化学方程式及其反应类型都正确的是22.【2017重庆A】在“欢迎来找茬”的趣味活动中,老师举出四个错误实例,在学生的错因分析中错误的是3.【2017重庆A】科研人员以纳米镍粒子为催化剂,将二氧化碳和氢气混合加热生成甲烷和水。
下列有关说法中错误的是A.该反应为置换反应B.甲烷是天然气的主要成分C.纳米镍粒子反应前后质量不变D.二氧化碳的排放易引起温室效应4.【2017浙江绍兴】下列属于置换反应的是A.H2+CuO Cu+H2O B.2KMnO4K2MnO4+MnO2+O2↑C.HCl+NaOH=NaCl+H2O D.2MgO+O22MgO5.【2017浙江嘉兴】以下四个化学反应都有气体产生,其反应类型和产生的气体性质均正确的是H22KCl+3O6.【2017浙江杭州】工业上可用如下反应侧取金属钡:2Al+4BaO3Ba↑+Ba(AlO2)2。
下列说法正确的是A.反应物铝能被磁铁吸引B.生成物Ba(AlO2)2属于氧化物C.反应前后铝元素的化合价发生改变D.该反应属于复分解反应7.【2017四川内江】下列反应属于复分解反应的是A.CO2+ H2O==H2CO3B.2HC1 +Ca(OH)2=CaCl2+ 2H2OC.2KMnO4K2MnO4+MnO2+O2↑D.2Na+2H2O==2NaOH + H2↑8.【2017四川内江】下列化学方程式书写错误的是A.Na2CO3+2HCl= 2NaCl+H2O+CO2↑B.CO2+Ca(OH)2==CaCO3↓+H2OC.CuSO4+ BaOH=CuOH↓+ BaSO4D.3CO+Fe2O3高温2Fe+3CO29.【2017山东临沂】下列化学方程式书写正确的是A.2NaOH+CuSO4=Cu(OH)2↓+NaSO4 B.Ba(NO3)2+H2SO4=BaSO4↓+HNO3 C.C+2CuO高温2Cu+CO2 D.Fe2O3+6HCl=2FeC12+3H2O 10.【2017江苏扬州】下列属于置换反应的是A.2H2O2H2↑+O2↑B.H2+CuO △Cu+H2OC.S+O2SO2D.NaOH+HCl=NaCl+H2O11.【2017天津】己知A+3B=2C+3D中,已知2.3gA跟4.8gB恰好完全反应生成4.4gC。

【化学】初中化学化学方程式的计算解题技巧及练习题含解析一、中考化学方程式的计算1.我国科学家实现电催化高效分解硫化氢制氢技术,反应的化学方程式为H 2S 一定条件S ↓ +H 2 .请计算生产 3吨 H 2,理论上需要 H 2S 多少吨?【答案】51吨【解析】【分析】【详解】解:设理论上需要H 2S 的质量为x22S +H 342x3tH S ↓一定条件34x =23tx=51 t答:理论上需要H 2S 51吨。2.过氧化钙(CaO 2)常用于活鱼运输时的增氧剂,过氧化钙与水反应方程式为:2CaO 2+2H 2O ═2Ca (OH )2+O 2↑.某过氧化钙样品中含有少量不溶于水且不与水反应杂质,取该样品15.0g 投入盛有108.0g 水的烧杯中,缓慢搅拌,充分反应,最终收集到氧气质量为3.20g ,计算该样品中过氧化钙的质量分数____(写出计算过程)。
【答案】96%【解析】【分析】【详解】解:设过氧化钙质量为x ,22222CaO 2H O =2Ca(OH)O 14432x3.2g 14432=x 3.2g++↑x=14.4g , 该样品中过氧化钙的质量分数是:14.4g 15.0g×100%=96%, 答:该样品中过氧化钙的质量分数是96%。
3.波尔多液是一种运用广泛的农药,由熟石灰和硫酸铜配制而成。
某工厂用以下反应:2Cu+O2+2H2SO4=2CuSO4+2H2O 来生产硫酸铜,若要制得 40kg 硫酸铜。
试计算:(1)硫酸铜中铜元素质量分数是_____。
(2)若恰好消耗稀硫酸的质量是 200kg,则该稀硫酸溶质的质量分数是多少_____?【答案】40% 12.25%【解析】【分析】【详解】(1)CuSO4中Cu元素质量分数=6464100%=100%=40%6432416160⨯⨯++⨯。
(2)设消耗的硫酸的质量为x 。
22442H SO2CuSO2Cu O2=2982160x 40kg2H O+++⨯⨯x29840kg2160⨯=⨯x=24.5kg则稀硫酸溶质的质量分数=24.5kg100%=12.25%200kg⨯。

中考化学专项训练:化学方程式的计算练习题及解析一、初中化学利用化学方程式选择题1.在反应A+3B=2C+2D中,A和B的相对分子质量之比9:11,已知1.8gA与一定量B恰好完全反应成5.1gD,则在此反应中反应物B和生成物C的质量比为?()A.2:1 B.2:3 C.3:1 D.1:22.现有下列四组物质:①乙炔(C2H2)和苯(C6H6);②乙烷(C2H6)和乙醇(C2H6O);③丁烷(C4H10)和乙醚(C4H10O);④甲苯(C7H8)和甘油(C3H8O3)。
当总质量一定时,各组中的两种物质无论按何种质量比混合,完全燃烧生成水的质量均相同。
符合该条件的共有A.1组B.2组C.3组D.4组3.科学家最新发现,可以将树木纤维素转变为超级储能装置,该反应的微观示意图如下。
下列说法正确的是A.反应前后分子总数不变B.反应中 X、Z 两种物质的质量比为 3:7C.反应中 Y 和 W 的物质的量之比为 4:5D.参加反应的 Y 中氮元素的质量一定等于生成 Z 的质量4.Fe和FeO的混合物,测得其中铁元素的质量分数为80%.取该混合物7.0g,加足量稀硫酸完全溶解,生成FeSO4的质量为()A.7.6g B.15.2g C.20.0g D.40.0g5.偏二甲肼(C2H8N2)与N2O4反应能放出巨大的能量,化学方程式为C2H8N2+2N2O4═2X↑+3N2↑+4H2O↑,下列说法正确的是()A.该反应属于化合反应B.X的化学式为COC.偏二甲肼中氮的质量分数最大D.生成N2和H2O的质量比14:16.关于化学反应2X+Y=2Z的叙述正确的是()A.Z可能是单质,也可能是化合物B.反应中X、Y、Z三种物质的质量比是2:1:2C.若X和Y的相对分子质量分别为M和N,则Z的相对分子质量为M+ND.若ag的X完全反应生成bg的Z,则同时消耗(b﹣a)g 的Y7.已知:在650℃时,CuSO4分解为CuO与气体,在1400℃时,CuO受热发生如下分解反应:4CuO2Cu2O+O2↑.现将16gCuSO4高温加热一段时间,冷却后称量剩余固体为7.6g.下列说法错误的是()A.剩余固体为混合物B.产生的气体中,硫、氧的质量比为8∶26 C.剩余固体中含6.4g铜元素D.剩余固体用足量CO还原,可产生CO23.3g8.如图是某反应的微观示意图。
兰州市2017年初中学业水平考试化学(A)注意事项:1.全卷共100分,考试时间100分钟。
2.考生必须将姓名、准考证号、考场号、座位号等个人信息填(涂)写在答题卡上。
3.考生务必将答案直接填(涂)写在答题卡的相应位置上。
4.可能用到的相对原子质量:H-1 C-12 O-16 Ca-40 Mg-24 Zn-65 Cl-35.一、选择题:本大题25小题,一、10小胜每题一分,11 -25 l1%题每题2分,共40分.在每小题给出的四个选项中,只有一项是符合题目要求的。
1.实验室里发生的下列变化,属于化学变化的是A.盐酸挥发B.试管破碎C.石蜡燃烧D.胆矾研碎2.下列物质属于混合物的是A.干冰B.火碱C.白磷D.料酒3.现代社会对能量的需求量越来越大,下列不属于新能源的是A.核能B.天然气C.可燃冰D.风能4.有机合成材料的出现是材料史上的一次重大突破,下列属于合成材料的是A.尼龙绳索B.钛合金C.白瓷盘子D.玻璃5.洁净的空气对于人类和其它动植物都非常重要.下列气体目前不计入空气污染指数的项目是A.二氧化碳B.二氧化氮C.臭氧D.一氧化碳6.把少量下列物质分别放入水中,充分搅拌。
可以得到溶液的是A.面粉B.苏打粉C.花生油D.牛奶7.下列数据是人体内一些液体的正常pH范围,其中酸性最强的是A.尿液4.7-8.4 B.唾液6.6-7.1 C.血浆7.35-7.45 D.胃液0.9-1.58.在阳台上用营养液进行无土栽培蔬菜,己成为城镇居民“亲近自然,享受绿色生活”的家庭时尚。
营养液配方中属于复合肥料的是A.CO(NH2)2B.K2SO4C.NH4H2PO4D.Ca(H2PO4)29.下列实验基本操作正确的是10.下列在“关注地球一小时,参与环保低碳行动”中的做法不合理的是A .骑“共享单车”出行B .就地焚烧垃圾C .道路洒水、空中喷雾D .使用环保购物袋11.汞是一种有害元素,相关信息如图所示。
下列说法中正确的是A .原子核外有80个电子B .相对原子质量为200.6 gC .汞有毒,是非金属元素D .图中Y 代表的是Ag12.硫代硫酸钠,又名大苏打,化学式为Na 2S 2O 3,其中S 元素的化合价是 A .+2 B .+4 C .+6 D .-213.PLA 是一种新型可降解塑料,以乳酸(C 3H 6O 3 )为主要原料聚合而成,下列有关乳酸的说法错误的是A .乳酸是由碳、氢、氧三种元素组成B .乳酸分子中含有12个原子C .乳酸的相对分子质量是90D .乳酸中氧元素的质量分数最大=100%⨯⨯化学式中某原子的个数其相对原子质量化合物中元素的质量分数化合物的相对分子质量,14.下列关于四种粒子的结构示意图说法正确的是A .①、②的化学性质相似B .②所示的粒子符号为NaC .③在化学反应中易失去电子D .④中X 可能为815.“84消毒剂”是以次氯酸钠为主要有效成分的消毒液。
山西省2017年中考化学试题可能用到的相对原子质量:H—1 C—12 N—14 O-16 Cl—35.5 K—39一、选择题(在每小题给出的四个选项中,只有一项符合题目要求。
每小题2分,共20分)1、化学使世界变得绚丽多彩,科学家为此作出了巨大的贡献。
其中研究空气成分的科学家是( )2、化学用语是学习化学的重要工具。
下列表示两个氧原子的符号是()A.O2B.2O C。
O2— D.O-23、为防止造成生命财产的损害,某些场所常贴有下列图标,其中表示“禁止带火种”的是()4、化学家戴维最早制得了曾用作麻醉剂的笑气(化学式为N2O),其中氮元素的化合价是()A。
—1 B.—2 C。
+1 D.+55、蛋白质是构成细胞的基本物质,是机体生长及修补受损组织的主要原料。
下列物质富含蛋白质的是()6、吸烟有害健康。
香烟燃烧产生的烟气中含有尼古丁(化学式为C10H14N2)。
下列有关说法正确的是()A.尼古丁分子中含有氮分子B.尼古丁的相对分子质量为162gC。
尼古丁分子中碳、氢原子个数比为5:7 D。
尼古丁由碳、氢、氧三种元素组成7、在一次基本实验操作比赛中,小芳完成了以下操作。
你认为错误的是()8、小美从某粒子结构示意图(如下图)中,获取了下列信息,其中错误的是()A.它有两个电子层B。
它的核电荷数为12C.它表示阴离子D。
它表示相对稳定结构9、提纯是化学实验常用的一种方法。
除去下表混合物中的杂质,所选除杂试剂错误的是()选项混合物(括号内为杂质)除杂试剂A NaOH溶液(Na2CO3) 适量的氢氧化钙溶液B CaO粉末(CaCO3)足量的蒸馏水C Cu粉(Fe)足量的稀硫酸D CuSO4溶液(H2SO4)足量的氧化铜粉末10、“归纳整理"是一种很好的学习方法。
下面是同学们在复习中梳理得到的一组图像,其中图像与实验表述一致的是()A.加水稀释NaOH溶液B。
一定温度下,向不饱和KNO3溶液中加入KNO3固体C。
计算题1.某班同学在做完“二氧化碳的制取和性质”实验后,废液缸中盛有大量的盐酸与氯化钙的混合溶液(不考虑其它杂质).为了对废液进行处理,某同学做了如下实验:取废液缸上层清液于烧杯中,逐滴滴入溶质质量分数为%的碳酸钠溶液至过量,滴入碳酸钠溶液质量(/g)与生成沉淀的质量(/g)的变化关系如图所示.(计算结果精确到%)求:(1)当废液中盐酸完全反应时,生成的二氧化碳的质量.(2)实验过程中实际参加反应的碳酸钠溶液的质量为多少(3)当废液中两种物质刚好消耗完毕时,所得溶液中氯化钠的质量分数.2.将一些氧化铜粉末加入到100克质量分数为14%的硫酸溶液中,微热至氧化铜全部溶解,再向蓝色溶液中加入W克铁粉,充分反应后,过滤,烘干,得到干燥的固体物质仍是Wg,求:(1)原先氧化铜的质量是多少(2)最后得到的溶液中溶质的质量分数为多少(3)当W为何值时才能满足加入的铁粉和得到的固体质量相等\3.市场上某补钙制剂的说明书如图所示:请计算(不要求写计算过程):(1)葡萄糖酸钙的相对分子质量为;(2)葡萄糖酸钙中碳、氢、氧、钙四种元素的质量比为;(3)此钙片中含葡萄糖酸钙的质量分数为.4.20℃时硫酸的密度和溶质质量分数对照表:密度(克/厘米3)<溶质质量分数(%)102040608098>为测定铜锌合金的组成,取试样5克,加入质量分数为10%的稀硫酸至恰好不再产生气体为止,收集到0.04克氢气.试计算:(1)铜锌合金中锌的质量分数是多少(2)测定时用去10%的稀硫酸多少毫升(3)要配制上述质量分数的稀硫酸500毫升,需98%的浓硫酸多少毫升5.尿素是常用的一种化肥,其化学式为CO(NH2)2,根据其化学式进行计算(1)尿素的相对分子质量;(2)尿素中氮元素的质量分数是多少(3)60克尿素中含有氮元素多少克(4)多少克碳酸氢铵(NH4HCO3)中所含的氮元素与60克尿素中所含的氮元素质量相等6.某水泥厂化验室,为了测定某矿山石灰石中碳酸钙的质量分数,取石灰石样品与足量稀盐酸在烧杯中反应(假设石灰石样品中杂质不与稀盐酸反应也不溶于水.)有关实验数据如下表::反应前反应后实验数据烧杯和稀盐酸的质量石灰石样品'的质量烧杯和其中混合物的质量150g12g157.6g(1)根据质量守恒定律可知,反应中生成二氧化碳的质量为g.(2)求该石灰石中碳酸钙的质量分数.7.将氯酸钾与二氧化锰的混合粉末28.5克加热到不再放出氧气为止,得到固体残留物18.9克,试计算:*(1)生成氧气多少克(2)残留固体中都含有什么各多少克8.如图为某试剂公司出品的过氧化氢溶液(俗称双氧水)的标签.小达欲配制100g6%的过氧化氢溶液,需用该过氧化氢溶液多少克9.学校课外活动小组为了测定某钢铁厂生铁样品中铁的质量分数,在实验室中称取生铁样品5.8g 放入烧杯中(烧杯的质量为30g).然后再加入50g稀硫酸,使之充分反应后,称量,烧杯及烧杯中物质的总质量为85.6g(已知该反应中稀硫酸恰好反应完,杂质不参与反应).请计算:(1)产生氢气的质量是多少(2)该生铁样品中铁的质量分数(精确到%)(3)反应后的溶液中溶质的质量分数(精确到%)10.石灰厂为了测定一批石灰石样品中碳酸钙的质量分数,取用4g石灰石样品,把20g稀盐酸分4次加入样品中(样品中除碳酸钙外,其余的成分既不与盐酸反应,也不溶于水),充分反应后经过滤、干燥等操作,最后称量,得实验数据如下表:第二次加入5g第三次加入5g第四次加入5g稀盐酸的用量'第一次加入5g剩余固体的质量3g2g1g1g(1)该石灰石样品中碳酸钙的质量分数是;。
综合计算1.如图是某奶粉包装袋上部分文字说明,根据说明判断下列说法中正确的是.此奶粉不含任何化学成分 .此包奶粉中蛋白质的质量为25gD .奶粉中的钙、铁、磷、锌指的是元素 【答案】D 【解析】试题分析:从图示看:此奶粉是混合物;此奶粉一定含化学成分;此包奶粉中蛋白质的质量为=300克*25%=75g.故选D . 考点:基本概念和计算2.把一定质量的a ,b ,c ,d 四种物质放入一密闭容器中,在一定条件下反应一段时间后,测得反应后各物质的质量如下,下列说法中正确的是:A .a 和c 是反应物B .d 一定是催化剂C .X=2.0D .该反应是化合反应 【答案】D 【解析】试题分析∶由题中信息知,A .a 和b 是反应物,c 是生成物。
故A 错误。
B .d 可能是催化剂。
故B 错误。
C .X=1.2 。
故C 错误。
D .该反应是化合反应。
故D 正确。
考点∶考查质量守恒定律的应用。
3.经测定某含有C 、O 两种元素的混合气体中,C 元素的质量分数为30%,则该混合物中 A.一定有CO 2 B .一定有CO C .一定有O 2 D .一定有CO 2 CO 【答案】A 【解析】试题分析:CO 中C%=12/(12+16)×100%=43%, CO 2中C%= 12/(12+16+16)×100%=27%, O 2中C%= 0%。
那么C 元素的质量分数为30%,只能是混合气体,可以是CO 2和CO 、O 2,也可以是CO 2和CO 、CO 2500mg和O2。
综上选A。
考点:化学式的计算4.由氢氧化钠(NaOH)和过氧化钠(Na2O2)组成混合物,并检测出氢元素的质量分数为1%,那么混合物中钠元素的质量分数为A.46% B.57.5% C.58.4% D.无法计算【答案】C【解析】试题分析∶由氢氧化钠(NaOH)和过氧化钠(Na2O2)组成混合物组成知,氢元素的质量分数为1%,则NaO的质量分数为99%.根据钠元素质量∶氧元素质量=23∶16, 39∶99%=23∶x, x=58.4%. 考点∶考查根据定组成定律进行有关计算。
化学方程式的计算1.下列说法错误的是( )A. 质量相等的CO 2和CO 中所含氧原子的个数比是14:11B. 53g 碳酸钠和42g 碳酸氢钠分别与过量的盐酸反应,则碳酸钠放出的CO 2多。
C. 某化合物3.2g 与氧气点燃后恰好完全反应,生成4.4g 二氧化碳和3.6g 水。
该化合物中只含有碳、氢两种元素。
D. 取一定量氧化铁与氧化铜的混合物,向其中加入50g 、14.6%的稀盐酸,恰好完全反应生成盐和水,则原混合物中氧元素的质量是1.6g【答案】BC【解析】A 、假设两物质的质量都是m ,则两物质的分子个数比是: 1216m + : 12162m +⨯ =11:7,则氧原子的个数比是:11:7×2=11:14;B 、设53g 碳酸钠和42g 碳酸氢钠分别与过量的盐酸反应,生成二氧化碳的质量分别为:x , yNa 2CO 3+2HCl====2NaCl+CO 2↑+H 2O106 4453g x 106/53g=44/x x=22gNaHCO 3+HCl ====NaCl+CO 2↑+H 2O ,84 4442g y 84/42g=44/y y=22gC 、据质量守恒定律可知反应前后元素的种类不变,所以根据生成二氧化碳和水,可知化合物中一定有碳元素和氢元素,可能含有氧元素,且二氧化碳中碳元素的的质量等于化合物中碳元素的质量为:4.4g ×12100%12+216⨯⨯ =1.2g ,同理可计算氢元素的质量为:3.6g ×12100%12+16⨯⨯⨯ =0.4g ;碳元素和氢元素的质量和为 1.6g<3.2g ;该化合物中含有碳、氢、氧三种元素。
D 、:氧化铁和盐酸反应生成氯化铁和水,氯化铜和盐酸反应生成氯化铜和水,水中的氢元素来自于氯化氢,氧元素来源于氧化铁与氧化铜,水中氢元素和氧元素的质量比为2:16,设原混合物中氧元素的质量是x ,50g ×14.6%×(1÷36.5×100%):x=2:16,x=1.6g 选BC点睛:①化学反应前后元素的种类质量不变,②方程式的计算,关键根据化学反应方程式找出相关物质的质量关系,利用反应中物质的质量比不变进行列比例计算,易错点是,由方程式求质量比算数错误,所以这一步要仔细检查。
2.某CuO 与C 的混合物,共10 g ,加热至不再有气体生成的时候,将生成的气体通入足量的澄清石灰水中,得到沉淀5 g,则原混合物中CuO的质量可能为A. 8 gB. 8.4 gC. 8.6 gD. 9.4 g【答案】AD【解析】碳与氧化铜反应生成铜和二氧化碳。
二氧化碳与氢氧化钙反应碳酸钙的沉淀和水。
根据反应方程找出碳、氧化铜、碳酸钙的质量关系。
由碳酸钙的质量可求出参加反应的碳和氧化铜的质量,如果反应物有剩余,碳和氧化铜都有可能。
据此分析计算。
解:设参加反应的碳的质量为x,CuO的质量为y。
由发生的反应:C + 2CuO高温 2Cu + CO2↑和CO2 + Ca(OH)2 = CaCO3↓+ H2O,可以得出碳、氧化铜、碳酸钙之间的质量关系是:C ~ 2CuO ~ CaCO312 160 100x y 5g12160100==x y g5x=0.6gy=8g因为混合物的质量10g>0.6g+8g=8.6g,剩余物的质量是:10g-8.6g=1.4g。
所以当碳有剩余时碳的质量为:0.6g+1.4g=2g,CuO的质量为8g;当氧化铜有剩余时,氧化铜的质量为:8g+1.4g=9.4g,碳的质量为0.6g。
故混合物中氧化铜的质量为:8g或9.4g。
点睛:解答本题的关键是要考虑反应物是否过量。
3.烧杯中盛有CuCl2和HCl的混合溶液100g,向其中滴加10%的NaOH溶液,烧杯中溶液的质量与滴加溶液的质量关系如图所示。
下列说法正确的是A. ab段反应产生蓝色沉淀B. bc段溶液增加70.2gC. c点对应的溶质质量分数为4.9%D. d点溶液中溶质有2中,且PH>7【答案】BD【解析】烧杯中盛有CuCl2和HCl的混合溶液100g,向其中滴加10%的NaOH溶液,氢氧化钠先和稀盐酸反应生成氯化钠和水,当稀盐酸反应完后,再与氯化铜反应,生成氢氧化铜沉淀和氯化钠,据此分析判断。
A.由图像可知,ab段反应是氢氧化钠先和稀盐酸反应生成氯化钠和水,故错误;B.由题意可知:与氯化铜反应的氢氧化钠的质量为:(160.0-80.0)g×10%=8.0g设生成氢氧化铜的质量为x,生成氯化钠的质量为y。
CuCl2+2NaOH=Cu(OH) 2↓+2NaCl80 98 1178.0g x yx=9.8gy=11.7gbc段溶液增加的质量为:80g-9.8g=70.2g。
故B正确;C.设氢氧化钠与盐酸反应生成氯化钠的质量为z。
HCl+NaOH=NaCl+H2O40 58.580g zz=11.7gc点对应的溶质质量分数为: =9.3%。
故错误;D. d点溶液中溶质有过量的氢氧化钠和生成的氯化钠且PH>7,正确。
点睛:酸、碱、盐的性质;根据化学方程式的计算。
4.铁与稀盐酸反应产生氯化亚铁(FeCl)和氢气.在天平两边的托盘上各放有一个盛足量稀盐酸的烧杯,把天平调节平衡.然后向其中一个烧杯中加入5.3g碳酸钠,向另一个烧杯中加入铁片,若要使反应后天平保持平衡,加入铁片的质量是B.5.3gC.3.215gD.3.1g【答案】C【解析】试题分析∶利用差量法,Na2CO3→CO2,质量增加62.106/62=5.3g/x,x=3.1g.若要使反应后天平保持平衡,加入铁片的质量是∶Fe→H2,质量增加54,56/54=x/3.1g,x=3.215g.故C正确。
考点∶考查根据化学方程式进行计算。
5.在天平的两个托盘上各放一个烧杯,杯中盛有相同的稀硫酸,此时天平平衡。
如果一边放少许锌粒,另一边放入相同质量的铁,两者完全溶解后,天平指针()A、偏向有锌的一边B、偏向有铁的一边C、不偏转D、无法判断【答案】A【解析】试题分析:在天平的两个托盘上各放一个烧杯,杯中盛有相同的稀硫酸,此时天平平衡。
如果一边放少许锌粒,另一边放入相同质量的铁,两者完全溶解后,说明两种金属都完全反应,天平指针的偏转取决于生成氢气的多少,生成氢气越多,托盘上剩余物质量越少,反之剩余物质量越多。
同质量的铁比锌生成氢气多,所以天平指针偏向加锌的一边。
考点:化学方程式的计算,天平的使用6.在CO和CO2的混合气体中,氧元素的质量分数为64%。
将10克混合气体先通入灼热的氧化铁充分反应后,再通入足量的石灰水中,最多可得到白色沉淀物A.5.6克 B.6克 C.10克 D.30克【答案】D【解析】试题分析:CO和灼热的氧化铁充分反应后生成二氧化碳和铁,二氧化碳与氢氧化钙反应生成碳酸钙沉淀和水,在CO和CO2的混合气体中,氧元素的质量分数为64%,则碳元素占36%,10克混合气体中碳元素的质量为3.6g,二氧化碳中碳元素的质量为3.6g,可计算出二氧化碳的质量是13.2g, Ca(OH)2+CO2=CaCO3↓+H2O44 10044/13.2g=100/x x=30g考点:根据化学反应方程式的计算7.60g铁、镁、锌混合物与足量的稀硫酸充分反应后得到混合溶液,蒸干得到156g固体。
则反应产生的氢气质量为A.2.0g B.3.0g C.4.0g D.无法计算【答案】A【解析】试题分析:铁、镁、锌混合物与足量的稀硫酸充分反应分别生成硫酸亚铁、硫酸锌、硫酸镁,60g 铁、镁、锌混合物与足量的稀硫酸充分反应后得到混合溶液,蒸干得到156g固体。
可知硫酸亚铁、硫酸锌、硫酸镁的质量和为156g,其中金属元素的质量为60g,硫酸根的质量为96g,硫酸根与氢的质量比为96:2,所以被置换的氢元素质量为2g,生成氢气的质量等于置换出的氢元素的质量,也是2g。
考点:根据化学反应方程式的计算8.丙烷(化学式C3H8)是液化石油气的主要成分,取一定量的丙烷在一盛有氧气的密闭容器中燃烧,生成7.2克的水,以及CO 和CO2若干,则生成的CO 和CO2的混合气体质量可能是A.8.2克 B.12.4克 C.16.6克 D.20克【答案】B【解析】试题分析:反应前氢元素的质量即丙烷中氢元素的质量等于反应后水中氢元素的质量为:7.2g×(2÷18×100%)=0.8 g;丙烷中碳、氢元素的质量比为36:8,所以碳元素的质量为3.6g;如果全都是一氧化碳存在,则一氧化碳的质量为 3.6g÷(12÷28×100%)=8.4g,如果全都是二氧化碳存在,则二氧化碳的质量为3.6g÷(12÷44×100%)=13.2g,生成的CO 和CO2的混合气体质量可能是在8.4g~13.2g范围内。
考点:化学式的计算9.下列说法正确的是 ( )A. 用适量稀硫酸溶液与氯化钡溶液恰好完全反应后,所得溶液pH=7B. 水在通电条件下发生分解反应,生成氢气和氧气的质量比是2:1C. 等质量、等浓度的氢氧化钠溶液与稀盐酸混合,充分反应后滴入酚酞不变色D. 足量的稀盐酸与质量比为4:3的镁、铝发生反应应,产生气体质量相等【解析】BaCl2 +H2SO4=BaSO4↓+2HCl ,用适量稀硫酸溶液与氯化钡溶液恰好完全反应后,所得溶液pH<7,错误;B. 水在通电条件下发生分解反应,生成氢气和氧气的体积比是2:1,错误;C. NaOH+HCl==NaCl+H2O,反应物的质量比是40:36.5,等质量、等浓度的氢氧化钠溶减与都盐酸混合,充分反应后稀盐酸有剩余,溶液显酸性,滴入酚酞不变色,正确;D. 设镁的质量是4m,与足量稀盐酸反应生成氢气的质量为x,铝的质量是3m,与足量稀盐酸反应生成氢气的质量为y,2Al+6HCl==2AlCl3+3H2↑ Mg+2HCl== MgCl2+H2↑54 6 24 23m y 4m x54 6=3my解得y=3m242=4mx解得x=3m故足量的稀盐酸与质量比为4:3的镁、铝发生反应,产生气体质量相等,正确。
故选CD。
点睛:本题主要考查学生质量守恒定律的应用能力。
10.现有甲、乙两份质量相等的石灰石,甲份经研磨成为粉末状,乙份为块状,向两份中分别加入足量的稀盐酸至不再产生气体,下列图像正确的是【答案】C【解析】试题分析:现有甲、乙两份质量相等的石灰石,甲份经研磨成为粉末状,粉末状与盐酸接触更充分,比乙份为块状反应更快,但是不改变生成物的质量,向两份中分别加入足量的稀盐酸至不再产生气体,最终生成气体一样多。
考点:化学与图表11..在托盘天平的两边各放一只烧杯,调节天平平衡,向两烧杯中分别注入相同质量、相同浓度的稀硫酸;然后向右盘的烧杯中放入一定质量的Mg粉,同时向左盘的烧杯中放入等质量的Zn粉,充分反应后两种金属都有剩余。