分析化学第九章配位化合物与配位滴定法
- 格式:doc
- 大小:150.00 KB
- 文档页数:9



配位滴定法的要求配位滴定法是一种常用的分析化学技术,用于确定溶液中金属离子的浓度。
它基于配位反应的原理,通过加入一种适当的配位剂,使金属离子与配位剂形成稳定的配合物,从而实现对金属离子的定量测定。
在进行配位滴定实验时,有一些关键要求需要满足,以确保实验结果的准确性和可重复性。
以下是配位滴定法的要求:1. 选择合适的配位剂:配位滴定法的核心是选择适当的配位剂,以实现金属离子与配位剂形成稳定的配合物。
配位剂应具有高度选择性,能够与待测金属离子发生特异性的配位反应,并形成可观察的配合物。
2. 校准滴定溶液:在进行配位滴定之前,需要校准滴定溶液的浓度。
校准过程可以通过滴定已知浓度的标准溶液来完成。
校准滴定溶液的浓度应尽量接近待测溶液的浓度,以提高准确度。
3. 准确称量试样:为了获得准确的结果,需要准确称量待测溶液。
使用准确的天平,并遵循正确的称量程序,确保称量的溶液量符合实验要求。
4. 保持温度稳定:配位滴定过程中,温度的变化可能会影响反应的速率和平衡。
因此,需要在实验过程中保持温度的稳定性。
可以使用恒温槽或温度控制设备来控制反应温度。
5. 使用适当的指示剂:指示剂在滴定过程中起到指示滴定终点的作用。
选择适当的指示剂很重要,它应与滴定剂和金属离子配位反应,且在滴定终点时有明显的颜色变化。
指示剂的选择应根据所测定的金属离子和配位剂的特性进行。
6. 严格的试剂处理:在配位滴定法中,试剂的纯度和处理过程对结果的准确性和重复性至关重要。
试剂应具有高纯度,避免有杂质的存在。
试剂的保存和处理应符合实验室的规定,以确保实验的可靠性。
7. 熟练的操作技巧:熟练的操作技巧对于配位滴定实验的成功至关重要。
滴定过程中需要准确控制滴定剂的滴加速度和滴定速度,以及观察指示剂的变化。
熟练的技巧可以提高实验的准确性和效率。
8. 记录实验数据:在配位滴定实验中,准确记录实验数据是非常重要的。
包括滴定剂的用量,滴定终点的观察和指示剂的变化等。

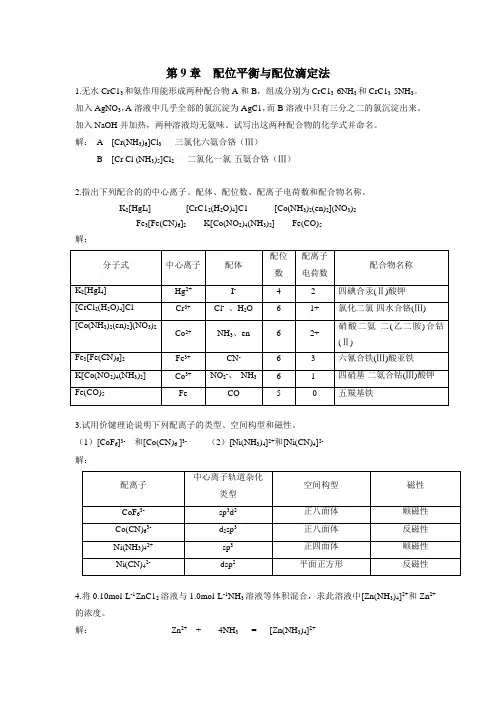
第9章配位平衡与配位滴定法1.无水CrC13和氨作用能形成两种配合物A和B,组成分别为CrC13·6NH3和CrC13·5NH3。
加入AgNO3,A溶液中几乎全部的氯沉淀为AgC1,而B溶液中只有三分之二的氯沉淀出来。
加入NaOH并加热,两种溶液均无氨味。
试写出这两种配合物的化学式并命名。
解:A [Cr(NH3)6]Cl3三氯化六氨合铬(Ⅲ)B [Cr Cl (NH3)5]Cl2二氯化一氯·五氨合铬(Ⅲ)2.指出下列配合的的中心离子、配体、配位数、配离子电荷数和配合物名称。
K2[HgI4] [CrC12(H2O)4]C1 [Co(NH3)2(en)2](NO3)2Fe3[Fe(CN)6]2K[Co(NO2)4(NH3)2] Fe(CO)5解:3.试用价键理论说明下列配离子的类型、空间构型和磁性。
(1)[CoF6]3-和[Co(CN)6 ]3- (2)[Ni(NH3)4]2+和[Ni(CN)4]2-解:4.将0.10mol·L-1ZnC12溶液与1.0mol·L-1NH3溶液等体积混合,求此溶液中[Zn(NH3)4]2+和Zn2+的浓度。
解:Zn2++ 4NH3= [Zn(NH3)4]2+平衡浓度/mol·L -1 x 0.5-4×0.05+4x ≈0.3 0.05-x ≈0.0594342243109230050⨯=⋅==++..x .)NH (c )Zn (c ))NH (Zn (c K f θx =c(Zn 2+)=2.13×10-9mol·L -15.在100mL0.05mol·L -1[Ag(NH 3)2]+溶液中加入1mL 1mol·L -1NaC1溶液,溶液中NH 3的浓度至少需多大才能阻止AgC1沉淀生成?解: [Ag(NH 3)2]++Cl - = AgCl + 2NH 3 平衡浓度/mol·L -1 0.05 0.01 c(NH 3)107233210771101111-+-⨯⨯⨯===..K K ))NH (Ag (c )Cl (c )NH (c K sp f j 11073510107711011010050--⋅=⨯⨯⨯⨯=Lmol .....)NH (c6.计算AgC1在0.1mol·L -1氨水中的溶解度。





第九章 配位化合物与配位滴定法习题1.是非判断题1-1中心离子的未成对电子数越多,配合物的磁矩越大。
1-2配合物由内界和外界组成。
1-3配位数是中心离子(或原子)接受配位体的数目。
1-4配位化合物K 3[Fe(CN)5CO]的名称是五氰根·一氧化碳和铁(Ⅱ)酸钾。
1-5一般说来,内轨型配合物比外轨型配合物稳定。
1-6配合物中由于存在配位键,所以配合物都是弱电解质。
1-7同一种中心离子与有机配位体形成的配合物往往要比与无机配合体形成的配合物更稳定。
1-8配合物的配位体都是带负电荷的离子,可以抵消中心离子的正电荷。
1-9电负性大的元素充当配位原子,其配位能力强。
1-10在螯合物中没有离子键。
1-11配位物中心离子所提供杂化的轨道,其主量子数必须相同。
1-12配合物的几何构型取决于中心离子所采用的杂化类型。
1-13外轨型配离子磁矩大,内轨型配合物磁矩小。
1-14配离子的配位键越稳定,其稳定常数越大。
1-15氨水溶液不能装在铜制容器中,其原因是发生配位反应,生成[Cu(NH 3)4]2+,使铜溶解。
1-16在配离子[Cu(NH 3)4]2+解离平衡中,改变体系的酸度,不能使配离子平衡发生移动。
1-17已知[HgI 4]2-的4θβ=K 1,[HgCl 4]2-的4θβ=K 2,,则反应[HgCl 4]2-+4I -=[HgI 4]2-+4Cl -的平衡常数为K 1/K 2。
1-18 [Cu(NH 3)3]2+ 的积累稳定常数β3是反应[Cu(NH 3)2]2+ + NH 3⇔[Cu(NH 3)3]2+的平衡常数。
1-19已知θϕ[Fe 3+/Fe 2+]=0.77V ,电极反应[Fe(C 2O 4)3]3-+ e=[Fe(C 2O 4)2]2-+ C 2O 42-,在标准状态时,θϕ的计算式为:θθθθθϕϕc O C c c O C Fe c c O C Fe c Fe F /)(/])([/])([lg 0592.0)/e 2422242334223---+⋅++(= 。

配位滴定法概述一. 配位反应的普遍性配位物具有极大的普遍性。
严格地说,简单离子只有在高温气态下存在。
在溶液中,由于溶剂化的作用,不存在简单离子。
因此,溶液中的金属离子(Mn+)“应该”以M(H2O)nn+ 表示。
溶液中的配位反应实际上是配位体与溶剂分子间的交换,在水溶液中:M(H2O)n + L ==M(H2O)n-1 L + (H2O)稳定性:小<大但通常可简化为:M+L==ML——以配位(交换)反应为基础进行滴定分析的方法即“配位滴定法”。
例:AgNO标液滴定CN-:Ag ++ 2CN- ==[Ag(CN)2]- ,K=1.0′1021以KI为指示剂,终点生成AgI, 溶液浑浊。
配位反应在分析化学中应用非常广泛,许多显色剂、萃取剂、沉淀剂、掩蔽剂等都是配合物。
二. 配合物的分类按配位体所含配位原子的数目可分为单齿配位体(:F-, :NH3 ) 和多齿配位体 ( H2N-CH2-CH2-NH2 ) 。
前者形成单齿(非螯合)配合物,后者形成螯合物。
(一)单齿配位化合物——掩蔽和辅助配位M+n L==MLn(L只有一个配位原子)与多元酸相似,单齿配合物时逐级形成的(分步),一般相邻两个之比较接近,稳定性不高。
例:配合离子的形成过程Cu+ NH3== Cu(NH3)2+k1 = 1.4′104Cu(NH3)2++ NH3== Cu(NH3)22+k2= 3.1′103Cu(NH3)22++ NH3== Cu(NH3)32+k3= 7.8′102Cu(NH3)32++ NH3== Cu(NH3)42+k4 = 1.4′102(1)分步稳定常数:k,1/k = k离n ——分步离解常数(2)累计稳定常数:b第一级累积稳定常数b1 = k1第二级累积稳定常数b2= k1 k2┇┇第n级累积稳定常数b4 = k1 k2…kn(3)总稳定常数K:K= b n(二)螯合物配位体中含二个以上配位原子,与金属离子配位有二个以上结合点形成环状结构形象地称为螯合物螯合物的特点:同种配位原子的稳定性:螯合物 >非螯合物环多 > 环少大环 > 小环由于螯合物的稳定性一般较大,有利于滴定分析。
第九章配位化合物与配位滴定法章节测试题一、选择题(每题1.5分30分)1.[Co(en)(C2O4)]2-中心离子的配位数是。
A. 3B. 4C. 5D. 62.下列配合物命名不正确的是。
A [Co(ONO)(NH3)5]SO4硫酸一亚硝酸·五氨根合钴(III)B [Co(NH3)5H2O]Cl3三氯化一水·五氨合钴(Ⅲ)C [PtCl(NO2)(NH3)4]CO3碳酸一硝基·一氯·四氨合铂(IV)D [CrBr2(H2O)4]Br∙2H2O 二水合溴化二溴·四水合铬(III)3.下列物质是顺磁的为。
A. [Zn (NH3)4]2+B. [Co (NH3)6]3+C. [TiF4] -D. [Cr (NH3)6]3+4.[Fe(CO)5]的磁矩为零。
它的空间构型为。
A. 三角锥形B. 四方形C. 三角双锥形D. 四方锥形5.对于配合物[Cu(NH3)4][PtCl4],下列说法正确的是。
A. 前面部分是外界B. 后面部分是外界C. 两部分都是配离子D. 两部分都是外界6.价键理论的解释正确的是。
A. 不是所有的中心原子都能生成内轨型配合物B. 不是所有的中心原子都能生成外轨型配合物C. 中心离子用于形成配位键的轨道是杂化轨道D. 正电荷高的中心离子形成的配合物都是杂化轨道7.K3[FeF6]的磁矩比K3[Fe(CN)6]大,可以解释为。
A. 中心离子的氧化数不同B. F-对中心离子的影响更大C. 配位原子的电负性不同D. CN-是弱的电子接受体8.根据晶体场理论,判断高自旋配合物的判据为。
A. 分裂能大于成对能B. 电离能大于成对能C. 分裂能大于成对能D. 分裂能小于成对能9.[ Ni(CN)4]-的空间构型是。
A. 正四面体B. 正四方锥C. 平面四方形D. 变形四面体10.用硫酸处理可以取代化合物中的Cl-,但氨的含量不变,用硝酸银处理有三分之一的Cl-沉淀,判断化学式为。
A. [Co (NH3)4] Cl3B. [Co (NH3)4Cl3]C. [Co (NH3)4 Cl] Cl2D. [Co (NH3)4 Cl2] Cl11.在配位滴定中用返滴定方法测定Al3+,若在pH=5~6时返滴定过量的EDTA,应选用的标准溶液为。
A. Al3+B. Ca2+C. Zn2+D. Ag+12.金属指示剂的封闭现象是由于。
A. MN比MY更稳定B. MY比MN更稳定C. MY比MIn更稳定D. MIn比MY更稳定lg K 13.在pH为9的NaF溶液中,a ThF=109.0,a Th(OH)=104.7,a Y(H)=101.3,θThY lg K 为。
=23.2,θThYA. 2B. 9.2C. 12.9D. 14.214.在配位滴定中,下列有关酸效应的叙述,正确的是。
A. 酸效应系数愈大,配合物的稳定性愈大B. 酸效应系数愈小,配合物的稳定性愈大C. pH愈大,酸效应系数愈大D. 酸效应系数愈大,配位滴定曲线的pM突跃范围愈大15.在Fe3+,Zn2+共存的溶液中,用EDTA测定Fe3+,要消除Zn2+的干扰,最简便的是。
A. 沉淀分离法B. 控制酸度法C. 配位掩蔽法D. 离子交换16.酸效应曲线不能回答的问题是。
A. 进行各金属离子滴定时的最低pH值B. 在一定pH值范围内滴定某种金属离子时,哪些离子可能有干扰C. 控制溶液的酸度,有可能在同一溶液中连续测定几种离子D. 准确测定各离子时溶液的最低酸度17.用EDTA 滴定Bi 3+时,为了消除 Fe 3+的干扰,采用的掩蔽剂是 。
A. 抗坏血酸B. KCNC. 草酸D. 三乙醇胺18.在强酸性介质中,以二甲酚橙为指示剂,测定Zn - EDTA 配合物的EDTA 组分,需使用的标准溶液是 。
A. Pb(NO 3)2B. Bi(NO 3)3 C . CdSO 4 D. CaCl 219.用指示剂 ( In ),以EDTA ( Y ) 滴定金属离子M 时常加入掩 蔽 剂 (X) 消除某干扰离子 (N) 的影响。
不符合掩蔽剂加入条件的是 。
A. K NX <K NYB. K NX >> K NYC. K MX <<K MYD. K MIn >K MX20.已知AgBr 的θsP p K = 12.30,[Ag(NH 3)2]+ 的θf lg K = 7.40,则AgBr 在 1.001mol ⋅L -1 NH 3 溶液中的溶解度 (mol ⋅L -1)为 。
A. 10-4.90B. 10-6.15C. 0. 10-9.85D. 10-2.45二、填空题(每空1分,17分)1.根据磁矩可以判断 [Mn(CN)6]4- (μ=1.73 B.M.)是_________ (高或低)自旋的;[CoF 6]3- (μ=4.90B .M.) 是_________ (“高”或“低”)自旋的。
2.在pH 大于12时,EDTA 以_________形式存在,若不存在其他的副反应,此时MY 配合物稳定常数___________条件稳定常数。
3.在pH=1的Bi 3+、Pb 2+离子浓度共存的体系中,可用___________方法滴定Bi 3+、而Pb 2+不干扰。
4.由于Fe 3+与铬黑T 形成的配合物的稳定性比Fe 3+与EDTA 形成的配合 物的 定性大,所以Fe 3+对铬黑T 有____________ 作用。
5.以铬黑T 作指示剂,用EDTA 滴定Zn 2+。
当有少量Fe 3+,Al 3+ 存在时,看不到终点颜色变化,这是由于 _______________ 。
6.某金属指示剂在溶液中存在下列平衡:H 3In 3-p K 4= 3.23H 2In 4-p K 5= 6.3HIn5-p K 6= 12.36-In 已知H 6In 至H 2In 4-各型体均呈黄色, Hin 5-和In 6-为红色,它们的金属离子配合物 (MIn) 均为红紫色。
此指示剂适宜在pH 范围使用。
7.欲用EDTA滴定含有Zn2+ ,Al3+混合溶液中的Zn2+时,可用________________掩蔽Al3+,使其生成稳定性较好的______ 配离子,以消除Al3+的干扰。
8.金属指示剂之所以能指示滴定过程中金属离子浓度的变化情况,是由于__________的颜色与____________的颜色有明显的不同。
9.用EDTA 溶液滴定Cu2+溶液时,如果滴定物的浓度和氨性缓冲溶液用量一定时,则该滴定反应的pCu突跃范围取决于____ _____。
10.在含有酒石酸和KCN的氨性溶液中,用EDTA滴定Pb2+、Zn2+混合溶液中的Pb2+、Zn2+,酒石酸的作用是、KCN的作用是。
11.EDTA滴定反应的pM突跃范围大小,取决于人们对滴定分析的____________ 以及滴定反应的_____________________ 。
二、判断是非,并说明理由(每题2分,共12分)1.配位滴定铝时,常用返滴定法或置换滴定法。
2.配位滴定中常用的标准溶液是乙二胺四乙酸。
3.配位剂的浓度越大,生成的配合物的配位数就越大。
4.配合物由内界和外界两部分组成。
5.配位数就是配体的数目。
6.配离子的电荷等于中心离子的电荷。
三、简答题(每题3分,共12分)1.为什么大多数过渡金属的配离子是有色的?2.为什么AgBr沉淀可溶解于KCN溶液,而Ag2S不溶?3.配位滴定为何要控制酸度?如何控制?3+的试液中测定Bi3+;试设计简要方案(包4.不经分离用配位滴定法在含有Fe括滴定剂、酸度、指示剂,所需其他试剂以及滴定方式)。
已知lg K FeY = 25.1,lg K BiY = 27.94。
四、计算题(3分+4分+6分+6分+9分)1.计算下列反应的平衡常数,并判断反应方向:[HgCl4]2-+4I- =[HgI4]2-+4Cl-2.100 mL 浓度为0.10mol·L -1的AgNO 3溶液,加入过量NH 3·H 2O 后,稀释至200 mL 。
若此溶液中游离NH 3的浓度为1mol ⋅L -1,求溶液中Ag +的浓度 。
( 已 知 [Ag(NH 3)2]+的 lg β1 = 3.40, lg β2 = 7.40 )3、50mL 浓度为0.020mol ⋅L -1 Ni(NO 3)2溶液,加入NH 3 - NH 4Cl 缓冲溶液后,稀释至100mL ,此时溶液pH= 10,其中游离NH 3浓度为0.10mol·L -1。
计 算:(1) 镍的副反应系数3Ni(NH )α ;(2)镍与EDTA 配合物的条件稳定常数;(3) 在此条件下能否用EDTA 的标准溶液滴定Ni 2+ 。
(已 知 [Ni(NH 3)6]2+的 lg β1 ~ lg β6 为 :2.75 ; 4.95 ; 6.64 ;7.79; 8.50 ; 8.49 ;pH= 10时, lg αY(H) = 0.45 ,lg αNi(OH) = 0 ,θNiY lg K = 18.67)4.溶液中Ca 2+和Zn 2+的浓度均为2.0×10-2 mol·L -1,用2.0×10-2 mol·L -1EDTA 溶 液滴定Ca 2+到终点时,[CN -]=0.10 mol·L -1。
(1)问能否准确滴定?(2)求滴定Ca 2+的适宜pH 范围。
θθCaY(lg 10.69,lg 16.50)K K ==5.在50mL0.01 mol·L -1的硝酸银溶液中加入10mol·L -1的氨水30ml ,并加水稀释到100mL ,计算:(1)混合溶液中各种离子的浓度。
(2)若加入0.0745g 氯化钾,有无氯化银沉淀析出?阻止氯化银沉淀析出,原来混合溶液中氨水的浓度最低是多少?(3)若加入0.12g 溴化钾有无溴化银析出?要阻止其析出原溶液中溴化银浓度最低是多少?参考答案一、选择题1.B2.A3.D4.C5.C6.C7.C8.D9.C 10.D 11.C 12.D 13.C14.B 15.B 16.D 17.A18.B 19.A 20.D二、填空题1.低,高2.分子;等于3.用控制酸度4.封闭5.Fe3+,Al3+对指示剂封闭6.小于6.37.氟化钠,[AlF6]3-8.金属指示剂配合物MIn 、处于游离态的指示剂In9.金属离子副反应系数10.辅助配位剂;掩蔽剂11.准确度、条件稳定常数和金属离子初试浓度三、判断是非,并说明理由1.对,原因(1)在室温下,Al 3+与EDTA 反应速率慢;(2)Al 3+会引起指示剂封闭;(3)Al 3+易水解成多羟基配合物,使配位比不恒定。