工业流程专项练习(一)汇编
- 格式:doc
- 大小:446.00 KB
- 文档页数:8


《工业流程题》1、运用废旧电池铜帽(含Cu、Zn)制取海绵铜(Cu),并得到硫酸锌溶液E,重要流程如下图所示(反映条件已略去):(1)过程中会发生:2Cu+2H2SO4+O22CuSO4+2X,X化学式为。
(2)过程是先加入过量B、充分反映后再进行分离。
分离操作名称是,该操作中用到玻璃仪器有烧杯、玻璃棒和,玻璃棒作用是(3)物质D是一种酸,过程反映化学方程式为;判断固体C中非铜杂质被物质D反映完全现象是:继续加入D时无。
(4)A~E中含铜、锌两种元素有(填字母序号)。
2、超细碳酸钙可用于生产钙片,牙膏等产品。
运用碳化法生产超细碳酸钙重要流程示意图,如图(1)石灰石重要成分化学式为(2)乳化池中,生石灰与水发生反映,其反映方程式为。
其基本化学反映类型是(3)过筛与过滤类似,其目是拦截(填“不不大于”或“不大于”)筛孔直径颗粒。
(4)碳化塔中反映化学方程式为。
3、下图是用粗硅(含CaCO3及不溶于酸杂质)制备高纯硅一种简易流程:(1)操作①名称是_____,完毕此操作需要玻璃仪器有烧杯、玻璃棒、__________。
该操作中玻璃棒作用是___________________________。
(2)粗硅中加入过量稀盐酸目是__________________________________。
(3)反映②化学方程式是_____________________________。
(4)上述生产流程中,可以循环运用物质是_________________(填化学式)。
(5)反映②如果H2中混入O2,从安全角度考虑,也许引起后果是_________________。
4、实验室废弃液中含一定量AgNO3 ,兴趣小组同窗回收金属银流程如下:请认真分析以上流程,回答下列问题:(1)操作Ⅰ、Ⅱ所需要玻璃仪器有:烧杯、玻璃棒、.(2)讨论a选取:甲同窗以为用锌,乙同窗以为用铜,你以为(填“甲”或“乙”)选取更合理,你选取理由是.加入a发生反映化学方程式是.(3)固体B成分是(填化学式)(4)操作中加入适量稀硫酸发生化学方程式5、21世纪是钛世纪.下图是运用钛白粉(TiO2)生产海绵钛(Ti)一种工艺流程:(1)将化石燃料中煤隔绝空气加强热可以得到上述流程中哪种物质(填编号)。

工业流程题1、以电解食盐水为基础制取氯气、氢氧化钠等产品旳工业称为“氯碱工业”,它是目前化学工业旳重要支柱之一。
由于粗盐中具有少许MgCl2、CaCl 2、Na 2SO 4等杂质,不符合电解规定,因此必须通过精制。
以粗盐为原料旳“氯碱工业”流程如下:回答问题: (1)氯气、氢氧化钠在工业上有广泛旳用途。
下列有关氢氧化钠旳描述中,错误旳是 。
A .能清除油污,可做厨房清洁剂 B.易溶于水,溶解时放出大量旳热C .水溶液能使石蕊溶液变红 D.可用作某些气体旳干燥剂(2)操作②旳名称是 ,操作④旳名称是 。
(3)操作①②间除杂质时所加旳三种试剂是NaOH 溶液、Na 2CO 3溶液、BaCl 2溶液(均过量),其次序规定是:Na 2CO 3溶液必须在BaCl 2溶液之 (填“前”或“后”)加入。
有同学提出用 溶液替代BaCl 2溶液可到达同样旳目旳。
(4)电解饱和NaCl 溶液旳化学方程式是 。
(5)该流程中可以循环运用旳物质是 。
2、MnO 2是一种重要旳无机功能材料,粗MnO 2(具有较多旳MnO 和MnCO 3)旳提纯是工业生产旳重要环节.如图是某研究性学习小组在试验室中模拟工业上粗MnO 2转化为MnO 2旳工艺流程.请回答问题: 依次加入过量的三种试剂除杂粗盐悬浊液沉淀滤液NaCl 溶液饱和NaCl 溶液H 2Cl 210%的NaOH 溶液16%的NaCl 溶液50%的NaOH 溶液NaCl 晶体加适量的水②加盐酸,调pH=7①③④电解⑤⑥(1)操作A旳名称是_________.(2)NaClO3中氯元素旳化合价为_________价.(3)蒸发所需旳仪器有铁架台(带铁圈)、蒸发皿、酒精灯和_________.(4)写出加稀硫酸H2SO4时产生CO2旳化学方程式_________.(5)该流程中可以循环运用旳物质是H2SO4和_________.3、高纯氧化钙是用于电子工业重要旳无机化工原料.用硝酸钙溶液制备高纯氧化钙旳工艺流程如下:反应池中发生反应旳化学方程式为:CO2+2NH3•H2O+Ca(NO3)2═2NH4NO3+CaCO3↓+H2O请回答问题:(1)过滤操作中玻璃棒旳作用是.(2)过滤后所得沉淀表面也许具有旳可溶性杂质有(写出一种即可).(3)该工艺流程中可循环使用旳物质是.(4)冷却需在干燥旳环境中进行,否则制得旳高纯氧化钙中会混有旳杂质是.(5)上述流程中旳副产物NH4NO3可用作氮肥,氮肥旳重要作用是.A、增进植物生长,叶色浓绿B、增强作物旳抗寒,抗旱能力C、增强作物旳抗病虫害和抗倒伏能力.4、FeSO4•7H2O是一种重要旳食品和饲料添加剂.某工业废渣主成分是Fe2O3,还具有CaCO3和SiO2(不溶于水也不溶于稀硫酸),试验室用此废渣制备FeSO4•7H2O旳流程如图1:请根据流程图回答问题:(1)稀硫酸与粉末中旳氧化铁反应旳化学方程式为(2)操作②所需要旳玻璃仪器是:烧杯、玻璃棒和.(3)经测定,滤渣中只具有CaSO4和SiO2,你认为试验室(填“能”或者“不能”)用粉末状旳石灰石与稀硫酸反应制二氧化碳.(4)Fe与Fe2(SO4)3反应旳化学方程式为.(5)硫酸亚铁旳溶解度曲线如图2.待结晶完毕后,滤除晶体,用少许冰水洗涤2﹣3次.用冰水洗涤旳目旳是:Ⅰ除去晶体表面附着旳杂质;Ⅱ.5、工业上以高纯度旳二氧化锰为原料制备高锰酸钾旳重要流程如下:已知有关物质旳溶解度(20℃)如下表:(1)KMnO4中锰元素旳化合价为。

xxx学校2012-2013学年度2月月考卷学校:___________姓名:___________班级:___________考号:___________一、选择题(题型注释)二、填空题(题型注释)1.钛是21世纪金属。
下面是利用钛白粉(TiO 2)生产海绵钛(Ti )的一种工艺流程:已知:① Mg(s)+Cl 2 (g)=MgCl 2 (s) △H =-641kJ·mol -1② Cl 2(g)+1/2Ti (s)=1/2TiCl 4 (l) △H =-385 kJ·mol -1 (1)钛白粉是利用TiO 2+发生水解生成钛酸(H 2TiO 3)沉淀,再煅烧沉淀制得的。
TiO 2+发生水解的离子方程式为 。
(2)反应I 在800~900℃下进行,还生成一种可燃性无色气体,该反应的化学方程式为 ;反应II 的热化学方程式为 。
(3)该工艺流程中,可以循环使用的物质有(填化学式)。
(4)在800℃~1000℃时电解TiO 2也可制得海绵钛,装Mg 、ArTiCl 4(l ) 焦炭钛白粉 Cl 2反应ⅡMgCl 2海绵钛电解Mg 、Cl 2分离熔融置如右图所示。
图中b是电源的极,阴极的电极反应式为。
答案:(1)TiO2++2H2O=H2TiO3↓+2H+(2)TiO2+2Cl2+2C TiCl4+2CO2Mg(s)+TiCl4(l)=2MgCl2(s)+Ti(s) △H=-512 kJ·mol-1(3)Mg、Cl2(4)正TiO2+4e-=Ti+2O2-略2.利用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化尾气,又能获得应用广泛的Ca(NO3)2,其部分工艺流程如下:(1)硝酸工业尾气一般用碱液吸收,写出一个吸收尾气离子方程式。
(2)上述工艺中采用气液逆流接触吸收(尾气从吸收塔底部进入,石灰乳从吸收塔顶部喷淋),其目的是;滤渣可循环利用,滤渣的主要成分是 (填化学式)。
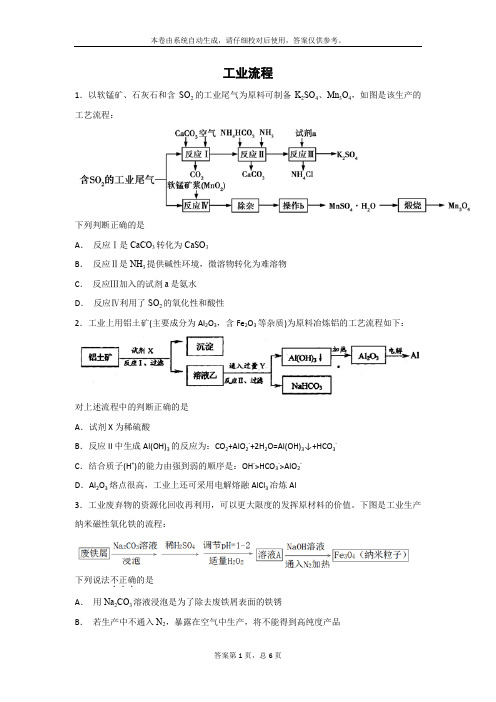
工业流程1.以软锰矿、石灰石和含SO2的工业尾气为原料可制备K2SO4、Mn3O4,如图是该生产的工艺流程:下列判断正确的是A.反应Ⅰ是CaCO3转化为CaSO3B.反应Ⅱ是NH3提供碱性环境,微溶物转化为难溶物C.反应Ⅲ加入的试剂a是氨水D.反应Ⅳ利用了SO2的氧化性和酸性2.工业上用铝土矿(主要成分为Al2O3,含Fe2O3等杂质)为原料冶炼铝的工艺流程如下:对上述流程中的判断正确的是A.试剂X为稀硫酸B.反应II中生成Al(OH)3的反应为:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-C.结合质子(H+)的能力由强到弱的顺序是:OH->HCO3->AlO2-D.Al2O3熔点很高,工业上还可采用电解熔融AlCl3冶炼Al3.工业废弃物的资源化回收再利用,可以更大限度的发挥原材料的价值。
下图是工业生产纳米磁性氧化铁的流程:下列说法不正确...的是A.用Na2CO3溶液浸泡是为了除去废铁屑表面的铁锈B.若生产中不通入N2,暴露在空气中生产,将不能得到高纯度产品C.加适量的H2O2是为了将部分Fe2+氧化为Fe3+ ,涉及反应:H2O2+2Fe2++2H+=2Fe3++2H2O D.溶液A中Fe2+和Fe3+的浓度比为1:27.铜是有色金属,被广泛地应用于电气、轻工、机械制造、建筑工业、国防工业等领域,铜的冶炼和加工对于现代社会有着重要的意义。
(1)工业上可用黄铜矿冶炼粗铜,简要流程如下:在转炉中,经过两步反应生成粗铜,其的热化学方程式分别为:则总反应的热化学方程式为:_______________________________________;(2)粗铜可用电解法精炼,电解过程中,粗铜应做____极;精铜一侧电极反应式为__________;(3)电解精炼时粗铜中Fe、Zn等杂质元素会进入电解质溶液,一段时间后需要对电解液除杂净化,其中除去铁元素的一种操作如下:下表为部分阳离子以氢氧化物形式沉淀时溶液的pH:①试剂a是_______________,其作用是_________________________________________;②溶液A加入CuO调节pH的目的是________________________________________(用必要的离子方程式和适当的文字说明)。

一、仪器的认识1. 可加热仪器2.计量仪器(1)⎩⎪⎨⎪⎧ ①计数时要平视凹液面最低处;②无“0”刻度,刻度由下而上逐渐增大;③精确度不高于0.1 mL ;④选取规格要遵循“大而近”,如量取5.6 mL NaOH 溶液应选取10 mL 量筒,而不能选用50 mL 量筒;⑤不可加热,不可作反应容器,不可用于溶液的稀释。
(2)⎩⎪⎨⎪⎧ ①使用前要检查是否漏水;②加液体用玻璃棒引流,当液面距刻度线1~2 cm 时改用胶头滴管,加液体至凹液面最低处与刻 度线相切。
(3) ⎩⎪⎨⎪⎧①使用前要检查是否漏水;②“0”刻度在上;③精确度为0.01 mL ;④A 用于量取酸性溶液和氧化性溶液,B 用于量 取碱性溶液;⑤要先用待装液润洗再装溶液。
(4)3.分离、提纯仪器 仪器图形与名称 主要用途 使用方法和注意事项(1)向小口容器中转移液体 (2)加滤纸后,可过滤液体 (1)制作过滤器时,滤纸紧贴漏斗壁,用水润湿,注意不得留有气泡(2)滤纸低于漏斗边缘,液体低于滤纸边缘(1)用于随时添加液体 (2)萃取、分液 (1)注意活塞不得渗漏(2)分离液体时,下层液体由下口流出,上层液体由上口倒出除去气体中的杂质 (1)一般选择与杂质气体反应的试剂作吸收液(2)装入液体量不宜超过容积的2/3(3)气体的流向为:长进短出 用于干燥或吸收某些气体,干燥剂为粒状、常用无水CaCl 2、碱石灰 (1)注意干燥剂或吸收剂的选择 (2)一般为大口进气,小口出气常用于分离沸点相差较大的互溶液体混合物 冷却水的流向应下进上出二、工业生产流程主线与核心三、物质制备类工艺流程题①先是确定要制备什么物质,从题干或问题中获取有用信息,了解产品的性质(具有某些特原料预处理 产品分离提纯反应条件原料循环利用 排放物的无害化处理殊性质的产物,要采取必要的措施来避免在生产过程中产生其它杂质,比如:产品受热易分解,可能要低温烘干、减压烘干、减压蒸发等);①分析流程中的每一步骤,从几个方面了解流程:反应物是什么?反应方程式是什么?该反应造成了什么后果?对制造产品有什么作用?①从问题中获取信息,帮助解题。
中考化学专项复习《工业流程题》分析流程图1.关注“箭头”:箭头进入的是投料(即反应物);出去的是生成物(包括主产物和副产物);(回头的箭头)表示循环利用的物质2.关注流程“三线”和“核心”(如下图)3.关注方框内所指4.工艺流程的评价①设计方案的科学性:能否达到实验目的,杂质是否完全除去,是否引入新的杂质等。
②安全性和简便性:尽量选用较温和的反应条件,避免高温、高压条件。
③对环境的影响:是否符合绿色化学理念,是否产生有毒气体等。
④节约性:原料利用率要尽量高。
5.书写相关方程式、判断可循环利用的物质、对流程评价或改进等原料预处理的方法1.粉碎或研磨目的是:增大固液(或固气或固固)接触面积,加快反应(溶解)速率,增大原料的转化率(或浸取率)。
2.煅烧或灼烧目的是:不易转化的物质转为容易提取的物质;其他矿转化为氧化物;除去有机物;除去热不稳定的杂质3.酸浸目的是:溶解、去氧化物(膜)、调节pH促进水解(沉淀)4.碱溶目的是:去油污,去铝片氧化膜,溶解铝、二氧化硅,调节pH促进水解(沉淀)5.加入氧化剂:转化为易于被除去(沉淀)的离子。
6.煮沸:除去溶解在溶液中的气体,如氧气控制反应条件的方法1.温度的控制(1)加热:加快反应速率或溶解速率;除杂,除去热不稳定的杂质,如NaHCO3、Ca(HCO3)2、KMnO4、I2、NH4Cl等物质;使沸点相对较低或易升华的原料气化。
但要注意避免反应物或生成物的过热分解。
(2)降温:防止某物质在高温时会溶解(或分解);使某个沸点较高的产物液化,使其与其他物质分离;降低晶体的溶解度,减少损失。
(3)控温:(用水浴带温度计便于控温且受热均匀)防止某种物质温度过高时会分解或挥发;为了使某物质达到沸点挥发出来;使催化剂的活性达到最好;防止副反应的发生。
(4)降温或减压可以减少能源成本,降低对设备的要求,达到绿色化学的要求。
2.调节溶液的pH:(1)目的:使溶液中的金属阳离子形成氢氧化物完全沉淀而除去(2)需要的物质:含主要阳离子的难溶性氧化物或氢氧化物或碳酸盐,即能与H+反应,使pH增大的物质如用MgO、Mg(OH)2等等。
工业流程模拟题汇编【例题1】以软锰矿粉(主要含MnO2,还含有少量的Fe2O3、Al2O3等杂质)为原料制取高纯MnO2的流程如图所示:已知:①常温下Ksp[Fe(OH)3]=8.0×10-38,Ksp[Al(OH)3]= 4.0×10-34②常温下,氢氧化物沉淀的条件:Al3+、Fe3+完全沉淀的pH分别为4.6、3.4,Mn2+开始沉淀的pH为8.1。
③常温下,当溶液中金属离子物质的量浓度小于或等于4×10-5mol/L时,可视为该金属离子已被沉淀完全。
(1)酸浸的过程中发生的主要反应为:_________________酸浸的过程中不能用浓盐酸代替硫酸,原因是:________酸浸过程中加入一定量的硫酸,硫酸不能过多或者过少。
硫酸过多造成氨的损失,硫酸过少时,酸浸会有红褐色渣出现,原因是:_________(2)加入氨水应调节pH的范围为:_______,当Fe3+恰好沉淀完全时,c(Al3+)=___mol/L(3)”过滤II”所得滤渣为MnCO3,滤液中溶质的主要成分是_____(填化学式)(4)加入碳酸氢铵产生沉淀的过程称为“沉锰”。
①“沉锰”过程中放出CO2,反应的离子方程式为:_______②“沉锰”过程中沉锰速率与温度的关系如图所示。
当温度高于60℃时,沉锰速率随着温度升高而减慢的原因可能是:(5)焙烧MnCO3的装置如图所示:①焙烧时所发生反应的化学方程式为。
②焙烧一定时间后需转动石英管,目的是。
[答案](1)MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;后续氧化过程中加入的二氧化锰会氧化浓盐酸;硫酸浓度偏小时,铁离子水解程度较大,会有红褐色氢氧化铁沉淀生成(2)4.6~8.1 ;0.05(3)(NH4)2SO4(4)①Mn2++2HCO3-=MnCO3↓+CO2↑+H2O②温度过高时碳酸氢铵的分解速率显著加快,沉锰速率随碳酸氢铵浓度的减小而减慢(5)①2MnCO3+O22MnO2+2CO2②使得MnCO3能充分反应,提高MnCO3的转化率【例题2】用含钴废料(主要成分Co2O3,含少量Fe2O3、Al2O3、NiO、SiO2等)制备草酸钴晶体(CoC2O4⋅2H2O)的流程如图:(1)滤渣Ⅰ的成分是;浸钴时Al2O3溶解的离子方程式为;Co2O3溶解的离子方程式为。
滤濟c溶液c 铝上矿NaOHC 滤& a髓 jIL 溶液a过量 试剂A 过滤滤渣b过g 试剂B 过滤过滤、煆烧----------- > 氧化铅工业流程专题复习1. (15分)蓝铜矿主要含2CuCOyCu (OH ) 2,还含有少量Fe 、Si 的化合物,工业上以蓝铜矿为原料制 备Cu 及CaCO 3,方法有多种。
(1 )蓝铜矿与焦炭加热可以生成铜、二氧化碳和水,写!li 该反应的化学方程式 _________________________________________________________Fe(OH)(3)巾溶液C 获得C U SO 4,5H 2O,耑要经过加热蒸发,冷却结晶、过滤等操作,加热蒸发至 _____________ _____________ 时停止加热。
玻璃棒在整个操作屮的作川是 ________________________________________(4)制备CaCO 3时,应向CaCl 2溶液屮先通入(或先加入) ______程中有氨气逸出、应选用下列 _______________ 装置吸收尾气(填代号)。
(5)从溶液C 巾获得Cu 的方法有 ____________________________________ (写出两种不同方法) (6)用惰性电极电解硫酸铜溶液一段时间后,加入2molCu (OH ) 2固体使硫酸铜溶液复原(复原是指熔 液溶质成分及浓度与原来完全相同),则此电解过程屮共转移电子 _______________ mol 。
2. (16分)铝土矿的主要成分是A12O 3,还含有Fe 2O 3、SiO 2等杂质。
I .从铝土矿中提取氧化铝的流程如下图所示:具体方法步骤如下:请回答下列问题:(2)溶液A 的金属离子有Cu 2+、Fe 2\ Fe 3\从下列所给试剂中选择:检验溶液A 中含有Fe 2+的S 佳试 剂为(填代号),实验步骤巾试剂①为 _________________________ (填代号)。
化学化工流程类试题典型的化学化工流程试题的鉴赏和突破题型1海水资源的利用实质是考查混合物的除杂、分离、提纯的有关实验基础知识、基本操作和技能。
(1) 制盐工业[例1]粗盐中含有 MgCl 2、CaCl 2等杂质,工业提纯粗盐的工艺流程如下图所示。
(3) 若步骤①和步骤②的顺序颠倒,则最后所得的精盐水中还含有[例2]某食盐样品中含有少量沙土、氯化钙和氯化镁。
以下是除去食盐样品中沙土、氯化 钙和氯化镁的实验流程。
(2) 海水提取金属镁[例3]海水中有大量可以利用的化学资源,例如氯化镁、氯化钠、溴化钾等。
综合利用海水 制备金属镁的流程如下图所示:O,在实验室中进行此项操作时,需要的玻璃仪器有烧杯、玻电解⑶ 工业冶炼镁常用电解 MgCl 2的方法,反应为 MgCl 2 Mg +祁誌水 和「話加人过址(^^ C列OHh 潛谁加人过员酌 N 且Qd 準谁③[梧祢水](1) Ca(OH) 2 溶液的 pH_应的化学方程式为 __________________(2) 步骤③操作a 的名称是 和7(填“> ”步骤①反OO 步骤④加入适量盐酸的目的是除去滤液中Na 2CO 3过滤 ⑴ ⑵ ⑶ ⑷ 根据流程图回答:操作I 的名称是 __________ ,加入的试剂 写出NaOH 与杂质反应的化学方程式:加入试剂B 的目的是 _____________________蒸发结晶时用到玻璃棒的作用是 匚| MKk 斤器两(1)贝壳主要成分的化学式是 ⑵操作a 的名称是 ______________ 璃棒、 _______________________片滤液(4)写出第②、③两步反应的化学方程式:② _______________________________________ ③ _______________________________________[例4]近年来有人提出了利用海水 (含氯化钠)处理含二氧化硫的废气,该方法的流程如下:SOi (回收)*氯气 -----上图中从海水最终得到“ NaCI(产品)”的过程属于或“化学变化”(4) 反应④的化学方程式为题型2空气资源一一合成氨工艺流程[例5]合成氨是人类科学技术上的一项重大突破,对社会发展与进步做出了巨大贡献。
△工业流程专项练习(一)、印刷材料工艺例1、下图是氧化沉淀法生产复印用高档Fe 3O 4粉的工艺流程简图,根据要求回答问题。
(1)铁的另两种常见氧化物的化学式是 、 。
(2)加水溶解过程中,在实验室里通常要使用的玻璃仪器有烧杯和 ,操作A 的名称是 。
(3)副产品P 是 ,由溶液N 获得该副产品的操作顺序是b → → →d 。
a .过滤b .加热浓缩c .冷却结晶d .晶体加热至完全失去结晶水 (4)通空气时的化学方程式是4Fe (OH )2 + 2H 2O + O 2 === 4 Fe (OH )3,由沉淀M 获得Fe 3O 4的过程中发生的反应为Fe (OH )2 + 2Fe (OH )3 === Fe 3O 4 + 4H 2O ,控制“一定量空气 ”的目的是 ,沉淀M 中Fe (OH )2 和Fe (OH )3的最佳质量比为 。
(相对分子质量:Fe (OH )2 —90,Fe (OH )3—107)(同步练习)1、(2008年广东省)氯化铁能腐蚀铜,工业上常用此原理生产印刷线路板。
以下是印刷线路板的生产及废液的处理过程:请回答下列问题:(1)步骤②中发生了两个反应:2FeCl 3+Fe=3FeCl 2和(2)滤渣的成份有 ,步骤③中发生反应的化学方程式是 (3)该流程中可以循环、回收利用的物质是: 。
(二)、化肥生产工艺例2、(2009镇江)(15分)某化工厂为综合利用生产过程中的副产品CaSO 4,与相邻的化肥厂联合设计了制备(N H 4)2S O 4的工艺流程。
【工艺流程及原理】沉淀池中发生的主要化学反应为:CO2+2NH3+CaSO4+H2O=CaCO3↓+(N H4)2S O4【讨论交流】(1)操作a的名称是,若在实验室进行此操作,用到的玻璃仪器除玻璃棒、烧杯外,还需要。
(2)经操作a后得到的固体物质在煅烧炉中高温分解生成X和Y两种物质,该工艺中,Y被作为原料之一循环利用。
Y的化学式为。
(3)沉淀池中也可能生成少量NH4HCO3,该反应的化学方程式为此空超纲可不答。
【硫酸铵化肥等级测定】(1)判断(N H4)2S O4化肥中有无NH4HCO3:取少量试样溶于水,滴加足量的,无气泡产生,则可判断该化肥中不存在NH4HCO3。
(2)化肥中氮元素含量的测定(已确定该化肥中不存在NH4HCO3杂质):查阅资料:①已知:(N H4)2S O4+2NaOH Na2SO4+2NH3↑+2H2O氨气极易溶于水,其水溶液为氨水。
氨水呈碱性,不稳定,易挥发。
②工业判断硫酸铵化肥等级指标如下:实验设计:按右图所示装置进行实验。
(1)实验过程中,往烧瓶中加入足量浓氢氧化钠溶液,并加热使硫酸铵充分反应完全转化为NH3。
(2)烧杯中的试剂是为了吸收产生的氨气,下列最适宜的试剂是(填序号);①水②浓HCl ③稀H2SO4④NaOH溶液烧杯中干燥管的作用是。
交流讨论:实验小组的同学认为,用上述实验装置测得的结果可能会出现下列情况。
(1)甲同学认为:应在实验装置A、B之间增加一个装有(填“浓硫酸"或“碱石灰”)的干燥装置,否则实验测得的硫酸铵化肥含氮量可能偏高。
(2)乙同学认为:在实验装置A、B之间增加正确的干燥装置后进行实验,测得的硫酸铵化肥含氮量可能偏低,理由是。
实验测定:经讨论后,他们改进了实验装置,排除了可能产生误差的因素,重新进行实验。
取硫酸铵化肥样品13.5 g 进行实验,测得B 装置增重与反应时间的关系如右图所示。
请通过计算判断该化肥的等级。
计算过程:该化肥的等级为 品。
(同步练习)2.(08扬州)某化工厂为综合利用生产过程中的副产品(NH 4)2SO 4(1)上述流程中,沉淀池中发生的主要化学反应为:CO 2+2NH 3+CaSO 4+H 2O =CaCO 3↓+(NH 4)2SO 4,煅烧炉中发生的化学反应方程式为 。
该工艺中可循环使用的X 为 (填化学式,下同),副产品Y 为 。
(2)操作b 的过程是 、冷却结晶、 。
(三)、侯氏制碱工艺 例3(2008年镇江)某校化学兴趣小组参观制碱厂后,获得以下信息并对相关问题进行研究。
【产品与原理】该厂采用“侯氏制碱法”生产化工产品——纯碱(Na 2CO 3)和化肥NH 4Cl 。
生产原理是:将NH 3和CO 2通入饱和食盐水中得到NaHCO 3和NH 4Cl 的混合物,反应为:NaCl (饱和)+ NH 3 + CO 2 + H 2O = NaHCO 3↓+ NH 4Cl ;分离出NaHCO 3,加热制得纯碱。
【生产流程】【相关资料】NH 4Cl == NH 3↑+HCl ↑已知20【问题讨论】:⑴氨碱工业最关键的一步是:在加压的条件下不断向饱和的氨盐水中通入二氧化碳气体,溶液中会有碳酸氢钠晶体析出。
试分析该流程需要加压条件的原因是: 。
△CO 2NH NH 4)2SO 4晶体 副产品Y(2)反应①中发生了两个反应,写出其中的化学方程式:。
(3)溶液B中的溶质有。
(4)上述生产流程中可循环使用的是(填序号)。
A.挥发性气体CB.溶液DC.氢氧化镁D.化肥NH4Cl (四)、海水提取镁工艺例4、(2008年)(11分)镁合金的强度高、机械性能好。
这些特性使金属镁成为制造汽车、飞机、火箭的重要材料,从而获得“国防金属”的美誉。
海水提镁是国际上的主要趋势,工业流程图如下;其步骤为:I.将海边大量存在的贝壳(主要成分为CaCO3)煅烧成生石灰,并将生石灰制成石灰乳Ⅱ.将石灰乳加入到海水反应池中,经过沉降、过滤得到Mg(OH)2沉淀Ⅲ.在Mg(OH)2沉淀中加入盐酸中和得到MgCl2溶液,再经蒸发结晶得到MgCl2·6H2OⅣ.将MgCl2·6H2O在一定条件下加热得到无水MgCl2V.电解熔融的无水MgCl2可得到Mg(1)请根据上述步骤回答问题:①写出步骤I、Ⅲ的有关化学方程式:I.贝壳煅烧成生石灰Ⅲ.Mg(OH)2沉淀中加入盐酸中和②步骤I~V中有分解反应的是(填写步骤序号):。
③步骤Ⅲ中的蒸发是利用风吹日晒来完成的,而在实验室中进行蒸发操作需要的主要仪器有、、酒精灯、带铁圈的铁架台、坩埚钳等。
④上述海水提镁的流程中,采取了哪些措施来降低成本、减少污染的?请写出其中一点:。
⑤某小组没计下列实验方案:称取bg镁铝合金,与足量的稀盐酸完全反应。
欲计算镁的质量分数,该实验中还需测定的一种数据是(同步练习)3.(9分)海水是一种重要的自然资源。
以下是我市对海水资源的部分利用。
(1)从海水中获取淡水。
常用的操作方法是。
(2)从海水中获得氯化钠。
将海水进行可得到粗盐;为除去粗盐中含有的SO 42-、Ca 2+、Mg 2+等杂质,有如下操作:①溶解;②加过量的Na 2CO 3溶液; ③加过量的BaCl 2溶液;④加适量的盐酸;⑤加过量NaOH 溶液;⑥蒸发结晶;⑦过滤。
正确的操作顺序是 。
(用序号填一种合理组合)。
(3)从海水中得到金属镁。
下图是从海水中提取镁的简单流程。
上述过程中,沉淀B 与试剂C 发生的是中和反应,则沉淀B 的化学式为 ,由无水MgCl 2制取Mg 的化学方程式为 。
海水本身就是含有MgCl 2的溶液,它与通过步骤①、②得到的MgCl 2溶液有何不同: 。
(4)海水“制碱”。
下图是海水“制碱”的部分简单流程。
步骤Ⅲ、步骤Ⅳ反应的化学方程式为: 、 。
制氨盐水的过程中要先通入氨气,再通入二氧化碳。
如果反过来,二氧化碳的吸收率会降低。
这是因为 。
中考原题经典1.(2010成都,16,12分)石笋和钟乳石的形成过程中会发生如下两个反应:(a )CaCO 3+CO 2+H 2O →Ca(HCO 3)2 (b) Ca(HCO 3)2 → CaCO 3↓+CO 2↑+H 2O 下图中,A 为单质,常温常压下C 为气体,固态时可用于人工降雨。
D 溶液为浅绿色,G 是发酵粉的主要成分之一。
FG 、G F 的反应分别类似上述反应a 与b 。
(部分产(2) A 在氧气中燃烧的现象是____________________________________; (3) 比较反应b 与反应⑧,推测反应b 发生时的条件为_____________; (4) 写化学方程式:反应③_______________________________________; 反应④_______________________________________。
(5)将x 露置在空气中,其质量会___________(填“增大”、“减小”或“不变”);该现象是否符合质量守恒定律?___________(填“符合”或“不符合”)。
(6)总结反应⑤、⑨、⑩的特点,可得出的结论是_____________________________________。
【知识模块】在做实验流程题的过程中,要通过流程图及题目的信息中得到信息进行解答。
由于该类题型主要与高中的知识挂钩,且对于中考而言,算是一种新题型,故学生应该认真对待。
1.分析比较物质在组成、性质等方面的异同,可为物质的分离和鉴别提供依据。
⑴从组成上看,BaCl 2、NaCl 都含有 元素,但BaSO 4不含有; ⑵将BaSO 4、BaCl 2、NaCl 三种固体组成的混合物溶于足量的水后,充分搅拌后过滤,留在滤纸上的固体是 ;⑶根据BaCl 2溶液和NaCl 溶液中的金属离子不同,可用稀硫酸将NaCl 溶液和BaCl 2溶液鉴别开。
请写出稀硫酸和BaCl 2反应的化学方程式 ;⑷按如下方案分离BaCl 2和NaCl 的固体混合物时,X溶液中溶质是 。
A .K 2CO 3 B .Na 2CO 3 C. Na 2SO 42. 食盐是人们生活中不可缺少的调味剂,随着人们健康意识的提高,市场上出现 了“加碘盐”、“叶绿素锌钠盐”、“低钠盐”等。
某种低钠盐由NaCl 、KCl 、MgSO 4三种物质组成,用它进行以下实验(假设每步均恰好完全反应)。
(1)写出步骤①的化学方程式:(2)当x 是AgNO 3时,白色沉淀C 是 ,当x 是NaOH 时,白色沉淀C 是 3. (2011南京市质检,27. 10分)汽车作为一种常见交通工具,已走进千家万户。
请回答下列问题:(1) 目前汽车使用的燃料是汽油。
将石油加热,利用各成分的沸点不同将它们分离可得到汽油,该过程属于 变化。
我国已推广使用车用乙醇汽油,它是在汽油中加入适量的乙醇,作为汽车的燃料。
下列叙述正确的是。
(填字母)A.乙醇汽油是一种新型的化合物 B.乙醇可通过粮食发酵的方法制得C.使用乙醇汽油能减少有害气体的排放 D.乙醇和汽油都是可再生能源(2)汽车尾气(含有CO、NO等物质)是城市空气的污染物,治理的方法之一是在汽车的排气管上装一个催化转换器,使CO和NO反应,生成两种无毒气体,试写出CO与NO反应的化学方程式。