蛋白质电泳技术介绍
- 格式:ppt
- 大小:1.30 MB
- 文档页数:31

SDS-PAGE电泳是一种常用的蛋白质分析技术,通过电泳分离蛋白质样品的方法得到了广泛的应用。
本文将着重介绍SDS-PAGE电泳的基本原理。
一、SDS-PAGE电泳的概念SDS-PAGE是一种已经被广泛应用的蛋白质分离技术,它的全称是聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis)。
这种电泳技术利用聚丙烯酰胺凝胶作为分离介质,通过直流电场将蛋白质样品分离出不同电荷和大小的蛋白质成分。
二、SDS-PAGE电泳的原理1. 聚丙烯酰胺凝胶SDS-PAGE电泳中所使用的凝胶是由聚丙烯酰胺构成的。
聚丙烯酰胺凝胶具有一定的孔隙结构,可以根据蛋白质的大小和电荷来调整孔隙的大小,从而实现不同大小的蛋白质的分离。
2. SDS处理SDS是指月桂基硫酸钠,它是一种阴离子表面活性剂。
在SDS-PAGE 电泳中,将样品中的蛋白质经过SDS处理后,蛋白质表面都会均匀地吸附一定数量的SDS分子,并且使蛋白质呈负电荷。
这样,所有的蛋白质分子都会带有类似的电荷密度,可以消除蛋白质的本身的电荷特性,使蛋白质在电场作用下只受到电场力的作用,而不受到其他因素干扰。
3. 蛋白质分离将经过SDS处理的蛋白质样品加载到聚丙烯酰胺凝胶上,然后通过电泳进行分离。
经电泳分离后,蛋白质会根据其大小和电荷迁移到不同位置,从而使不同的蛋白质分离开来。
三、SDS-PAGE电泳的应用SDS-PAGE电泳技术在生物化学和分子生物学研究领域应用广泛。
它可以用于研究蛋白质的分子量、纯度和比例,也可以用于检测蛋白质的存在和表达水平,同时还可以用于鉴定蛋白质的异构体等。
四、SDS-PAGE电泳的发展SDS-PAGE电泳技术自问世以来,经过不断的改进和完善,在蛋白质分离和分析领域一直处于领先地位。
未来,随着科学技术的不断进步,SDS-PAGE电泳技术也将会迎来新的发展,并在更广泛的领域得到应用。


westernblot电泳原理及步骤一、概述西方印迹(w es te rnb l ot)是一种重要的蛋白质分析技术,广泛应用于分子生物学和生物化学研究中。
它通过将待检蛋白质进行SD S-P AG E电泳分离,再转移到聚合物膜上,利用特异性抗原与抗体结合的原理,检测目标蛋白质的存在与表达水平。
二、原理1.SD S-PA GE电泳分离-准备样品:将待检蛋白质样品加入去离子水、蛋白质缓冲液和还原剂混合,使蛋白质变性和解聚。
-加载样品:将样品加入聚丙烯酰胺凝胶(p ol ya cr yl am id eg e l)孔上。
-电泳分离:将准备好的凝胶置于电泳槽中,通电使蛋白质在凝胶中由负极向正极运动分离。
2.转膜-准备转膜装置:将P V DF或N C膜与吸水性纸张浸泡后,叠放在转膜装置中,并按压缩成一整体。
-预处理转膜:将转膜装置放入转渍缓冲液中浸泡,使其湿润。
-转移:将电泳完的凝胶与转膜装置层叠,加上固定层叠板,施加压力进行转膜。
3.免疫检测-封闭:将转膜后的膜置于封闭液中,阻断非特异性结合位点,减少背景信号。
-孵育:将膜与目标蛋白对应的一抗抗体孵育,使其与目标蛋白特异性结合。
-洗涤:用洗涤缓冲液洗去非特异性结合的抗体。
-二抗检测:将膜与与一抗相应的辣根过氧化物酶标记的二抗孵育,二抗与一抗结合形成复合物。
-显示:加入发色底物,与酶催化反应,生成可视化的蛋白质带谱。
三、操作步骤1.准备样品-将待检蛋白质样品加入适量去离子水、蛋白质缓冲液和还原剂混合。
-完全溶解样品,可加热至95°C处理。
2.SD S-PA GE电泳分离-准备分离凝胶:根据目标蛋白质的分子量选择合适浓度的凝胶。
-加载样品:用自动吸管或微量注射器将样品均匀地加载到聚丙烯酰胺凝胶孔上。
-启动电泳:将准备好的凝胶放入电泳槽中,加入电泳缓冲液,通电进行电泳。
3.转膜-准备转膜装置:按照转膜装置的说明书操作,准备好转膜膜和膜瓶。
-预处理转膜:将PVD F或N C膜与吸水性纸张浸泡,并放入转膜缓冲液中浸泡片刻。


SDS-PAGE电泳的基本原理和应用1. SDS-PAGE电泳的基本原理1.1 电泳原理SDS-PAGE是一种基于凝胶电泳的蛋白质分析技术。
其中SDS是十二烷基硫酸钠(Sodium Dodecyl Sulfate)的缩写,是一种表面活性剂,能够使蛋白质样品中的蛋白质在电场作用下带负电荷,同时也能够给蛋白质提供线性结构。
1.2 凝胶电泳凝胶电泳是一种利用膠體凝膠將生物物质分开的电泳技术。
在SDS-PAGE中,常使用聚丙烯酰胺凝胶(Polyacrylamide gel)作为电泳介质。
聚丙烯酰胺凝胶是一种聚合物凝胶,通过调整聚丙烯酰胺单体和交联剂的比例,可以调整凝胶的孔径。
1.3 SDS-PAGE的步骤SDS-PAGE主要包括以下几个步骤:•准备样品:将待测蛋白质样品添加SDS、还原剂和草酸,使蛋白质样品变性和解离。
•准备凝胶:制备聚丙烯酰胺凝胶,将之倒入电泳槽中,插入电泳板。
•加载样品:将准备好的样品加入凝胶双孔板中,注意标记样品位置。
•电泳:将准备好的样品盖在电泳槽上,接上电源进行电泳分离。
•显色染色:将分离出的蛋白质进行显色染色,以观察结果。
•图像分析:利用成像仪或凝胶图像分析系统对染色的凝胶图像进行定量分析。
2. SDS-PAGE电泳的应用2.1 蛋白质分析SDS-PAGE电泳是蛋白质分析的基础技术,通过对蛋白质样品进行电泳分离,可以获得蛋白质的表观分子质量、纯度和组成信息。
这对于研究蛋白质结构、功能以及与疾病的关系等具有重要意义。
2.2 分子生物学研究SDS-PAGE电泳在分子生物学研究中有多种应用。
例如,可以用于检测基因表达的变化,比较不同条件下的蛋白质组分等。
此外,SDS-PAGE也可以用于鉴定蛋白质的亚细胞定位、研究蛋白质与其他分子(如核酸、小分子化合物等)的相互作用等方面。
2.3 药物研发SDS-PAGE电泳在药物研发领域也有广泛应用。
例如,可以用于药物候选化合物与蛋白质之间的相互作用研究,评估药物的结合能力和亲合力。

sds-page蛋白凝胶电泳原理
SDS-PAGE(聚丙烯酰胺凝胶电泳)是一种常用的蛋白质分离
和分析技术。
其原理基于蛋白质的电荷密度和分子质量。
1. SDS(十二烷基硫酸钠):在SDS-PAGE中,SDS被用作
溶胀剂。
SDS能够与蛋白质中的氢键和疏水作用相互作用,
使蛋白质的二级、三级结构被破坏并线性展开。
SDS与蛋白
质发生作用后,每个蛋白质分子上的SDS数量差不多是相同的,即每个氨基酸上有约2.7个SDS分子。
2. 聚丙烯酰胺凝胶:SDS处理后的蛋白质在凝胶中呈均匀线
性状。
聚丙烯酰胺是一种电泳凝胶,可形成细小的孔隙结构。
这些孔隙可以分离不同分子质量的蛋白质。
3. 电泳过程:在凝胶上形成一个电场,蛋白质带有负电荷,向阳极迁移。
溶胶中的离子也会随之迁移,以维持电中性。
由于SDS已经使蛋白质的结构线性化,其迁移速度主要取决于分
子质量。
较大分子所需的孔隙更大,迁移速度更慢,较小分子则迁移更快。
4. 可视化和测量:分离结束后,可以通过染色剂(如Coomassie Brilliant Blue)将蛋白质染色。
染色剂与蛋白质结合,形成蓝色或紫色的带状条纹,使蛋白质带的位置可见。
在染色后,可以使用图像分析软件测量带的强度和相对迁移距离,从而推断蛋白质的分子质量。
通过SDS-PAGE,可以将不同分子质量的蛋白质分离开来,
并进行定量分析。
它是一种常用的蛋白质研究技术,在生物化学、生命科学和临床诊断等领域得到广泛应用。


昆虫血淋巴和组织的蛋白质电泳昆虫的各种组织均含有多种蛋白质和各种酶类。
例如:血淋巴中经分离和纯化后已鉴定的蛋白质有卵黄原蛋白(卵黄蛋白的前体)、激素结合蛋白、各种脂蛋白、多肽激素储存蛋白、血红蛋白(仅存在于极少数昆虫中)和各种酶类。
采用聚丙烯酰胺凝胶电泳分析这些蛋白质和酶类,得到理想的蛋白谱和酶谱,是进行昆虫生理、毒理、病理和生态学等研究的重要手段。
凝胶电泳技术是蛋白质及酶分析中的常用手段。
现已广泛应用于植物学、动物学、医学等许多领域。
大量试验表明,凝胶电泳技术在作物品种鉴定中起着举足轻重的作用,此技术在动物物种鉴定等方面也已有较多应用。
SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)技术是凝胶电泳技术的一种,是蛋白质分析中最常用的手段之一。
SDS-PAGE分离后的蛋白条带,通常用考马斯亮蓝进行染色。
20世纪70年代产生了一种更为敏感的染色方法-银染法。
近几年,又相继报道了许多改进的银染方法,包括二胺银染法、无二胺银染法、照相银染法、负片银染法、正片银染法和海波银染法。
目前,较常用的银染方法为海波银染法。
一、原理聚丙烯凝胶是由单体丙烯酰胺(简称Acr和交联剂N, N'-甲叉双丙烯酰胺(简称Bis)在加速剂过硫酸铵(简称AP)和催化剂TEMED(N,N, N, N'-四甲基乙二胺)作用下聚合交联成三维网状结构的凝胶,能起到分子筛的作用,以此凝胶为支持物的电泳称为聚丙稀酰胺凝胶电泳(Polyacrylamide gel electrophoresis简称PACE)。
二、材料、仪器设备及试剂(一)实验材料玉米螟幼虫。
(二)仪器设备夹心式垂直板电泳槽、直流稳压电齒(电压300〜600 V,电流50〜100 mA)、注射器、微量进样器、移液管、细长头滴管、染色缸、镊子、烧杯、滤纸、冰箱、试管及试管架等。
(三)试剂30%丙烯酰胺混合液(Acr:Bis =29:1):称取Acr 30g和Bis 0.8g,用蒸馏水溶解并定容至100 mL,贮棕色瓶中于4℃保存,可用1-2个月。

蛋白质电泳的原理
首先,蛋白质电泳的原理基于蛋白质在电场中的迁移速度与其分子大小和电荷
有关。
一般来说,蛋白质分子越大,电荷越小,其迁移速度越慢;反之,蛋白质分子越小,电荷越大,其迁移速度越快。
这种原理被广泛应用于蛋白质的分离和检测中。
其次,蛋白质电泳分为凝胶电泳和聚丙烯酰胺凝胶电泳两种主要类型。
凝胶电
泳是将蛋白质样品加载到聚丙烯酰胺凝胶中,然后通过电泳迁移来实现蛋白质的分离。
而聚丙烯酰胺凝胶电泳是利用聚丙烯酰胺凝胶作为分离介质,通过不同的电场条件来实现蛋白质的分离和检测。
另外,蛋白质电泳的操作步骤一般包括样品制备、凝胶制备、电泳操作和染色
检测。
在样品制备过程中,需要对蛋白质样品进行处理,如加热变性、还原和煮沸等,以使其具有良好的电泳性质。
凝胶制备是将聚丙烯酰胺凝胶溶液注入电泳槽中,并在固化后形成凝胶板。
电泳操作是将样品加载到凝胶中,然后施加电场进行分离。
染色检测是在电泳结束后,使用染色剂将蛋白质染色,然后观察和记录分离的结果。
总的来说,蛋白质电泳是一种重要的生物化学实验技术,它在生物医学研究、
临床诊断和药物开发等领域具有广泛的应用。
通过本文的介绍,相信读者对蛋白质电泳的原理和操作步骤有了更深入的了解,希望能够对相关领域的研究和实践有所帮助。
蛋白质电泳技术
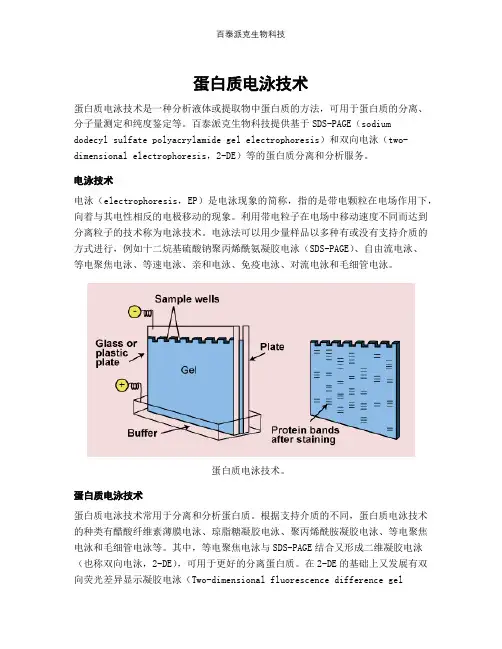
蛋白质电泳技术是一种分析液体或提取物中蛋白质的方法,可用于蛋白质的分离、分子量测定和纯度鉴定等。
百泰派克生物科技提供基于SDS-PAGE(sodium
dodecyl sulfate polyacrylamide gel electrophoresis)和双向电泳(two-dimensional electrophoresis,2-DE)等的蛋白质分离和分析服务。
电泳技术
电泳(electrophoresis,EP)是电泳现象的简称,指的是带电颗粒在电场作用下,向着与其电性相反的电极移动的现象。
利用带电粒子在电场中移动速度不同而达到分离粒子的技术称为电泳技术。
电泳法可以用少量样品以多种有或没有支持介质的方式进行,例如十二烷基硫酸钠聚丙烯酰氨凝胶电泳(SDS-PAGE)、自由流电泳、
等电聚焦电泳、等速电泳、亲和电泳、免疫电泳、对流电泳和毛细管电泳。
蛋白质电泳技术。
蛋白质电泳技术
蛋白质电泳技术常用于分离和分析蛋白质。
根据支持介质的不同,蛋白质电泳技术的种类有醋酸纤维素薄膜电泳、琼脂糖凝胶电泳、聚丙烯酰胺凝胶电泳、等电聚焦电泳和毛细管电泳等。
其中,等电聚焦电泳与SDS-PAGE结合又形成二维凝胶电泳(也称双向电泳,2-DE),可用于更好的分离蛋白质。
在2-DE的基础上又发展有双向荧光差异显示凝胶电泳(Two-dimensional fluorescence difference gel
electrophoresis,2D-DIGE),可在同一块胶上同时分离多个分别由不同荧光标记的样品。
蛋白电泳用途
蛋白电泳是一种重要的蛋白质分析技术,在生物科学、医学研究和临床诊断等领域具有广泛的应用:
1. 血清蛋白分析:蛋白电泳可以用于分析血清中的蛋白质,帮助医生了解患者的血清蛋白浓度和组分比例。
血清蛋白的总量和各个蛋白质组分的分析在临床诊断上具有很重要的意义,例如,蛋白电泳可以将血清蛋白分为白蛋白、1、2、3-球蛋白等不同区带,每个区带含有一种或多种蛋白成分,各区带的变化与疾病间有密切关系。
2. 蛋白质分离和纯化:蛋白电泳可以用于分离和纯化蛋白质样品。
不同的蛋白质分子在电场中具有不同的电泳迁移率,通过电泳技术可以将目的蛋白质与其他蛋白质分离出来,便于进一步研究和应用。
3. 蛋白质分子量测定:通过蛋白电泳,可以测定蛋白质的分子量,这对于研究蛋白质的结构和功能具有重要意义。
4. 蛋白质纯度鉴定:蛋白电泳可以用于鉴定蛋白质样品的纯度。
在电泳图中,纯蛋白质通常呈现单一的区带,若出现多个区带,可能表示蛋白质样品中含有多种蛋白质。
5. 疾病诊断:蛋白电泳技术在疾病诊断中具有重要作用。
例如,某些疾病会导致血清蛋白的表达量和比例发生改变,通过蛋白电泳可以观察这些变化,为临床诊断提供依据。
6. 生物研究:蛋白电泳可用于研究蛋白质在生物体内的表达、相互作用、翻译后修饰等过程,有助于揭示生物系统的调控机制。
总之,蛋白电泳技术在生物科学研究、医学诊断和治疗、蛋白质工程等领域具有广泛的应用价值。
蛋白质电泳实验报告
《蛋白质电泳实验报告》
蛋白质电泳是一种常用的生物化学分离技术,通过电泳原理将蛋白质分子按照
其大小和电荷进行分离,从而得到蛋白质的分子量和电荷信息。
本实验旨在通
过蛋白质电泳技术对不同样本中的蛋白质进行分析,以期了解其在生物体内的
功能和特性。
实验中,我们首先准备了不同来源的蛋白质样本,包括细胞提取液、血清和组
织液等。
接着,我们将这些样本加载到聚丙烯酰胺凝胶电泳板上,并进行电泳
分离。
随后,我们使用共染色法或Western blot法对分离后的蛋白质进行染色,以观察其分离情况和分子量。
实验结果显示,不同来源的样本中蛋白质的分离情况各异。
在细胞提取液中,
我们观察到多个蛋白质条带,分子量分布较为广泛;而在血清样本中,蛋白质
的分子量则相对较为集中。
这些结果表明,不同来源的样本中蛋白质的组成和
特性存在明显差异,这可能与其在生物体内的功能和代谢有关。
通过本次实验,我们不仅对蛋白质电泳技术有了更深入的了解,也对不同来源
样本中蛋白质的分布和特性有了更清晰的认识。
这为我们进一步探究蛋白质在
生物体内的功能和代谢提供了重要的参考和依据。
希望通过今后的研究和实验,我们能够更全面地了解蛋白质在生物体内的作用和机制,为生命科学领域的发
展做出更大的贡献。
血清蛋白电泳原理血清蛋白电泳是一种常见的生物化学分析技术,用于分离和定量血清中的蛋白质。
其原理基于蛋白质在电场中的迁移速度不同,从而实现分离。
下面将详细介绍血清蛋白电泳的原理。
1. 原理概述血清蛋白电泳是一种将血清中的蛋白质按照电荷、大小和形状进行分离的技术。
它基于蛋白质在电场中迁移速度不同的特性,通过将样品放置在凝胶上,利用电场对凝胶进行加速,使得不同大小、形状、电荷的蛋白质在凝胶上呈现出不同的迁移距离,从而实现了对血清中各种类型蛋白质的分离和定量。
2. 原理详解(1)凝胶制备血清蛋白电泳需要使用聚丙烯酰胺凝胶或琼脂糖凝胶作为载体。
这些凝胶具有多孔性结构,在加入样品后可以帮助样品进行分离。
(2)电泳条件血清蛋白电泳需要在一定的电场下进行,常用的电场强度为100-200V/cm。
在电泳过程中,凝胶和样品都需要浸泡在缓冲液中,缓冲液可以帮助维持pH值和离子浓度的稳定。
(3)分离机制血清蛋白电泳的分离机制基于蛋白质在电场中迁移速度不同的特性。
蛋白质分为阴离子、阳离子和中性三类。
在碱性条件下,蛋白质会带有负电荷,成为阴离子;在酸性条件下,蛋白质会带有正电荷,成为阳离子;而在等电点附近,则呈现出中性。
当样品被加入凝胶后,在电场作用下,不同大小、形状、电荷的蛋白质将呈现出不同的迁移距离。
一般来说,在聚丙烯酰胺凝胶上进行血清蛋白电泳时,大分子量的蛋白质会停留在凝胶上方,小分子量则会穿过凝胶,到达凝胶下方。
而在琼脂糖凝胶上进行血清蛋白电泳时,大分子量的蛋白质会停留在凝胶下方,小分子量则会穿过凝胶,到达凝胶上方。
(4)染色和定量血清蛋白电泳完成后,需要进行染色和定量。
通常使用染色剂共沉淀法或银染法进行染色。
其中,共沉淀法可以同时染色多种蛋白质,银染法则对少量样品有更好的灵敏度。
定量可以通过比较样品与标准品的带强度来实现。
标准品是一组已知浓度的蛋白质溶液,在血清蛋白电泳前需要进行校正。
3. 应用范围血清蛋白电泳广泛应用于临床诊断、科学研究和药物开发等领域。
生物化学常用的四大技术
生物化学是研究生物体内生化过程的科学领域,它涉及到许多技术手段的应用,本文介绍常用的四大技术:
1. 蛋白质电泳技术
蛋白质电泳是研究蛋白质结构和功能的重要手段。
它将蛋白质在凝胶中进行分离和检测,蛋白质会在电场作用下在凝胶中移动,根据大小和电荷的不同,蛋白质分子被分离开来。
蛋白质电泳可以用于研究蛋白质质量、酸碱性、电荷、结构等信息。
2. 分子克隆技术
分子克隆技术是在细胞或体外实现DNA分子的扩增和克隆,以便于对基因功能和结构的研究。
它包括PCR技术、DNA测序技术、基因组学、转基因技术等多种技术手段。
分子克隆技术可以用于研究基因的表达、调控、突变和功能等。
3. 质谱分析技术
质谱分析技术是基于物质的质量和电荷比的不同,通过质谱仪对物质进行分析和检测。
质谱分析技术可以用于研究蛋白质、核酸、糖类等生物分子的结构、组成和功能等。
4. 免疫学技术
免疫学技术是基于机体免疫系统的原理,通过抗体和抗原的结合来检测、分离、纯化和鉴定生物分子。
免疫学技术包括ELISA、Western blot、免疫印迹、免疫沉淀、免疫荧光等技术。
免疫学技术可以用于研究蛋白质、细胞、病毒等生物分子的鉴定和检测。