人教版《物质结构-晶体密度的计算》
- 格式:ppt
- 大小:639.50 KB
- 文档页数:13


氯化钠晶体密度计算
氯化钠晶体的密度是由它的原子量和单位体积的原子或分子的数目
共同决定的。
氯化钠是一种常见的工业盐,由单质氯和单质钠构成。
体积中每个分子的质量为23克/摩尔(二元分子的分子式:NaCl)。
氯化钠晶体的密度可以用公式:ρ=MW/V(克/立方厘米)计算,其中
MW为分子质量,V是体积。
因此,氯化钠晶体的密度计算结果为每
立方厘米约有2.17克。
氯化钠晶体由NaCl分子构成,其中每个NaCl分子重量为58.44克/摩尔,而该晶体的密度则可以用下面的公式计算出来:ρ=均重/体积,其中,均重为NaCl分子重量,也就是58.44克/摩尔,而体积则涉及到晶
体结构。
从固溶体学的角度考虑,氯化钠晶体由Na+和Cl-离子构成,形成八面体晶格,且有双列晶体结构,其晶胞体积为V = (19.2)^3Å^3 (Å为牛顿),所以氯化钠晶体密度计算结果为每立方厘米约有2.16克。
此外,氯化钠晶体可以在高温环境中显示出不同的性质。
当温度升高
到1000℃或更高时,当它处于液体状态时,晶体的体积会减小,从而
使其密度急剧升高。
基于热力学的规律,当温度升高至1000℃时,每
立方厘米的密度可能会增加至2.19克或更高。
因此,氯化钠晶体的密度既取决于 NaCl分子重量,又受体积和温度的
影响。
从上述可以看出,晶体的密度一般比液体高出许多,可以达到
2.17-2.19克/立方厘米。

《晶体结构与性质》检测题一、单选题1.下列各组物质中,按熔点由低到高的顺序排列正确的是()①O2、I2、Hg②CO、Al、SiO2③Na、K、Rb④Na、Mg、AlA.①③B.①④C.②③D.②④2.下列变化规律叙述正确的是A.O、S、Na、K的原子半径依次增大B.Na、Mg、Al、Si的还原性依次增强C.HF、HCl、H2S、PH3的稳定性依次增强D.CH4、NaCl、SO2、SiO2的熔点依次增高3.有关晶体的说法不正确的是A.都有自范性B.都是无色透明的C.有各向异性D.有固定熔点4.下列各组晶体中,化学键的类型相同是A.SO2与MgO B.NaCl与HClC.CO2与H2O D.CCl4与KCl5.M元素的1个原子失去2个电子转移到Y元素的2个原子中去,形成化合物Z。
下列说法中正确的是() A.Z是共价化合物B.Z可表示为M2YC.Z的电子式可表示为D.M形成+2价阳离子6.下列说法或表示正确的是A.氯化钠晶体中,每个Na+周围距离相等且紧邻的Na+共有12个B.酒石酸(HOOC-CHOH-CHOH-COOH)不存在手性碳原子C.熔点:MgBr2<SiCl4<SiCD.邻羟基苯甲酸分子内形成了氢键,所以沸点高于对羟基苯甲酸7.下列说法正确的是()A.共价化合物和离子化合物中,一定都含有非金属元素B.阴阳离子之间有强烈的吸引作用而没有排斥作用,所以离子键的核间距相当小C.失电子难的原子获得电子的能力一定强D.含有共价键的化合物必是共价化合物8.N A代表阿伏加德罗常数的值,下列说法正确的是A.12 g金刚石中含有化学键的数目为4N AB.18 g的D2O中含有的质子数为10C.28 g的乙烯和环已烷混合气体中所含原子总数为6N AD.1 L 1mol·L¯1的NH4Cl溶液中NH4+和Cl―的数目均为1N A9.关于下列晶体物质的熔沸点高低排列判断正确的是()A.Rb>K>Na B.金刚石>晶体硅>二氧化硅>碳化硅C.H2O>H2S>H2Se>H2Te D.CaO>BaO>NaCl>KCl10.下列选项中,对于指定项目的数目前后相等的是()A.电子数:17gOH—与1mol-OHB.双键数目:1mol与4mol C2H4C.分子数:常温常压下16g氧气与4g氦气D.阴离子总数:72gCaO2与62g Na2O11.下列说法正确的是( )A.电子层结构相同的不同离子,其半径随核电荷数增大而减小B.C、O、S原子半径依次增大,氢化物稳定性逐渐增强C.ⅠA族元素与ⅠA族元素形成的化合物都为离子化合物D.ⅠA族元素的阴离子还原性越强,其最高价氧化物对应的水化物酸性越强12.某些物质的熔点数据如下表,据此做出的下列判断中错误的是A.表中BCl3和CO2均是分子晶体B.铝的化合物的晶体均是离子晶体C.同族元素的氧化物可形成不同类型的晶体D.不同族元素的氧化物可形成相同类型的晶体13.下列说法正确的是A.范德华力普遍存在于分子之间,如液态水中因范德华力的存在使水分子发生缔合B.H2SO4为强电解质,硫酸晶体是能导电的C.冰中1个H2O可通过氢键与4个水分子相连,所以冰中H2O分子与氢键的比值为1:4D.氢键有饱和性和方向性,所以液态水结成冰时体积会变大二、填空题14.中国古代四大发明之一——黑火药,它在爆炸时发生的化学反应为2KNO3+3C+S=A+N2↑+3CO2↑(已配平)(1)①除S外,上列元素的电负性从大到小依次为__________。



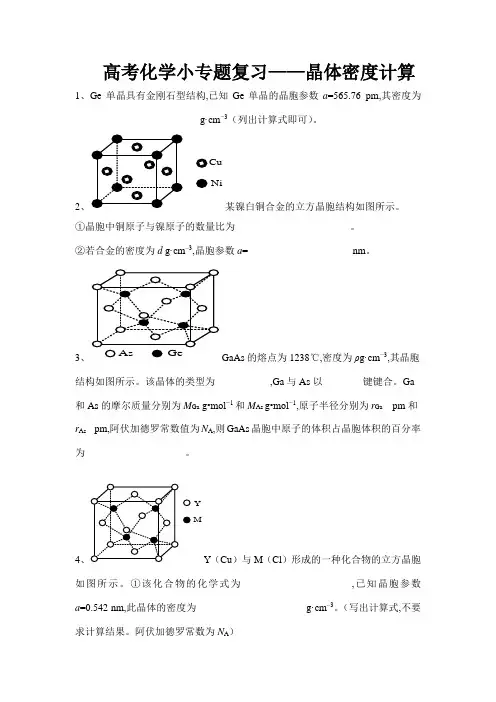
高考化学小专题复习——晶体密度计算1、Ge单晶具有金刚石型结构,已知Ge单晶的晶胞参数a=565.76 pm,其密度为_________________________g·cm−3(列出计算式即可)。
2CuNi某镍白铜合金的立方晶胞结构如图所示。
①晶胞中铜原子与镍原子的数量比为_______________________。
②若合金的密度为d g·cm–3,晶胞参数a=_____________________nm。
3、GaAs的熔点为1238℃,密度为ρg·cm−3,其晶胞结构如图所示。
该晶体的类型为___________,Ga与As以________键键合。
Ga 和As的摩尔质量分别为M Ga g•mol−1和M As g•mol−1,原子半径分别为r Ga pm和r As pm,阿伏加德罗常数值为N A,则GaAs晶胞中原子的体积占晶胞体积的百分率为____________________。
4YMY(Cu)与M(Cl)形成的一种化合物的立方晶胞如图所示。
①该化合物的化学式为______________________,已知晶胞参数a=0.542 nm,此晶体的密度为______________________g·cm–3。
(写出计算式,不要求计算结果。
阿伏加德罗常数为N A)5、(O)和B(Na)能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566nm,F的化学式为____________;晶胞中A原子的配位数为____________;列式计算晶体F的密度(g·c m¯3)___________________________________。
6、Al单质为面心立方晶体,其晶胞参数a=0.405nm,晶胞中铝原子的配位数为_________,列式表示Al单质的密度为________________________g·cm¯3(不必计算出结果)7、金刚石晶胞含有_______个碳原子。

建立“模型认知”核心素养在《物质结构》中的应用———以金刚石模型为例薛晓燕(陕西省西安市西安外国语大学附属西安外国语学校710061)摘要:高中化学教学十分重视学生核心素养的培养,而“模型认知”思维作为化学学科核心素养的重要组成部分备受关注.本文通过金刚石模型的建立阐述化学模型在化学学科中的重要地位与价值,引导学生形成对该模型的理解、应用、构建三个层次.从而提升学生的探索能力、知识形成能力及分析能力.关键词:核心素养;模型认知;物质结构;高中化学中图分类号:G632文献标识码:A文章编号:1008-0333(2020)07-0085-03收稿日期:2019-12-05作者简介:薛晓燕(1985.11-),女,本科,中学一级教师,从事高中化学教学研究.“模型认知”是高中化学核心素养重要构成要素,该能力建立在证据推理素养基础上,依据物质结构、组成、变化特点提出假设,使学生可通过推理、分析、思考,将研究对象具体化,以该体系为依据建造认知模型,在模型中展示各个构成要素之间的关系及本质特征,使化学现象可通过模型解释,得出化学规律及现象本质,使学生在掌握化学知识基础上,达到培养其“模型认知”思维等核心素养的目的,凸显高中化学教育创新实践价值.笔者以金刚石模型为例,浅谈一下建立“模型认知”的应用.一、建立金刚石晶体结构单元模型1.金刚石晶体中正四面体结构单元(1)如何理解金刚石结构?金刚石结构中的每个原子与相邻的4个原子形成正四面体.在金刚石晶体中,每个碳原子的4个价电子以sp 3杂化方式形成4个完全等同的原子轨道,与最相邻的4个碳原子形成共价键.这4个共价键之间的角度都相等,为109ʎ28.(2)如何理解正四面体中心这个碳原子(①号碳原子)参与形成4个C —C 单键,每个碳原子对一个C —C 单键的“贡献”都是1/2,所以数目相当于4ˑ1/2=2,故金刚石中1mol C 原子形成2mol C -C 单键.除金刚石以外,还有硅、锗等.2.金刚石晶体中网状结构六元环如何理解金刚石晶体中每个碳原子被12个六元环共有?在金刚石晶体中,最小的环为六元环,环中六个碳原子不在同一个平面上,只有四个碳原子(②③④⑤号碳原子)在同一平面上.因每个碳原子可形成四条C -C 共价键共价键,所以经过任意一个C 原子的任意两条C —C 共价键的组合共有C 34共6种.又由于任意两条C —C 共价键可形成两个六元环,所以经过任意一个碳原子的六元环数为:6ˑ2=12个.每个碳原子实际被12个六元环共有.二、金刚石晶胞结构1.认识金刚石晶胞结构金刚石晶胞结构为立方晶系,碳原子分布于8个顶角和6个面心,同时在晶胞内部有4个碳原子位于4条体对角线的1/4、3/4处.每个碳原子周围都有4个碳原子,配位数为4,碳原子之间形成共价键,为正四面体构型.原子坐标参数,表示晶胞内部各原子的相对位置,用坐标参数来分析一下金刚石的结构.其中原子坐标参数A 为(0,0,0);B 为(1/2,1/2,0);D 为(1/4,1/4,1/4);C 为(1/4,3/4,1/4)2.金刚石晶胞中碳原子数是多少?每个晶胞中含有碳原子数8个顶角ˑ1/8+6个面心ˑ1/2+内部4个碳原子=8,所以每个晶胞实际含有8个碳原子.—58—三、晶体边长a 与碳原子半径r 的关系及金刚石晶胞中碳原子空间利用的计算1.晶体边长a 与碳原子半径r 的关系设晶胞边长为a ,设碳原子半径为r .A 为(0,0,0),B 为(1/4,1/4,1/4),A 原子与B 原子是紧密接触的所以AB 间距离d =2r ,利用数学空间向量中两点之间的距离计算公式:d =(x 2-x 1)2+(y 2-y 1)2+(z 2-z 1)槡2.得知AB 间距离=14()-02+14()-02+14()-0槡2a =槡34a所以2r =槡34a ,r =槡38a 2.晶胞中碳原子空间利用率的计算(1)空间利用率:指构成晶体的原子、离子或分子在整个晶体空间中所占有的体积百分比.空间利用率=晶胞中球体积晶胞体积ˑ100%(2)空间利用率的计算步骤:第一步:计算晶胞中的微粒数第二步:计算晶胞的体积第三步:找出球的半径r 与晶胞边长a 的关系所以金刚石晶胞中碳原子在晶胞中的空间占有率w =8ˑ43πr 3a 3ˑ100%又根据上述知识得到r =槡38a ,所以w =8ˑ43πr 3a3=槡3π16ˑ100%四、利用晶胞常数计算晶体密度1.晶体密度的计算(1)晶体的密度=N ·MN A ·V 晶胞,其中N 为每摩尔的晶胞中所含有的原子(离子)的个数,M 为原子或离子的摩尔质量,N A 为阿伏加德罗常数,V 晶胞为晶胞体积.(2)计算步骤:第一步:确定晶胞中的粒子数第二步:确定晶胞体积第三步:代入公式进行计算(3)注意长度单位的换算常见长度单位换算关系:1cm =10-2m 1nm =10-9m=10-7cm 1pm =10-12m =10-10cm2.应用模型将所需论证的化学问题套用在该模型中,为学生系统认知化学问题提供路径,充实原有化学思维,提高学生化学学习能力,扩展“模型认知”思维辐射范围,提升学生模型认知能力,达到培养其核心素养教育目的.例1高考链接一(2015全国1卷节选)碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:(1)在石墨烯晶体中,每个C 原子连接个六元环,每个六元环占有个C 原子.(2)在金刚石晶体中,C 原子所连接的最小环也为六元环,每个C 原子连接个六元环,六元环中最多有个C 原子在同一平面.解析(1)由石墨烯的结构可知,每个C 原子连接3个六元环,每个六元环占有的C 原子数为13ˑ6=2.(2)由金刚石的结构可知,每个C 可参与形成4条C —C 键,其中任意两条边(共价键)可以构成2个六元环.根据组合知识可知四条边(共价键)任选其中两条有6组,6ˑ2=12.因此每个C 原子连接12个六元环.六元环中C 原子采取sp 3杂化,为空间六边形结构,最多有4个C 原子位于同一平面.例2高考链接二(2019全国1卷第35题节选)图(a )是MgCu 2的拉维斯结构,Mg 以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的Cu.图(b )是沿立方格子对角面取得的截图.可见,Cu 原子之间最短距离x =pm ,Mg 原子之间最短距离y =pm.设阿伏加德罗常数的值为N A ,则MgCu 2的密度是g ·cm -3(列出计算表达式).从图(b )可看出,Cu 原子间最短距离x ,它是立方体面对角线的1/4,由于立方体面对角线的长度是槡2a .所以Cu 原子间最短距离x =槡24a .由于Mg 原子以金刚石方式堆积.所以掌握金刚石的结构及计算,这道题将会很容易解答.分析可知Mg 原子—68—的半径r =槡38a ,所以Mg 原子之间最短距离y =槡34a pm该晶胞中含有8个Mg 原子和16个Cu 原子,也就是有8个MgCu 2基本单元.所以,MgCu 2的密度为N ·M N A ·V 晶胞=8ˑ24+16ˑ64N A a 3ˑ10-30综上所述,高中化学核心素养“模型认知”思维在教学中若想得到有效培养,教师需秉持以人为本教育理念,关注学生化学知识学习动向,引导学生善用化学思维,组就“模型认知”思维体系,通过建模准备、提出假设、建立模型、检验模型及应用模型,使学生掌握建模方法,体悟建模过程,形成建模意识,达到建立“模型认知”思维体系的目的.参考文献:[1]夏俊.关于培养“模型认知”的化学核心素养的探索以“建立高考化学实验题解题模型”为例[J ].读与写(教育教学刊),2018,15(06):119-120.[2]李鹏鸽.模型认知素养及其在化学概念教学中的落实[J ].教学与管理,2018(04):64-66.[3]李似麒,林玉琼.高考理综Ⅰ卷化学图像题对“证据推理与模型认知”的考查及启示[J ].福建教育学院学报,2017,18(11):126-128.[4]陆军.化学教学中引领学生模型认知的思考与探索[J ].化学教学,2017(11):22-23.[5]査有梁.中学化学教学建模[M ].南宁:广西教育出版社,2003.[责任编辑:季春阳]同分异构体的书写与数目的确定穆玉鹏(山东省博兴县第一中学256500)摘要:同分异构现象是有机化合物普遍存在的结构现象,也是有机物数量与种类繁多的最主要原因.近年来,同分异构体的书写、数量判断以及同分异构体之间的比较与确定等,已经成为各类考试,特别是高考的热点问题.现简单介绍同分异构体的书写与数目的确定,供参考.关键词:同分异构体;书写;数目;有机物中图分类号:G632文献标识码:A 文章编号:1008-0333(2020)07-0087-02收稿日期:2019-12-05作者简介:穆玉鹏(1976.2-),男,山东省滨州人,本科,中学一级教师,从事高中化学教学研究.一、同分异构体的书写1.同分异构体的分类2.同分异构体的书写方法(1)芳香族化合物同分异构体①烷基的类别与个数,即碳链异构.②若有2个侧链,则存在邻、间、对三种位置异构.若有3个侧链则存在邻、偏、均三种位置异构.(2)具有官能团的有机物一般的书写顺序:碳链异构→官能团位置异构→官能团类别异构.3.几种异类异构体(1)C n H 2n (n ≥3):烯烃和环烷烃.(2)C n H 2n -2(n ≥4):二烯烃和炔烃.(3)C n H 2n +2O (n ≥2):饱和一元醇和饱和一元醚.(4)C n H 2n O (n ≥3):饱和一元醛、烯醇和环氧烷、饱和一元酮.(5)C n H 2n O 2(n ≥2):饱和一元羧酸、饱和一元羧酸与饱和一元醇形成的酯等.(6)C n H 2n +1O 2N (n ≥2):氨基酸、硝基烷.例1已知D (C 6H 8O 2)结构简式为CH ≡C —CH 2COOC 2H 5,X 与D 互为同分异构体,且具有完全相同官能团.X 的核磁共振氢谱显示三种不同化学环境的氢,其峰面积之比为3ʒ3ʒ2.写出3种符合上述条件的X的结—78—。



晶胞密度计算范文晶胞密度(Crystal Density)是指晶体的质量与晶胞体积的比值,通常以克/立方厘米(g/cm³)为单位。
它是材料科学和固态物理学中重要的一个参数,可以用来描述晶体的紧密程度和原子排列的密集程度。
晶胞密度的计算需要知道晶体的质量和晶胞的体积。
1.确定晶体的质量:晶体的质量可以通过称重的方式获得。
通常使用电子天平或天平进行准确测量,确保晶体质量的精确性和准确性。
2.确定晶胞的体积:晶胞的体积可以通过晶体的晶胞参数来计算。
晶胞参数是指晶体中晶胞的几何参数,包括晶胞的长度、角度和对称性。
晶体学常用的晶胞参数有晶胞长度(a、b、c)和晶胞角度(α、β、γ)。
晶胞的体积可以通过以下公式计算:V = a × b × c × sin(β)其中,V为晶胞体积,a、b、c分别为晶胞的长度,β为晶胞的角度。
3.计算晶胞密度:晶胞密度可以通过晶体的质量和晶胞的体积计算。
晶胞密度(D)等于晶体的质量(m)除以晶胞的体积(V),即:D=m/V其中,D为晶胞密度,m为晶体的质量,V为晶胞的体积。
晶胞密度的计算需要注意以下几点:1.确保晶体质量的准确性:在进行晶体质量测量时,需要使用准确的天平,并注意将晶体完全去除杂质和水分,以确保质量测量的准确性。
2.确定晶体晶胞参数的准确性:晶体晶胞参数的准确性对晶胞密度的计算非常重要。
晶体的晶胞参数可以通过X射线衍射等实验技术获得,也可以通过晶体结构模拟软件进行计算。
3. 单位换算:在计算过程中需要注意单位之间的换算。
晶胞质量通常以克(g)为单位,晶胞体积可以使用立方厘米(cm³)或立方米(m³)为单位,晶胞密度通常以克/立方厘米(g/cm³)为单位。
总之,晶胞密度的计算是通过确定晶体的质量和晶胞的体积,然后将质量除以体积来获得。
这个参数对于理解晶体的结构、性质和应用具有重要的意义。
第三章《 晶体结构与性质》测试题一、单选题1.下列化合物中,属于原子晶体的是A .干冰B .氯化钠C .氟化硅D .二氧化硅 2.如图是a 、b 两种不同物质熔化时的温度变化曲线,下列说法正确的是( )A .a 没有固定的熔点B .a 是非晶体C .b 是晶体D .b 是非晶体 3.以下过程与化学键断裂无关的是A .氯化钠熔化B .干冰升华C .金刚石熔化D .金属汞汽化 4.下列叙述错误的是( )A .区别晶体与非晶体最科学的方法是对固体进行X −射线衍射实验B .外观呈现规则多面体的物质,内部微观粒子在三维空间一定呈周期性有序排列C .晶体具有各向异性,所以用红热的铁针刺中涂有石蜡的水晶柱面,熔化的石蜡呈椭圆形D .乙醇和水都是极性分子,符合相似相溶原理,且它们易形成分子间氢键,故乙醇易溶于水5.对于下列性质的比较正确的是A .离子半径:r(Cl -)>r(S 2-)>r(Na +)B .元素的电负性:Si<P<NC .稳定性:H 2O>H 2S>HClD .晶格能:MgO>NaBr>NaCl 6.晶体具有各向异性,如蓝晶石(Al 2O 3·SiO 2)在不同方向上的硬度不同;又如石墨在与层垂直的方向上的电导率是与层平行的方向上的电导率的4110。
晶体的各向异性主要表现在( )①硬度 ②导热性 ③导电性 ④光学性质A .①③B .②④C .①②③D .①②③④ 7.下列说法中错误的是①H 2O 汽化成水蒸气破坏分子间作用力、H 2O 分解为H 2和O 2,需要破坏共价键 ②C 4H 10的两种同分异构体因为分子间作用力大小不同,因而沸点不同③因为晶体硅的摩尔质量比金刚石的摩尔质量大,所以晶体硅的熔点比金刚石的高④SiO2与CO2的分子结构类似,所以化学性质类似⑤分子晶体中,共价键键能越大,该分子晶体的熔、沸点越高A.①②⑤B.①②③C.②④⑤D.③④⑤8.根据下表中的数据,结合学过的化学知识,判断下列说法正确的是A.以上四种物质中,只有SiCl4是共价化合物B.若上述数据变化规律具有普遍性,则可预测:LiCl 的沸点大于BCl3的沸点C.因为AlCl3的沸点低,所以工业上可用电解熔融AlCl3制备AlD.据上述数据,可判断NaCl、MgCl2为分子晶体9.下列对一些实验事实的理论解释正确的是()A.A B.B C.C D.D10.W、X、Y、Z均为短周期主族元素,原子序数依次增加,X、Y同周期,W、Z同主族,且X、Y最外层电子数之和是W、Z最外层电子数之和的6倍。
新教材适用高中化学学案新人教版选择性必修2:微专题5 常见晶体结构的比较与分析晶体结构的计算一、常见晶体结构的比较与分析1.常见共价晶体结构的分析晶体晶胞结构结构分析金刚石(1)每个C与相邻_4__个C以共价键结合,形成正四面体结构。
每个晶胞中含_8__个C原子(2)键角均为_109°_28′__(3)最小碳环由_6__个C组成且6个C不在同一平面内,每个C原子被12个六元环共用(4)每个C参与_4__个C—C的形成,C原子数与C—C数之比为_12__(5)ρ=8×12N A·a3g·cm-3键长=34a(a为晶胞边长,N A 为阿伏加德罗常数的值)SiO2(1)每个Si与_4__个O以共价键结合,形成正四面体结构(2)每个正四面体占有1个Si,4个“12O”,因此二氧化硅晶体中Si与O的个数比为_12__(3)最小环上有_12__个原子,即_6__个O,_6__个Si(4)ρ=8×60N A·a3g·cm-3(a为晶胞边长,N A为阿伏加德罗常数的值)SiC、BP、AlN (1)每个原子与另外_4__个不同种类的原子形成_正四面体__结构(2)密度:ρ(SiC)=4×40N A·a3g·cm-3;ρ(BP)=4×42N A·a3g·cm-3;ρ(AlN)=4×41N A·a3g·cm-3(a为晶胞边长,N A为阿伏加德罗常数的值)2.常见分子晶体结构的分析晶体晶胞结构结构分析干冰(1)_8__个CO2分子占据立方体顶角且在_6__个面的面心又各有1个CO2分子(2)每个CO2分子周围紧邻的CO2分子有_12__个(3)ρ=4×44N A·a3g·cm-3(a为晶胞边长,N A为阿伏加德罗常数的值)白磷ρ=4×124N A·a3g·cm-3(a为晶胞边长,N A为阿伏加德罗常数的值)3.常见离子晶体结构的分析晶体晶胞结构结构分析(a为晶胞边长)NaCl (1)在晶体中,每个Na+同时吸引_6__个Cl-,每个Cl-同时吸引_6__个Na+,配位数为6。
规则晶体的密度计算【讨论】在初中物理中,我们学习了密度概念。
密度是某一物质单位体积的质量,就是某一物质质量与体积的比值。
密度是物质的一种属性,我们无限分割某一物质,密度是不变的(初中老师说过)。
这儿请注意几个问题:其一,密度受环境因素,如温度、压强的影响。
“热胀冷缩”引起物质体积变化,同时也改变了密度。
在气体问题上,更是显而易见。
其二,从宏观角度上来看,无限分割的确不改变物质的密度;但从微观角度来看呢,当把物质分割到原子级别时,我们拿出一个原子和一块原子间的空隙,或在一个原子中拿出原子核与核外部分,其密度显然都是不一样的。
在化学中有关晶体密度的求算,我们是从微观角度来考虑的。
宏观物质分到何时不应再分了呢?我们只要在微观角度找到一种能代表该宏观物质的密度的重复单位。
一般我们都是选取正方体型的重复单位,它在三维空间里有规则地堆积(未留空隙),就构成宏观物质了,也就是说这个正方体重复单位的密度代表了该物质的密度。
我们只要求出该正方体的质量和体积,不就是可以求出其密度了吗?现在,我们先主要来探讨一下正方体重复单位的质量计算。
【例题1】如图2-1所示为高温超导领域Array里的一种化合物——钙钛矿的结构。
该结构是具有代表性的最小重复单元。
确定该晶体结构中,元素钙、钛、氧的个数比及该结构单元的质量。
(相对原子质量:Ca 40.1 Ti47.9 O 16.0;阿佛加德罗常数:6.02×1023)【分析】我们以右图2-1所示的正方体结构单元为研究对象,讨论钙、钛、氧这三种图2-1元素属于这个正方体结构单元的原子(或离子)各有几个。
首先看钙原子,它位于正方体的体心,自然是1;再看位于顶点上的钛原子,属于这个正方体是1/8吗?在第一节中,我们曾将一个大正方体分割成八个小正方体,原来在大正方体的一个原子被分割成了八个,成为小正方体的顶点。
因此,位于正方体顶点上的原子属于这个正方体应为1/8。
再看位于棱心上的氧原子,将它再对分就成为顶点(或者可认为两个顶点拼合后成为棱心)。