第二章_化学反应的方向和吉布斯函数变
- 格式:ppt
- 大小:1.53 MB
- 文档页数:93









第二章 化学反应进行的方向和限度教学内容1. 焓变与变化方向;2. 熵变与变化方向;3. 吉布斯函数变与变化方向;4. 化学反应的限度——化学平衡。
教学要求理解标准熵、标准生成吉布斯函数变、标准平衡常数等有关概念;掌握反应的熵变与吉布斯函数变的求算方法;熟悉等温等压条件下化学反应进行方向的判断方法;掌握吉布斯方程及转化温度的计算方法;掌握标准平衡常数(ΘK )的表达和ΘK 与标准吉布斯函数变的关系及化学平衡的相关计算;了解影响化学平衡移动的有关因素。
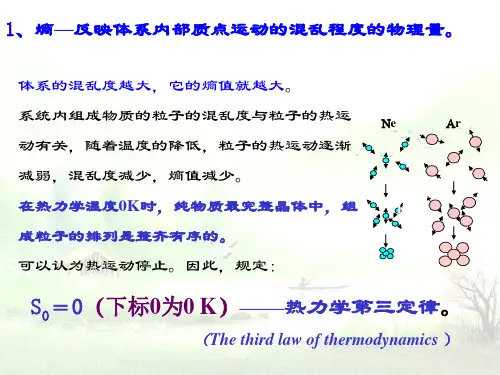
知识点与考核点1.熵(S )系统内微观质点混乱度的量度。
Ωln k S =(k 是Boltzmann 常数,Ω是微观状态数(与混乱度密切相关)。
熵是状态函数。
2. 热力学第三定律在0K 时,任何纯物质、完整晶体的绝对熵为0,(固体在0K 时,任何物质的 热运动停止,只有一种微观状态,即Ω=1)。
3. 标准摩尔熵(θm S )一定温度下,1mol 纯物质在标准情况下的规定熵。
人为规定:处于标准条件下的水合H + 离子的标准熵为零,其它离子的标准熵为其相对值。
4.影响熵的因素① 相同物质S g > S l > S s ;② 分子数越多、分子量越大、物质结构越复杂,熵越大; ③ 固体溶解于水,熵增加,而气体溶解于水,熵减小; ④ 温度越高,熵越大。
5.反应熵变的计算对化学反应a A + f F = g G + d D=θ∆m r S gS θm ,G + dS θm ,D – aS θm ,A – fS θm ,F =∑θνBB ,m B S 。
注意:①计量系数;②物质的聚集状态。
6. 熵变与化学反应方向等温等压条件下,熵变大于零(S ∆> 0)有利于变化过程自发进行,但 不能单独作为判断化学反应方向的标准。
7. 焓变与化学反应方向等温等压条件下,焓变小于零(H ∆> 0)有利于变化过程自发进行,但 不能单独作为判断变化过程方向的标准。
8. 吉布斯函数TS H G -= (G 为状态函数,为复合函数)。
