初中化学方程式大全(高级书写版)
- 格式:doc
- 大小:16.00 KB
- 文档页数:7


中考化学化学方程式分类总汇一.物质与氧气的反应:1. 镁在空气中燃烧:2Mg + O 22MgO 2. 铁在氧气中燃烧:3Fe + 2O 2Fe 3O 4 3. 铜在空气中受热:2Cu + O 2 2CuO4. 铝在空气中变暗:4Al + 3O 2 === 2Al 2O 35. 氢气中空气中燃烧:2H 2 + O 2 2H 2O6. 红磷(白磷)在空气中燃烧:4P + 5O 2 2P 2O 57. 硫粉在空气中燃烧: S + O 2SO 2 8. 碳在空气中充分燃烧:C + O 2CO 2 9. 碳在空气中不充分燃烧:2C + O 22CO 10. 一氧化碳在空气中燃烧:2CO + O 22CO 2 11. 甲烷在空气中燃烧:CH 4 + 2O 2CO 2 + 2H 2O (天然气、沼气主要成分燃) 12. 酒精在空气中燃烧:C 2H 5OH + 3O 22CO 2 + 3H 2O 二.几个分解反应:13. 水在直流电的作用下分解:2H 2O2H 2↑+ O 2 ↑ 14. 加热高锰酸钾:2KMnO 4 K 2MnO 4 + MnO 2 + O 2↑ (实验室制取氧气)15. 过氧化氢的分解(有少量的二氧化锰):2H 2O 2 2 H 2O + O 2↑ (实验室制取氧气)16. 加热氯酸钾(有少量的二氧化锰):2KClO 32KCl + 3O 2 ↑ (实验室制取氧气) 17. 碳酸不稳定而分解:H 2CO 3 === H 2O + CO 2↑18. 高温煅烧石灰石:CaCO 3高温CaO + CO 2↑ (工业 制取二氧化碳原理) 三.几个氧化还原反应:19. 氢气还原氧化铜:H 2 + CuOCu + H 2O 20. 木炭还原氧化铜:C+ 2CuO 高温2Cu + CO 2↑21. 焦炭还原氧化铁:3C+ 2Fe 2O 3高温4Fe + 3CO 2↑22. 焦炭还原四氧化三铁:2C+ Fe 3O 4高温3Fe + 2CO 2↑ 23. 一氧化碳还原氧化铜:CO+ CuO Cu + CO 224. 一氧化碳还原氧化铁:3CO+ Fe 2O 3高温2Fe + 3CO 2 (炼铁原理:赤铁矿) △ △ △ △25. 一氧化碳还原四氧化三铁:4CO+ Fe 3O 4高温3Fe + 4CO 2 (炼铁原理:磁铁矿)四.单质、氧化物、酸、碱、盐的相互关系 (1)金属单质 + 酸 -------- 盐 + 氢气 (置换反应)26. 锌和稀硫酸反应:Zn + H 2SO 4 === ZnSO 4 + H 2↑ (实验室制取氢气)27. 铁和稀硫酸反应:Fe + H 2SO 4 === FeSO 4 + H 2↑ 反应慢28. 镁和稀硫酸反应:Mg + H 2SO 4 === MgSO 4 + H 2↑ 反应太快29. 铝和稀硫酸反应:2Al +3H 2SO 4 === Al 2(SO 4)3 +3H 2↑30. 锌和稀盐酸反应:Zn + 2HCl=== ZnCl 2 + H 2↑ (实验室制取氢气)31. 铁和稀盐酸反应:Fe + 2HCl=== FeCl 2 + H 2↑ 反应慢32. 镁和稀盐酸反应:Mg+ 2HCl=== MgCl 2 + H 2↑ 反应太快33. 铝和稀盐酸反应:2Al + 6HCl === 2AlCl 3 + 3H 2↑(2)金属单质 + 盐(溶液) ------- 另一种金属 + 另一种盐34. 铁和硫酸铜溶液反应:Fe + CuSO 4 === FeSO 4 + Cu (湿法炼铜)35. 铝和硫酸铜溶液反应:2Al + 3CuSO 4 === Al 2(SO 4)3 + 3Cu36. 铝和硝酸银溶液反应:Al + 3AgNO 3 ===Al(NO 3)3 + 3Ag37. 铜和硝酸银溶液反应:Cu + 2AgNO 3 === Cu(NO 3)2 + 2Ag(3)酸 + 盐 -------- 另一种酸 + 另一种盐38. 大理石与稀盐酸反应:CaCO 3 + 2HCl === CaCl 2 + H 2O + CO 2↑(实验室制取二氧化碳原理)39. 碳酸钠与稀盐酸反应: Na 2CO 3 + 2HCl === 2NaCl + H 2O + CO 2↑(灭火器原理)40. 碳酸氢钠与稀盐酸反应: NaHCO 3 + HCl === NaCl + H 2O + CO 2↑( 除C O 2中的HCl )五.其它反应:41. 二氧化碳溶于水:CO 2 + H 2O === H 2CO 3 (解释二氧化碳通入石蕊溶液变红)42. 生石灰溶于水:CaO + H 2O === Ca(OH)2 (放热反应)43. 三氧化硫溶于水:SO 3 + H 2O === H 2SO 4 (硫酸型酸雨形成原因之一)44. 碳与二氧化碳在高温下的反应:C + CO 2 高温2CO (吸热反应)45. 二氧化碳通入澄清石灰水CO 2 + Ca(OH)2 === CaCO 3 ↓+ H 2O 检验或验证CO 246. 氢气在氯气中燃烧:H 2 + Cl 22HCl (氯化氢气体溶于水后就是盐酸) 47. 钠在氯气中燃烧:2Na+ Cl 2 2NaCl48. 硫酸铜晶体受热分解:CuSO 4·5H 2O CuSO 4 + 5H 2O ↑49. 无水硫酸铜检验水:CuSO 4 + 5H 2O === CuSO 4·5H 2O (证明水存在)50.拉瓦锡测定空气成分:2Hg + O 2 2HgO△△。

课外化学方程式的书写1、铜器在潮湿的空气中,在氧气、二氧化碳和水份的作用下、表面会慢慢地生成一层绿色的铜锈,主要成分的化学式为Cu2(OH)2CO3。
该反应的化学方程式为:___________________________ 。
2、人类很早就发现,孔雀石[主要成分的化学式Cu2(OH)2CO3]在熊熊燃烧的树木中灼烧后,发生分解反应,生成三种氧化物,剩余固体再与碳反应,余烬里有一种红色光亮的金属显露出来。
试用化学方程式表示孔雀石变化的两个主要反应:(1)____________________ _。
(2)______________________。
3、将铜粉放入稀硫酸中并通入氧气,溶液的颜色变成蓝色。
这一反应的化学方程式是________ 。
4、黑火药是我国古代四大发明之一,它是由木炭、硫黄、火硝(硝酸钾)按一定比例混合而成的,爆炸时生成硫化钾、氮气和二氧化碳。
黑火药爆炸的化学方程式是_______________________ 。
5、家庭使用的液化气是碳氢化合物,化学式可写为CxHy在空气中完全燃烧生成 ________,化学方程式为_______________________________________________________。
6、取8克某有机化合物(相对分子质量为32),在氧气中完全燃烧生成11克二氧化碳和9克水,则该有机物中一定含有________________元素,误服该有机物会使人中毒失明甚至死亡,写出此有机物在空气中燃烧的化学方程式____________________________________。
7、海洛因、鸦片、大麻都是严重危害人类健康的毒品,其中大麻主要成分的化学式为C21H30O2,在空气中焚烧大麻主要成分的化学方程式是_______________________________。
8、河水里的微生物使有机物(以C6H10O5表示)转化为CO2和H2O的过程中所需的O2量叫生化需氧量(BOD),BOD是衡量水体质量的一个指标。

九年级化学方程式大全最全整理化学方程式是描述化学反应过程的一种表示方法,通过化学方程式,我们可以了解反应物、生成物之间的量比关系以及反应过程中的能量变化。
在九年级的化学学习中,了解常见的化学方程式以及它们的意义是非常重要的。
本文将为大家整理九年级化学方程式的大全,以供参考。
一、氧化还原反应方程式氧化还原反应是指物质中的原子的氧化态和还原态发生改变的反应。
我们可以通过化学方程式来描述氧化还原反应。
1. 单质与非金属元素反应:- 氧化反应示例:C + O2→ CO2- 还原反应示例:2H2O → 2H2 + O22. 单质与金属元素反应:- 氧化反应示例:S + O2 → SO2- 还原反应示例:2Ag2O → 4Ag + O23. 金属之间的氧化还原反应:- 同金属不同氧化态:Cu + 2AgNO3 → Cu(NO3)2 + 2Ag- 不同金属不同氧化态:Zn + 2HCl → ZnCl2 + H2二、酸碱反应方程式酸碱反应是指酸和碱发生中和反应的过程。
下面是几组常见的酸碱反应方程式。
1. 碱与酸反应:- 碱氢氧化物和酸:NaOH + HCl → NaCl + H2O- 碱氮氢化合物和酸:NH3 + HCl → NH4Cl2. 碱与金属氢氧化物反应:- NaOH:NaOH + KOH → NaK + H2O- Mg(OH)2:2Mg(OH)2 + 2HCl → MgCl2 + 2H2O三、置换反应方程式置换反应是指一个元素或离子被另一个元素或离子取代的反应。
下面是几组典型的置换反应方程式。
1. 金属与酸的置换反应:- 镁与稀盐酸:Mg + 2HCl → MgCl2 + H2↑- 铁与硫酸:Fe + H2SO4 → FeSO4 + H2↑2. 金属与金属盐溶液的置换反应:- 铜与硫酸铁:Cu + FeSO4 → CuSO4 + Fe四、还原反应方程式还原反应是指物质从氧化态还原为较低的氧化态或还原为金属的过程。

科粤版初三化学上册知识点梳理重点题型(常考知识点)巩固练习化学方程式书写及其计算(提高)【学习目标】1. 通过具体化学反应分析,理解化学方程式的含义。
2.掌握化学方程式的书写原则和步骤;了解几种化学方程式的配平方法;能熟记并能书写常见反应的化学方程式。
3.掌握有关反应物、生成物质量的计算;掌握解计算题的基本格式。
【要点梳理】要点一、化学方程式1.定义:用化学式来表示化学反应的式子,叫做化学方程式,又叫反应方程式。
2.化学方程式的含义:3.化学方程式的读法(以S+O2SO2为例):(1)质的方面:硫和氧气在点燃条件下反应生成二氧化硫。
(2)量的方面:每32份质量的硫和32份质量的氧气完全反应生成64份质量的二氧化硫。
(3)粒子方面:每1个硫原子和1个氧分子反应生成1个二氧化硫分子。
【要点诠释】1.在化学反应中,反应物、生成物之间的质量比就是化学计量数与相对分子质量之积的比;2.化学式前面的数字之比是反应物与生成物之间的粒子数之比,而不是质量比。
要点二、化学方程式的书写原则和步骤1.书写化学方程式时应遵循两条原则:(《化学方程式的书写及其计算》)(1)一是以科学实验的事实为依据,写出反应物和生成物的化学式。
(2)二是以质量守恒定律为根据,等号两边各种原子的种类和数目必须相同。
2.书写化学方程式的五个步骤(以高锰酸钾受热分解为例)(1)“写”:根据实验事实,短线左边写反应物的化学式,右边写生成物的化学式,不止一种物质的用加号连接。
KMnO4─K2MnO4+MnO2+O2(2)“配”:调整化学式前边的化学计量数,使短线左右两边同种原子的数目相等。
2KMnO4─K2MnO4+MnO2+O2(3)“注”:注明反应条件、气体放出符号“↑”和沉淀符号“↓”。
如果反应物和生成物中都有气体或都有固体,气体生成物或固体生成物就不要注“↑”或“↓”。
(4)“改”:配平后必须把短线改为等号。
2KMnO4K2MnO4+MnO2+O2↑(5)“查”:一查化学式;二查配平(等号两边各种原子的总数是否相等);三查条件;四查生成物的状态。
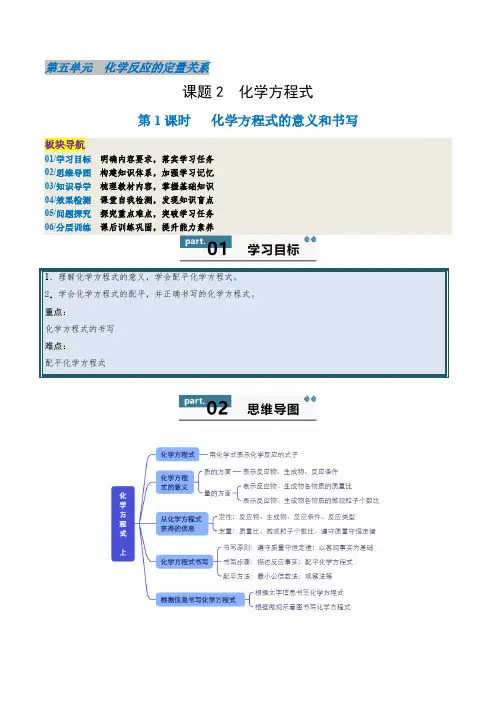
第五单元化学反应的定量关系课题2 化学方程式第1课时化学方程式的意义和书写板块导航01/学习目标明确内容要求,落实学习任务02/思维导图构建知识体系,加强学习记忆03/知识导学梳理教材内容,掌握基础知识04/效果检测课堂自我检测,发现知识盲点05/问题探究探究重点难点,突破学习任务06/分层训练课后训练巩固,提升能力素养一、化学方程式及意义1.化学方程式:用 来表示化学反应的式子。
2.化学方程式的意义3.从化学方程式获得的信息二、化学方程式的书写1.书写原则(1)要以为基础,写出反应物、生成物和反应条件,体现化学反应中的关系。
(2)要遵守,使等号两边各原子的种类与数目相等,体现化学反应中的关系。
2.书写化学方程式的步骤(以磷在氧气中燃烧生成五氧化二磷的反应为例)【易错提醒】(1)如果反应物和生成物中都有气体,气体生成物就不注“↑”号,如C+O2 点燃CO2;(2)溶液中的反应,若反应物和生成物中都有固体,固体生成物也不注“↓”号,如Fe+CuSO4==FeSO4+Cu。
(3)“↑”和“↓”只能标注在生成物中,不能标注在反应物中。
(4)“点燃”不能与“加热”、“∆”混淆,也不能写成“燃烧”。
3.化学方程式的配平方法三、根据信息书写化学方程式1.根据文字信息书写化学方程式从文字表述中找出、和,然后配平。
典例:写出下列与氢气有关的反应的化学方程式。
(1)在1200~1300 ℃时,三氯化硼(BCl3)蒸气与干燥、纯净的氢气反应可制得单质硼(B)和氯化氢:。
(2)氢化钙(CaH2)固体是一种储氢材料,能与水反应生成氢氧化钙和氢气:。
【易错提醒】(1)反应条件要严格按照题给信息书写,不能擅自改动。
如“1200℃”不能写成“高温”;“一定条件”、“催化剂”、“高温高压”等都要原文照抄,不可改动。
(2)关注反应物和生成物的状态,考虑是否需要添加气体符号和沉淀符号。
2.根据微观反应示意图书写化学方程式(1)恰好完全反应时典例:二氧化碳转化为甲醇的微观示意图如图所示,请回答:写出该反应的化学方程式:。

物质结构元素周期律1、4Li + O 2--------- 2Li2 O 4Na+O= 2Nc fe O 2Na+O 2------------- N aQ22Na+2H 2O===2NaOH+H 2 f 2K+2H 2O===2KOH+H 2 f 2、卤素单质与氢气反响(条件、现象不同)F2 + H 2 === 2HF C12 + H 2 === 2HCl B Q + H 2 === 2HBr I2 + H 2 === 2HI 3、卤素单质间的置换反响:(1)CI2可以从溴化物(或碘化物)中置换出B「2 (或12):①Cl2+2NaBr=Br 2+2NaCI ② Cb+2KI=I 2+2KCI(2) Br2可以从碘化物中置换出I2 :Br2+2KI=I 2+2KBr 4、Mg+2H 2O === Mg(OH) 2+H 2f(沸水)2AI+6HCI===2AICI 3+3H 2 f Mg+2HCI :===MgCI 2+ H 2 f 5Cl£+£Ma gUad第二章化学反响与能量1、Ba(0H)2 • 8H2O+2NH 4CI==BaCl2+2NH 3 f +10H2O NaOH+HCI==NaCI+H 2O2、原电池原理(1)概念:原电池是把化学能转变成电能的装置(2)典型的原电池(Zn-Cu原电池)负极(锌):Zn-2e=Zn 2+(氧化反响) 正极(铜):2H++2e =H 2 f (复原反响) 电子流动方向:由锌经过外电路流向铜。
总反响离子方程式:Zn+2H +=Zn 2++H 2 f 催化剂3、2HQ= △ 2HzO+Q f4、2C + 0 2空2CO Fe2O3 + 3C0 局丘2Fe + 3CO2第三章有机化合物1、甲烷的主要化学性质(1)氧化反响占燃CH 4(g)+2O 2(g)占燃CO2(g)+2H 2O(I) (2)取代反响n—C—村亠LAjY:厶H—c—Cl + H^ C| (I)r【H CJ14 + Cl£—亠cn3ci + nciI t…光"CH^C1£斗Cl2——> CHC13-1- MCI CRjCl 4- 4- HC1I , 光亠小卄+ Cl2—-* CCI4 十HC1⑶聚合反响::;-r/・::.|(1)氧化反响(2)取代反响①②苯与硝酸(用状液体硝基苯。

九年级常考的15个化学方程式以下是九年级常考的一些化学方程式:1. 氧化反应:- 2Mg + O2 →2MgO (镁和氧气生成氧化镁)2. 酸碱中和反应:- HCl + NaOH →NaCl + H2O (盐酸和氢氧化钠生成氯化钠和水)3. 单质与氧气反应:- 2H2 + O2 →2H2O (氢气和氧气生成水)4. 金属与非金属氧化物反应:- 2Al + 3CuO →3Cu + Al2O3 (铝和铜氧化物生成铜和氧化铝)5. 水解反应:- CaCl2 + H2O →Ca(OH)2 + 2HCl (氯化钙和水生成氢氧化钙和盐酸)6. 还原反应:- 2K + 2H2O →2KOH + H2 (钾和水生成氢氧化钾和氢气)7. 燃烧反应:- C3H8 + 5O2 →3CO2 + 4H2O (丙烷和氧气燃烧生成二氧化碳和水)8. 置换反应:- Zn + CuSO4 →ZnSO4 + Cu (锌和硫酸铜置换生成硫酸锌和铜)9. 分解反应:- 2HgO →2Hg + O2 (氧化汞分解成汞和氧气)10. 碱金属与水反应:- 2Na + 2H2O →2NaOH + H2 (钠和水生成氢氧化钠和氢气)11. 碳酸盐分解反应:- CaCO3 →CaO + CO2 (碳酸钙分解成氧化钙和二氧化碳)12. 氢氧化物分解反应:- 2AgOH →Ag2O + H2O (氢氧化银分解成氧化银和水)13. 硫酸盐分解反应:- Na2SO4 →Na2O + SO3 (硫酸钠分解成氧化钠和三氧化硫)14. 过氧化物分解反应:- 2H2O2 →2H2O + O2 (过氧化氢分解成水和氧气)15. 含氧酸盐分解反应:- 2KClO3 →2KCl + 3O2 (高氯酸钾分解成氯化钾和氧气)。

初中化学方程式总结初中化学方程式总结总结是事后对某一阶段的学习或工作情况作加以回顾检查并分析评价的书面材料,它可以给我们下一阶段的学习和工作生活做指导,因此我们要做好归纳,写好总结。
你想知道总结怎么写吗?以下是小编收集整理的初中化学方程式总结,仅供参考,希望能够帮助到大家。
初中化学方程式总结1与氢有关的化学方程式:Zn+H2SO4==ZnSO4+H2↑现象:有可燃烧的气体生成。
通过上面的讲解希望同学们能很好的学习,相信同学们会学习的很好,预祝大家很好的参加考试。
初中化学关于自然界中水的方程式汇总。
下面是对有关自然界中的水的方程式汇总学习,希望同学们很好的掌握下面的知识。
自然界中的水:17、水在直流电的作用下分解(研究水的组成实验):2H2O 通电2H2↑+ O2 ↑18、生石灰溶于水:CaO + H2O == Ca(OH)219、二氧化碳可溶于水: H2O + CO2==H2CO3相信上面对自然界中的水的相关化学方程式的讲解,同学们已经能很好的掌握了吧,相信同学们会从中学习的很好的哦。
初中化学中氧气的性质方程式汇总讲解对于化学方程式中,关于氧气的性质知识的方程式学习,同学们认真看看下面的内容。
氧气的性质:单质与氧气的反应:(化合反应)1、镁在氧气中燃烧:2Mg + O2 点燃 2MgO2、铁在氧气中燃烧:3Fe + 2O2 点燃 Fe3O43、铜在氧气中受热:2Cu + O2 加热 2CuO4、铝在氧气中燃烧:4Al + 3O2 点燃 2Al2O35、氢气在氧气中燃烧:2H2 + O2 点燃 2H2O6、红磷在氧气中燃烧(研究空气组成的实验):4P + 5O2 点燃2P2O57、硫在氧气中燃烧: S + O2 点燃 SO28、碳在氧气中充分燃烧:C + O2 点燃 CO29、碳在氧气中不充分燃烧:2C + O2 点燃 2CO化合物与氧气的反应:10、一氧化碳在氧气中燃烧:2CO + O2 点燃 2CO211、甲烷在氧气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O12、酒精在氧气中燃烧:C2H5OH + 3O2 点燃 2CO2 + 3H2O氧气的:13、拉瓦锡研究空气的成分实验 2HgO 加热2Hg+ O2 ↑14、加热高锰酸钾:2KMnO4 加热K2MnO4 + MnO2 + O2↑(实验室制氧气原理1)15、加热氯酸钾和二氧化锰混合物:2KClO3 =加热MnO2= 2KCl+3O2 ↑ (实验室制氧气原理2)16、过氧化氢在二氧化锰作催化剂条件下分解反应:2H2O2 =MnO2= 2H2O+ O2 ↑(实验室制氧气原理3)植物的光合作用:6CO2+6H2O 阳光/叶绿素 6O2+C6H12O6 初中化学方程式总结2化学方程式计算的理论依据就是质量守恒定律。

人教版九年级上册化学化学方程式书写专项训练(有答案)人教版九年级上册化学化学方程式书写专项练习卷(有答案)1.镁在空气中燃烧2.铁在氧气中燃烧3.氢气在空气中燃烧4.红磷在空气中燃烧5.硫粉在空气中燃烧6.碳在氧气中充分和不充分燃烧(2个方程式)7.水在直流电的作用下分解8.过氧化氢分解9.加热氯酸钾(有少量的二氧化锰作催化剂)10.加热高锰酸钾11.氧化汞受热分解12.高温煅烧碳酸钙13.铁和硫酸铜溶液(并写出反应现象)14.氢气还原氧化铜15.碳酸钠和稀盐酸反应16.检验二氧化碳的存在17.实验室制取二氧化碳气体18.酒精的燃烧19.一氧化碳还原氧化铜20.一氧化碳还原氧化铁21.碳还原氧化铜22.碳还原二氧化碳23.二氧化碳与水的反应24.碳酸的分解25.实验室制取氢气26.铁和硫酸溶液反应27.铝和硫酸溶液反应28.铁和盐酸溶液反应29.碳还原氧化铁30氢气还原氧化铁31.铝和硫酸铜溶液反应32.铜和硝酸银溶液反应33.硫酸铜和氢氧化钠反应34.一氧化碳在空气中燃烧35.氧化钙(生石灰)和水的反应36.甲烷在空气中燃烧37.碳在空气中的不完全燃烧38.氢氧化钠和二氧化碳反应(除去二氧化碳)39.碳酸钠与稀硫酸反应40.碳酸钡与稀硫酸反应答案1.镁在空气中燃烧2Mg+O 2____________点燃2MgO2.铁在氧气中燃烧3Fe+2O 2____________点燃Fe 3O 43.氢气在空气中燃烧2H 2+O 2____________点燃2H 2O4.红磷在空气中燃烧4P+5O 2____________点燃2P 2O 55.硫粉在空气中燃烧S+O 2____________点燃SO 26.碳在氧气中充分和不充分燃烧(2个方程式)C+O 2____________点燃CO 22C+O 2____________点燃2CO7.水在直流电的作用下分解2H 2O ____________通电2H 2+O 2↑8.过氧化氢分解2H 2O 2____________MnO 22H 2O+O 2↑9.加热氯酸钾(有少量的二氧化锰作催化剂)2K ClO 3____________MnO 2△2KCl+3O 2↑10.加热高锰酸钾2KMnO 4________△K 2MnO 4+MnO 2+O 2↑ 11.氧化汞受热分解2HgO ________△2Hg+O 2↑ 12.高温煅烧碳酸钙CaCO 3____________高温CaO+CO 2↑13.铁和硫酸铜溶液(并写出反应现象)Fe+CuSO4=FeSO4+Cu反应现象:铁表面有红色固体生成,溶液由蓝色变为浅绿色。

高中所有化学方程式一、非金属单质(F2、Cl2、 O2、 S、 N2、 P 、 C 、 Si)1、氧化性:F2+H2=2HFF2+Xe(过量)=XeF22F2(过量)+Xe=XeF4nF2+2M=2MFn (表示大部分金属) 2F2+2H2O=4HF+O22F2+2NaOH=2NaF+OF2+H2O F2+2NaCl=2NaF+Cl2F2+2NaBr=2NaF+Br2F2+2NaI =2NaF+I2F2+Cl2 (等体积)=2ClF3F2 (过量)+Cl2=2ClF37F2(过量)+I2=2IF7Cl2+H2=2HCl3Cl2+2P=2PCl3Cl2+PCl3=PCl5Cl2+2Na=2NaCl3Cl2+2Fe=2FeCl3Cl2+2FeCl2=2FeCl3Cl2+Cu=CuCl22Cl2+2NaBr=2NaCl+Br2Cl2+2NaI =2NaCl+I25Cl2+I2+6H2O=2HIO3+10HClCl2+Na2S=2NaCl+SCl2+H2S=2HCl+SCl2+SO2+2H2O=H2SO4+2HCl Cl2+H2O2=2HCl+O22O2+3Fe=Fe3O4O2+K=KO2S+H2=H2S2S+C=CS2S+Fe=FeSS+2Cu=Cu2S3S+2Al=Al2S3S+Zn=ZnSN2+3H2=2NH3N2+3Mg=Mg3N2N2+3Ca=Ca3N2N2+3Ba=Ba3N2N2+6Na=2Na3NN2+6K=2K3NN2+6Rb=2Rb3NP4+6H2=4PH3P+3Na=Na3P2P+3Zn=Zn3P22.还原性S+O2=SO2S+O2=SO2S+6HNO3(浓)=H2SO4+6NO2+2H2O3S+4HNO3(稀)=3SO2+4NO+2H2ON2+O2=2NO4P+5O2=P4O10(常写成P2O5)2P+3X2=2PX3(X表示F2、Cl2、Br2)PX3+X2=PX5P4+20HNO3(浓)=4H3PO4+20NO2+4H2OC+2F2=CF4C+2Cl2=CCl42C+O2(少量)=2COC+O2(足量)=CO2C+CO2=2COC+H2O=CO+H2(生成水煤气)2C+SiO2=Si+2CO(制得粗硅)Si(粗)+2Cl=SiCl4(SiCl4+2H2=Si(纯)+4HCl)Si(粉)+O2=SiO2Si+C=SiC(金刚砂)Si+2NaOH+H2O=Na2SiO3+2H23、(碱中)歧化Cl2+H2O=HCl+HClO(加酸抑制歧化、加碱或光照促进歧化)Cl2+2NaOH=NaCl+NaClO+H2O2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O 3Cl2+6KOH(热、浓)=5KCl+KClO3+3H2O 3S+6NaOH=2Na2S+Na2SO3+3H2O4P+3KOH(浓)+3H2O=PH3+3KH2PO211P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4 3C+CaO=CaC2+CO3C+SiO2=SiC+2CO二、金属单质(Na、Mg、Al、Fe)的还原性2Na+H2=2NaH4Na+O2=2Na2O2Na2O+O2=2Na2O22Na+O2=Na2O22Na+S=Na2S(爆炸)2Na+2H2O=2NaOH+H22Na+2NH3=2NaNH2+H24Na+TiCl4(熔融)=4NaCl+TiMg+Cl2=MgCl2Mg+Br2=MgBr22Mg+O2=2MgOMg+S=MgSMg+2H2O=Mg(OH)2+H22Mg+TiCl4(熔融)=Ti+2MgCl2Mg+2RbCl=MgCl2+2Rb2Mg+CO2=2MgO+C2Mg+SiO2=2MgO+SiMg+H2S=MgS+H2Mg+H2SO4=MgSO4+H22Al+3Cl2=2AlCl34Al+3O2=2Al2O3(钝化)4Al(Hg)+3O2+2xH2O=2(Al2O3.xH2O)+4Hg4Al+3MnO2=2Al2O3+3Mn2Al+Cr2O3=Al2O3+2Cr2Al+Fe2O3=Al2O3+2Fe2Al+3FeO=Al2O3+3Fe2Al+6HCl=2AlCl3+3H22Al+3H2SO4=Al2(SO4)3+3H22Al+6H2SO4(浓)=Al2(SO4)3+3SO2+6H2O(Al、Fe在冷、浓的H2SO4、HNO3中钝化)Al+4HNO(稀)=Al(NO3)3+NO+2H2O2Al+2NaOH+2H2O=2NaAlO2+3H22Fe+3Br2=2FeBr3Fe+I2=FeI2Fe+S=FeS3Fe+4H2O(g)=Fe3O4+4H2Fe+2HCl=FeCl2+H2Fe+CuCl2=FeCl2+CuFe+SnCl4=FeCl2+SnCl2(铁在酸性环境下、不能把四氯化锡完全还原为单质锡Fe+SnCl2==FeCl2+Sn)三、非金属氢化物(HF、HCl、H2O、H2S、NH3)1、还原性:4HCl(浓)+MnO2=MnCl2+Cl2+2H2O4HCl(g)+O2=2Cl2+2H2O16HCl+2KMnO4=2KCl+2MnCl2+5Cl2+8H2O14HCl+K2Cr2O7=2KCl+2CrCl3+3Cl2+7H2O2H2O+2F2=4HF+O22H2S+3O2(足量)=2SO2+2H2O2H2S+O2(少量)=2S+2H2O2H2S+SO2=3S+2H2OH2S+H2SO4(浓)=S+SO2+2H2O3H2S+2HNO(稀)=3S+2NO+4H2O5H2S+2KMnO4+3H2SO4=2MnSO4+K2SO4+5S+8H2O 3H2S+K2Cr2O7+4H2SO4=Cr2(SO4)3+K2SO4+3S+7H2O H2S+4Na2O2+2H2O=Na2SO4+6NaOH2NH3+3CuO=3Cu+N2+3H2O2NH3+3Cl2=N2+6HCl8NH3+3Cl2=N2+6NH4Cl4NH3+3O2(纯氧)=2N2+6H2O4NH3+5O2=4NO+6H2O4NH3+6NO=5N2+6HO(用氨清除NO)NaH+H2O=NaOH+H24NaH+TiCl4=Ti+4NaCl+2H2CaH2+2H2O=Ca(OH)2+2H22、酸性:4HF+SiO2=SiF4+2H2O(此反应广泛应用于测定矿样或钢样中SiO2的含量)2HF+CaCl2=CaF2+2HClH2S+Fe=FeS+H2H2S+CuCl2=CuS+2HClH2S+2AgNO3=Ag2S+2HNO3H2S+HgCl2=HgS+2HClH2S+Pb(NO3)2=PbS+2HNO3H2S+FeCl2=2NH3+2Na==2NaNH2+H2(NaNH2+H2O=NaOH+NH3)3、碱性:NH3+HCl=NH4ClNH3+HNO3=NH4NO32NH3+H2SO4=(NH4)2SO4NH3+NaCl+H2O+CO2=NaHCO3+NH4Cl (此反应用于工业制备小苏打、苏打)4、不稳定性:2HF=H2+F22HCl=H2+Cl22H2O=2H2+O22H2O2=2H2O+O2H2S=H2+S2NH3=N2+3H2四、非金属氧化物1、低价态的还原性:2SO2+O2=2SO32SO2+O2+2H2O=2H2SO4(这是SO2在大气中缓慢发生的环境化学反应)SO2+Cl2+2H2O=H2SO4+2HClSO2+Br2+2H2O=H2SO4+2HBrSO2+I2+2H2O=H2SO4+2HISO2+NO2=SO3+NO2NO+O2=2NO2NO+NO2+2NaOH=2NaNO2(用于制硝酸工业中吸收尾气中的NO和NO2)2CO+O2=2CO2CO+CuO=Cu+CO23CO+Fe2O3=2Fe+3CO2CO+H2O=CO2+H22、氧化性:SO2+2H2S=3S+2H2OSO3+2KI=K2SO3+I2NO2+2KI+H2O=NO+I2+2KOH(不能用淀粉KI溶液鉴别溴蒸气和NO2)4NO2+H2S=4NO+SO3+H2O2NO2+Cu=4CuO+N2CO2+2Mg=2MgO+C(CO2不能用于扑灭由Mg、Ca、Ba、Na、K等燃烧的火灾) SiO2+2H2=Si+2H2OSiO2+2Mg=2MgO+Si3、与水的作用:SO2+H2O=H2SO3SO3+H2O=H2SO43NO2+H2O=2HNO3+NON2O5+H2O=2HNO3P2O5+H2O=2HPO3P2O5+3H2O=2H3PO4(P2O5极易吸水、可作气体干燥剂P2O5+3H2SO4(浓)=2H3PO4+3SO3)CO2+H2O=H2CO34、与碱性物质的作用:SO2+2NH3+H2O=(NH4)2SO3SO2+(NH4)2SO3+H2O=2NH4HSO3(这是硫酸厂回收SO2的反应.先用氨水吸收SO2、再用H2SO4处理: 2NH4HSO3+H2SO4=(NH4)2SO4+2H2O+2SO2生成的硫酸铵作化肥、SO2循环作原料气)SO2+Ca(OH)2=CaSO3+H2O(不能用澄清石灰水鉴别SO2和CO2.可用品红鉴别)SO3+MgO=MgSO4SO3+Ca(OH)2=CaSO4+H2OCO2+2NaOH(过量)=Na2CO3+H2OCO2(过量)+NaOH=NaHCO3CO2+Ca(OH)2(过量)=CaCO3+H2O2CO2(过量)+Ca(OH)2=Ca(HCO3)2CO2+2NaAlO2+3H2O=2Al(OH)3+Na2CO3CO2+C6H5ONa+H2O=C6H5OH+NaHCO3SiO2+CaO=CaSiO3SiO2+2NaOH=Na2SiO3+H2O(常温下强碱缓慢腐蚀玻璃)SiO2+Na2CO3=Na2SiO3+CO2SiO2+CaCO3=CaSiO3+CO2五、金属氧化物1、低价态的还原性:6FeO+O2=2Fe3O4FeO+4HNO3=Fe(NO3)3+NO2+2H2O2、氧化性:Na2O2+2Na=2Na2O(此反应用于制备Na2O)MgO、Al2O3几乎没有氧化性、很难被还原为Mg、Al. 一般通过电解制Mg和Al.Fe2O3+3H2=2Fe+3H2O (制还原铁粉)Fe3O4+4H2=3Fe+4H2O3、与水的作用:Na2O+H2O=2NaOH2Na2O2+2H2O=4NaOH+O2(此反应分两步:Na2O2+2H2O=2NaOH+H2O2 ;2H2O2=2H2O+O2. H2O2的制备可利用类似的反应: BaO2+H2SO4(稀)=BaSO4+H2O2)MgO+H2O=Mg(OH)2 (缓慢反应)4、与酸性物质的作用:Na2O+SO3=Na2SO4Na2O+CO2=Na2CO3Na2O+2HCl=2NaCl+H2O2Na2O2+2CO2=2Na2CO3+O2Na2O2+H2SO4(冷、稀)=Na2SO4+H2O2MgO+SO3=MgSO4MgO+H2SO4=MgSO4+H2OAl2O3+3H2SO4=Al2(SO4)3+3H2O(Al2O3是两性氧化物:Al2O3+2NaOH=2NaAlO2+H2O)FeO+2HCl=FeCl2+3H2OFe2O3+6HCl=2FeCl3+3H2OFe2O3+3H2S(g)=Fe2S3+3H2OFe3O4+8HCl=FeCl2+2FeCl3+4H2O六、含氧酸1、氧化性:4HClO3+3H2S=3H2SO4+4HClHClO3+HI=HIO3+HCl3HClO+HI=HIO3+3HClHClO+H2SO3=H2SO4+HClHClO+H2O2=HCl+H2O+O2(氧化性:HClO>HClO2>HClO3>HClO4、但浓、热的HClO4氧化性很强)2H2SO4(浓)+C=CO2+2SO2+2H2O2H2SO4(浓)+S=3SO2+2H2OH2SO4+Fe(Al) 室温下钝化6H2SO4(浓)+2Fe=Fe2(SO4)3+3SO2+6H2O2H2SO4(浓)+Cu=CuSO4+SO2+2H2OH2SO4(浓)+2HBr=SO2+Br2+2H2OH2SO4(浓)+2HI=SO2+I2+2H2OH2SO4(稀)+Fe=FeSO4+H22H2SO3+2H2S=3S+2H2O4HNO3(浓)+C=CO2+4NO2+2H2O6HNO3(浓)+S=H2SO4+6NO2+2H2O5HNO3(浓)+P=H3PO4+5NO2+H2O6HNO3+Fe=Fe(NO3)3+3NO2+3H2O4HNO3+Fe=Fe(NO3)3+NO+2H2O30HNO3+8Fe=8Fe(NO3)3+3N2O+15H2O36HNO3+10Fe=10Fe(NO3)3+3N2+18H2O30HNO3+8Fe=8Fe(NO3)3+3NH4NO3+9H2O2、还原性:H2SO3+X2+H2O=H2SO4+2HX(X表示Cl2、Br2、I2)2H2SO3+O2=2H2SO4H2SO3+H2O2=H2SO4+H2O5H2SO3+2KMnO4=2MnSO4+K2SO4+2H2SO4+3H2OH2SO3+2FeCl3+H2O=H2SO4+2FeCl2+2HCl3、酸性:H2SO4(浓) +CaF2=CaSO4+2HFH2SO4(浓)+NaCl=NaHSO4+HClH2SO4(浓) +2NaCl=Na2SO4+2HClH2SO4(浓)+NaNO3=NaHSO4+HNO33H2SO4(浓)+Ca3(PO4)2=3CaSO4+2H3PO42H2SO4(浓)+Ca3(PO4)2=2CaSO4+Ca(H2PO4)23HNO3+Ag3PO4=H3PO4+3AgNO32HNO3+CaCO3=Ca(NO3)2+H2O+CO2(用HNO3和浓H2SO4不能制备H2S、HI、HBr、(SO2)等还原性气体)4H3PO4+Ca3(PO4)2=3Ca(H2PO4)2(重钙)H3PO4(浓)+NaBr=NaH2PO4+HBrH3PO4(浓)+NaI=NaH2PO4+HI4、不稳定性:2HClO=2HCl+O24HNO3=4NO2+O2+2H2OH2SO3=H2O+SO2H2CO3=H2O+CO2H4SiO4=H2SiO3+H2O七、碱1、低价态的还原性:4Fe(OH)2+O2+2H2O=4Fe(OH)32、与酸性物质的作用:2NaOH+SO2(少量)=Na2SO3+H2O NaOH+SO2(足量)=NaHSO32NaOH+SiO2=NaSiO3+H2O2NaOH+Al2O3=2NaAlO2+H2O2NaOH+Cl2=NaCl+NaClO+H2ONaOH+HCl=NaCl+H2ONaOH+H2S(足量)=NaHS+H2O2NaOH+H2S(少量)=Na2S+2H2O3NaOH+AlCl3=Al(OH)3+3NaCl NaOH+Al(OH)3=NaAlO2+2H2O (AlCl3和Al(OH)3哪个酸性强?)NaOH+NH4Cl=NaCl+NH3+H2OMg(OH)2+2NH4Cl=MgCl2+2NH3.H2OAl(OH)3+NH4Cl 不溶解3、不稳定性:Mg(OH)2=MgO+H2O2Al(OH)3=Al2O3+3H2O2Fe(OH)3=Fe2O3+3H2OCu(OH)2=CuO+H2O八、盐1、氧化性:2FeCl3+Fe=3FeCl22FeCl3+Cu=2FeCl2+CuCl2(用于雕刻铜线路版)2FeCl3+Zn=2FeCl2+ZnCl2FeCl3+Ag=FeCl2+AgCFe2(SO4)3+2Ag=FeSO4+Ag2SO4(较难反应) Fe(NO3)3+Ag 不反应2FeCl3+H2S=2FeCl2+2HCl+S2FeCl3+2KI=2FeCl2+2KCl+I2FeCl2+Mg=Fe+MgCl22、还原性:2FeCl2+Cl2=2FeCl33Na2S+8HNO3(稀)=6NaNO3+2NO+3S+4H2O3Na2SO3+2HNO3(稀)=3Na2SO4+2NO+H2O2Na2SO3+O2=2Na2SO43、与碱性物质的作用:MgCl2+2NH3.H2O=Mg(OH)2+NH4ClAlCl3+3NH3.H2O=Al(OH)3+3NH4ClFeCl3+3NH3.H2O=Fe(OH)3+3NH4Cl4、与酸性物质的作用:Na3PO4+HCl=Na2HPO4+NaClNa2HPO4+HCl=NaH2PO4+NaClNaH2PO4+HCl=H3PO4+NaClNa2CO3+HCl=NaHCO3+NaClNaHCO3+HCl=NaCl+H2O+CO23Na2CO3+2AlCl3+3H2O=2Al(OH)3+3CO2+6NaCl 3Na2CO3+2FeCl3+3H2O=2Fe(OH)3+3CO2+6NaCl 3NaHCO3+AlCl3=Al(OH)3+3CO23NaHCO3+FeCl3=Fe(OH)3+3CO23Na2S+Al2(SO4)3+6H2O=2Al(OH)3+3H2S3NaAlO2+AlCl3+6H2O=4Al(OH)35、不稳定性:Na2S2O3+H2SO4=Na2SO4+S+SO2+H2ONH4Cl=NH3+HClNH4HCO3=NH3+H2O+CO22KNO3=2KNO2+O22Cu(NO3)3=2CuO+4NO2+O22KMnO4=K2MnO4+MnO2+O22KClO3=2KCl+3O22NaHCO3=Na2CO3+H2O+CO2Ca(HCO3)2=CaCO3+H2O+CO2CaCO3=CaO+CO2MgCO3=MgO+CO2有机化学部分高中阶段 常用化学反应方程式1、钠在空气中燃烧(黄色的火焰) 2Na + O 2 Na 2O 2 钠块在空气中变暗4Na +O 2=2Na 2ONa 2O 在空气中加热(变黄) 2Na 2O +O 2=2Na 2O 22、钠与水反应(浮、熔、游、响、红) 2Na + 2H 2O = 2H 2O + H 2 ↑2Na + 2H 2O = 2Na + + 2OH -+ H 2 ↑3、过氧化钠与水的反应(放热反应、Na 2O 2是强氧化剂,用于漂白) 2Na 2O 2 + 2H 2O = 4NaOH + O 2 ↑ 2Na 2O 2 + 2H 2O = 4Na ++4OH -+O 2↑碱性氧化物Na 2O 与水的反应 Na 2O +H 2O =2NaOH4、过氧化钠可用在呼吸面具和潜水艇中作为氧气来源,原因是: 2Na 2O 2 + 2CO 2 = 2Na 2CO 3 + O 25、苏打(纯碱)与盐酸反应 ①盐酸中滴加纯碱溶液Na 2CO 3 + 2HCl = 2NaCl + H 2O +CO 2↑ CO 32-+ 2H += H 2O + CO 2↑ ②纯碱溶液中滴加盐酸,至过量Na 2CO 3 + HCl = NaHCO 3 + NaCl CO 32- + H + = HCO 3-NaHCO 3+HCl =NaCl +H 2O +CO 2↑ 6、小苏打受热分解2NaHCO 3 △Na 2CO 3 + H 2O +CO 2 ↑7、固体氢氧化钠和碳酸氢钠混合物在密闭容器中加热 NaHCO 3 + NaOH△Na 2CO 3 + H 2OHCO 3-+ OH-= H 2O + CO 32-(若是溶液中反应有离子方程式)8、金属锂在空气中燃烧 4Li + O 2△2Li 2O9、氯气的性质铜丝在氯气中剧烈燃烧(棕色烟)Cu + Cl 2点燃CuCl 2之后加水,可由绿色溶液(浓)得到蓝色溶液(稀)Cl 2 +2FeCl 2 =2FeCl 3 2Cl 2+2NaBr =2NaCl +Br 2 Cl 2 +2NaI =2NaCl +I 2Cl 2+SO 2 +2H 2O =H 2SO 4 +2HCl 2Na + Cl 2点燃2NaCl10、铁在氯气中剧烈燃烧 2Fe + 3Cl 2点燃3FeCl 311、氢气在氯气中燃烧(苍白色火焰) H 2 + Cl 2点燃2HCl氟气与氢气反应(黑暗处即可爆炸) H 2+F 2=2HF12、氯气溶于水(新制氯水中含H +、Cl -、ClO -、OH -、Cl 2、HClO 、H 2O ) Cl 2 + H 2O = HCl + HClO Cl 2 + H 2O = H ++ Cl -+ HClO13、次氯酸见光分解(强氧化剂、杀菌消毒,漂白剂) 2HClO 2HCl + O 2↑ 14、工业制漂白粉的原理及漂白粉的失效 2Ca(OH)2 + 2Cl 2 =Ca(ClO)2 + CaCl 2 + 2H 2O 2Ca(OH)2 +2Cl 2 =2Ca 2++2ClO -+2Cl -+2H 2OCa(ClO)2+CO 2+H 2O =CaCO 3↓+2HClO 2HClO 2HCl + O 2↑Ca 2++2ClO -+ CO 2 + H 2O =CaCO 3↓+ 2HClO 15、氯气的实验室制法:(仪器:分液漏斗,圆底烧瓶) MnO 2 +4HCl(浓) MnCl 2+Cl 2↑+2H 2O MnO 2 +4H ++2Cl-Mn 2++Cl 2↑+2H 2O16、新制氯水注入盛溴化钠溶液的试管中Cl 2 + 2NaBr = Br 2 + 2NaCl光照光照Cl2+2Br-=Br2+2Cl-17、铁与硫加热反应Fe +S FeS铁与氧气加热反应3Fe+2O2Fe3O4铁在氯气中加热反应2Fe+3Cl22FeCl318、硫化亚铁与稀盐酸反应FeS +2HCl =FeCl2+H2S↑FeS +2H+=Fe2++H2S↑19、硫酸工业制法黄铁矿(FeS2):4FeS2+11O28SO2+2Fe2O3二氧化硫制三氧化硫(无色固体,熔点16.8℃)2SO2+O2催化剂加热2SO3吸收塔中(98%的浓硫酸):SO3+H2O=H2SO420、铜与浓硫酸反应:Cu+2H2SO4 (浓)CuSO4 +2H2O+SO2 ↑21、碳与浓硫酸反应:C+2H2SO4(浓)2H2O+CO2↑+2SO2↑22、工业制单质硅(碳在高温下还原二氧化硅)SiO2+2C 高温Si +2CO↑23、二氧化硅与氢氧化钠反应SiO2+2NaOH =Na2SiO3+H2O SiO2+2OH -=SiO32-+H2O 24、氮气和氢气反应(工业合成氨)N2+3H2催化剂高温高压2NH325、氮气和氧气放电下反应(雷雨发庄稼)N2+O2 2NO2NO +O22NO2二氧化氮溶于水放电3NO 2+H2O 2HNO3+NO3NO 2+H2O 2H++2NO3-+NO 26、HNO3与Fe的反应Al、Fe遇浓HNO3、浓硫酸钝化(常温)Fe与浓HNO3加热Fe+6HNO3△Fe(NO3)3+3NO2↑+3H2OFe与稀HNO3反应Fe+4HNO3=Fe(NO3)3+NO↑+2H2O3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O27、NO2、O2的混合气通入水中无剩余气体4NO2+O2+2H2O =4 HNO328、NO 、O2的混合气通入水中无剩余气体4NO+3O2+2H2O =4 HNO329、五氧化二磷与热水反应P2O5+3H2O(热)=2H3PO430. 磷在氯气中燃烧2P +3Cl2点燃2PCl3(白色烟雾)2P +5Cl2点燃2PCl531. 氨的催化氧化4NH3+5O24NO +6H2O32. 碳酸氢铵受热分解NH4HCO3△NH3↑+H2O↑ +CO2↑33. 用浓盐酸检验氨气(白烟生成)HCl +NH3=NH4Cl34. 硫酸铵溶液与氢氧化钠溶液混合加(NH4)2SO4+2NaOH △3↑+Na2SO4+2H2ONH4++OH -△NH3↑+H2O35. 硝酸铵溶液与氢氧化钠溶液混合(不加热)NH4NO3+NaOH =NH3·H2O +NaNO3 NH4++OH-=NH3·H2O 36. 铝箔在氧气中剧烈燃烧4Al +3O2点燃2Al2O337. 铝片与稀盐酸反应2Al +6HCl =2AlCl3+3H2↑2Al +6H+=2Al3++3H2↑38. 铝与氢氧化钠溶液反应2Al+2NaOH +2H2O =2NaAlO2+3H2↑2Al +2OH -+2H2O =2AlO2-+3H2↑39. 铝与三氧化二铁高温下反应(铝热反应)2Al +Fe2O3高温2Fe +Al2O340. 镁在二氧化碳中燃烧2Mg +CO2点燃2MgO +C41. 氧化铝溶于氢氧化钠溶液Al 2O3+2NaOH 2NaAlO2+H2OAl2O3+2OH -=2AlO2-+H2O42. 硫酸铝溶液中滴过量氨水Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+3(NH4)2SO4Al3++3 NH3·H2O =Al(OH)3↓+3NH4+43. ①氢氧化铝溶液中加盐酸Al(OH)3+3HCl =AlCl3+3H2OAl(OH)3+3H+=Al3++3H2O②Al(OH)3与NaOH溶液反应:Al(OH)3+NaOH NaAlO2+2 H2O Al(OH)3+OH-=AlO2-+2 H2O44. 高温下铁与水反应3Fe +4H2O(g) 高温Fe3O4+4H245. 铁与盐酸反应Fe +2HCl =FeCl2+H2↑Fe +2H+=Fe2++H2↑46. 氧化铁溶于盐酸中Fe2O3+6HCl =2FeCl3+3H2OFe2O3+6H+=2Fe3++3H2O47. 氯化铁中滴入氢氧化钠溶液(红褐色沉淀)FeCl3+3NaOH =Fe(OH)3↓+3NaCl Fe3++3OH -=Fe(OH)3↓48. 氢氧化亚铁在空气中被氧化(白色沉淀变为红褐色沉淀) 4Fe (OH)2 + O 2 + 2H 2O = 4Fe (OH)3 49. 氯化亚铁溶液中通入氯气 2FeCl 2 + Cl 2 = 2FeCl 3 2 Fe 2++ Cl 2 = 2 Fe 3++ 2Cl - 50. 氯化铁溶液中加入铁粉2FeCl 3 + Fe = 3FeCl 22Fe3++ Fe = 3Fe 2+51. 甲烷与氯气取代生成四氯化碳 CH 4 + 4Cl 2CCl 4 + 4HCl52. 乙烯实验室制法(浓硫酸作催化剂,脱水剂) CH 3CH 2OH H 2O + CH 2=CH 2 ↑ 53. 乙烯通入溴水中CH 2=CH 2 + Br 2 CH 2BrCH 2Br54. 制取聚乙烯、聚丙烯n CH 2=CH 2催化剂n CH 3–CH=CH 2催化剂CH 3 55. 乙炔的制取 CaC 2 + 2H 2OCa(OH)2 + ↑ 56. 由乙炔制聚氯乙烯+ HCl H 2C=CHCln H 2C=CHCl催化剂57. 苯与液溴反应(需铁作催化剂) +Br 2 +HBr58. 苯的硝化反应+ HNO 3 + H 2O 59. 苯与氢气加成生成环己烷浓H 2SO 4 170℃2-CH 2 nCH -CH 2 nFe浓H 2SO 4 55-60NO 2OH| 催化剂△ CH -CH 2nHC ≡CH HC ≡CH+ 3H 2催化剂 △60. 甲苯发生硝化反应 +3HONO 2浓硫酸 △+3H 2O61. 溴乙烷水解 CH 3CH 2Br + H 2OCH 3CH 2OH + HBr62. 溴乙烷消去反应CH 3CH 2Br +NaOH +NaBr + H 2O63. 乙醇与钠反应 2CH 3CH 2OH + 2Na 2CH 3CH 2ONa + H 2↑64. 乙醇催化氧化2CH 3CH 2OH + O 2 2CH 3CHO + 2H 2O65. 苯酚与氢氧化钠溶液反应+ NaOH +H 2O 66. 苯酚钠溶液中通入二氧化碳+ CO 2 + H 2O+NaHCO 367. 苯酚的定性检验定量测定方法:+3Br 2 ↓+ 3HBr68. 丙醛制1-丙醇 CH 3CH 2CHO + H 2催化剂 △CH 3CH 2CH 2OH69. 乙醛制乙酸 2CH 3CHO + O 2催化剂 △2CH 3COOH70. 乙醛的银镜反应CH 3CHO + 2[Ag(NH 3)2]OH H 2O + 2Ag↓+ 3NH 3 ↑ + CH 3COONH 471. 乙醛与新制氢氧化铜悬浊液CH 3 ––NO 2| NO 2O 2N –– CH 3| NaOH △醇 △CH 2 =CH 2 Cu △—OH —ONa—ONa—OH ––Br |BrBr –– OH | —OHCH 3CHO + 2Cu(OH)2 Cu 2O ↓+ 2H 2O + CH 3COOH72. *乙酸与氢氧化铜悬浊液2CH 3COOH + Cu(OH)2 = (CH 3COO)2Cu + 2H 2O 73. 乙酸乙酯制取(用饱和碳酸钠溶液收集)CH 3COOH + CH 3CH 2OH CH 3COOC 2H 5 + H 2O74. 葡萄糖结构简式CH 2OH─CHOH─CHOH─CHOH─CHOH─CHO75. 蔗糖水解方程式 C 12H 22O 11 + H 2O催化剂C 6H 12O 6 + C 6H 12O 6蔗糖 葡萄糖 果糖 76. 淀粉水解(C 6H 10O 5)n + nH 2O催化剂nC 6H 12O 6淀粉 葡萄糖 77. 硬脂酸甘油酯皂化反应+3NaOH3 +C 17H 35COONa浓硫酸△CH 2–OH|CH –OH | CH 2–OHC 17H 35COO─CH 2C 17H 35COO─CHC 17H 35COO─CH 2。
初中化学方程式
初中化学方程式通常是指初中化学教材中所涉及的化学反应方程式。
下面是一些常见的初中化学方程式示例:
1. 金属与酸的反应:
金属+ 酸→ 相应的金属盐+ 氢气
例如:镁+ 硫酸→ 硫酸镁+ 氢气
2. 金属与非金属的反应:
金属+ 非金属→ 金属盐
例如:钠+ 氯→ 氯化钠
3. 酸与碱的反应:
酸+ 碱→ 相应的盐+ 水
例如:硫酸+ 钠氢氧化物(氢氧化钠)→ 硫酸钠+ 水
4. 燃烧反应:
烃(烷烃或烯烃)+ 氧气→ 二氧化碳+ 水
例如:甲烷+ 氧气→ 二氧化碳+ 水
5. 酸与碳酸盐的反应:
酸+ 碳酸盐→ 相应的盐+ 二氧化碳+ 水
例如:盐酸+ 碳酸钠→ 氯化钠+ 二氧化碳+ 水
这些是初中化学中常见的反应方程式示例,通过学习这些方程式,学生可以理解化学反应的基本原理和能量变化。
需要注意的是,这里只是给出了一些基本的方程式示例,实际化学反应可能更加复杂,具体的反应方程式需要根据实验或理论计算得出。
高中化学方程式大全一、非金属单质(F2,Cl2,O 2,S,N2,P,C,Si,H)1、氧化性:F2+H2===2HF (阴暗处爆炸)F2+Xe(过量)==XeF22F2(过量)+Xe==XeF4 (XeF4是强氧化剂,能将Mn2+氧化为MnO4–)nF2+2M===2MFn(M表示大部分金属)2F2+2H2O===4HF+O2 (水是还原剂)2F2+2NaOH===2NaF+OF2+H2OF2+2NaCl===2NaF+Cl2F2+2NaBr===2NaF+Br2F2+2NaI===2NaF+I27F2(过量)+I2===2IF 7F2+Cl2(等体积)===2ClF (ClF属于类卤素:ClF+H2O==HF+HClO )3F2(过量)+Cl2===2ClF3 (ClF3+3H2O==3HF+HClO3 )Cl2+H 22HCl (将H2在Cl2点燃;混合点燃、加热、光照发生爆炸) 3Cl2+2P 2PCl3Cl2+PCl3PCl5Cl2+2Na2NaCl3Cl2+2Fe2FeCl3Cl2+Cu CuCl2Cl2+2FeCl2===2FeCl3 (在水溶液中:Cl2+2Fe 2+===2Fe3++3Cl-)Cl 2+2NaBr===2NaCl+Br2Cl2+2Br-=2Cl -+Br2Cl2+2KI===2KCl+I2Cl2+2I-=2Cl-+I23Cl2(过量)+2KI+3H2O===6HCl+KIO3 3Cl2+I–+3H2O=6H++6Cl–+IO3–5Cl2+I2+6H2O===2HIO3+10HCl 5Cl2+I2+6H2O=10Cl–+IO3–+12H+Cl2+Na2S===2NaCl+S↓Cl2+S2–=2Cl–+S↓Cl2+H2S===2HCl+S↓ (水溶液中:Cl2+H2S=2H++2Cl–+S↓Cl2+SO2+2H2O===H2SO4+2HCl Cl2+SO2+2H2O=4H++SO42–+2Cl–Cl2+H2O2===2HCl+O2Cl2+H2O2=2H++Cl–+O22O2+3Fe Fe3O4O2+K===KO2S+H2H2S 2S+C CS2S+Zn ZnSS+Fe FeS (既能由单质制取,又能由离子制取)S+2Cu Cu2S (只能由单质制取,不能由离子制取)3S+2Al Al2S3 (只能由单质制取,不能由离子制取)N2+3H2催化剂高温高压2NH3N2+3Mg Mg3N2N2+3Ca Ca3N2N2+3Ba Ba3N2N2+6Na2Na3N N2+2Al2AlNH2+2Li2LiH2、还原性S+O2SO2S+H2SO4(浓)3SO2↑+2H2OS+6HNO3(浓)H2SO4+6NO2↑+2H2O S+4H++6==6NO2↑+2H2O+-24SO3S+4HNO3(稀)3SO2+4NO↑+2H2O 3S+4H++4-3NO3SO2+4NO↑+2H2O N2+O2 2NO4P+5O2P4O10(常写成P2O5)2P+3X22PX3(X表示F2,Cl2,Br2) PX3+X2 PX5P4+20HNO3(浓)4H3PO4+20NO2↑+4H2OC+2F2CF4C+2Cl2CCl4C+O2(足量)CO2 2C+O2(少量)2COC+CO22CO C+H2O CO+H2(生成水煤气)2C+SiO2Si+2CO(制得粗硅)Si(粗)+2Cl2SiCl4 (SiCl4+2H2===Si(纯)+4HCl)Si(粉)+O2SiO2Si+C SiC(金刚砂)Si+2NaOH+H2O==Na2SiO3+2H2↑(Si+2OH-+H2O=-23SiO+2H2↑)3、歧化反应Cl2+H2O==HCl+HClO(加碱或光照促进歧化:(Cl2+H2O H++Cl–+HClO)Cl2+2NaOH==NaCl+NaClO+H2O (Cl2+2OH–=Cl–+ClO–+H2O)Cl2+2Ca(OH)2==CaCl2+Ca(ClO)2+2H2O (Cl2+2OH–=Cl–+ClO–+H2O)3Cl2+6KOH(浓)5KCl+KClO3+3H2O (3Cl 2+6OH–5Cl–+ClO3–+3H2O) 3S+6NaOH2Na2S+Na2SO3+3H2O (3S+6OH–2S2–+SO32–+3H2O)4P+3KOH(浓)+3H2O==PH3↑+3KH2PO2(4P+3OH–+3H2O==PH3↑+3H2PO2–) 11P+15CuSO4+24H2O==5Cu3P+6H3PO4+15H2SO43C+CaO CaC2+CO↑3C+SiO2SiC+2CO↑二.金属单质(Na,Mg,Al,Fe,Cu )的还原性2Na+H22NaH 4Na+O2==2Na2O 2Na 2O+O22Na2O 22Na+O2Na2O2 2Na+S==Na2S(爆炸)2Na+2H2O==2NaOH+H2↑2Na+2H2O=2Na++2OH―+H2↑2Na+2NH3==2NaNH2+H2↑2Na+2NH3=2Na++2NH2―+H2↑4Na+TiCl44NaCl+Ti Mg+Cl2MgCl 2Mg+Br2MgBr 22Mg+O 22MgO Mg+S MgS2Cu+S Cu2S (Cu2S只能由单质制备) Mg+2H2O Mg(OH)2+H2↑2Mg+TiCl4Ti+2MgCl2Mg+2RbCl MgCl2+2Rb2Mg+CO22MgO+C 2Mg+SiO22MgO+SiMg+H2S==MgS+H2Mg+H2SO4==MgSO4+H2↑(Mg+2H+=Mg2++H2↑)2Al+3Cl22AlCl34Al+3O2===2Al2O3 (常温生成致密氧化膜而钝化,在氧气中燃烧)4Al(Hg)+3O2+2xH2O===2(Al2O3.xH2O)+4Hg(铝汞齐)4Al+3MnO22Al2O3+3Mn 2Al+Cr2O3Al2O3+2Cr (铝热反应)2Al+Fe 2O3Al2O3+2Fe 2Al+3FeO Al2O3+3Fe2Al+6HCl===2AlCl3+3H2↑2Al+6H+=2Al3++3H2↑2Al+3H2SO4===Al2(SO4)3+3H2↑2Al+6H+=2Al3++3H2↑2Al+6H2SO4(浓)===Al2(SO4)3+3SO2+6H2O (Al,Fe在冷,浓的H2SO4,HNO3中钝化) Al+4HNO3(稀)===Al(NO3)3+NO↑+2H2O Al+4H++NO3–=Al3++NO↑+2H2O2Al+2NaOH+2H2O===2NaAlO2+3H2↑2Al+2OH–+2H2O=2AlO2–+3H2↑2Fe+3Br2===2FeBr 33Fe+2O2 Fe3O42Fe+O22FeO (炼钢过程)Fe+I2FeI2Fe+S FeS (FeS既能由单质制备,又能由离子制备)3Fe+4H2O(g)Fe3O4+4H2↑Fe+2HCl===FeCl2+H2↑Fe+2H+=Fe2++H2↑Fe+CuCl2===FeCl2+Cu Fe+Cu2+=Fe2++Cu↓Fe+SnCl4===FeCl2+SnCl2(铁在酸性环境下,不能把四氯化锡完全还原为单质锡Fe+SnCl2==FeCl2+Sn↓Fe+Sn2+=Fe2++Sn↓三.非金属氢化物(HF,HCl,H2O,H2S,NH3) 金属氢化物(NaH)1、还原性:4HCl(浓)+MnO 2MnCl 2+Cl 2↑+2H 2O 4H ++2Cl –+MnO 2Mn 2++Cl 2↑+2H 2O4HCl(浓)+PbO 2PbCl 2+Cl 2↑+2H 2O 4H ++2Cl –+PbO 2Pb 2++Cl 2↑+2H 2O 4HCl(g)+O 22Cl 2+2H 2O16HCl+2KMnO 4===2KCl+2MnCl 2+5Cl 2↑+8H 2O 16 H ++10Cl -+2MnO 4–=2Mn 2++5Cl 2↑+8H 26HCl+KClO 3==KCl+3Cl 2↑+3H 2O 6H ++5Cl –+ClO 3–=3Cl 2↑+3H 2O14HCl+K 2Cr 2O 7===2KCl+2CrCl 3+3Cl 2↑+7H 2O 14H ++6Cl –+Cr 2O 72–=2Cr 3++5Cl 2↑+7H 2O 2H 2O+2F 2===4HF+O 22HCl+F 2=2HF+Cl 2 (F 2气与HCl 、HBr 、HI 、H 2S 、NH 3气体不能共存) 2HBr+Cl 2=2HCl+Br 2 (Cl 2气与HBr 、HI 、H 2S 、NH 3气体不能共存) 2H 2S+3O 2(足量)2SO 2+2H 2O 2H 2S+O 2(少量)2S ↓+2H 2O2H 2S+SO 2===3S ↓+2H 2O H 2S+H 2SO 4(浓)===S ↓+SO 2↑+2H 2O3H 2S+2HNO 3(稀)===3S ↓+2NO ↑+4H 2O 3H 2S+2H ++2NO 3–=3S ↓+2NO ↑+4H 2O5H 2S+2KMnO 4+3H 2SO 4===2MnSO 4+K 2SO 4+5S ↓+8H 2O 5H 2S+2MnO 4–+6H +=2Mn 2++5S ↓+8H 2O 3H 2S+K 2Cr 2O 7+4H 2SO 4===Cr 2(SO 4)3+K 2SO 4+3S ↓+7H 2O3H 2S+Cr 2O 72–+8H +===2Cr 3++3S ↓+7H 2OH 2S+4Na 2O 2+2H 2O===Na 2SO 4+6NaOH H 2S+4Na 2O 2+2H 2O=8Na ++-24SO +-OH 2NH 3+3CuO3Cu+N 2+3H 2O2NH 3+3Cl 2===N 2+6HCl 8NH 3+3Cl 2===N 2+6NH 4ClNH 3+NaNO 2+HCl==NaCl+N 2↑+2H 2O NH 3+NO 2–+H +=N 2↑+2H 2O 4NH 3+3O 2(纯氧)2N 2+6H 2O4NH 3+5O 2 催化剂△ 4NO+6H 2O 4NH 3+6NO===5N 2+6H 2O (用氨清除NO)NaH+H 2O===NaOH+H 2↑ (生氢剂) NaH+H 2O=Na ++OH –+H 2↑ 4NaH+TiCl 4Ti+4NaCl+2H 2↑ CaH 2+2H 2O=Ca(OH)2↓+2H 2↑2、酸性:4HF+SiO 2===SiF 4+2H 2O (可测定矿样或钢样中SiO 2的含量,玻璃雕刻) 4HF+Si===SiF 4+2H 2↑2HF+CaCl 2===CaF 2+2HCl H 2S+Fe===FeS ↓+H 2↑H 2S+CuCl 2===CuS ↓+2HCl (弱酸制强酸的典型反应) H 2S+Cu 2+=CuS ↓+2H +H 2S+2AgNO 3===Ag 2S ↓+2HNO 3 H 2S+2Ag +=Ag 2S ↓+2H +H 2S+HgCl 2===HgS ↓+2HCl H 2S+Hg 2+=HgS ↓+2H +H 2S+Pb(NO 3)2===PbS ↓+2HNO 3 (铅试纸检验空气中H 2S) H 2S+Pb 2+=PbS ↓+2H +H 2S+2Ag===Ag 2S+H 2↑(银器在空气中变黑的原因)2NH 3(液)+2Na==2NaNH 2+H 2↑ (NaNH 2+H 2O===NaOH+NH 3↑) 3、NH 3的碱性:NH 3+HX===NH 4X (X :F 、Cl 、Br 、I 、S)NH 3+HNO 3===NH 4NO 3 NH 3+H +=NH 4+2NH 3+H 2SO 4===(NH 4)2SO 4 NH 3+H +=NH 4+NH 3+NaCl+H 2O+CO 2===NaHCO 3+NH 4Cl (侯德榜制碱:用于工业制备小苏打,苏打)NH 3+H 2S==NH 4HS NH 3+H 2S=NH 4++HS -4、不稳定性: 2HFH 2+F 22HClH 2+Cl 22H 2O 2H 2+O 2 2H 2O 2===2H 2O+O 2 H 2SH 2+S2NH 3催化剂N 2+3H 22HIH 2+I 2四.非金属氧化物(SO 3、SO 2、N 2O 、NO 、N 2O 3、NO 2、N 2O 4、N 2O 5、CO 、CO 2、SiO 2、P 2O 3、P 2O 5、Cl 2O 、Cl 2O 3、Cl 2O 5、Cl 2O 7、ClO 2) 1、低价态的还原性:(SO 2、CO 、NO)2SO 2+O 2+2H 2O===2H 2SO 4(这是SO 2在大气中缓慢发生的环境化学反应) 2SO 2+O 2催化剂 加热2SO 3 SO 2+NO 2===SO 3+NOSO 2+Cl 2+2H 2O===H 2SO 4+2HCl Cl 2+SO 2+2H 2O=4H ++SO 42–+2Cl –SO 2+Br 2+2H 2O===H 2SO 4+2HBr Br 2+SO 2+2H 2O=4H ++SO 42–+2Br –SO 2+I 2+2H 2O===H 2SO 4+2HI I 2+SO 2+2H 2O=4H ++SO 42–+2I –2NO+O 2===2NO 2NO+NO 2+2NaOH===2NaNO 2(用于制硝酸工业中吸收尾气中的NO 和NO 2).* NO+NO2+2OH–=2NO2–2CO+O22CO2CO+CuO Cu+CO23CO+Fe2O32Fe+3CO2CO+H2O 催化剂加热CO2+H22、氧化性:SO2+2H2S===3S+2H2OSO3+2KI K 2SO3+I2NO2+2KI+H2O===NO+I2+2KOH(不能用淀粉KI溶液鉴别溴蒸气和NO2)4NO2+H2S===4NO+SO3+H2O2NO2+Cu4CuO+N2N2O+Zn ZnO+N2CO2+2Mg2MgO+C (CO2不能用于扑灭由Mg,Ca,Ba,Na,K等燃烧的火灾)SiO2+2H2Si+2H2O SiO2+2Mg2MgO+Si3、与水的作用:SO2+H2O===H2SO3SO3+H2O===H2SO4SO3+H2O=2H++SO42–3NO2+H2O===2HNO3+NO (NO2不是硝酸的酸酐)N2O5+H2O===2HNO3N2O5+H2O=2H++2NO3–P2O5+H2O(冷水)===2HPO3P2O5+3H2O(热水)===2H3PO4 (P2O5极易吸水,可作气体干燥剂)P2O5+3H2SO4(浓)===2H3PO4+3SO3CO2+H2O===H2CO3Cl2O+H2O==2HClOCl2O7+H2O==2HClO4 Cl2O7+H2O=2H++2ClO4–4、与碱性物质的作用:SO2+2NH3+H2O===(NH4)2SO3SO2+(NH4)2SO3+H2O===2NH4HSO32NH4HSO3+H2SO4===(NH4)2SO4+2H2O+2SO2↑(硫酸工业尾气处理)SO2+Ca(OH)2===CaSO3↓+H2O (不能用澄清石灰水鉴别SO2和CO2.可用品红鉴别) SO3+MgO===MgSO4SO3+Ca(OH)2===CaSO4↓+H2OCO2+NH3+H2O===NH4HCO3CO2+2NH3(过量)+H2O===(NH4)2CO3 (NH4)2CO3(NH2)2CO+2H2OCO2+2NH3(NH2)2CO+H2O (工业制取尿素)CO2+2NaOH(过量)==Na2CO3+H2O 2OH-+CO2=CO32–+H2OCO2(过量)+NaOH==NaHCO3OH-+CO2=HCO3–CO2+Ca(OH)2(过量)==CaCO3+H2O Ca2++2OH+CO2=CaCO3↓+H2O2CO2(过量)+Ca(OH)2==Ca(HCO3)2OH―+CO2=HCO3–CO2+CaCO3+H2O==Ca(HCO3)2CO2+CaCO3+H2O=Ca2++2HCO3–CO2(不足)+2NaAlO2+3H2O===2Al(OH)3↓+Na2CO3CO2+3H2O+AlO2–=Al(OH)3↓+CO32–CO2(足)+NaAlO2+2H2O===Al(OH)3↓+NaHCO3CO2+2H2O+AlO2–=Al(OH)3↓+HCO 3–CO2+C6H5ONa+H2O===C6H 5OH↓+NaHCO3CO2+C6H5O―+H2O=C6H5OH↓+HCO3–SiO2+CaO CaSiO3 (炼钢造渣)SiO2+2NaOH===Na2SiO3+H2O(常温下强碱缓慢腐蚀玻璃)SiO2+Na2CO3Na2SiO3+CO2 (制取玻璃)SiO2+CaCO3CaSiO3+CO2 (制取玻璃)2NO2+2NaOH==NaNO2+NaNO3+H2O2NO2+2OH―=NO3–+NO2―+H2ONO+NO2+2NaOH==2NaNO2+H2O (制取硝酸工业尾气吸收)NO+NO2+2OH―=2NO3–+H2O 五.金属氧化物1、低价态的还原性:6FeO+O2===2Fe3O4FeO+4HNO3===Fe(NO3)3+NO2+2H2O FeO+4H++NO3―=Fe3++NO2↑+2H2O2、氧化性:Na2O2+2Na2Na2O(此反应用于制备Na2O)MgO,Al2O3几乎没有氧化性,很难被还原为Mg,Al.一般通过电解制Mg和Al. Fe2O3+3H22Fe+3H2O(制还原铁粉)Fe3O4+4H23Fe+4H2O CuO+H2Cu+H2O2Fe3O4+16HI==6FeI2+8H2O+2I22Fe3O4+16H++4I―=6Fe2++8H 2O+2I2Fe2O3+Fe 3FeO (炼钢过程中加入废钢作氧化剂)FeO+C Fe+CO (高温炼钢调节C含量)2FeO+Si2Fe+SiO2 (高温炼钢调节Si含量)3、与水的作用:Na2O+H2O==2NaOH Na2O+H2O=2Na++2OH–2Na2O2+2H2O===4NaOH+O2↑2Na2O2+2H2O=4Na++4OH–+O2↑(此反应分两步:Na2O2+2H2O===2NaOH+H2O2;2H2O2===2H2O+O2 H2O2的制备可利用类似的反应:BaO2+H2SO4(稀)===BaSO4+H2O2)MgO+H2O===Mg(OH)2(缓慢反应)4、与酸性物质的作用:Na2O+SO3==Na2SO4Na2O+CO2==Na2CO3MgO+SO3===MgSO4Na2O+2HCl==2NaCl+H2O Na2O+2H+=2Na++H2O2Na2O2+2CO2==2Na2CO3+O2↑Na2O2+H2SO4(冷,稀)===Na2SO4+H2O2MgO+H2SO4===MgSO4+H2O MgO+2H+=Mg2++H2OAl2O3+3H2SO4===Al2(SO4)3+3H2O Al2O3+6H+=2Al3++3H2OAl2O3+2NaOH===2NaAlO2+H2O (Al2O3两性氧化物)Al2O3+2OH―=2AlO2―+H2OFeO+2HCl===FeCl2+H2O FeO+2H+=Fe2++H2OFe2O3+6HCl===2FeCl3+3H2O Fe2O3+6H+=2Fe3++3H2OFe3O4+8HCl===FeCl2+2FeCl3+4H2O Fe3O4+8H+=2Fe3++Fe2++4H2O六.含氧酸1、氧化性: 4HClO3+3H2S===3H2SO4+4HCl ClO3–+3H2S=6H++SO42–+Cl–HClO3+HI===HIO3+HCl ClO3–+I–=IO3–+Cl–3HClO+HI===HIO3+3HCl 3HClO+I-=IO3–+3H++Cl–HClO+H2SO3===H2SO4+HCl HClO+H2SO3=3H++SO42–+Cl–HClO+H2O2===HCl+H2O+O2↑HClO+H2O2=H++Cl–+H2O+O2↑(氧化性:HClO>HClO2>HClO3>HClO4,但浓,热的HClO 4氧化性很强)2H2SO4(浓)+C CO2↑+2SO2↑+2H2O2H2SO4(浓)+S3SO2↑+2H2OH2SO 4+Fe(Al)室温下钝化 6H2SO4(浓)+2Fe Fe2(SO4)3+3SO2↑+6H2O2H2SO4(浓)+Cu CuSO4+SO2↑+2H2OH2SO4(浓)+2HBr===SO2↑+Br2+2H2O (不能用浓硫酸与NaBr制取HBr)H2SO4(浓)+2HI===SO2↑+I2+2H2O (不能用浓硫酸与NaI制取HI)H2SO4(稀)+Fe===FeSO4+H2↑2H++Fe=Fe2++H2↑H2SO3+2H2S===3S↓+3H2O4HNO3(浓)+C CO2↑+4NO 2↑+2H2O6HNO3(浓)+S H2SO4+6NO2↑+2H2O6HNO3(浓足)+Fe===Fe(NO3)3+3NO2↑+3H2O4HNO3(浓)+Fe(足)===Fe(NO3)2+NO2↑+2H2O(先得Fe3+,在Fe过量时再生成Fe2+的盐) 4HNO3(稀足)+Fe===Fe(NO3)3+NO↑+2H2O 4H++NO3-+Fe=Fe3++NO↑+2H2O30HNO3+8Fe===8Fe(NO3)3+3N2O↑+15H2O 30 H++6NO3–+8Fe=8Fe3++3N2O↑+15H2O36HNO3+10Fe===10Fe(NO3)3+3N2↑+18H2O 36H++6NO3–+10Fe=8Fe3++3N2↑+18H2O30HNO3+8Fe===8Fe(NO3)3+3NH4NO3+9H2O 30 H++3NO3–+8Fe=8Fe3++3NH4++9H2O4Zn+10HNO3(稀)==4Zn(NO3)2+N2O↑+5H2O 4Zn+10H++2NO3–=4Zn2++N2O↑+5H2O4Zn+10HNO3(稀)==4Zn(NO3)2+NH4NO3+3H2O 4Zn+10H++NO3–=4Zn2++NH4++5H2O2、还原性:H2SO3+X2+H2O===H2SO4+2HX (X表示Cl2,Br2,I2) H2SO3+X2+H2O=4H++SO42-+X–2H2SO3+O2==2H2SO42H2SO3+O2=4H++SO42-H2SO3+H2O2===H2SO4+H2O H2SO3+H2O2=2H++SO42–+H2O5H2SO3+2KMnO4===2MnSO4+K2SO4+2H2SO4+3H2O 5H2SO3+2MnO4–=2Mn2++4H++3SO42–+3H2OH2SO3+2FeCl3+H2O===H2SO4+2FeCl2+2HCl H2SO3+2Fe3++H2O=4H++2Fe2+ +SO42–3、酸性:H2SO4(浓)+CaF2 CaSO4+2HF↑(不挥发性酸制取挥发性酸)H2SO4(浓)+NaCl NaHSO4+HCl↑(不挥发性酸制取挥发性酸)H2SO4(浓)+2NaCl Na2SO4+2HCl↑(不挥发性酸制取挥发性酸) H2SO4(浓)+NaNO3NaHSO4+HNO3↑(不挥发性酸制取挥发性酸)3H2SO 4(浓)+Ca3(PO4)23CaSO4+2H3PO4(强酸制弱酸酸)2H2SO 4(浓)+Ca3(PO4)22CaSO4+Ca(H2PO4)2 (工业制磷肥)2HNO3+CaCO3==Ca(NO3)2+H2O+CO2↑2H++CaCO3=Ca2++H2O+CO2↑(用HNO3和浓H2SO4不能制备H2S,HI,HBr, SO2等还原性气体)4H 3PO4+Ca3(PO4)2 3Ca(H2PO4)2 (重钙)H3PO4(浓)+NaBr NaH2PO4+HBr↑ (不挥发性酸制取挥发性酸,磷酸是非氧化性酸)H3PO4(浓)+NaI NaH2PO4+HI↑4、不稳定性:2HClO2HCl+O2↑(保存在棕色瓶中)4HNO34NO2↑+O2↑+2H2O (保存在棕色瓶中)H2SO3H2O+SO2↑ (在加热或酸性条件下分解)H2CO3H2O+CO 2↑ (在加热或酸性条件下分解)H4SiO4H 2SiO3+H2O H2SiO3 SiO2↓+H2OH2S2O3H2O+S↓+SO2↑(在加热或酸性条件下分解)七.碱1、低价态的还原性:4Fe(OH)2+O2+2H2O===4Fe(OH)32、与酸性物质的作用:2NaOH+SO2(少量)==Na2SO3+H2O OH–+SO2=SO32–+H2ONaOH+SO2(足)==NaHSO3OH-+SO2(足)=HSO3–2NaOH+SiO2==Na2SiO3+H2O OH-+SiO2=SiO32–+H2O2NaOH+Al2O3==2NaAlO2+H2O 2OH-+Al2O3=2AlO2–+H2O2KOH+Cl2==KCl+KClO+H2O Cl2+2OH–=Cl–+ClO–+H2O NaOH+HCl==NaCl+H2O H++OH =H2ONaOH+H2S(足)==NaHS+H2O OH–+H2S=HS–+H2O2NaOH+H2S(少量)==Na2S+2H2O 2OH–+H2S=S2–+2H2O3NaOH+AlCl3==Al(OH)3↓+3NaCl 3OH–+Al3+=Al(OH)3↓NaOH+Al(OH)3==NaAlO2+2H2O OH–+Al(OH)3=AlO 2–+2H2OCa(OH)2+2NH4Cl2CaCl2+2NH3↑+2H 2O (实验室制NH3)NaOH+NH4Cl NaCl+NH3↑+H2OMg(OH)2+2NH4Cl==MgCl2+2NH3·H2O (Al(OH)3+NH4Cl不溶解)Ba(OH)2+H2SO4==BaSO4↓+2H2O 2H++2OH–+Ba2++SO42–=BaSO4↓2H2O3、不稳定性:Mg(OH)2MgO+H2O 2Al(OH)3Al2O3+3H2O2Fe(OH)3Fe2O3+3H2O Cu(OH)2CuO+H2O 2AgOH==Ag2O+H2O八.盐1、氧化性:(在水溶液中)2FeCl3+Fe==3FeCl22Fe3++Fe=3Fe2+2FeCl3+Cu===2FeCl2+CuCl2 (用于雕刻铜线路版) 2Fe3++Cu=2Fe2++Cu2+2FeCl3+Zn(少量)===2FeCl2+ZnCl22Fe3++Zn=2Fe2++Zn2+FeCl3+Ag===FeCl2+AgCl↓2Fe3++Cl-+2Ag=2Fe2++2AgCl↓Fe2(SO4)3+2Ag===FeSO4+Ag2SO4↓(较难反应) Fe(NO3)3+Ag不反应2FeCl3+H2S===2FeCl2+2HCl+S↓2Fe3++H2S=2Fe2++2H++S↓2FeCl3+2KI===2FeCl2+2KCl+I22Fe3++2I-=2Fe2++I2FeCl2+Mg===Fe+MgCl2Fe2++Mg=Fe+Mg2+NaNO2+NH4Cl==NaCl+N2↑+2H2O (实验室制氮气) NH4++NO2-=N2↑+2H2O2、还原性:2FeCl2+3Cl2===2FeCl3 (在水溶液中不需加热) 2Fe2++3Cl2=2Fe3++6Cl-3Na2S+8HNO3(稀)===6NaNO3+2NO↑+3S+4H2O 3S2-+8H++2NO3-=2NO↑+3S+4H2O3Na2SO3+2HNO3(稀)===3Na2SO4+2NO↑+H2O 3SO32-+2H++2NO3-=3SO42-+2NO↑+H2O2Na2SO3+O2===2Na2SO4 (Na 2SO3在空气中易变质)Na2SO3+S Na2S2O3Na2S+Cl2==2NaCl+S↓(在水溶液中) S2-+Cl2=2Cl-+S↓3、与碱性物质的作用:Ca(OH)2+CuSO4==Cu(OH)2↓+CaSO4↓ (波尔多液)MgCl2+2NH3·H2O===Mg(OH)2↓+2NH4Cl Mg2++2NH3·H2O=Mg(OH)2↓+2NH4+AlCl3+3NH3·H2O===Al(OH)3↓+3NH4Cl Al3++3NH3·H2O=Al(OH)2↓+3NH4+FeCl3+3NH3·H2O===Fe(OH)3↓+3NH4Cl Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+CuSO4+2NH3·H2O(不足)==Cu(OH)2↓+(NH4)2SO4Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+ Cu(OH)2+4NH3·H2O=Cu(NH3)4(OH)2+4H2OCu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O铜氨溶液CuSO4+4NH3·H2O(足)==Cu(NH3)4SO4+4H2O 总方程式Cu2++4NH3·H2O=[Cu(NH3)4]2++4H2O铜氨溶液AgNO3+NH3·H2O==AgOH↓+NH4NO3 2AgOH=Ag2O(灰黑色)+H2OAg2O+4NH3·H2O=2[Ag(NH3)2]++2OH-+3H2O银氨溶液AgNO3+2NH3·H2O==Ag(NH3)2NO3+2H2OAg++2NH3·H2O=[Ag(NH3)2]++2H2O 总方程式ZnSO4+2NH3·H2O(不足)==Zn(OH)2↓+(NH4)2SO4 Zn2++2NH3·H2O=Zn(OH)2↓+2NH4+ Zn(OH)2+4NH3·H2O=Zn(NH3)4(OH)2+4H2OZnSO4+4NH3·H2O(足)==Zn(NH3)4SO4+4H2OZn2++4NH3·H2O=[Zn(NH3)4]2++4H2O总方程式4、与酸性物质的作用:强酸制弱酸,或不挥发性酸制挥发性酸Na3PO4+2HCl===Na2HPO4+2NaCl PO43-+2H+=H2PO4-Na2HPO4+HCl===NaH2PO4+NaCl HPO42-+H+=H2PO4-NaH2PO4+HCl===H3PO4+NaCl H2PO4-+H+=H3PO4Na2CO3+HCl===NaHCO3+NaCl CO32-+H+=HCO3-NaHCO3+HCl===NaCl+H2O+CO2↑HCO3-+H+=CO2↑+H2O3Na2CO3+2AlCl3+3H2O==2Al(OH)3↓+3CO2↑+6NaCl (物质之间的双水解反应) 3CO32-+2Al3++3H2O=2Al(OH)3↓+3CO2↑3Na2CO3+2FeCl3+3H2O===2Fe(OH)3↓+3CO2+6NaCl (物质之间的双水解反应) 3CO32-+2Fe3++3H2O=2Fe(OH)3↓+3CO2↑3NaHCO3+AlCl3===Al(OH)3↓+3CO2↑(物质之间的双水解反应) 3HCO3-+Al3+=2Al(OH)3↓+3CO2↑3NaHCO3+FeCl3===Fe(OH)3↓+3CO2↑(物质之间的双水解反应)3HCO3-+Fe3+=2Fe(OH)3↓+3CO2↑3Na2S+Al2(SO4)3+6H2O===2Al(OH)3↓+3H2S↑(物质之间的双水解反应) 3S2-+2Al3++3H2O=2Al(OH)3↓+3H2S↑3NaAlO2+AlCl3+6H2O==4Al(OH)3↓+3NaCl (物质之间的双水解反应) 3AlO2-+Al3++6H2O=4Al(OH)3↓3NaAlO2+FeCl3+6H2O==3Al(OH)3↓+Fe(OH)3↓+3NaCl3AlO2-+Fe3++6H2O=3Al(OH)3↓+Fe(OH)3↓NaAlO2+NH4Cl+2H2O==Al(OH)3↓+NH3·H2O+NaCl AlO2-+NH4++2H2O=Al(OH)3↓+NH3·H2O Na2CO3+H2O+CO2===2NaHCO3CO32-+H2O+CO2=2HCO3-Na2CO3+H2O+2SO2==2NaHSO3+CO2↑ (1:2)CO32-+H2O+2SO2=2HSO3-+CO2↑2Na2CO3(足)+H2O+SO2==Na2SO3+2NaHCO3 (CO2中的SO2不能用Na2CO3洗气)2CO32-+H2O+SO2=SO32-+2HCO3-(2:1)Na2CO3+SO2==Na2SO3+CO2(1:1) CO32-+SO2=SO32-+CO2NaHCO3+SO2===NaHSO3+CO2 (CO2中的SO2可能用NaHCO3洗气)2HCO3-+SO2=2HSO3-+CO22NaHCO3+SO2==Na2SO3+2CO2+H2O 2HCO3-+SO2=SO32-+2CO2+H2ONa2SiO3+2HCl===H2SiO3↓+NaCl 或Na2SiO3+2HCl+H2O===H4SiO4↓+2NaCl SiO32-+2H+=H2SiO3↓或SiO32-+2H++H2O=H4SiO4↓Na2SiO3+CO2+2H2O===H2SiO3↓+Na2CO3SiO32-+CO2+2H2O=H4SiO4↓+CO32-5、盐与盐复分解反应Na2SO4+BaCl2==BaSO4↓+2NaCl(沉淀不溶于盐酸、硝酸)SO32-+Ba2+=BaSO4↓Na2SO3+BaCl2==BaSO3↓+2NaCl (沉淀溶于盐酸,在硝酸中生成新的沉淀,沉淀不消失)SO32-+Ba2+=BaSO3↓Na2CO3+BaCl2==BaCO3↓+2NaCl(沉淀溶于盐酸、沉淀消失)CO32-+Ba2+=BaCO3↓Na2CO3+CaCl2==CaCO3↓+2NaCl (NaHCO3不反应)CO32-+Ca2+=CaCO3↓AgNO3+NaCl==AgCl↓+NaNO3Ag++Cl-=AgCl↓AgNO3+NaBr==AgBr↓+NaNO3Ag++Br-=AgBr↓AgNO3+KI==AgCl↓+KNO3 Ag++I-=AgI↓3AgNO3+Na3PO4==Ag3PO4↓+3NaNO33Ag++PO43-=Ag3PO4↓CuSO4+Na2S==CuS↓+Na2SO4Cu2++S2-=CuS↓FeCl3+3KSCN==Fe(SCN)3+3KCl.* Fe3++3SCN-=Fe(SCN)3 (血红色,用于Fe 3+的特性检验)6、不稳定性:Na 2S2O3+H2SO4===Na2SO4+S↓+SO2↑+H2O S2O 32-+2H+=S↓+SO2↑+H2ONH4Cl NH3↑+HCl↑NH4I NH3↑+HI↑ 2HI H2+I2NH4I NH3↑+H 2↑+I2↑NH4HCO3NH 3↑+H2O+CO2↑2KNO32KNO2+O2↑2Cu(NO3)32CuO+4NO2↑+O2↑2AgNO32Ag+2NO 2↑+O2↑(保存在棕色瓶中)5NH4NO34N2↑+2HNO3+9H2O10NH 4NO38N2↑+4NO2↑+O2↑+20H2O↑(硝酸铵爆炸反应)2KMnO4K2MnO4+MnO2+O2↑2KClO32KCl+3O2↑2NaHCO3Na2CO3+H2O+CO2↑Ca(HCO3)2CaCO3+H2O+CO2↑CaCO3CaO+CO2↑MgCO3MgO+CO2↑九、电离方程式1、酸的电离(H2SO4、HNO3、HCl、HBr、HI、H3PO4、HF、H2SO3、CH3COOH、H2CO3、H2S、HNO2、C6H5OH、HCN、HClO)H2SO4==2H++SO42-或:H2SO4+2H2O==2H3O++SO42-HNO3==H ++NO3-或:HNO3+H2O==H 3O++NO3- (以下雷同)HCl==H++Cl-HBr==H++Br-HI==H++I-H3PO4H++H2PO -4H2PO-4H++HPO-24HPO-24H++PO-34HF H++F- H 2SO3H++HSO-3 HSO-3H++SO-23CH3COOH H++CH3COO-H 2CO3H++-3HCO-3HCO H++-23COH2S H++-HS-HS H++-2S HNO2H++NO-2C6H5OH H++C6H5O- (苯酚不是酸,显酸性)HCN H++CN-HClO H++ClO- H2O H++OH-2H2O H3O++OH-2、碱的电离(NaOH、KOH、Ba(OH)2、Mg(OH)2、Al(OH)3、NH 3·H2O)NaOH==Na++OH-KOH==K++OH-Ba(OH)2==Ba 2++2OH-Mg(OH)2Mg2++2OH-Al(OH)3Al3++3OH-酸式电离:Al(OH)3H++-2AlO+H2ONH3·H2O+4NH+2OH-Ca(OH)2==Ca2++2OH- (澄清石灰水)Ca(OH)2Ca2++2OH- (石灰悬浊液)3、盐的电离(NaCl、Na2SO4、NaHSO4、Na2SO3、NaHSO3、MgSO4、CaSO4、Al2(SO4)3、CuSO4、AlCl3、AgNO3、CH3COONa、NH4NO3、FeCl3、Na2CO3、NaHCO3、Na2S、NaHS、NaH2PO4、Na2HPO4、Na3PO4、KI、NaBr、NaClO、AgCl、CaCO3)NaCl==Na++Cl- Na2SO4==2Na++-24SO NaHSO4==H++Na++-24SONa2SO3==2Na++-24SO NaHSO3==Na++HSO3- (错误书写:NaHSO3==Na++H++SO42-)MgSO4==Mg2++-24SO Al2(SO4)3==2Al3++3-24SO CuSO4==Cu2++-24SOAlCl3==Al3++3Cl- AgNO3==Ag++NO3 CH3COONa==CH3COO-+Na+NH 4NO 3==NH 4++NO 3-FeCl 3==Fe 3++3Cl - Na 2CO 3==2Na ++-23CONaHCO 3==Na ++-3HCO (错误书写:NaHCO 3==Na ++H ++-23CO ) Na 2S==2Na ++-2SNaHS==Na ++HS - (错误书写:NaHS==Na ++H+-2S )NaH 2PO 4==Na ++H 2PO -4Na 2HPO 4==2Na ++HPO -24 (错误书写:Na 2HPO 4==2Na ++H ++PO -34) Na 3PO 4==3Na ++PO -34KI==K ++I ―NaBr==Na ++Br―NaClO==Na ++ClO―AgCl Ag ++-Cl (难溶、微溶物质在水中发生微弱电离)CaCO 3Ca 2++-23CO (错误书写:CaCO 3==Ca 2++CO -23) CaSO 4Ca 2++SO -24(错误书写:CaSO 4==Ca 2++SO -24)3、熔融电离 NaCl Na ++-Cl MgCl 2Mg 2++2-Cl Na 2O2Na ++O2― Al 2O 32Al 3++3O2―十、水解反应1、单水解---可逆水解NH 4Cl+H 2O NH 3·H 2O+HCl NH 4++H 2O H ++NH 3·H 2OFeCl 3+3H 2O Fe(OH)3+3HCl Fe 3++3H 2O Fe(OH)3+3H +AlCl 3+3H 2O Al(OH)3+3HCl Al 3++3H 2O Al(OH)3+3H +CuSO 4+2H 2O Cu(OH)2+H 2SO 4 (金属活动顺序表中Mg 2+以后的阳离子均水解) NaHCO 3+H 2O H 2CO 3+NaOH (NaHSO 4不水解,NaHSO 3电离大于水解)Na 2CO 3+H 2O NaHCO 3+NaOH CO 32-+H 2O HCO 3-+OH –NaHCO 3+H 2O H 2CO 3+NaOH(第一步远远大于第二步,二步不能叠加)Na 2SO 3+H 2O NaHSO 3+NaOH SO 32-+H 2O HSO 3-+OH –NaHSO 3+H 2O H 2SO 3+NaOH(第一步远远大于第二步,二步不能叠加)HSO 3-+H 2O H 2SO 3+OH -Na 2S+H 2O NaHS+NaOH S 2-+H 2O HS -+OH –NaHS+H 2O H 2S+NaOH(第一步远远大于第二步,二步不能叠加)HS -+H 2O H 2S+OH -Na 3PO 4+H 2O Na 2HPO 4+NaOH PO 43-+H 2O HPO 42-+OH –Na 2HPO 4+H 2O NaH 2PO 4+NaOH HPO 42-+H 2O H 2PO 4-+OH –NaH 2PO 4+H 2O H 3PO 4+NaOH H 2PO 4-+H 2O H 3PO 4+OH –CH 3COONa+H 2O CH 3COOH+NaOH CH 3COO -+H 2O CH 3COOH+OH –C 6H 5ONa+H 2O C 6H 5OH+NaOH C 6H 5O -+H 2O C 6H 5OH+OH –2、双水解 CH 3COONH 4+H 2O CH 3COOH+NH 3·H 2O NH 4F+H 2O HF+NH 3·H 2OAl 2S 3+6H 2O==Al(OH)3↓+H 2S ↑ (隔绝空气,密封保存) Mg 3N 2+6H 2O==Mg(OH)2↓+NH 3↑(隔绝空气,密封保存) Na 3P+3H 2O==3NaOH+PH 3↑(隔绝空气,密封保存)Zn 3P 2+6H 2O==Zn(OH)2↓+PH 3↑(Zn 3P 2一种老鼠药,PH 3剧毒神经毒剂) CaC 2+2H 2O==Ca(OH)3↓+C 2H 2↑(隔绝空气,密封保存) C 2H 5ONa+H 2O==C 2H 5OH+NaOH 十一、电解及电极方程式1、电解质溶液在惰性电极条件下,或阴极是较活泼金属电极,阳极是惰性电极条件下的电解 2NaCl+2H 2O2NaOH+H 2↑+Cl 2↑(-)2H 2O+2e-==H 2↑+2OH - 或 2H ++2e -==H 2↑(+)2Cl --2e-==Cl 2↑ 2Cl -+2H 2O 2OH -+H 2↑+Cl 2↑CuCl 2Cu+Cl 2↑(-)Cu 2++2e-==Cu ↓(+)2Cl - -2e-==Cl 2↑Cu2++2Cl-Cu↓+Cl2↑2CuSO4+2H2O2Cu↓+O2↑+2H2SO4(-)2Cu2+ + 4e-==2Cu↓(+)2H2O - 4e-==O2↑+4H+或:4OH- -4e-==O 2↑+2H2O 4H2O4H++4OH - 2Cu2++2H2O 2Cu↓+O2↑+4H+2H2O2H2↑+O2↑(-) 4H++4e-==2H2↑(+)4OH- -4e-==O2↑+2H2O中性电解 4H2O4H ++4OH-2H2O H2↑+O2↑酸性水解:(-) 4H++4e-==2H2↑(+)2H2O-4e-==O2↑+4H+ 4OH- -4e-==O2↑+2H2O2H2O H2↑+O2↑碱性水解:(-) 4H2O+4e-==2H2↑+4OH-或:4H++4e-==2H2↑(+)4OH--4e-==O2↑+2H2O2H2O H2↑+O2↑2、电镀:镀件作阴极,被镀金属作阳极,被镀金属的含氧酸盐作电解质溶液镀铜:CuSO4电镀液镀件(-) Cu2++2e-==Cu↓纯铜(+) Cu–2e-==Cu2+镀锌:ZnSO4电镀液镀件(-) Zn2++2e-==Zn↓纯锌(+) Zn–2e-==Zn2+镀银:AgNO3电镀液镀件(-) Ag++e-==Ag↓纯银(+) Ag–e-==Ag+镀镍:NiSO4电镀液镀件(-) Ni2++2e-==Ni↓纯镍(+) Ni–2e-==Ni2+3、熔融状态下的电解:2NaCl(熔融)2Na+Cl2↑(-)2Na++2e-==2Na(+)2Cl--2e-==Cl2↑2Na++2Cl-(熔融)2Na+Cl2↑2Al2O3(熔融)4Al+2O2↑(-)4Al3++12e–==4Al(+)6O2- -12e-==3O2↑4Al3+ +6O2-4Al+3O2↑NaHF2(熔融)H2↑+F2↑(-)2H++2e–==H2↑(+)2F- -2e-==F2↑2HF H2↑+F2↑十二、原电池反应X—Y(电解质溶液) 或 X//电解质溶液//Y (1)不可逆电池苏打电池:Zn—Cu(H2SO4)Zn极(-) Zn–2e-==Zn2+ (氧化反应)Cu极(+) 2H++2e-==H2↑ (还原反应).*离子方程式 Zn+2H+==H2↑+Zn2+化学方程式 Zn+H2SO4=ZnSO4+H2↑铁碳电池:Fe—C(H2CO3)Fe极(-) Fe–2e-==Fe2+ (氧化反应)C极 (+) 2H++2e -==H2↑ (还原反应)离子方程式 Fe+2H+==H2↑+Fe2+ (析氢腐蚀)铁碳电池:Fe—C(H2O、O2)Fe极(-) 2Fe–4e-==2Fe2+ (氧化反应)C极 (+) O2+2H2O+4e-==4-OH (还原反应)化学方程式 2Fe+O2+2H2O==2Fe(OH)2 (吸氧腐蚀)4Fe(OH)2+O2+2H2O==4Fe(OH)32Fe(OH)3==Fe2O3·nH2O+(3-n)H2O (铁锈的生成过程) 铝镍电池:Al—Ni(NaCl溶液、O2)Al极(-) 4Al–12e-==4Al3+(氧化反应)Ni极(+)3O2+6H2O+12e-==12-OH(还原反应) 化学方程式 4Al+3O2+6H2O==4Al(OH)3 (海洋灯标电池)干电池:Zn—MnO2(NH4Cl糊状物) NH4Cl+H2O==NH3·H2O+HClZn极(-) Zn–2e-==Zn2+(氧化反应)Cu极(+) 2MnO2+2H++2e-==Mn2O3+H2O (还原反应) 化学方程式 Zn+2NH4Cl+2MnO2=ZnCl2+Mn2O3+2NH3↑(2)可逆电池铅蓄电池:Pb—PbO2(浓硫酸)放电Pb极 (-) Pb+H2SO4–2e-==PbSO4+2H+(氧化反应) PbO2极 (+)PbO2+H2SO4+2H++2e-==PbSO4+2H2O (还原反应) 化学方程式 Pb+PbO2+2H2SO4==2PbSO4+2H2OPb—PbO2(浓硫酸)充电Pb极 (-) PbSO4+2H+–2e-== Pb+H2SO4(还原反应) PbO2极 (+)PbSO4+2H2O+2e-==PbO2+H2SO4+2H+(氧化反应) 化学方程式 2PbSO4+2H2O==Pb+PbO2+2H2SO4锂电池:Li—LiMnO2(固体介质)(-) Li–e-==Li+(氧化反应)(+) MnO2+Li++e-==LiMnO2+H2O (还原反应) 化学方程式 Li+MnO2==LiMnO2银锌电池:Zn—Ag2O(NaOH)Zn极(-) Zn+2OH––2e-==ZnO+H2O (氧化反应) Cu极(+) Ag2O+H2O+2e-==2Ag+2-OH(还原反应) 化学方程式 Zn+Ag2O ==ZnO+2Ag(3)高能燃料电池:H2—O2(NaOH)Pt极(-) 2H2+4-OH–4e-==4H2O (氧化反应)Pt极(+) O2+2H2O+4e-==4-OH(还原反应) 化学方程式 2H2+O2==2H2OCH4—O2(NaOH)Pt极(-) CH4+10-OH–8e-==-23CO+7H2O (氧化反应) Pt极(+) 2O2+4H2O+8e-==8-OH(还原反应) 化学方程式 CH4+2O2+2NaOH==Na2CO3+3H2O十三、热化学方程式C(s)+1/2O2(g)==CO(g);△H=-393.5kJ/molC(s)+O2(g)==CO2(g);△H=-110.5kJ/molCO(g)+1/2O2(g)==CO2(g);△H=-283.0kJ/molH2(g)+1/2O2(g)==H2O(g);△H=-241.8kJ/molH2(g)+1/2O2(g)==H2O(l);△H=-285.8kJ/mol2H2(g)+O2(g)==2H2O(g);△H=-483.6kJ/mol2H2(g)+O2(g)==2H2O(l);△H=-571.6kJ/molCH4(g)+2O2(g)==CO2(g)+2H2O(l);△H=-890.3kJ/molC 8H 18(l)+12.5O 2(g)==8CO 2(g)+9H 2O(l);△H=-5518kJ/mol C 6H 12O 6(s)+6O 2(g)==6CO 2(g)+6H 2O(l);△H=-2800kJ/mol N 2H 4(g)+O 2(g)==N 2(g)+2H 2O(g);△H=-534kJ/mol S(s)+O 2(g)==SO 2(g); △H=-297kJ/molFeS 2(s)+11/4O 2(g)==1/2Fe 2O 3(s)+2SO 2(g);△H=-853kJ/mol SO 2(s)+1/2O 2(g)==SO 3(g);△H=-98.3kJ/mol SO 3(g)+H 2O(l)==H 2SO 4(l);△H=-130.8kJ/mol H 2(g)+Cl 2(g)==2HCl(g);△H=-184.6kJ/mol C(s)+H 2O(g)==H 2(g)+CO 2(g);△H=+131.5kJ/mol 3H 2(g)+N 2(g)==2NH 3(g);△H=-92.2kJ/mol 2O 2(g)+N 2(g)==2NO 2(g);△H=+68kJ/molO 2(g)+N 2(g)==2NO(g);△H= -kJ/mol O 2(g)+2NO(g)==2NO 2(g);△H= -kJ/mol 2NO 2(g)==N 2O 4(g);△H= -kJ/mol Cu(s)+1/2O 2(g)==CuO(s);△H=-157kJ/mol CaCO 3(s)+==CaO(s)+CO 2(g);△H=+1777kJ/molC(石墨) + O 2(g) === CO 2(g); △H = -393.51kJ ·mol -1C(金刚石) + O 2(g) === CO 2(g); △H = -395.41kJ ·mol -1C(石墨) ===C(金刚石); △H = +1.9kJ ·mol -1NaOH(aq)+HCl(aq)=NaCl(aq)+H 2O(l);△H=-57.3kJ/mol KOH(aq)+HNO 3(aq)=NaNO 3(aq)+H 2O(l);△H=-57.3kJ/molNaOH(aq)+1/2H 2SO 4(aq)=1/2Na 2SO 4(aq)+H 2O(l);△H=-57.3kJ/mol有机方程式甲烷↑+−−→−+∆432CaO 3CH CO Na NaOH COONa CHO H 2CO O 2CH 2224+−−→−+点燃HCl Cl CH Cl CH 324+−→−+光HCl Cl CH Cl Cl CH 2223+−→−+光HCl CHCl Cl Cl CH 3222+−→−+光 HCl CCl Cl CHCl 423+−→−+光24H 2C CH +−−→−高温乙烯O H CH CH OH CH CH 222C17023+↑=−−→−--。
1.碳与氧气(不足)的反应2C+O2==== 2CO-碳与氧气(充足)的反应C+O2==== CO2-2.一氧化碳与氧气的反应2CO+O2==== 2CO2-3.二氧化碳与碳的反应CO2+C==== 2CO-4.碳酸氢钠与盐酸的反应NaHCO3+HCl==== NaCl+H2O+CO2↑5.碳酸钠与盐酸的反应Na2CO3+ 2HCl==== 2NaCl+ H2O+ CO2↑6.碳酸钙与盐酸的反应CaCO3+2HCl==== CaCl2+ H2O+ CO2↑7.碳酸氢钠与氢氧化钠的反应NaHCO3+NaOH==== Na2CO3 +H2O-8.碳酸钠与氢氧化钙的反应Na2CO3+Ca(OH)2==== CaCO3↓+ 2NaOH-9.碳酸氢钠(少量)与氢氧化钙的反应NaHCO3+ Ca(OH)2==== CaCO3↓+NaOH+ H2O-碳酸氢钠(过量)与氢氧化钙的反应2NaHCO3+ Ca(OH)2==== CaCO3↓+Na2CO3+2H2O-10.碳酸氢钠加热的反应2NaHCO3==== Na2CO3+ H2O+CO2↑11.碳酸氢钙加热的反应Ca(HCO3)2==== CaCO3↓+H2O+CO2↑12.碳酸钙加热的反应CaCO3==== CaO+CO2↑13.二氧化碳(过量)通入氢氧化钙溶液中的反应Ca(OH)2+2CO2==== Ca(HCO3)2-二氧化碳(少量)通入氢氧化钙溶液中的反应Ca(OH)2+CO2==== CaCO3↓+H2O-14.氮气与氧气的反应N2+O2==== 2NO-15.一氧化氮与氧气的反应2NO+O2==== 2NO2-16.二氧化氮与水的反应3NO2+ H2O==== 2HNO3+ NO-17.氮气与氢气的反应N2+3H2========= 2NH3-18.氨气与水的反应NH3+H2O==== NH3?H2O-19.氨气与盐酸的反应NH3+HCl==== NH4Cl-20.氨气与硫酸的反应2NH3+H2SO4==== (NH4)2SO4-21.氨气与强酸的离子的反应NH3+H+==== NH4+-22.氨的催化氧化的反应4NH3+5O2====== 4NO+6H2O-23.碳酸氢铵加热的反应NH4HCO3==== NH3↑+CO2↑+H2O-24.氯化铵加热的反应NH4Cl==== NH3↑+HCl↑25.碳酸铵加热的反应(NH4)2CO3==== 2NH3↑+CO2↑+H2O-26.氯化铵与氢氧化钙的反应2NH4Cl+ Ca(OH)2==== CaCl2+2NH3↑+2H2O-27.氯化铵与氢氧化钠的反应NH4Cl+ NaOH==== NaCl+NH3↑+H2O-28.碳酸氢铵与氢氧化钠的反应NH4HCO3+2NaOH==== Na2CO3+NH3↑+2H2O-29.碳酸氢铵与氢氧化钙的反应NH4HCO3+Ca(OH)2==== CaCO3↓+NH3↑+2H2O-30.硝酸的分解的反应4HNO3========= 4NO2↑+O2↑+2H2O-31.铜与浓硝酸的反应Cu+4HNO3(浓)==== Cu(NO3)2+2NO2↑+2H2O-32.铜与稀硝酸的反应3Cu+8HNO3(稀)==== 3Cu(NO3)2+2NO↑+4H2O-33.铁与浓硝酸的反应Fe+6HNO3(浓)==== Fe(NO3)3+3NO2↑+3H2O-34.铁与稀硝酸的反应Fe+4HNO3(稀)==== Fe(NO3)3+NO↑+2H2O-35.碳与浓硝酸的反应C+4HNO3(浓)==== CO2↑+4NO2↑+2H2O-36.一氧化氮与一氧化碳的反应2NO+2CO====== N2+2CO2-37.一氧化氮与氧气和水的反应4NO+3O2+2H2O==== 4HNO3-38.二氧化氮与氧气和水的反应4NO2+O2+2H2O==== 4HNO3-39.氢氧化钠吸收二氧化氮和一氧化氮的反应2NaOH+NO2+NO==== 2NaNO2+H2O-40.氨气(过量)与氯气的反应8NH3+3Cl2==== 6NH4Cl+N2-氨气(少量)与氯气的反应2NH3+3Cl2==== 6HCl+N2-41.二氧化氮生成四氧化二氮的反应2NO2==== N2O4-42.硫与铜的反应S+2Cu==== Cu2S-43.硫与铁的反应S+Fe==== FeS-44.硫与钠的反应S+2Na==== Na2S-45.硫与铝的反应3S+2Al==== Al2S3-46.硫与汞的反应S+Hg==== HgS-47.硫与氧气的反应S+O2==== SO2-48.硫与氢气的反应S+H2==== H2S-49.硫与氢氧化钠的反应3S+6NaOH==== 2Na2S+Na2SO3+3H2O-50.硫与浓硫酸的反应S+2H2SO4(浓)==== 3SO2+2H2O-51.黑火药点燃S+2KNO3+3C==== K2S+3CO2↑+N2↑52.二氧化硫(少量)与氢氧化钠的反应SO2+2NaOH==== Na2SO3+H2O-二氧化硫(过量)与氢氧化钠的反应SO2+NaOH==== NaHSO3-53.二氧化硫与氢氧化钙的反应SO2+Ca(OH)2==== CaSO3↓+H2O-54.二氧化硫与亚硫酸钙溶液的反应SO2+CaSO3+H2O ==== Ca(HSO3)2-55.二氧化硫与水的反应SO2+H2O==== H2SO3-56.二氧化硫与硫化氢的反应SO2+2H2S==== 3S↓+2H2O-57.二氧化硫与氧气的反应2SO2+O2====== 2SO3-58.二氧化硫与过氧化钠的反应SO2+Na2O2==== Na2SO4-59.二氧化硫与氯水的反应SO2+ Cl2+2H2O==== H2SO4+2HCl-60.三氧化硫与水的反应SO3+H2O==== H2SO4-61.亚硫酸与氧气的反应2H2SO3+O2==== 2H2SO4-62.亚硫酸钠与氧气的反应2Na2SO3+O2==== 2Na2SO4-63.浓硫酸与铜的反应2H2SO4(浓)+Cu==== CuSO4+SO2↑+2H2O-64.浓硫酸与碳的反应2H2SO4(浓)+C==== CO2↑+2SO2↑+2H2O寿-65.工业制备硫酸(初步) 4FeS2+11O2==== 8SO2+2Fe2O3-66.实验室制备硫酸(初步) Na2SO3+H2SO4(浓)==== Na2SO4+SO2↑+H2O-67.硫化氢(少量)与氢氧化钠的反应H2S+2NaOH==== Na2S+2H2O-硫化氢(过量)与氢氧化钠的反应H2S+NaOH==== NaHS+H2O-68.硫化氢(少量)与氨气的反应H2S+2NH3==== (NH4)2S-硫化氢(过量)与氨气的反应H2S+NH3==== NH4HS-69.硫化氢与氧气(不足)的反应2H2S+O2==== 2S↓+2H2O 2H2S+O2==== 2S+2H2O-硫化氢与氧气(充足)的反应2H2S+3O2==== 2SO2+2H2O-70.硫化氢与氯气的反应H2S+Cl2==== 2HCl+S↓71.硫化氢与浓硫酸的反应H2S+H2SO4(浓)==== S↓+SO2↑+2H2O-72.硫化氢的制备FeS+H2SO4==== FeSO4+H2S↑73.电解饱和食盐水(氯碱工业) 2NaCl+2H2O==== 2NaOH+H2↑+Cl2↑74.电解熔融状态氯化钠(制单质钠) 2NaCl==== 2Na+Cl2↑75.海水制镁(1) CaCO3==== CaO+CO2-(2) CaO+H2O==== Ca(OH)2-(3) Mg2++2OH2-==== Mg(OH)2↓(4) Mg(OH)2+2HCl==== MgCl2+2H2O-(5) MgCl2==== Mg+Cl2↑76.镁在空气中燃烧(与氧气的反应) 2Mg+O2==== 2MgO-(与氮气的反应) 3Mg+N2==== Mg3N2-(与二氧化碳的反应) 2Mg+CO2==== 2MgO+C-77.镁与氯气的反应Mg+Cl2==== MgCl2-78.镁与水的反应Mg+2H2O==== Mg(OH)2+H2↑79.镁与盐酸的反应Mg+2HCl==== MgCl2+H2↑80.镁与氢离子的反应Mg+2H+==== Mg2++H2↑81.二氮化三镁与水的反应Mg3N2+6H2O==== 3Mg(OH)2↓+2NH3↑82.镁与溴水的反应(颜色退去) Mg+Br2==== MgBr2-(产生气泡) Mg+2HBr==== MgBr2+H2↑83.溴与水的反应Br2+H2O==== HBr+HBrO-84.溴与氢氧化钠的反应Br2+2NaOH==== NaBr+NaBrO+H2O-85.溴与氢气的反应Br2+H2==== 2HBr-86.溴与铁的反应3Br2+2Fe==== 2FeBr3-87.碘与铁的反应I2+Fe==== FeI2-88.溴与碘化钾的反应Br2+2KI==== 2KBr+I2-89.氯气与溴化钾的反应2KBr+Cl2==== 2KCl+Br2-第四章-90.硅与氧气的反应Si+O2==== SiO2-91.硅与氯气的反应Si+2Cl2==== SiCl4-92.硅与氢气的反应Si+2H2===== SiH4-93.二氧化硅与氟的反应Si+2F2==== SiF4-94.硅与碳的反应Si+C==== SiC-95.硅与氢氧化钠溶液的反应Si+2NaOH+H2O==== Na2SiO3+2H2↑96.硅与氢氟酸的反应Si+4HF==== SiF4+2H2↑97.单质硅的制备(1.制备)SiO2+2C==== Si+2CO-(2.提纯)Si+2Cl2==== SiCl4-(3.提纯)SiCl4+2H2==== Si+4HCl-98.二氧化硅与氢氧化钠的反应SiO2+2NaOH==== Na2SiO3+H2O-99.二氧化硅与氧化钠的反应SiO2+Na2O==== Na2SiO3-100.二氧化硅与碳酸钠的反应SiO2+Na2CO3==== Na2SiO3+ CO2↑101.二氧化硅与氧化钙的反应SiO2+CaO==== CaSiO3-102.二氧化硅与碳酸钙的反应SiO2+CaCO3==== CaSiO3+CO2↑103.二氧化硅与氢氟酸的反应SiO2+4HF==== SiF4+2H2O-104.硅酸的制备Na2SiO3+ CO2+H2O==== H2SiO3↓+ Na2CO3-105.硅酸加热分解H2SiO3==== SiO2+H2O-106.铝与氧气的反应4Al+3O2==== 2Al2O3-107.铝与氯气的反应2Al+3Cl2==== 2AlCl3-108.铝与盐酸的反应2Al+6HCl==== 2AlCl3+3H2↑109.铝与氢氧化钠的反应2Al+2NaOH+6H2O==== 2Na[Al(OH)4]+3H2↑110.铝与水的反应2Al+6H2O==== 2Al(OH)3+3H2↑111.铝与三氧化二铁的反应(铝热反应)2Al+Fe2O3==== 2Fe+Al2O3-112.铝与二氧化锰的反应(铝热反应)4Al+3MnO2==== 3Mn+2AlO3-113.氧化铝与盐酸的反应Al2O3+6HCl==== 2AlCl3+3H2O-114.氧化铝与氢氧化钠的反应Al2O3+2NaOH+3H2O==== 2Na[Al(OH)4]-115.电解氧化铝2Al2O3==== 4Al+3O2↑116.硫酸与与一水合氨的反应Al2(SO4)3+6NH3?H2O==== 2Al(OH)3↓+3(NH4)2SO4-117.氯化铝与一水合氨的反应AlCl3+3NH3?H2O==== Al(OH)3↓+3NH4Cl-118.氯化铝与氢氧化钠(少量)的反应AlCl3+3NaOH==== Al(OH)3↓+3NaCl-119.氢氧化铝与氢氧化钠的反应Al(OH)3+NaOH==== Na[Al(OH)4]-120.氯化铝与氢氧化钠(过量)的反应AlCl3+4NaOH==== Na[Al(OH)4]+3NaCl-121.四羟基合氯酸钠与盐酸(少量)的反应Na[Al(OH)4]+HCl==== Al(OH)3↓+NaCl+H2O-122.氢氧化铝与盐酸的反应Al(OH)3+3HCl==== AlCl3+3H2O-123.四羟基合氯酸钠与盐酸(过量)的反应Na[Al(OH)4]+4HCl==== AlCl3+NaCl+4H2O-124.四羟基合氯酸钠与氯化铝的反应3Na[Al(OH)4]+AlCl3==== 4Al(OH)3↓+3NaCl-.* 125.向四羟基合氯酸钠中通入过量二氧化碳Na[Al(OH)4]+CO2==== Al(OH)3↓+NaHCO3-126.铜在潮湿空气中被腐蚀2Cu+O2+H2O+CO2==== Cu2(OH)2CO3-127.铜与氧气的反应2Cu+O2==== 2CuO-128.铜与氯气的反应Cu+Cl2==== CuCl2-129.铜氧化在高温下转化4CuO==== 2Cu2O+O2↑130.硫酸铜与水的反应CuSO4+5H2O==== CuSO4?5H2O-。
化学方程式的书写与应用第四章认识化学变化第三节第一课时学习目标:能正确书写简单的化学方程式学习过程:二、化学方程式用_______________来表示化学反应的式子叫化学方程式。
1、化学方程式的书写原则:⑴以客观事实为依据,不能编造事实上不存在的物质和化学反应;⑵要遵守质量守恒定律,即反应前后各原子的_______和_______必须相等。
2、化学方程式的书写步骤:①写:根据实验事实写出反应物和生成物的化学式:P+O2—P2O5②配:根据反应前后原子的种类和数目不变的原理,在反应物和生成物的化学式前配上适当的化学计量数,使各种元素的原子个数反应前后相等,配平后短线改等号;配平方法:观察法、最小公倍数法、分数法等4P+5O2=2P2O5③注:a、注明反应条件如点燃、加热、光照、通电、催化剂等,写在等号的上方;b、若无气体参加反应,生成的气体的化学式后要注“↑”c、若无固体参加反应,生成的固体的化学式后要注“↓”点燃4P+5O2=2P2O5④查:检查等号两边原子的种类和数目是否相等练习:书写下列反应的化学方程式1、硫磺在氧气中燃烧______________________________________________2、木炭在氧气中燃烧______________________________________3、木炭在氧气中燃烧____________________________________4、镁带在氧气中燃烧______________________________________________5、铁丝在氧气中燃烧______________________________________________6、一氧化碳在氧气中燃烧__________________________________________7、铜在空气中加热________________________________________________8、铜绿受热分解__________________________________________________ 9、碳酸氢铵受热分解______________________________________________ 10、实验室加热高锰酸钾制氧气_____________________________________ 11、双氧水与二氧化锰混合制氧气___________________________________ 12、二氧化碳与水反应______________________________________________ 13、碳酸受热分解__________________________________________________ 14、二氧化碳通入澄清石灰水中______________________________________15、实验室制取二氧化碳____________________________________________ 16、氢气在空气中燃烧______________________________________________ 17、红磷燃烧___________________________________________________ ___ 18、水通电分解___________________________________________________ _ 19、氢氧化钠溶液和硫酸铜溶液反应__________________________________例:已知2KNO 3+3C+S△ K 2S+X↑+3CO2↑,据此推出X的化学式______练习:已知H2SO4+Na2S2O3==Na2SO4+S↓+X↑+H2O,则X的化学式________例:配平化学方程式:⑴ Fe + Cl2 点燃FeCl3 ⑵ Al + H2SO4 ==== Al2(SO4)3 + H2 ⑶ CO2 + KOH === K2CO3 + H2O练习:配平化学方程式C2H5OH + O2 点燃CO2 + H2OH催化剂 2 + N 2高温高压NH3CO + NO催化剂N2 + CO2C6H12O6 + O2 点燃CO2 + H2OCO2 + H2O ===== C6H12O6 + O21第三节第二课时学习目标:能正确书写简单的化学方程式;初步掌握配平的技巧。
初中化学方程式大全(高级书写版)
(1)单质与氧气的反应:
1、镁在空气中燃烧:
2、铁在氧气中燃烧:
3、铜在空气中受热:
4、铝在空气中燃烧:
5、氢气中空气中燃烧:
6、红磷在空气中燃烧:
7、硫粉在空气中燃烧:
8、碳在氧气中充分燃烧:
9、碳在氧气中不充分燃烧:
(2)化合物与氧气的反应:
一氧化碳在氧气中燃烧:
甲烷在空气中燃烧:
酒精在空气中燃烧:
辛烷在空气中燃烧:
二、分解反应:(1)分解反应制氧气双氧水催化分解:氯酸钾(二氧化锰)分解:
高锰酸钾受热分解:
水在直流电的作用下分解:
(2)不溶性碳酸盐受热分解碱式碳酸铜受热分解:
煅烧石灰石:
碳酸镁受热分解:
(3)碳酸氢盐受热分解碳酸氢钠受热分解:碳酸氢钙受热分解:
碳酸氢铵受热分解:
(4)不溶性碱受热分解氢氧化镁受热分解:氢氧化铜受热分解:
氢氧化铁受热分解:
氢氧化铝受热分解:
(5)其他碳酸不稳定而分解:
三、氧化还原反应:
氢气还原氧化铜:
氢气还原氧化亚铁:
氢气还原氧化铁:
氢气还原四氧化三铁:
木炭还原氧化铜:
焦炭还原氧化亚铁:
焦炭还原氧化铁:
焦炭还原四氧化三铁:
一氧化碳还原氧化铜:
一氧化碳还原氧化亚铁:
一氧化碳还原氧化铁:
一氧化碳还原四氧化三铁:
木炭与二氧化碳反应:
四、金属的化学性质金属通性:①活泼金属酸═ 盐②相对活泼金属置换相对不活泼金属(1)金属 + 酸═ 盐 + 氢气(置换反应)镁和稀硫酸反应:
铝和稀硫酸反应:
锌和稀硫酸反应:
铁和稀硫酸反应:
镁和稀盐酸反应:
铝和稀盐酸反应:
锌和稀盐酸反应:
铁和稀盐酸反应:
(2)金属+ 盐(溶液)═ 新金属+新盐铝和硫酸铜溶液反应:
锌和氯化铜溶液反应:
锌和硫酸铜溶液反应:
铁和硫酸铜溶液反应:
铁和硝酸银溶液反应:
铜和硝酸银溶液反应:
铜和硝酸汞溶液反应:
五、酸的化学性质酸的通性:①使指示剂变色②和氢以前活泼金属发生置换反应③碱性氧化物 + 酸═ 盐水④酸 + 碱
═ 盐 + 水⑤酸 + 盐═新酸 + 新盐(1)使指示剂变色(2)酸 + 金属单质═ 盐 + 氢气(3)酸 + 碱性氧化物═ 盐 +水氧化铁和稀盐酸反应:
氧化铁和稀硫酸反应:
氧化铜和稀盐酸反应:
氧化铜和稀硫酸反应:
氧化镁和稀硫酸反应:
氧化钙和稀盐酸反应:
氧化钙和硝酸反应:
(4)酸 + 碱═ 盐 + 水盐酸和烧碱起反应:
盐酸和氢氧化钾反应:
盐酸和氢氧化铜反应:
盐酸和氢氧化钙反应:
盐酸和氢氧化铁反应:
氢氧化铝药物治疗胃酸过多:
硫酸和烧碱反应:
硫酸和氢氧化钾反应:
硫酸和氢氧化铜反应:
硫酸和氢氧化铁反应:
硫酸和氢氧化钡反应:
硝酸和烧碱反应:
硝酸和氢氧化钡反应:
(5)酸 + 盐═ 新酸 + 新盐稀盐酸与大理石反应:
稀盐酸与碳酸钠反应: 稀盐酸与碳酸镁反应: 盐酸和硝酸银溶液反应:
盐酸与小苏打溶液反应:
盐酸与碳酸氢钠溶液反应:
硫酸和碳酸钠反应:
硫酸和氯化钡溶液反应:
八、碱的化学性质碱的通性:①使指示剂变色②碱 + 酸性氧化物═盐 + 水③碱 + 酸═ 盐 + 水④碱 + 盐═新碱 + 新盐(1)使指示剂变色(2)碱 + 酸性氧化物═ 盐 +水苛性钠暴露在空气中变质:
火碱吸收二氧化硫气体:
烧碱吸收三氧化硫气体:
熟石灰放在空气中变质:
消石灰吸收二氧化硫:
(3)碱 + 酸═ 盐 + 水(4)碱 + 盐═ 新碱 + 新盐氢氧化钠与硫酸铜:
氢氧化钠与氯化铁:
氢氧化钠与氯化镁:
氢氧化钾与氯化铜:
氢氧化钙与碳酸钠:
*铵盐:铵盐+碱△ 盐+ NH3↑+ H2O氯化铵与氢氧化钠共热:氯化铵与氢氧化钙共热:硫酸铵与氢氧化钾共热:九、盐的化学性质盐的通性:① 金属+盐═ 新盐+新金属②盐+酸═ 新盐+新酸③ 盐+碱═ 新盐+新碱④盐+ 盐═ 两种新盐(1)盐+金属═新盐 + 新金属(2)盐+酸═ 新盐+新酸(3)盐+碱═ 新盐+新碱(4)盐+盐═ 两种新盐氯化钠溶液和硝酸银溶液:
硫酸钠和氯化钡溶液反应:
氯化钙与碳酸钠溶液反应:
硝酸钡与碳酸钾溶液反应:
硝酸银与碳酸钾溶液反应:
八、酸性氧化物的性质:酸性氧化化物通性:①酸性氧化物水═ 相对应的酸②酸性氧化物碱性氧化物═ 盐③酸性氧化物碱═ 盐水注意:
不溶于水(1)酸性氧化物 + 水═ 相对应的酸二氧化碳与水反应:
二氧化硫与水反应:
三氧化硫与水反应:
三氧化二氮与水反应:
五氧化二氮与水反应:
五氧化二磷与水反应:
(2)酸性氧化物+碱═ 盐+水(3)酸性氧化物+碱性氧化物═ 盐氧化钙与二氧化碳反应:
氧化钙与二氧化硫反应:
氧化钠与二氧化碳反应:
六、碱性氧化物的性质碱性氧化化物通性:①碱性氧化物 + 水═ 相对应的碱②碱性氧化物 + 酸性氧化物═ 盐③碱性氧化物 + 酸═ 盐 + 水(1)碱性氧化物+水═ 相对应的碱氧化钠与水反应:
生石灰与水反应:
氧化钡与水反应:
特别注意:CuO 黑色、Cu2O 红色、FeO 黑色、 Fe2O3 红棕色、Fe3O4 黑色、MgO灰白色、Al2O3白色,这些氧化物均不溶于水,所以这些氧化物不与水反应。
(2)碱性氧化物 + 酸性氧化物═ 盐(见酸性氧化物)(3)碱性氧化物+酸═ 盐+水(见酸的化学性质)。