脾淋巴细胞分离
- 格式:docx
- 大小:21.70 KB
- 文档页数:2



淋巴细胞增殖实验报告一、实验目的本实验旨在通过体外培养淋巴细胞,观察不同刺激条件下淋巴细胞增殖的情况,探讨淋巴细胞增殖与免疫应答的关系,为进一步研究免疫调节机制提供实验依据。
二、实验材料1. 实验动物:昆明种小鼠,体重20-25g,雌雄不限。
2. 试剂:RPMI-1640培养基、胎牛血清、淋巴细胞分离液、植物血凝素(PHA)、刀豆素A(ConA)、胰蛋白酶、二甲基亚砜(DMSO)、ELISA试剂盒等。
3. 仪器:超净工作台、CO2培养箱、倒置显微镜、酶标仪、流式细胞仪等。
三、实验方法1. 淋巴细胞分离:取小鼠颈椎脱臼处死,无菌操作下取出脾脏,加入胰蛋白酶消化,离心洗涤,再用淋巴细胞分离液分离淋巴细胞。
2. 淋巴细胞培养:将分离得到的淋巴细胞用RPMI-1640培养基重悬,调整细胞密度为1×10^6个/mL,加入PHA或ConA作为刺激剂,分别设置无刺激组、PHA刺激组、ConA刺激组等。
3. 细胞增殖观察:将培养的淋巴细胞置于CO2培养箱中培养,分别在24h、48h、72h、96h和120h取样,用倒置显微镜观察细胞形态变化,并计算细胞数量。
4. ELISA检测:取培养上清液,按照ELISA试剂盒说明书检测细胞因子(如IL-2、IFN-γ等)含量。
5. 流式细胞术检测:取培养的淋巴细胞,用荧光标记的抗体检测T细胞亚群(如CD4+、CD8+等)和细胞周期分布。
四、实验结果1. 细胞形态观察:随着培养时间的延长,淋巴细胞在PHA或ConA刺激下逐渐转变为淋巴母细胞,细胞体积增大,核仁明显,细胞浆内出现空泡。
2. 细胞增殖:在PHA或ConA刺激下,淋巴细胞数量显著增加,且呈时间依赖性。
3. 细胞因子检测:ELISA结果显示,在PHA或ConA刺激下,培养上清液中IL-2、IFN-γ等细胞因子含量显著升高。
4. 流式细胞术检测:流式细胞术结果显示,在PHA或ConA刺激下,T细胞亚群CD4+和CD8+的比例发生改变,且细胞周期分布发生变化。

从小鼠脾脏中分离淋巴细胞
方法一:
1用注射器内芯或者研棒研磨过100目筛网,Hank’s液冲洗,收集分离的脾细胞悬液。
2另取无菌试管,先加入淋巴细胞分离液,然后将试管倾斜,略放平,吸取刚刚制备的细胞悬液缓慢的加入试管中,一般分离液和细胞悬液的体积比为1:2,要轻要慢,不要冲破了淋巴细胞分离液和细胞悬液的界面。
室温水平离心2000转/分钟,30分钟。
3离心后取出试管,可以看到不同的分层,一般上面是非细胞成分和细胞碎片,接下来是单个核细胞,再往下是红细胞等。
吸走上层非细胞层弃之,吸出单个核层在另外无菌试管中,因为淋巴细胞分离液对细胞有毒性作用,加入PBS离心洗两遍(1000转/分钟,10分钟)。
4倾倒上清,用RPMI-1640重悬细胞。
方法二:
用注射器内芯或者研棒研磨过100目筛网,Hank’s液冲洗,收集分离的脾细胞悬液,2000r/min离心3min,弃上清。
加红细胞裂解液8mL,混匀脾细胞,静置5-6min,待红细胞完全破碎,2000r/min离心3min,弃上清去除红细胞,Hank’s液洗1-2遍,用RPMI-1640(含10%胎牛血清)重悬细胞。


小鼠全脾分离及淋巴细胞的获取实验步骤:1.杀鼠:将小鼠颈椎脱臼处死,70%酒精喷涂表面,无菌条件下剖开小鼠腹腔2.分离全脾:取脾,横切约1mm厚放入固定液,作为组化样本,其余组织放入1ml 5% FCS 1640.3.脾淋巴细胞的分离:1)脾脏处理:将脾脏置于200目滤网上,用5mL注射器内芯轻轻研磨,不断向组织上滴加2ml 5% FCS 1640,直至组织内绝大部分细胞被分离,1ml注射器抽吸滤过,将细胞收集于5ml离心管中。
.2)500g,3min,弃上清。
3)红细胞裂解:加入1ml 红细胞裂解液,轻轻吹打混匀,室温裂解2分钟至红细胞完全破碎。
4)500g,5min,弃上清。
5)洗涤1次:加入1ml 5% FCS 1640,重悬沉淀,500g,3分钟,弃上清。
加入1mL 10% FCS1640重悬,取出15μL计数;6)台盼蓝染色细胞计数:1:20稀释细胞悬液,与0.4%台盼蓝染液9:1混合,计数;计算终浓度为1×107/mL所需加入10% FCS 1640的量。
7)加入适量10% FCS 1640调整细胞浓度至1×107/mL,置于4ºC备用。
小鼠淋巴结分离及淋巴细胞的获取实验步骤:1.杀鼠:将小鼠颈椎脱臼处死,70%酒精喷涂表面,无菌条件下剖开小鼠腹腔2.分离淋巴结:取腋下,腹股沟,肠系膜淋巴结,其中腋下淋巴结置固定液中送组化,其余淋巴结放入1ml 5% FCS 1640.3.淋巴结淋巴细胞的分离:1)淋巴结处理:将淋巴结漂浮于3ml 5% FCS 1640(玻璃平皿)中,用无菌大镊子紧捏淋巴结,并用5mL注射器内芯轻轻研磨,绝大部分淋巴细胞游离置培养基中,1ml注射器抽吸滤过,将细胞收集于5ml离心管中。
.2)500g,3min,弃上清。
3)洗涤:加入1ml 5% FCS 1640,重悬沉淀,500g,3分钟,弃上清。
加入1mL 10% FCS1640重悬,取出15μL计数;4)台盼蓝染色细胞计数:1:20稀释细胞悬液,与0.4%台盼蓝染液9:1混合,计数;计算终浓度为1×107/mL所需加入10% FCS 1640 的量。

小鼠淋巴细胞的分离培养
一、血液中淋巴细胞的分离:
1在1.5ML离心管中加入淋巴细胞分离液0.7ML;
2眼部采集小鼠的抗凝血,抗凝剂20%.。
3轻轻将血液加入淋巴细胞分离液的表面,立即以2000—2500转/分离心10MIN。
4小心吸取上层细胞,转移至另一1.5ML离心管中,再用HANK’S 悬浮至1.5ML,再离心,去上清,再悬浮,等待分型用。
二、鼠脾脏中淋巴细胞的分离:
1无菌采集鼠的脾脏,且灭菌注射器的弯针头轻轻扎取,尽可能使单个细胞分离,再分别用4层灭菌纱布过滤2次。
2将滤液小心加入淋巴细胞分离液中。
离心。
3 吸取上层淋巴细胞,HANK‘S液洗涤2次(尽可能去除淋巴
细胞分离液)。
4加入1640培养液进行培养。
、
*淋巴细胞分离液不低于全部液体的50%。

肝脏免疫学实验室淋巴细胞分离技术肝脏淋巴细胞分离1.小鼠摘眼球放血后,剪开颈动脉处死,摘取肝脏。
2.将肝脏放在200目钢丝网上自边缘开始研磨,转至15ml离心管中。
3.650rpm×1min离心,将上层液体转至15ml离心管中。
4.1500prm×5min离心后弃上清,重复洗两次。
5.6ml 40% Percoll 溶液重悬沉淀,将3ml 70% Percoll溶液加于其底层,2000rpm×20min,升6降2。
6.吸取两层Percoll溶液之间的白细胞层至15ml离心管中,加满PBS后2000rpm×5min 离心收集细胞。
7.1ml PBS 重悬细胞后,吸取10ul细胞悬液,按照1:1的比例与台盼蓝混匀后计数。
脾脏淋巴细胞分离1.小鼠摘眼球放血后剪开颈动脉处死,摘取脾脏。
2.用载玻片的粗糙面将脾脏一点一点磨碎,将收集的研磨悬液通过200目尼龙网过滤至15ml离心管中,1500rpm×5min离心收集细胞。
3.8ml PBS重悬细胞沉淀,在底层加入3ml Ficoll , 2000rpm×20min,升6降2。
4.吸取两层溶液之间的白细胞层至15ml离心管,加满PBS后2000rpm×5min离心收集细胞。
5.6-8 ml PBS 重悬细胞后,吸取10ul细胞悬液,按照1:1的比例与台盼蓝混匀后计数。
胸腺淋巴细胞分离1.小鼠摘眼球放血后,剪开颈动脉处死,摘取胸腺。
2.将胸腺放在200目钢丝网上研磨,将收集的研磨悬液通过尼龙网过滤至15ml离心管中,1500rpm×5min离心收集细胞。
3.6-8ml PBS 重悬细胞沉淀,再次通过200目尼龙网过滤后,吸取10ul细胞悬液,按照1:1的比例与台盼蓝混匀后计数。
淋巴结淋巴细胞分离1.小鼠摘眼球放血后脱臼处死,摘取淋巴结。
2.用载玻片的粗糙面将淋巴结磨碎,将收集的研磨悬液通过200目尼龙网过滤至15ml 离心管中,1500rpm×5min离心收集细胞。

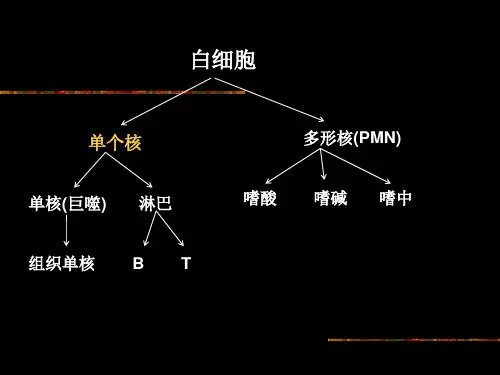
小鼠脾脏淋巴细胞分离与计数实验报告小鼠脾脏淋巴细胞分离与计数实验报告一、引言淋巴细胞是免疫系统中重要的细胞成分,其在免疫应答和抗体产生中发挥着关键作用。
为了研究淋巴细胞的功能和特性,需要将其从组织中分离出来并进行计数。
本实验旨在通过对小鼠脾脏进行淋巴细胞分离和计数,来获取关于淋巴细胞数量和纯度的信息。
二、材料与方法1. 实验动物:使用C57BL/6小鼠。
2. 仪器与试剂:离心管、离心机、PBS缓冲液、0.83%氯化铵溶液。
3. 实验步骤:A. 准备工作:i. 将离心管预冷至4℃。
ii. 准备PBS缓冲液,并保持在4℃。
B. 小鼠准备:i. 用无菌技术将小鼠安全固定在手术台上。
ii. 使用无菌器械,剪开腹部皮肤和腹壁,暴露脾脏。
iii. 小心取出脾脏并放入含有PBS缓冲液的离心管中。
C. 细胞分离:i. 使用无菌器械,将脾脏组织切碎至细胞悬浮液状态。
ii. 将细胞悬浮液通过70μm滤网过滤,以去除大块组织残渣。
iii. 向过滤后的细胞悬浮液中加入等体积的0.83%氯化铵溶液,进行红细胞溶解。
iv. 用PBS缓冲液洗涤淋巴细胞沉淀,重复此步骤2-3次。
D. 细胞计数:i. 取适量的淋巴细胞悬浮液,加入等体积的尝试涂片溶剂进行稀释。
ii. 在尝试涂片上使用布朗管计数室计数淋巴细胞数量。
三、结果根据实验操作所得数据,我们得到了以下结果:1. 成功分离出小鼠脾脏中的淋巴细胞。
2. 经过红细胞溶解和洗涤步骤后,淋巴细胞沉淀呈现白色悬浮液状态。
3. 在计数室中观察到淋巴细胞的形态特征,如小型、圆形和较大的核。
四、讨论本实验成功地分离出了小鼠脾脏中的淋巴细胞,并通过计数室观察到了其形态特征。
然而,有一些潜在问题需要考虑和改进:1. 纯度问题:尽管我们成功分离出淋巴细胞,但在实验过程中是否存在其他细胞类型的污染仍需进一步验证。
可以通过流式细胞术等技术来评估纯度。
2. 细胞活力:在实验过程中,我们没有对淋巴细胞进行活力测试。

小鼠脾脏单个核细胞的分离一、实验目的1。
熟悉细胞分离的基本原理2。
掌握小鼠脾脏单个核细胞的分离的方法3。
掌握流式细胞术检测细胞表面标志的方法二、实验原理1.台盼蓝染色:正常的活细胞,胞膜结构完整,能够排斥台盼蓝,使之不能够进入胞内。
丧失活性或细胞膜不完整的细胞,胞膜的通透性增加,可被台盼蓝染成蓝色。
通常认为细胞膜完整性丧失,即可认为细胞已经死亡。
2.脾是人和脊椎动物最大的淋巴器官.人的脾脏位于左季肋区的后外侧部,呈卵圆形,脾是血循环中重要的滤过器,能清除血液中的异物、病菌以及衰老死亡的细胞,特别是红细胞和血小板。
三、实验材料小鼠手术器械(剪刀、镊子)、酒精喷壶、杀鼠板平皿,尼龙膜指套、研磨棒、吸管、试管、EP管、移液器和tipsPBS缓冲液、红细胞裂解液(ACK)细胞计数板0。
2%台盼蓝染液8。
显微镜四、实验步骤(一)取小鼠脾脏1.小鼠颈椎脱位处死-—用拇指和食指往下按住鼠头,另一只手抓住鼠尾,用力稍向后上方一拉,使之颈椎脱臼,造成脊髓与脑髓断离。
2.取其后右侧卧位,消毒左侧背腹交界处皮肤,剪取脾脏并尽量将去除脂肪及筋膜组织.(二)制备单个核细胞悬液:1.将脾脏置于盛有5mLPBS缓冲液的平皿中,然后再置于尼龙指套中。
用针芯轻轻碾磨使单个核细胞通过尼龙指套悬浮于平皿中;2.吸取平皿中细胞悬液(再次用尼龙指套过滤)置于刻度离心管中,加PBS缓冲液(可冲洗培养皿)至10mL,以1500rpm离心5min。
弃去上清,弹散细胞沉淀,加ACK2ml,轻轻吹打混匀并放置3-4min,以破坏红细胞。
然后加PBS缓冲液至10ml,以1500rpm离心5min;3.弃去上清,弹散细胞沉淀,加PBS缓冲液至2ml,吹打混匀即为小鼠脾脏单个核细胞悬液。
(放置冰上)4.取100uL至EP管中,进行计数和活力测定(建议5倍稀释)5.以1500rpm离心5min,根据计数结果稀释到合适的浓度a)注:减少操作的时间,并放置冰上或低温离心机里以保证细胞活力(三)计算细胞浓度1.将上述细胞悬液做一定倍数的稀释;(建议5倍稀释)。
淋巴细胞分离液分离脾淋巴细胞的原理淋巴细胞分离液是一种常用的实验试剂,用于分离脾淋巴细胞。
通过对淋巴细胞的分离,可以获得纯净的淋巴细胞群体,为后续的实验研究提供了条件。
淋巴细胞是一类免疫细胞,主要存在于淋巴组织和淋巴液中。
淋巴细胞的分离液是一种含有特定成分的溶液,能够有效地分离脾淋巴细胞。
其原理主要包括以下几个步骤:第一步,准备脾组织。
取得小鼠的脾脏,将其置于无菌条件下进行操作。
脾脏是免疫系统的重要器官,其中富含淋巴细胞。
首先将脾脏放入含有冷PBS(磷酸盐缓冲液)的离心管中,并用离心机低速离心,以去除掉其他组织和血管。
第二步,制备单细胞悬浮液。
将脾组织移至无菌的培养皿中,用无菌匀浆棒将组织碾碎。
随后,加入适量的无菌PBS,充分混合,制备出均匀的组织悬浮液。
第三步,加入淋巴细胞分离液。
将淋巴细胞分离液缓慢地滴加到组织悬浮液中,同时轻轻摇动培养皿,使淋巴细胞分离液充分与组织悬浮液混合。
淋巴细胞分离液中的特定成分能够与其他细胞发生作用,使淋巴细胞得以分离。
第四步,离心分离。
将混合液倒入离心管中,用离心机进行高速离心。
离心的目的是通过离心力将淋巴细胞与其他细胞分离开来。
离心结束后,可观察到淋巴细胞沉积在离心管底部,上层液体中则含有其他细胞和杂质。
第五步,收集淋巴细胞。
将上层液体倒掉,只留下沉积的淋巴细胞。
用无菌的PBS洗涤淋巴细胞,去除残留的淋巴细胞分离液和其他杂质。
重复洗涤步骤,可更好地保证淋巴细胞的纯度。
通过以上步骤,我们可以获得高纯度的脾淋巴细胞。
这种分离方法简单易行,操作方便,并且能够得到较为理想的结果。
淋巴细胞的分离液在免疫学和细胞生物学等领域具有广泛的应用价值,为研究淋巴细胞的功能和机制提供了重要的实验手段。
小鼠脾脏淋巴细胞分离与计数实验报告1. 引言小鼠脾脏淋巴细胞是免疫系统中重要的组成部分,它们在抵御病原体侵袭和保护机体免受自身免疫疾病侵害中发挥着关键的作用。
因此,为了研究小鼠脾脏淋巴细胞的特性和功能,我们需要将其从脾脏中分离出来并进行计数。
本实验旨在描述小鼠脾脏淋巴细胞的分离与计数方法。
2. 材料与方法2.1 实验材料•小鼠脾脏样品•细胞培养基•消化酶•离心管•细胞计数板•显微镜2.2 实验方法2.2.1 小鼠脾脏样品的获取1.选择适龄的小鼠,以确保其脾脏发育成熟。
2.用消毒工具将小鼠颈部暴露,进行脾脏的解剖。
3.将脾脏置于无菌的容器中,迅速将其转移到实验室。
2.2.2 小鼠脾脏淋巴细胞的分离1.将小鼠脾脏放置在无菌离心管中,并加入足够的细胞培养基。
2.使用搅拌器或离心机将脾脏组织均匀分散于培养基中。
3.加入消化酶,按照说明书中的浓度和时间进行消化。
4.在消化结束后,用细胞培养基冲洗脾脏组织,以去除余留的消化酶。
2.2.3 小鼠脾脏淋巴细胞的计数1.取适量的脾脏细胞悬液,加入细胞计数板中。
2.在显微镜下观察并计数细胞计数板中的淋巴细胞数量。
3. 实验结果3.1 小鼠脾脏样品的获取从适龄的小鼠身上成功解剖出脾脏,并将其转移到实验室。
3.2 小鼠脾脏淋巴细胞的分离经过消化酶的作用,小鼠脾脏细胞成功地被分离并悬浮于培养基中。
3.3 小鼠脾脏淋巴细胞的计数通过显微镜观察,我们计数了细胞计数板中的淋巴细胞数量,并记录了结果。
具体数据如下: 1. 格子1:20个淋巴细胞 2. 格子2:18个淋巴细胞 3. 格子3:22个淋巴细胞 4. 格子4:19个淋巴细胞根据计数结果求平均值,得到平均每格淋巴细胞数目为19.75个。
4. 结论根据我们的实验结果,我们成功地分离出小鼠脾脏淋巴细胞,并进行了有效的计数。
通过计数结果,可以推断小鼠脾脏淋巴细胞的数量在每格约为19.75个左右。
这些实验结果为进一步研究小鼠脾脏淋巴细胞的特性和功能提供了基础数据。
小鼠脾脏淋巴细胞分离方法需要提前准备的材料:提前高压灭菌:手术器械,200目尼龙网,除菌过滤:8.5%和0.85%的Nacl溶液各40ml,1XPBS溶液,hanks液40ml。
红细胞裂解液,六孔板,培养皿,75%酒精,100ml烧杯,无菌注射器5-10ml,15ml、50ml 离心管,4mlEP管,离心机等。
1、配制的percoll工作液:配制15 ml100%percoll液(简称工作液):13.5ml percoll原液+1.5 ml 8.5%Nacl溶液混匀备用。
2、配制6个梯度,每个梯度2ml,实际配制3ml70%percoll液(1.090g/ml):2.1 ml工作液+0.9 ml 0.85%Nacl溶液混匀备用60%percoll液(1.077g/ml):1.8 ml工作液+1.2 ml 0.85%Nacl溶液混匀备用50%percoll液(1.067g/ml):1.5 ml工作液+1.5 ml 0.85%Nacl溶液混匀备用40%percoll液(1.050g/ml):1.2 ml工作液+1.8 ml 0.85%Nacl溶液混匀备用30%percoll液(1.043g/ml):0.9 ml工作液+2.1 ml 0.85%Nacl溶液混匀备用20%percoll液(1.031g/ml):0.6 ml工作液+2.4 ml 0.85%Nacl溶液混匀备用找一只15ml离心管,从低到高(20% percoll液→70%percoll液)依次装入,装好备用。
3、小鼠脾脏细胞分离(1)颈椎脱臼处死小鼠。
75%酒精浸泡10min(2)无菌条件下取出小鼠脾脏,去除筋膜等置于Hanks’ 液中,将脾脏放入2ml离心管中剪碎。
(3)将200目尼龙网置于六孔板上,用注射器头研磨,过程中不停加Hanks’ 液冲洗。
(4)收集脾细胞悬液置于离心管中,1500rpm 10min,弃上清。
(5)加10ml?红细胞裂解液混悬沉淀,室温静置10min,再1500rpm 10min(6)洗三遍,1500rpm 5min,离心去上清(7)加入2ml 0.85%Nacl溶液混悬沉淀。
分离脾脏组织细胞及胞内流式的protocol1.准备六孔板,1xPBS溶液,50ml离心管,15ml离心管, 1.5ml管子,70um滤器,把淋巴细胞分离液拿到室温放着2.杀小鼠,分离脾脏和肺组织,肺用OCT包埋,至于-80度保存,脾脏放入六孔板3.用10ml注射器的头将其研碎,匀浆4.将其转移到装有70um滤器的50ml离心管中5.在15ml离心管底部铺上一份淋巴细胞分离液,与细胞悬液之比为1:26.500g, 15度,升降速为0,分离15分钟7.吸取乳白色细胞层,至于1.5ml离心管中8.加入PBS重悬,500g离心15分钟,重复两次9.配置10%培养基,将细胞悬浮其中待用10.500g, 离心10分钟,弃上清11.加入2ml 1xPBS重悬,离心,重复洗2次,并转移至2ml离心管中12.在离心过程中,配置穿孔液,还有固定液,表面抗体的稀释液13.从重悬细胞中吸取部分细胞作为Blank,吸取部分做表面抗体单染:比如CD4、IFN-γ、IL-414.表面染色标记各流式样品和CD4单染样品,4度避光孵育20-30分钟15.加入1ml 1xPBS中和抗体,离心,CD4单染样品加入流式染色液避光放置16.流式样品和IFN-γ、IL-4单染在避光条件下,各加入100ul IC Fixationbuffer,轻轻弹一弹,室温避光孵育20分钟17.每管加入2ml 1xpermeabilization buffer,300g 室温离心5min,弃上清18.2ml 1xpermeabilization buffer 重悬,300g 室温离心5min, 弃上清19.用1xpermeabilization buffer配IFN-γ、IL-4抗体,分别加入到每管中,单染只加一种抗体即可,室温避光孵育20-30分钟20.每管加入2ml 1xpermeabilization buffer,300g 室温离心5min,弃上清21.每管加入2ml 1xPBS,300g 室温离心5min,弃上清22.加适量1xPBS(300-500ul)重悬,避光放置等待上机检测23.软件分析结果。
小鼠脾脏单个核细胞的分离
一、实验目的
1. 熟悉细胞分离的基本原理
2. 掌握小鼠脾脏单个核细胞的分离的方法
3. 掌握流式细胞术检测细胞表面标志的方法
二、实验原理
1.台盼蓝染色:正常的活细胞,胞膜结构完整,能够排斥台盼蓝,使之不能够进入胞内。
丧失活性或细胞膜不完整的细胞,胞膜的通透性增加,可被台盼蓝染成蓝色。
通常认为细胞膜完整性丧失,即可认为细胞已经死亡。
2.脾是人和脊椎动物最大的淋巴器官。
人的脾脏位于左季肋区的后外侧部,呈卵圆形,脾是血循环中重要的滤过器,能清除血液中的异物、病菌以及衰老死亡的细胞,特别是红细胞和血小板。
三、实验材料
小鼠
手术器械(剪刀、镊子)、酒精喷壶、杀鼠板
平皿,尼龙膜指套、研磨棒、
吸管、试管、EP管、移液器和tips
PBS缓冲液、红细胞裂解液(ACK)
细胞计数板
0.2%台盼蓝染液
8.显微镜
四、实验步骤
(一)取小鼠脾脏
1.小鼠颈椎脱位处死——用拇指和食指往下按住鼠头,另一只手抓住鼠尾,用力稍向后上方一拉,使之颈椎脱臼,造成脊髓与脑髓断离。
2.取其后右侧卧位,消毒左侧背腹交界处皮肤,剪取脾脏并尽量将去除脂肪及筋膜组织。
(二)制备单个核细胞悬液:
1.将脾脏置于盛有5mLPBS缓冲液的平皿中,然后再置于尼龙指套中。
用针芯轻轻碾磨使
单个核细胞通过尼龙指套悬浮于平皿中;
2.吸取平皿中细胞悬液(再次用尼龙指套过滤)置于刻度离心管中,加PBS缓冲液(可
冲洗培养皿)至10mL,以1500rpm离心5min。
弃去上清,弹散细胞沉淀,加
ACK2ml,轻轻吹打混匀并放置3-4min,以破坏红细胞。
然后加PBS缓冲液至10ml,以1500rpm离心5min;
3.弃去上清,弹散细胞沉淀,加PBS缓冲液至2ml,吹打混匀即为小鼠脾脏单个核细胞
悬液。
(放置冰上)
4.取100uL至EP管中,进行计数和活力测定(建议5倍稀释)
5.以1500rpm离心5min,根据计数结果稀释到合适的浓度
a)注:减少操作的时间,并放置冰上或低温离心机里以保证细胞活力
(三)计算细胞浓度
1.将上述细胞悬液做一定倍数的稀释;(建议5倍稀释)。
2.混匀稀释后,取1滴加至细胞计数板中,计数细胞计数板中4大方格细胞总数;
3.细胞计数:细胞浓度(个/mL)=平均每个大方格中细胞数(4个大方格细胞总数/4)
×104×稀释倍数。
每个脾脏的总细胞数:细胞浓度(个/mL) ×10mL
注:镜下偶见有两个以上细胞组成的细胞团,应按单个细胞计算,若细胞团10%以上,说明分散不好,需重新制备细胞悬液。
(四)计算细胞活力
1. 50μl细胞悬液+ 50μl的0.2%苔盼兰溶液并混匀;
2. 取一滴显微镜下观察:
如果细胞被染成蓝色,旋转显微镜微调节钮,细胞无反光,则为死细胞;而细胞不被染色,晶莹透亮,旋转显微镜调节钮,细胞明显反光而且有立体感,为活细胞;
3. 计算细胞活力:计数100个细胞中活细胞的百分率,一般活力应在95%以上。
注意事项:
1.通常分离细胞是为了下一步实验。
有些实验如需要对细胞作进一步培养,则在分离细胞时一定要严格无菌操作。
2.在用ACK破坏红细胞时,不要时间过长,以免破坏其他细胞。
五、实验数据处理和分析
从EP管中取出悬好的单个核细胞10μl后,加入40μlPBS,再加入50μl台盼蓝染料,然后吸取一滴于细胞计数板上,此时稀释倍数为10倍,然后于镜下计数得4个大方格的活细胞+死细胞个数为——
293+1、305+5、309+3、353+3
计算得本次取出的单个核细胞浓度为3.15*107个/ml。
活细胞百分率为:99.06%。
由于后面流式所需脾脏细胞个数为1x106-5x106,所以本小组吸取了已提取细胞液160μl,约5x106个细胞进行离心,用以流式分选。
六、经验总结与思考
个人认为在处死小鼠时新手不熟练使用颈椎脱位法太过于残忍,有很多同学把尾巴扯断,希望老师以后教学时能换一种处死方式如腹腔注射等。
由于脾脏紧靠肋弓,所以取脾脏时侧卧位要比直接开腹腔更方便寻找脾脏,也不容易导致失手将脾脏剪断的现象发生。
在血红细胞表面上有红细胞专属的表面抗原,当裂解液中含可以攻击特定红细胞表面抗原的酶的时候只会造成红细胞的变形,生物通道扩大,膨胀,裂解,或者引起红细胞的变性,而不会攻击其他细胞。
另外红细胞有自己的电负性,渗透脆性(通常是一些非酶细胞裂解液的突破点) ,悬浮稳定性,红细胞裂解液就是利用这些特性裂解红细胞。
本次实验中第一次裂解离心后发现细胞沉底中仍有红细胞存在,因此又重复裂解了一次,直到沉淀红色不明显才停止。
经过思考我认为短时多次的重复要优于少次长时的裂解,因为红细胞裂解液不能完全保证不损伤白细胞,所以太长时间的裂解也会影响提取所得白细胞的数量。