脾脏分离淋巴细胞
- 格式:docx
- 大小:14.68 KB
- 文档页数:1

小鼠脾脏淋巴细胞分离方法需要提前准备的材料:提前高压灭菌:手术器械,200目尼龙网,除菌过滤:8.5%和0.85%的Nacl溶液各40ml,1XPBS溶液,hanks液40ml。
红细胞裂解液,六孔板,培养皿,75%酒精,100ml烧杯,无菌注射器5-10ml,15ml、50ml 离心管,4mlEP管,离心机等。
1、配制的percoll工作液:配制15 ml100%percoll液(简称工作液):13.5ml percoll原液+1.5 ml 8.5%Nacl溶液混匀备用。
2、配制6个梯度,每个梯度2ml,实际配制3ml70%percoll液(1.090g/ml):2.1 ml工作液+0.9 ml 0.85%Nacl溶液混匀备用60%percoll液(1.077g/ml):1.8 ml工作液+1.2 ml 0.85%Nacl溶液混匀备用50%percoll液(1.067g/ml):1.5 ml工作液+1.5 ml 0.85%Nacl溶液混匀备用40%percoll液(1.050g/ml):1.2 ml工作液+1.8 ml 0.85%Nacl溶液混匀备用30%percoll液(1.043g/ml):0.9 ml工作液+2.1 ml 0.85%Nacl溶液混匀备用20%percoll液(1.031g/ml):0.6 ml工作液+2.4 ml 0.85%Nacl溶液混匀备用找一只15ml离心管,从低到高(20% percoll液→70%percoll液)依次装入,装好备用。
3、小鼠脾脏细胞分离(1)颈椎脱臼处死小鼠。
75%酒精浸泡10min(2)无菌条件下取出小鼠脾脏,去除筋膜等置于Hanks’ 液中,将脾脏放入2ml离心管中剪碎。
(3)将200目尼龙网置于六孔板上,用注射器头研磨,过程中不停加Hanks’ 液冲洗。
(4)收集脾细胞悬液置于离心管中,1500rpm 10min,弃上清。
(5)加10ml?红细胞裂解液混悬沉淀,室温静置10min,再1500rpm 10min(6)洗三遍,1500rpm 5min,离心去上清(7)加入2ml 0.85%Nacl溶液混悬沉淀。

提取大鼠淋巴细胞的步骤:1.准备工作:将实验用具(小剪子3把,小镊子3把,磁盘1个,离心管1盒,离心管盖1盒,筛网1盒,表面皿1组,注射器2支,手套1副,1000ul枪头1盒,200ul枪头1盒,10ul枪头1盒,白大褂)放在紫外光下照射30分钟以上。
实验试剂(PBS、无血清的培养液、有血清的培养液、淋巴细胞分离液)准备好。
检查酒精灯内酒精量灯芯、酒精棉量。
脱颈处死,放入酒精中浸泡20分钟(可放到无菌室中)。
3.拿好实验药液(有血清的培养液,无血清的培养液,PBS,淋巴细胞分离液)进入无菌室,穿好白服套袖,于手上身上喷好酒精消毒,进入操作台,擦拭台子,台子干后点燃酒精灯。
(缓冲液,生化反应中以免影响体系PH值波动),将大鼠取出至于磁盘中,于腹中线剪开皮毛,向左侧剪开,用镊子在大鼠左侧找到长条状的脾脏,将脾脏至于PBS中分离结缔组织。
注意:勿将脾脏接触到皮毛引起污染,结缔组织尽量去除干净200目),浸湿,用镊子夹取脾脏至于筛网上,用第一个注射器芯将其碾碎干净(碾碎至筛网上剩余物质为白色),吸取无血清培养液2mlPBS的无用表面皿中。
注意:夹取脾脏的镊子不可以碰到筛网以外的液体中,以免污染组织;注入培养液时不要产生气泡(气泡会影响细胞生长)。
6.避光条件下,第二个注射器吸取3ml淋巴细胞分离液(先注入气体再抽取液体)加于离心管中(加4个)。
将装有组织液的表面皿倾用新的一二混用注射器吸取3ml缓慢注入离心管中,一定要让界面明显。
7.稳拿离心管放入离心机中,离心(2500r/min,20min)。
注意:动作稳,配平时找放的稳得离心管。
若脾脏的状态不好,可适当增加离心转数(3000)。
8.稳稳拿出离心管,用200ul 的枪吸取离心管中处于中间的淡黄色条带(先排气后插入吸取液体,一般能吸取500-600的液体),集中收于第五、六个离心管中,9.离心(1500r/min,10min),慢弃上清(倒入刚才的表面皿中),加入PBS 6-7ml反复吹吸充分,离心(1500r/min,10min)。

一、实验目的1. 学习掌握脾细胞提取的基本原理和方法。
2. 熟悉无菌操作流程,提高实验操作技能。
3. 了解脾细胞在免疫学研究中的应用。
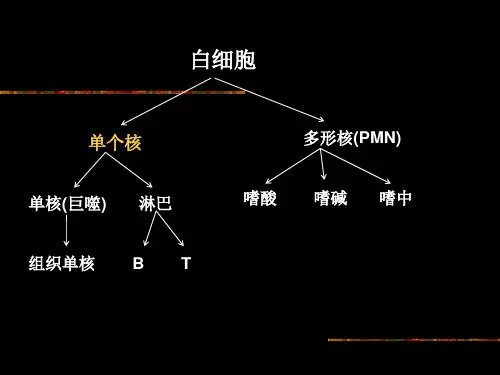
二、实验原理脾脏是人体重要的免疫器官,其中含有丰富的免疫细胞,如B淋巴细胞、T淋巴细胞、巨噬细胞等。
脾细胞提取实验旨在从脾脏中获取这些免疫细胞,为后续的免疫学研究和实验提供材料。
三、实验材料与仪器1. 实验材料:成年小鼠、胰蛋白酶、Hanks平衡盐溶液(HBSS)、FBS、离心管、吸管、解剖显微镜、手术刀、镊子、剪刀、无菌操作台等。
2. 实验仪器:细胞培养箱、低温离心机、细胞计数仪、显微镜等。
四、实验步骤1. 小鼠麻醉与解剖- 将小鼠置于解剖显微镜下,用麻醉剂将其麻醉。
- 小心切开小鼠腹部皮肤,暴露脾脏。
- 使用手术刀将脾脏从体内取出。
2. 脾细胞制备- 将脾脏置于Hanks平衡盐溶液中,轻轻漂洗去除杂质。
- 使用剪刀将脾脏剪成小块,放入装有胰蛋白酶的离心管中。
- 将离心管置于37℃水浴中消化10-15分钟,期间轻轻摇动。
- 停止消化后,用吸管将消化后的脾细胞悬液转移至新的离心管中。
- 1000g离心5分钟,弃去上清液。
- 加入适量的FBS,重悬细胞,制成脾细胞悬液。
3. 细胞计数与纯度鉴定- 使用细胞计数仪对脾细胞悬液进行计数,计算细胞总数。
- 取少量脾细胞悬液,进行染色(如台盼蓝染色),在显微镜下观察细胞活力和纯度。
4. 细胞培养- 将脾细胞悬液接种于细胞培养瓶中,放入细胞培养箱中培养。
- 定期观察细胞生长情况,记录细胞生长曲线。
五、实验结果1. 脾细胞悬液经离心后,上清液清亮,细胞沉底。
2. 细胞计数仪显示细胞总数为1.5×10^7个。
3. 台盼蓝染色结果显示细胞活力约为90%。
4. 细胞培养过程中,细胞生长良好,呈典型的淋巴细胞形态。
六、实验讨论1. 脾细胞提取实验过程中,无菌操作至关重要,应严格遵循无菌操作规程。
2. 胰蛋白酶消化脾细胞时,消化时间不宜过长,以免损伤细胞。


小鼠全脾分离及淋巴细胞的获取实验步骤:1.杀鼠:将小鼠颈椎脱臼处死,70%酒精喷涂表面,无菌条件下剖开小鼠腹腔2.分离全脾:取脾,横切约1mm厚放入固定液,作为组化样本,其余组织放入1ml 5% FCS 1640.3.脾淋巴细胞的分离:1)脾脏处理:将脾脏置于200目滤网上,用5mL注射器内芯轻轻研磨,不断向组织上滴加2ml 5% FCS 1640,直至组织内绝大部分细胞被分离,1ml注射器抽吸滤过,将细胞收集于5ml离心管中。
.2)500g,3min,弃上清。
3)红细胞裂解:加入1ml 红细胞裂解液,轻轻吹打混匀,室温裂解2分钟至红细胞完全破碎。
4)500g,5min,弃上清。
5)洗涤1次:加入1ml 5% FCS 1640,重悬沉淀,500g,3分钟,弃上清。
加入1mL 10% FCS1640重悬,取出15μL计数;6)台盼蓝染色细胞计数:1:20稀释细胞悬液,与0.4%台盼蓝染液9:1混合,计数;计算终浓度为1×107/mL所需加入10% FCS 1640的量。
7)加入适量10% FCS 1640调整细胞浓度至1×107/mL,置于4ºC备用。
小鼠淋巴结分离及淋巴细胞的获取实验步骤:1.杀鼠:将小鼠颈椎脱臼处死,70%酒精喷涂表面,无菌条件下剖开小鼠腹腔2.分离淋巴结:取腋下,腹股沟,肠系膜淋巴结,其中腋下淋巴结置固定液中送组化,其余淋巴结放入1ml 5% FCS 1640.3.淋巴结淋巴细胞的分离:1)淋巴结处理:将淋巴结漂浮于3ml 5% FCS 1640(玻璃平皿)中,用无菌大镊子紧捏淋巴结,并用5mL注射器内芯轻轻研磨,绝大部分淋巴细胞游离置培养基中,1ml注射器抽吸滤过,将细胞收集于5ml离心管中。
.2)500g,3min,弃上清。
3)洗涤:加入1ml 5% FCS 1640,重悬沉淀,500g,3分钟,弃上清。
加入1mL 10% FCS1640重悬,取出15μL计数;4)台盼蓝染色细胞计数:1:20稀释细胞悬液,与0.4%台盼蓝染液9:1混合,计数;计算终浓度为1×107/mL所需加入10% FCS 1640 的量。

小鼠淋巴细胞的分离培养
一、血液中淋巴细胞的分离:
1在1.5ML离心管中加入淋巴细胞分离液0.7ML;
2眼部采集小鼠的抗凝血,抗凝剂20%.。
3轻轻将血液加入淋巴细胞分离液的表面,立即以2000—2500转/分离心10MIN。
4小心吸取上层细胞,转移至另一1.5ML离心管中,再用HANK’S 悬浮至1.5ML,再离心,去上清,再悬浮,等待分型用。
二、鼠脾脏中淋巴细胞的分离:
1无菌采集鼠的脾脏,且灭菌注射器的弯针头轻轻扎取,尽可能使单个细胞分离,再分别用4层灭菌纱布过滤2次。
2将滤液小心加入淋巴细胞分离液中。
离心。
3 吸取上层淋巴细胞,HANK‘S液洗涤2次(尽可能去除淋巴
细胞分离液)。
4加入1640培养液进行培养。
、
*淋巴细胞分离液不低于全部液体的50%。

肝脏免疫学实验室淋巴细胞分离技术肝脏淋巴细胞分离1.小鼠摘眼球放血后,剪开颈动脉处死,摘取肝脏。
2.将肝脏放在200目钢丝网上自边缘开始研磨,转至15ml离心管中。
3.650rpm×1min离心,将上层液体转至15ml离心管中。
4.1500prm×5min离心后弃上清,重复洗两次。
5.6ml 40% Percoll 溶液重悬沉淀,将3ml 70% Percoll溶液加于其底层,2000rpm×20min,升6降2。
6.吸取两层Percoll溶液之间的白细胞层至15ml离心管中,加满PBS后2000rpm×5min 离心收集细胞。
7.1ml PBS 重悬细胞后,吸取10ul细胞悬液,按照1:1的比例与台盼蓝混匀后计数。
脾脏淋巴细胞分离1.小鼠摘眼球放血后剪开颈动脉处死,摘取脾脏。
2.用载玻片的粗糙面将脾脏一点一点磨碎,将收集的研磨悬液通过200目尼龙网过滤至15ml离心管中,1500rpm×5min离心收集细胞。
3.8ml PBS重悬细胞沉淀,在底层加入3ml Ficoll , 2000rpm×20min,升6降2。
4.吸取两层溶液之间的白细胞层至15ml离心管,加满PBS后2000rpm×5min离心收集细胞。
5.6-8 ml PBS 重悬细胞后,吸取10ul细胞悬液,按照1:1的比例与台盼蓝混匀后计数。
胸腺淋巴细胞分离1.小鼠摘眼球放血后,剪开颈动脉处死,摘取胸腺。
2.将胸腺放在200目钢丝网上研磨,将收集的研磨悬液通过尼龙网过滤至15ml离心管中,1500rpm×5min离心收集细胞。
3.6-8ml PBS 重悬细胞沉淀,再次通过200目尼龙网过滤后,吸取10ul细胞悬液,按照1:1的比例与台盼蓝混匀后计数。
淋巴结淋巴细胞分离1.小鼠摘眼球放血后脱臼处死,摘取淋巴结。
2.用载玻片的粗糙面将淋巴结磨碎,将收集的研磨悬液通过200目尼龙网过滤至15ml 离心管中,1500rpm×5min离心收集细胞。

第1篇一、实验目的1. 了解抗体生成细胞的分离和培养方法。
2. 学习观察和记录抗体生成细胞的形态变化。
3. 掌握抗体生成细胞活性检测的基本技术。
二、实验原理抗体生成细胞是指能够产生抗体的细胞,通常为B淋巴细胞。
在抗原刺激下,B淋巴细胞分化为浆细胞,浆细胞分泌特异性抗体。
本实验通过分离小鼠脾脏中的B淋巴细胞,体外培养并观察其形态变化,以及检测其产生抗体的能力,来研究抗体生成细胞的特性。
三、实验材料1. 实验动物:小鼠2. 试剂:抗原、抗体、Ficoll分层液、RPMI-1640培养基、胎牛血清、青霉素、链霉素、二甲基亚砜(DMSO)、细胞计数板、显微镜等。
四、实验步骤1. 小鼠脾脏细胞分离- 处死小鼠,取出脾脏。
- 将脾脏放入无菌培养皿中,用无菌剪刀剪碎。
- 加入Ficoll分层液,室温静置30分钟。
- 吸取中层细胞,用RPMI-1640培养基洗涤2次。
- 计数细胞,调整细胞浓度为1×10^6个/mL。
2. 细胞培养- 将细胞悬液加入含10%胎牛血清、青霉素、链霉素的RPMI-1640培养基中。
- 将细胞悬液分装至培养皿中,置于37℃、5%CO2的培养箱中培养。
- 每2天更换一次培养基。
3. 形态观察- 在显微镜下观察细胞形态变化,记录细胞生长情况。
4. 抗体生成细胞活性检测- 收集细胞培养液,离心去上清。
- 将细胞沉淀用RPMI-1640培养基重悬,加入抗原,37℃孵育1小时。
- 加入抗体,37℃孵育30分钟。
- 加入底物,观察颜色变化。
- 记录抗体生成细胞活性。
五、实验结果1. 细胞形态观察- 在培养过程中,细胞逐渐从单层排列变为多层排列,细胞体积增大,形态趋于扁平。
2. 抗体生成细胞活性检测- 加入抗原和抗体后,部分细胞出现颜色变化,说明这些细胞能够产生抗体。
六、实验讨论1. 本实验成功分离和培养了小鼠脾脏中的B淋巴细胞,并观察到了细胞形态的变化。
2. 抗体生成细胞活性检测结果表明,部分细胞能够产生抗体,证实了实验的成功。

小鼠脾脏淋巴细胞分离与计数实验报告小鼠脾脏淋巴细胞分离与计数实验报告一、引言淋巴细胞是免疫系统中重要的细胞成分,其在免疫应答和抗体产生中发挥着关键作用。
为了研究淋巴细胞的功能和特性,需要将其从组织中分离出来并进行计数。
本实验旨在通过对小鼠脾脏进行淋巴细胞分离和计数,来获取关于淋巴细胞数量和纯度的信息。
二、材料与方法1. 实验动物:使用C57BL/6小鼠。
2. 仪器与试剂:离心管、离心机、PBS缓冲液、0.83%氯化铵溶液。
3. 实验步骤:A. 准备工作:i. 将离心管预冷至4℃。
ii. 准备PBS缓冲液,并保持在4℃。
B. 小鼠准备:i. 用无菌技术将小鼠安全固定在手术台上。
ii. 使用无菌器械,剪开腹部皮肤和腹壁,暴露脾脏。
iii. 小心取出脾脏并放入含有PBS缓冲液的离心管中。
C. 细胞分离:i. 使用无菌器械,将脾脏组织切碎至细胞悬浮液状态。
ii. 将细胞悬浮液通过70μm滤网过滤,以去除大块组织残渣。
iii. 向过滤后的细胞悬浮液中加入等体积的0.83%氯化铵溶液,进行红细胞溶解。
iv. 用PBS缓冲液洗涤淋巴细胞沉淀,重复此步骤2-3次。
D. 细胞计数:i. 取适量的淋巴细胞悬浮液,加入等体积的尝试涂片溶剂进行稀释。
ii. 在尝试涂片上使用布朗管计数室计数淋巴细胞数量。
三、结果根据实验操作所得数据,我们得到了以下结果:1. 成功分离出小鼠脾脏中的淋巴细胞。
2. 经过红细胞溶解和洗涤步骤后,淋巴细胞沉淀呈现白色悬浮液状态。
3. 在计数室中观察到淋巴细胞的形态特征,如小型、圆形和较大的核。
四、讨论本实验成功地分离出了小鼠脾脏中的淋巴细胞,并通过计数室观察到了其形态特征。
然而,有一些潜在问题需要考虑和改进:1. 纯度问题:尽管我们成功分离出淋巴细胞,但在实验过程中是否存在其他细胞类型的污染仍需进一步验证。
可以通过流式细胞术等技术来评估纯度。
2. 细胞活力:在实验过程中,我们没有对淋巴细胞进行活力测试。

淋巴细胞分离液分离脾淋巴细胞的原理淋巴细胞分离液是一种常用的实验试剂,用于分离脾淋巴细胞。
通过对淋巴细胞的分离,可以获得纯净的淋巴细胞群体,为后续的实验研究提供了条件。
淋巴细胞是一类免疫细胞,主要存在于淋巴组织和淋巴液中。
淋巴细胞的分离液是一种含有特定成分的溶液,能够有效地分离脾淋巴细胞。
其原理主要包括以下几个步骤:第一步,准备脾组织。
取得小鼠的脾脏,将其置于无菌条件下进行操作。
脾脏是免疫系统的重要器官,其中富含淋巴细胞。
首先将脾脏放入含有冷PBS(磷酸盐缓冲液)的离心管中,并用离心机低速离心,以去除掉其他组织和血管。
第二步,制备单细胞悬浮液。
将脾组织移至无菌的培养皿中,用无菌匀浆棒将组织碾碎。
随后,加入适量的无菌PBS,充分混合,制备出均匀的组织悬浮液。
第三步,加入淋巴细胞分离液。
将淋巴细胞分离液缓慢地滴加到组织悬浮液中,同时轻轻摇动培养皿,使淋巴细胞分离液充分与组织悬浮液混合。
淋巴细胞分离液中的特定成分能够与其他细胞发生作用,使淋巴细胞得以分离。
第四步,离心分离。
将混合液倒入离心管中,用离心机进行高速离心。
离心的目的是通过离心力将淋巴细胞与其他细胞分离开来。
离心结束后,可观察到淋巴细胞沉积在离心管底部,上层液体中则含有其他细胞和杂质。
第五步,收集淋巴细胞。
将上层液体倒掉,只留下沉积的淋巴细胞。
用无菌的PBS洗涤淋巴细胞,去除残留的淋巴细胞分离液和其他杂质。
重复洗涤步骤,可更好地保证淋巴细胞的纯度。
通过以上步骤,我们可以获得高纯度的脾淋巴细胞。
这种分离方法简单易行,操作方便,并且能够得到较为理想的结果。
淋巴细胞的分离液在免疫学和细胞生物学等领域具有广泛的应用价值,为研究淋巴细胞的功能和机制提供了重要的实验手段。
小鼠脾脏淋巴细胞分离与计数实验报告1. 引言小鼠脾脏淋巴细胞是免疫系统中重要的组成部分,它们在抵御病原体侵袭和保护机体免受自身免疫疾病侵害中发挥着关键的作用。
因此,为了研究小鼠脾脏淋巴细胞的特性和功能,我们需要将其从脾脏中分离出来并进行计数。
本实验旨在描述小鼠脾脏淋巴细胞的分离与计数方法。
2. 材料与方法2.1 实验材料•小鼠脾脏样品•细胞培养基•消化酶•离心管•细胞计数板•显微镜2.2 实验方法2.2.1 小鼠脾脏样品的获取1.选择适龄的小鼠,以确保其脾脏发育成熟。
2.用消毒工具将小鼠颈部暴露,进行脾脏的解剖。
3.将脾脏置于无菌的容器中,迅速将其转移到实验室。
2.2.2 小鼠脾脏淋巴细胞的分离1.将小鼠脾脏放置在无菌离心管中,并加入足够的细胞培养基。
2.使用搅拌器或离心机将脾脏组织均匀分散于培养基中。
3.加入消化酶,按照说明书中的浓度和时间进行消化。
4.在消化结束后,用细胞培养基冲洗脾脏组织,以去除余留的消化酶。
2.2.3 小鼠脾脏淋巴细胞的计数1.取适量的脾脏细胞悬液,加入细胞计数板中。
2.在显微镜下观察并计数细胞计数板中的淋巴细胞数量。
3. 实验结果3.1 小鼠脾脏样品的获取从适龄的小鼠身上成功解剖出脾脏,并将其转移到实验室。
3.2 小鼠脾脏淋巴细胞的分离经过消化酶的作用,小鼠脾脏细胞成功地被分离并悬浮于培养基中。
3.3 小鼠脾脏淋巴细胞的计数通过显微镜观察,我们计数了细胞计数板中的淋巴细胞数量,并记录了结果。
具体数据如下: 1. 格子1:20个淋巴细胞 2. 格子2:18个淋巴细胞 3. 格子3:22个淋巴细胞 4. 格子4:19个淋巴细胞根据计数结果求平均值,得到平均每格淋巴细胞数目为19.75个。
4. 结论根据我们的实验结果,我们成功地分离出小鼠脾脏淋巴细胞,并进行了有效的计数。
通过计数结果,可以推断小鼠脾脏淋巴细胞的数量在每格约为19.75个左右。
这些实验结果为进一步研究小鼠脾脏淋巴细胞的特性和功能提供了基础数据。
小鼠脾脏淋巴细胞分离方法需要提前准备的材料:提前高压灭菌:手术器械,200目尼龙网,除菌过滤:8.5%和0.85%的Nacl溶液各40ml,1XPBS溶液,hanks液40ml。
红细胞裂解液,六孔板,培养皿,75%酒精,100ml烧杯,无菌注射器5-10ml,15ml、50ml 离心管,4mlEP管,离心机等。
1、配制的percoll工作液:配制15 ml100%percoll液(简称工作液):13.5ml percoll原液+1.5 ml 8.5%Nacl溶液混匀备用。
2、配制6个梯度,每个梯度2ml,实际配制3ml70%percoll液(1.090g/ml):2.1 ml工作液+0.9 ml 0.85%Nacl溶液混匀备用60%percoll液(1.077g/ml):1.8 ml工作液+1.2 ml 0.85%Nacl溶液混匀备用50%percoll液(1.067g/ml):1.5 ml工作液+1.5 ml 0.85%Nacl溶液混匀备用40%percoll液(1.050g/ml):1.2 ml工作液+1.8 ml 0.85%Nacl溶液混匀备用30%percoll液(1.043g/ml):0.9 ml工作液+2.1 ml 0.85%Nacl溶液混匀备用20%percoll液(1.031g/ml):0.6 ml工作液+2.4 ml 0.85%Nacl溶液混匀备用找一只15ml离心管,从低到高(20% percoll液→70%percoll液)依次装入,装好备用。
3、小鼠脾脏细胞分离(1)颈椎脱臼处死小鼠。
75%酒精浸泡10min(2)无菌条件下取出小鼠脾脏,去除筋膜等置于Hanks’ 液中,将脾脏放入2ml离心管中剪碎。
(3)将200目尼龙网置于六孔板上,用注射器头研磨,过程中不停加Hanks’ 液冲洗。
(4)收集脾细胞悬液置于离心管中,1500rpm 10min,弃上清。
(5)加10ml?红细胞裂解液混悬沉淀,室温静置10min,再1500rpm 10min(6)洗三遍,1500rpm 5min,离心去上清(7)加入2ml 0.85%Nacl溶液混悬沉淀。
分离脾脏组织细胞及胞内流式的protocol1.准备六孔板,1xPBS溶液,50ml离心管,15ml离心管, 1.5ml管子,70um滤器,把淋巴细胞分离液拿到室温放着2.杀小鼠,分离脾脏和肺组织,肺用OCT包埋,至于-80度保存,脾脏放入六孔板3.用10ml注射器的头将其研碎,匀浆4.将其转移到装有70um滤器的50ml离心管中5.在15ml离心管底部铺上一份淋巴细胞分离液,与细胞悬液之比为1:26.500g, 15度,升降速为0,分离15分钟7.吸取乳白色细胞层,至于1.5ml离心管中8.加入PBS重悬,500g离心15分钟,重复两次9.配置10%培养基,将细胞悬浮其中待用10.500g, 离心10分钟,弃上清11.加入2ml 1xPBS重悬,离心,重复洗2次,并转移至2ml离心管中12.在离心过程中,配置穿孔液,还有固定液,表面抗体的稀释液13.从重悬细胞中吸取部分细胞作为Blank,吸取部分做表面抗体单染:比如CD4、IFN-γ、IL-414.表面染色标记各流式样品和CD4单染样品,4度避光孵育20-30分钟15.加入1ml 1xPBS中和抗体,离心,CD4单染样品加入流式染色液避光放置16.流式样品和IFN-γ、IL-4单染在避光条件下,各加入100ul IC Fixationbuffer,轻轻弹一弹,室温避光孵育20分钟17.每管加入2ml 1xpermeabilization buffer,300g 室温离心5min,弃上清18.2ml 1xpermeabilization buffer 重悬,300g 室温离心5min, 弃上清19.用1xpermeabilization buffer配IFN-γ、IL-4抗体,分别加入到每管中,单染只加一种抗体即可,室温避光孵育20-30分钟20.每管加入2ml 1xpermeabilization buffer,300g 室温离心5min,弃上清21.每管加入2ml 1xPBS,300g 室温离心5min,弃上清22.加适量1xPBS(300-500ul)重悬,避光放置等待上机检测23.软件分析结果。
从小鼠脾脏中分离淋巴细胞
方法一:
1用注射器内芯或者研棒研磨过100目筛网,Hank’s液冲洗,收集分离的脾细胞悬液。
2另取无菌试管,先加入淋巴细胞分离液,然后将试管倾斜,略放平,吸取刚刚制备的细胞悬液缓慢的加入试管中,一般分离液和细胞悬液的体积比为1:2,要轻要慢,不要冲破了淋巴细胞分离液和细胞悬液的界面。
室温水平离心2000转/分钟,30分钟。
3离心后取出试管,可以看到不同的分层,一般上面是非细胞成分和细胞碎片,接下来是单个核细胞,再往下是红细胞等。
吸走上层非细胞层弃之,吸出单个核层在另外无菌试管中,因为淋巴细胞分离液对细胞有毒性作用,加入PBS离心洗两遍(1000转/分钟,10分钟)。
4倾倒上清,用RPMI-1640重悬细胞。
方法二:
用注射器内芯或者研棒研磨过100目筛网,Hank’s液冲洗,收集分离的脾细胞悬液,2000r/min离心3min,弃上清。
加红细胞裂解液8mL,混匀脾细胞,静置5-6min,待红细胞完全破碎,2000r/min离心3min,弃上清去除红细胞,Hank’s液洗1-2遍,用RPMI-1640(含10%胎牛血清)重悬细胞。