物理化学上册第四章-2
- 格式:ppt
- 大小:1.16 MB
- 文档页数:34




资料范本本资料为word版本,可以直接编辑和打印,感谢您的下载物理化学核心教程(第二版)沈文霞编科学出版社_课后习题详解第四章地点:__________________时间:__________________说明:本资料适用于约定双方经过谈判,协商而共同承认,共同遵守的责任与义务,仅供参考,文档可直接下载或修改,不需要的部分可直接删除,使用时请详细阅读内容第四章多组分系统热力学三.思考题参考答案1.偏摩尔量与摩尔量有什么异同?答:对于单组分系统,只有摩尔量,而没有偏摩尔量。
或者说,在单组分系统中,偏摩尔量就等于摩尔量。
只有对多组分系统,物质的量也成为系统的变量,当某物质的量发生改变时,也会引起系统的容量性质的改变,这时才引入了偏摩尔量的概念。
系统总的容量性质要用偏摩尔量的加和公式计算,而不能用纯的物质的摩尔量乘以物质的量来计算。
2.什么是化学势?与偏摩尔量有什么区别?答:化学势的广义定义是:保持某热力学函数的两个特征变量和除B以外的其他组分不变时,该热力学函数对B物质的量求偏微分。
通常所说的化学势是指它的狭意定义,即偏摩尔Gibbs自由能,即在等温、等压下,保持除B以外的其它物质组成不变时,Gibbs自由能随B物质的量的改变的变化率称为化学势。
用公式表示为:偏摩尔量是指,在等温、等压条件下,保持除B以外的其余组分不变,系统的广度性质X随组分B的物质的量的变化率,称为物质B的某种广度性质X 的偏摩尔量,用表示。
也可以看作在一个等温、等压、保持组成不变的多组分系统中,当时,物质B所具有的广度性质,偏摩尔量的定义式为化学势与偏摩尔量的定义不同,偏微分的下标也不同。
但有一个例外,即Gibbs自由能的偏摩尔量和化学势是一回事,狭意的化学势就是偏摩尔Gibbs 自由能。
3.Roult 定律和Henry定律的表示式和适用条件分别是什么?答:Roult 定律的表示式为:。
式中为纯溶剂的蒸气压,为溶液中溶剂的蒸气压,为溶剂的摩尔分数。




物理化学(上册)
绪论
第一章气体
第二章热力学第一定律
第三章热力学第二定律
第四章多组分系统热力学
第五章化学平衡
第六章相平衡
单组分化学势就是摩尔量吉布斯函数,用
多组分系统热力学基本关系式(适用条件封闭系统多组分)
由热力学基本关系式可以得到化学势广义定义
多相多组分化学势判据:
3. 多相多组分平衡时:
1.标准态:T温度、
2m3m
3.真实气体的化学势表示为:
1.逸度和逸度系数
2.逸度和逸度系数计算
1.以气体的标准态为标准态
m2m3m
2.以液体的标准态为标准态
以液体的标准态为标准态时:
物理化学。
1化学反应速率与化学平衡34.3.1 可逆反应与化学平衡(一)化学反应的可逆性和可逆反应绝大多数化学反应都有一定可逆性:例如:N 2 (g) + 3 H 2 (g) 2 NH 3 (g)只有极少数反应是不可逆的:例如: 2 KClO 3(s) =2 KCl (s) + 3 O 2 (g)可逆反应:在同一条件下,能同时向两个相反方向进行的反应。
4(二)化学平衡化学平衡的特征:(1)系统的组成不随时间而改变;(2)化学平衡是动态平衡。
(3)平衡状态与达到平衡的途径无关;定义:可逆反应在一定条件下,正反应速率等于逆反应速率时,反应体系所处的状态。
4.3.1 可逆反应与化学平衡5在373 K 恒温槽中反应一段时间后,达到平衡,测得平衡时N 2O 4和NO 2 浓度。
0.1600.100NO 2开始0.370.0700.100N 2O 4从反应混合物0.0720.100NO 2开始0.370.0140N 2O 4从产物0.1200NO 2开始0.360.0400.100N 2O 4从反应物c 2(NO 2)/c (N 2O 4)平衡浓度起始浓度N 2O 4-NO 2体系的平衡浓度(mol/L )(373K )化学平衡的实例N 2O 4 (g) 2 NO 2(g)无色红棕色64.3.2 平衡常数1. 定义:在一定温度下,可逆反应达到平衡时,产物浓度的方程式计量系数次方的乘积与反应物浓度的方程式计量系数次方的乘积之比,为一常数,称为“平衡常数”。
用K 表示。
2. 意义:表示在一定条件下,可逆反应能进行的极限。
K 越大,正反应进行得越彻底。
7有关化学平衡常数的说明①化学平衡常数K 只是温度的函数。
②平衡常数不涉及时间概念,不涉及反应速率。
例如:N 2O 4(g) 2 NO 2(g)T /K 273 323 373K 5×10-4 2.2×10-2 3.7×10-12SO 2(g) + O 2(g) 2SO 3(g) K =3.6 ×1024(298K)K 很大,但常温下反应速率很小。
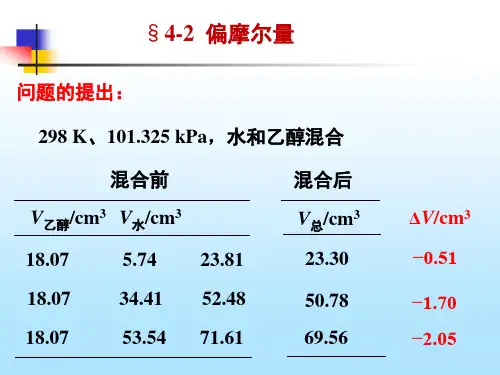
物理化学(上)第四章总结第四章主要公式及其适用条件一.偏摩尔量1.定义: B n p T BX nXBC =?≠,, ,该式只适用于均相系统。
2. 偏摩尔量的集合公式:∑==kB m B B X n X 1,,该式只适用于均相系统平衡态。
3.吉布斯—杜亥姆公式:01,=∑=kB m B B dX n二.化学势 1.化学势的定义:注意:(1)下标条件(2),只有用吉布斯自由能表示的化学势才是偏摩尔量。
2.化学势(指)与各因素的关系(1)化学势的集合公式:(2)化学势在等温等压下的吉布斯—杜亥姆公式:(3)化学势与压力、温度的关系:B ,,(c B)()cS V n BU n μ≠?=?,,(c B)()c T p n B G n ≠?=?,,(c B)()c S p n BH n ≠?=?)(,,)(B C C Bn V T n A≠??=3. 多组分系统热力学基本方程适用条件:均相系统,W/=0的任意过程。
4. 化学势判据对多组分体系,三.气体化学势的表达式1.理想气体化学势的表达式(1)纯理想气体的化学势:理想气体的标准态化学势。
即温度为T,p=p0=100kPa 的纯理想气体。
(2)混合理想气体中某组分B的化学势(P B-理想气体B的分压,而不是混合理想气体的总压)2.非理想气体的化学势(1)纯实际气体对于纯实际气体,θθμμp pRT T p T ~*ln )(),(+= 或:θθμμp p RT T p T ln )(),(*+=。
逸度因子:p p~=?。
(2)混合实际气体B 的化学势可表示为:θθμμp p RT T p T B B ~ln)(),(+= 路易斯-兰道尔规则:B B B y p p *~~=,(条件:*,B m B V V =) 四.溶液中各组分的化学势 1.稀溶液的两个经验定律(1)拉乌尔定律,x A :溶剂在溶液中的摩尔分数。
(2)亨利定律, x B :溶质在溶液中的摩尔分数;,b B :质量摩尔浓度,mol/kg ;,c B :物质的量浓度,mol/L 。