共价结合型果胶含量试剂盒说明书(分光光度法)
- 格式:doc
- 大小:40.00 KB
- 文档页数:2
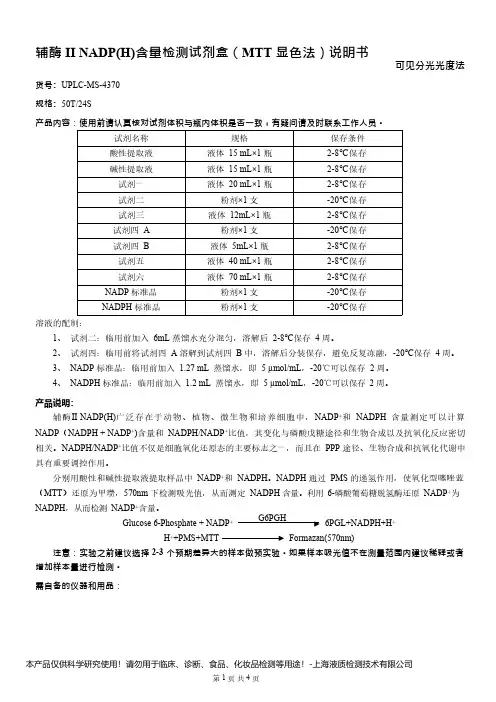
辅酶II NADP(H)含量检测试剂盒(MTT 显色法)说明书货号:UPLC-MS-4370规格:50T/24S可见分光光度法产品内容:使用前请认真核对试剂体积与瓶内体积是否一致,有疑问请及时联系工作人员。
试剂名称规格保存条件酸性提取液液体15mL×1瓶2-8℃保存碱性提取液液体15mL×1瓶2-8℃保存试剂一液体20mL×1瓶2-8℃保存试剂二粉剂×1支-20℃保存试剂三液体12mL×1瓶2-8℃保存试剂四A 粉剂×1支-20℃保存试剂四B 液体5mL×1瓶2-8℃保存试剂五液体40mL×1瓶2-8℃保存试剂六液体70mL×1瓶2-8℃保存NADP 标准品粉剂×1支-20℃保存NADPH 标准品粉剂×1支-20℃保存溶液的配制:1、试剂二:临用前加入6mL 蒸馏水充分混匀,溶解后2-8℃保存4周。
2、试剂四:临用前将试剂四A 溶解到试剂四B 中,溶解后分装保存,避免反复冻融,-20℃保存4周。
3、NADP 标准品:临用前加入1.27mL蒸馏水,即5µmol/mL ,-20℃可以保存2周。
4、NADPH 标准品:临用前加入1.2mL 蒸馏水,即5µmol/mL ,-20℃可以保存2周。
产品说明:辅酶ⅡNADP(H)广泛存在于动物、植物、微生物和培养细胞中,NADP +和NADPH 含量测定可以计算NADP (NADPH +NADP +)含量和NADPH/NADP +比值,其变化与磷酸戊糖途径和生物合成以及抗氧化反应密切相关。
NADPH/NADP +比值不仅是细胞氧化还原态的主要标志之一,而且在PPP 途径、生物合成和抗氧化代谢中具有重要调控作用。
分别用酸性和碱性提取液提取样品中NADP +和NADPH 。
NADPH 通过PMS 的递氢作用,使氧化型噻唑蓝(MTT )还原为甲瓒,570nm 下检测吸光值,从而测定NADPH 含量。

果糖-1,6-二磷酸(酯)酶(FBP)活性检测试剂盒说明书紫外分光光度法注意:正式测定之前选择2-3个预期差异大的样本做预测定。
货号:BC0920规格:50T/48S产品内容:提取液:液体60mL×1瓶,4℃保存。
试剂一:粉剂×1瓶,4℃保存;临用前加入45mL试剂四充分溶解待用,用不完的试剂于4℃保存。
试剂二:液体18μL×1瓶,-20℃保存。
临用前加入2.5mL蒸馏水充分溶解待用,用不完的试剂分装后-20℃分装保存,避免反复冻融。
试剂三:液体245μL×1瓶,-20℃保存;临用前加入2.5mL蒸馏水充分溶解待用,用不完的试剂分装后-20℃分装保存,避免反复冻融。
试剂四:液体50mL×1瓶,4℃保存。
产品简介:果糖-1,6-二磷酸酶(Fructose1,6-bisphosphatase,FBP)又称果糖-1,6-二磷酸酯酶,其在糖异生过程和光合作用同化物蔗糖的合成中起关键性的作用。
催化1,6-二磷酸果糖和水生成6-磷酸果糖和无机磷。
FBP催化1,6-二磷酸果糖和水,生成6-磷酸果糖和无机磷,在反应体系中添加的磷酸葡萄糖异构酶和6-磷酸葡萄糖脱氢酶依次催化生成6-磷酸葡萄糖酸和NADPH,测定340nm下NADPH的增加速率,即可计算FBP活性。
试验中所需的仪器和试剂:紫外分光光度计、天平、低温离心机、1mL石英比色皿、可调式移液枪、研钵/匀浆器、冰盒、蒸馏水。
操作步骤:一、粗酶液的提取:组织:按照质量(g):提取液体积(mL)为1:5~10的比例(建议称取约0.1g,加入1mL提取液)进行冰浴匀浆。
于4℃,8000g,离心10min,取上清,置冰上待测。
细胞:按照细胞数量(104个):提取液体积(mL)为500~1000:1的比例(建议500万细胞加入1mL提取液),冰浴超声波破碎细胞(功率300w,超声3秒,间隔7秒,总时间3min),于4℃,8000g,离心10min,取上清,置冰上待测。

食品中果胶含量的检测及分析近年来,随着人们对健康意识的提高,食品安全问题备受关注。
其中,果胶作为一种常见的食品添加剂,被广泛应用于食品工业中,起到增稠、保湿、增加食品口感等作用。
然而,果胶的合理使用量一直是个难题,因此,准确检测和分析食品中果胶的含量,具有重要的意义。
首先,我们需要了解果胶的特性。
果胶是一种天然的多糖,主要存在于植物的细胞壁中,其化学结构复杂,通常由果糖、半乳糖和葡萄糖等单糖单体组成。
由于果胶具有良好的增稠性和水胶性,因此常被用于制作果酱、果冻、果汁等食品。
然而,由于果胶的含量难以直接测定,我们需要采用科学的方法进行检测和分析。
一种常用的果胶检测方法是通过紫外分光光度法。
该方法的原理是利用果胶的特定吸收峰进行定量测定。
首先,将待测样品与硫酸交联,使果胶形成一种深紫色化合物。
然后,使用紫外分光光度计测定在特定波长下的吸光度值,并与标准曲线进行比对。
通过该方法,可以快速准确地检测食品中果胶的含量。
除了紫外分光光度法外,还可以采用高效液相色谱法(HPLC)进行果胶的分析。
该方法主要利用不同样品在液相色谱柱中的保留时间差异来测定果胶含量。
首先,将样品经过预处理,如提取、纯化等步骤,然后通过HPLC系统进行分析。
该方法能够同时检测多种含量不同的果胶,具有更高的灵敏度和准确度。
除了以上两种方法外,还可以通过核磁共振波谱(NMR)技术对果胶进行定性和定量分析。
核磁共振技术能够提供果胶的详细结构信息,并能够精确测定果胶的含量。
通过NMR技术,我们不仅可以了解果胶的基本组成,还能够探究果胶与其他成分之间的相互作用,为果胶的合理使用提供科学依据。
在食品工业中,合理使用果胶是确保产品质量和口感的重要因素。
因此,对于食品中果胶含量的检测和分析十分必要。
通过紫外分光光度法、HPLC和NMR等各种方法的结合应用,可以提高果胶检测的准确度和全面性。
同时,针对不同食品的果胶应用特点,应对果胶的使用量进行研究和控制,以确保食品的质量和安全。

果胶甲酯化程度试剂盒说明书 微量法100T/96S注 意:正式测定之前选择2-3 个预期差异大的样本做预测定。
测定意义:植物细胞壁中的果胶是植物初生细胞壁的主要成分,除了起结构支撑、物质运输等作用外,还具有抵抗逆境的作用。
果胶甲酯化程度影响了细胞壁的坚韧程度及其抗性。
测定原理:果胶甲酯键经皂化处理后释放出甲醇,甲醇与2,4-戊二酮反应显色,在412nm 下测定吸光值;同时半乳糖醛酸在70℃下与浓硫酸反应生成5-甲酰基-2-呋喃甲酸,5-甲酰基-2-呋喃甲酸与3,5-二甲基苯酚反应产生有色物质,在450nm 下有最大吸光值。
以甲醇生成量与半乳糖醛酸含量的比值代表果胶甲酯化程度。
自备实验用品及仪器:天平、低温离心机、酶标仪、96 孔板、恒温水浴锅、蒸馏水、硫酸。
试剂组成和配制:提取液:液体100mL×1 瓶,4℃保存。
试剂一:液体3mL×1 瓶,4℃保存。
试剂二:液体3mL×1 瓶,4℃保存。
试剂三:液体3mL×1 瓶,4℃避光保存。
试剂四:液体 2.5mL×1 瓶,4℃避光保存。
试剂五:粉剂×1 瓶,4℃避光保存;临用前加入22mL 试剂六充分溶解待用,用不完的试剂4℃避光保存。
试剂六:液体25mL×1 瓶,4℃保存。
试剂七:液体3mL×1 瓶,4℃保存。
试剂八:液体 2.5mL×1 瓶,4℃避光保存。
酶液提取:称取约0.1g 组织,加入1mL 蒸馏水,进行冰浴匀浆。
10000g 4℃离心10min,弃上清,留沉淀。
沉淀中加入1mL 提取液,混匀后90℃水浴2h,冷却至室温,10000g4℃离心10min,取上清待测。
测定操作表:1.甲醇生成量测定:试剂名称(μL)空白管测定管样本50提取液50试剂一25 25混匀,室温静置30min试剂二25 25试剂三20 20混匀,冰浴至紫色褪去,约需要15-30min试剂四20 20水60 60试剂五200 200混匀,60℃反应15min。
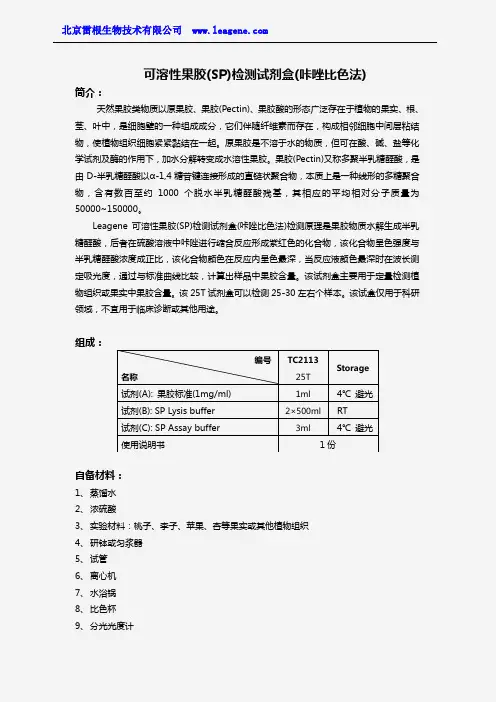
可溶性果胶(SP)检测试剂盒(咔唑比色法)简介:天然果胶类物质以原果胶、果胶(Pectin)、果胶酸的形态广泛存在于植物的果实、根、茎、叶中,是细胞壁的一种组成成分,它们伴随纤维素而存在,构成相邻细胞中间层粘结物,使植物组织细胞紧紧黏结在一起。
原果胶是不溶于水的物质,但可在酸、碱、盐等化学试剂及酶的作用下,加水分解转变成水溶性果胶。
果胶(Pectin)又称多聚半乳糖醛酸,是由D-半乳糖醛酸以α-1,4糖苷键连接形成的直链状聚合物,本质上是一种线形的多糖聚合物,含有数百至约1000个脱水半乳糖醛酸残基,其相应的平均相对分子质量为50000~150000。
Leagene 可溶性果胶(SP)检测试剂盒(咔唑比色法)检测原理是果胶物质水解生成半乳糖醛酸,后者在硫酸溶液中咔唑进行缩合反应形成紫红色的化合物,该化合物呈色强度与半乳糖醛酸浓度成正比,该化合物颜色在反应内呈色最深,当反应液颜色最深时在波长测定吸光度,通过与标准曲线比较,计算出样品中果胶含量。
该试剂盒主要用于定量检测植物组织或果实中果胶含量。
该25T 试剂盒可以检测25-30左右个样本。
该试盒仅用于科研领域,不宜用于临床诊断或其他用途。
组成:自备材料:1、 蒸馏水2、 浓硫酸3、 实验材料:桃子、李子、苹果、杏等果实或其他植物组织4、 研钵或匀浆器5、 试管6、 离心机7、 水浴锅8、 比色杯9、 分光光度计编号 名称TC2113 25T Storage试剂(A): 果胶标准(1mg/ml) 1ml 4℃ 避光 试剂(B): SP Lysis buffer 2×500ml RT 试剂(C): SP Assay buffer 3ml4℃ 避光 使用说明书1份操作步骤(仅供参考):1、可溶性果胶提取:①取果实或其他植物组织,洗净,擦干,称取剪碎的新鲜样品,置于研钵或匀浆器。
②加入SP Lysis buffer,充分研磨或匀浆后转入试管中。
用SP Lysis buffer冲洗研钵或匀浆器并转移至试管中,补加SP Lysis buffer。
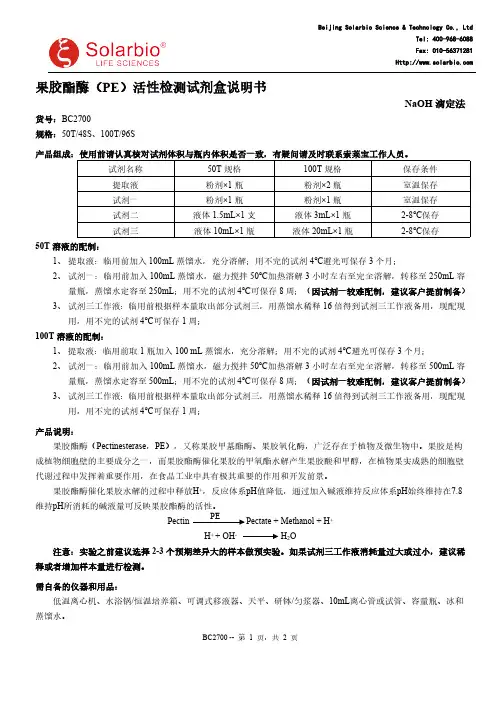
果胶酯酶(PE )活性检测试剂盒说明书NaOH 滴定法货号:BC2700规格:50T/48S 、100T/96S产品组成:使用前请认真核对试剂体积与瓶内体积是否一致,有疑问请及时联系索莱宝工作人员。
试剂名称50T 规格100T 规格保存条件提取液粉剂×1瓶粉剂×2瓶室温保存试剂一粉剂×1瓶粉剂×1瓶室温保存试剂二液体1.5mL×1支液体3mL×1瓶2-8℃保存试剂三液体10mL×1瓶液体20mL×1瓶2-8℃保存50T 溶液的配制:1、提取液:临用前加入100mL 蒸馏水,充分溶解;用不完的试剂4℃避光可保存3个月;2、试剂一:临用前加入100mL 蒸馏水,磁力搅拌50℃加热溶解3小时左右至完全溶解,转移至250mL 容量瓶,蒸馏水定容至250mL ;用不完的试剂4℃可保存8周;(因试剂一较难配制,建议客户提前制备)3、试剂三工作液:临用前根据样本量取出部分试剂三,用蒸馏水稀释16倍得到试剂三工作液备用,现配现用,用不完的试剂4℃可保存1周;100T 溶液的配制:1、提取液:临用前取1瓶加入100 mL 蒸馏水,充分溶解;用不完的试剂4℃避光可保存3个月;2、试剂一:临用前加入100mL 蒸馏水,磁力搅拌50℃加热溶解3小时左右至完全溶解,转移至500mL 容量瓶,蒸馏水定容至500mL;用不完的试剂4℃可保存8周;(因试剂一较难配制,建议客户提前制备)3、试剂三工作液:临用前根据样本量取出部分试剂三,用蒸馏水稀释16倍得到试剂三工作液备用,现配现用,用不完的试剂4℃可保存1周;产品说明:果胶酯酶(Pectinesterase ,PE ),又称果胶甲基酯酶、果胶氧化酶,广泛存在于植物及微生物中。
果胶是构成植物细胞壁的主要成分之一,而果胶酯酶催化果胶的甲氧酯水解产生果胶酸和甲醇,在植物果实成熟的细胞壁代谢过程中发挥着重要作用,在食品工业中具有极其重要的作用和开发前景。

果胶测定国标果胶是一种天然的多糖,在食品、医药、化工等领域都有广泛应用。
果胶的含量和品质检测是保证产品质量的重要手段。
目前,国内用于果胶含量检测的方法较多,其中GB/T 22405-2008《果胶含量的测定》是一项通用方法。
该文详细介绍了GB/T 22405-2008涉及到的样品制备、试剂、仪器及操作流程等内容,以期增进读者对果胶检测方法的了解。
一、适用范围本标准适用于水果、蔬菜、糖果、果酱、果脯等产品中的果胶含量的测定。
二、样品制备1. 选择符合要求的样品。
从已知品种的样品中挑选质量良好、没有病虫害、不含过多水分的样品。
如样品经过冷冻或烘干等处理,应在一定条件下还原样品的含水量和组分构成。
2. 样品制备。
样品分为以下两类:(1)加热提取法。
将样品磨碎或切成小块,以水或盐酸为溶剂进行提取,得到果胶及其他化学成分。
这种方法比较适用于需要解决胶质组分的产品。
具体步骤如下:①将约5g干样品磨碎或切成小块,放入蒸发皿内。
②加入10mL蒸馏水,混合均匀。
③将蒸馏水加温至100℃,煮沸1h。
④冷却后将提取液移入250mL容量瓶,用蒸馏水补足至刻度线。
①将约2g干样品磨碎或切成小块,加入100mL含5% HCl的二硫化碳溶液中,封紧瓶盖。
②在室温下振荡酸解24h。
③感光滤液器滤除大口碎屑,用蒸馏水冲洗滤纸至可通过0.45μm滤膜为止。
三、试剂1. 拉曼光谱法定量分析标准品2. 0.05mol/L NaOH溶液3. 氨溶液,pH调至7-84. 氢氧化钠,10g/L 氨水溶液5. 氨硫酸,3mol/L 氨水溶液6. 95% 乙醇7. 1, 2-丙二醇8. 2-甲基-2-丁醇9. N-(1-萘基)乙二胺,称量出0.5g+N-(1-萘基)乙二胺,加入5mL 1, 2-丙二醇中,溶解后加蒸馏水定容至1000mL。
10. D- 核糖16. Dimethylsulfoxide, DMSO17. Methyl alcohol, CH3OH18. 苯乙酮19. 地龙酸葡萄糖酰胺酶20. 过氧化氢四、仪器1. 电子天平2. 恒温水槽或恒温器3. 精密分析天平4. 烘箱5. 磁力搅拌器6. 开口离心机7. pH计8. 原子吸收分光光度计9. 拉曼光谱仪五、操作流程1. 标准品制备①从1, 2-丙二醇、95% 乙醇和2-甲基-2-丁醇中,各取30吨,称量到250ml的量筒中,然后将其混合均匀。

果胶类检测
果胶物质是生长在植物的细胞壁和细胞之间的物质,主要存在于植物的初生细胞壁和细胞之间的中层内,是细胞壁的基质多糖。
在浆果、果实和茎中最丰富。
每种多糖随植物来源、组织和发展阶段的不同,其侧链中残基的数目、种类、连接方式以及其他取代基存在的情况都有相当大的变化。
果胶
迪信泰检测平台采用生化法检测果胶系列物质,结合相应的试剂盒,可高效、精准的检测果胶系列物质的变化。
目前常见检测的果胶系列物质包括果胶酶、果胶、可溶性果胶、果胶酯酶等。
此外,我们还提供果胶类物质的生化试剂盒代测服务,以满足您的不同需求。
不同钙浓度处理对苹果水溶性果胶的影响
迪信泰检测平台可检测果胶类项目
原果胶含量检测
可溶性果胶(WSP) 含量检测
离子结合型果胶(ISP) 含量检测
共价结合型果胶(CSP)含量检测
多聚半乳糖醛酸酶(PG)活性检测
果胶酶活性检测
果胶酯酶活性检测
果胶裂解酶活性检测
生化法测定果胶类样本要求:
1. 请确保样本量大于0.2g或者0.2mL,测定样品不返还,请您保留备份。
周期:2~3周
项目结束后迪信泰检测平台将会提供详细中英文双语技术报告,报告包括:
1. 实验步骤(中英文)
2. 相关参数(中英文)
3. 图片
4. 原始数据
5. 果胶类物质含量/果胶相关酶活性信息。

For Research Use Only碧波Caspase-3活性分光光度法检测试剂盒Cat Number:Specification:Store at:4℃for one yearExpire date:MADE BY BIOBOX碧波Caspase-3活性分光光度法检测试剂盒一、产品简介Caspase 3 活性分光光度法检测试剂盒(Caspase 3 Activity Colorimetric Assay Kit)是采用分光光度法检测细胞或组织裂解液中Caspase 3酶活性或纯化的Caspase 3酶活性的试剂盒。
Caspase (Cysteine-requiring Aspartate Protease)是一个在细胞凋亡过程中起重要作用的蛋白酶家族。
Caspase 3也称CPP32、Yama或apopain,有时被写作caspase-3或caspase3,属于caspase家族的CED-3亚家族(CED-3 subfamily),是细胞凋亡过程中的一个关键酶。
Caspase 3是哺乳动物细胞中研究最多的一个caspase。
Caspase 3可以剪切procaspase 2、6、7和9,并可以直接特异性剪切许多caspase 底物,包括PARP (poly(ADP-ribose) polymerase) ,ICAD (Inhibitor of caspase-activated deoxyribonuclease),gelsolin和fodrin等。
这些由caspase 3介导的蛋白剪切是细胞凋亡分子机制的重要组成部分。
另外,caspase 3在细胞核凋亡过程中也起到了关键作用,包括染色质固缩(chromatin condensention) ,DNA片段化(DNA fragmentation)等。
同时caspase 3对细胞起泡(Cell blebbing)也起到关键作用。
Caspase-3在正常状态下以酶原的形式存在于胞浆中,没有活性;但在细胞发生凋亡阶段,它被激活,活化的Caspase-3由两个大亚基和两个小亚基组成,裂解相应的胞浆胞核底物,最终导致细胞凋亡。

NADP-苹果酸酶(NADP-ME)活性检测试剂盒说明书紫外分光光度法注意:正式测定之前选择2-3个预期差异大的样本做预测定。
货号:BC1120规格:50T/48S产品内容:提取液:液体70mL×1瓶,4℃保存;试剂一:液体40mL×1瓶,4℃保存;试剂二:粉剂×1瓶,4℃保存;临用前加入20mL提取液充分溶解备用;试剂三:粉剂×2支,4℃保存;用时每支加1mL双蒸水充分溶解备用;试剂四:粉剂×2支,-20℃保存;用时每支加500μL双蒸水充分溶解备用。
工作液:在15mL试剂二中加入2mL试剂三和1mL试剂四,可以根据比例现用现配。
产品说明:ME广泛存在于微生物、培养细胞、动物和植物胞浆中,尤其在植物组织中活性较高。
ME催化苹果酸氧化脱羧的可逆反应,产生丙酮酸和CO,以及伴随NAD(P)+的还原反应,是苹果酸代谢的关键酶。
ME活性与2生物合成和抗氧化密切相关。
近年来植物ME活性测定较多,已经成为抗氧化研究的热点。
根据辅酶专一性和对底物特异性的不同,可将ME分为NAD-ME(EC1.1.1.38)和NADP-ME(EC1.1.1.40)。
NADP-ME催化NADP+还原成NADPH,在340nm下测定NADPH增加速率。
试验中所需的仪器和试剂:紫外分光光度计、低温离心机、水浴锅、可调节移液器、1mL石英比色皿、匀浆器和蒸馏水操作步骤:一、粗酶液提取:细菌、细胞或组织样品的制备:细菌或培养细胞:先收集细菌或细胞到离心管内,弃上清,按照每500万细菌或细胞加入1mL提取液,超声波破碎细菌或细胞(功率20%,超声3s,间隔10s,重复30次)。
8000g 4℃离心10min,取上清,置冰上待测。
组织:称取约0.1g组织,加入1mL提取液进行冰浴匀浆。
8000g4℃离心10min,取上清,置冰上待测。
血清(浆)样品:直接检测。
二、测定步骤:1、紫外分光光度计预热30min以上,调节波长至340nm,蒸馏水调零。
水果中果胶物质的提取和测定一、实验目的1、温水基本操作,如PH计的使用、抽滤,分光光度计的使用,标准曲线的绘制;2、初步了解和掌握食品中某些成分的提取技术、分离技术以及测定方法,为灵活运用食品化学的研究方法奠定基础。
二、实验原理本实验采用钙离子螯合剂和果胶酶提取水果中的总果胶物质,然后用分光光度法测定总果胶物质,先用乙醇处理样品,使果胶沉淀,再用乙醇溶液洗涤沉淀,除去可溶性糖类、脂肪、色素等物质,从残渣中提得果胶物质。
采用NaOH溶液将果胶物质皂化,生成果胶酸钠,再经乙酸酸化使之生成果胶酸,再加入果胶酶使之水解。
分光光度法测定是以果胶分子的基本结构单位——半乳糖醛酸和咔唑的反应为基础的。
果胶经水解生成半乳糖醛酸,在强酸中与咔唑发生缩合反应,生成紫红色化合物,其呈色强度与半乳糖醛酸含量成正比,测定的结果可用脱水半乳糖醛酸(AUA)。
三、实验仪器与试剂仪器:玻璃器皿烧杯、试管、玻棒、胶头滴管、容量瓶、PH计、分光光度计试剂:①果胶酶提取液:1份果胶酶试剂和10份水在一起搅拌1h,然后离心除去沉淀,上清液即为果胶酶提取液;②1%EDTA溶液(乙二胺四乙酸);③醋酸溶液(1份醋酸+2份水);④浓硫酸;⑤95%乙醇;⑥精制乙醇:在1L95%乙醇中,加入4g锌粉和4ml硫酸(1+1),在水浴中回流24h,然后蒸馏,在馏出液中加入4g锌粉和4gKOH后再蒸馏一次;⑦一水半乳糖醛酸。
四、实验步骤1、果胶物质的提取将10g新鲜橘皮和125mL95%乙醇一起捣碎,抽滤后保留沉淀,用50mL75%乙醇洗涤沉淀两次,将沉淀转移到250mL烧杯中,加入100mL 1%EDTA溶液,用1mol/LNaOH将pH调节至11.5,保持30min后,再用醋酸溶液将果胶溶液酸化到PH5.0,然后加入10mL 果胶酶提取液,搅拌0.5h后,定容至250mL,2、半乳糖醛酸的比色测定在20Ⅹ200mm试管中准确加入12ml浓硫酸,用冰浴将试管及内容物冷却到3℃,吸入1.00ml 待测溶液,每毫升溶液中含5~40µg果胶物质。
资料范本本资料为word版本,可以直接编辑和打印,感谢您的下载果胶的提取与果胶含量的测定地点:__________________时间:__________________说明:本资料适用于约定双方经过谈判,协商而共同承认,共同遵守的责任与义务,仅供参考,文档可直接下载或修改,不需要的部分可直接删除,使用时请详细阅读内容果胶的提取与果胶含量的测定一、引言果胶广泛存在于水果和蔬菜中,如苹果中含量为0.7—1.5%(以湿品计),在蔬菜中以南瓜含量最多(达7%-17%)。
果胶的基本结构是以α-1,4苷键连接的聚半乳糖醛酸,其中部分羧基被甲酯化,其余的羧基与钾、钠、铵离子结合成盐。
在果蔬中,尤其是未成熟的水果和皮中,果胶多数以原果胶存在,原果胶通过金属离子桥(比如Ca2+)与多聚半乳糖醛酸中的游离羧基相结合。
原果胶不溶于水,故用酸水解,生成可溶性的果胶,再进行提取、脱色、沉淀、干燥,即为商品果胶。
从柑橘皮中提取的果胶是高酯化度的果胶(酯化度在70%以上)。
在食品工业中常利用果胶制作果酱、果冻和糖果,在汁液类食品中作增稠剂、乳化剂。
二、实验材料、试剂与仪器材料:桔皮,苹果等;试剂:0.25% HCL,95%乙醇(AR),精制乙醇,乙醚,0.05mol/L HCl,0.15%咔唑乙醇溶液,半乳糖醛酸标准液,浓硫酸(优级纯)仪器:分光光度计,50mL比色管,分析天平,水浴锅,回流冷凝器,烘箱等三、实验步骤(一)果胶的提取1、原料预处理:称取新鲜柑橘皮20g(或干样8g),用清水洗净后,放入250mL容量瓶中,加水120mL,加热至90℃保持5-10min,使酶失活。
用水冲洗后切成3~5mm的颗粒,用50℃左右的热水漂洗,直至水为无色、果皮无异味为止(每次漂洗必须把果皮用尼龙布挤干,在进行下一次的漂洗)。
2、酸水解提取:将预处理过的果皮粒放入烧杯中,加约60mL 0.25% HCL 溶液,以浸没果皮为宜,调pH至2.0~2.5,加热至90℃煮45min,趁热用100目尼龙布或四层纱布过滤。
果胶含量检测试剂盒说明书微量法注意:正式测定之前选择2-3个预期差异大的样本做预测定。
货号:BC1405规格:100T/48S产品内容:试剂一:标准液1mL×1支,4℃保存。
试剂二:液体5mL×1瓶,4℃保存。
产品说明果胶是一种植物胶体,分布于果蔬类植物中,存在于植物的细胞壁和细胞内层。
果胶中含有半乳糖醛酸、乳糖、阿拉伯糖、葡萄糖醛酸等,主要成分是半乳糖醛酸,其独特的物理、化学性质影响着植物源食品的口感和品质。
采用咔唑比色法测定果胶含量。
果胶水解成半乳糖醛酸,在硫酸溶液中与咔唑试剂缩合生成紫红色化合物,在530nm处有最大吸收峰。
测定样品中半乳糖醛酸的含量,即可确定果胶的含量。
需自备的仪器和用品研钵、可见分光光度计/酶标仪、水浴锅、1mL玻璃比色皿、可调式移液枪、浓硫酸和蒸馏水。
操作步骤:一、样品处理将组织样品捣碎,按照样品质量(g)和蒸馏水体积(mL)为1:5-10的比列(建议取约0.1g样品,加入1mL蒸馏水),充分匀浆,8000g、4℃离心10min,取上清液待测。
二、分光光度计或酶标仪预热30min以上,调节波长至530nm处,蒸馏水调零,试剂一和试剂二37℃预热10min以上。
三、测定操作表(在EP管中加入下列试剂)试剂名称(μL)空白管标准管对照管测定管待测样本5050试剂一50蒸馏水5050试剂二505050混匀浓硫酸400400400400充分混匀,95℃水浴5min后,冷却至室温,取200μL置微量石英比色皿或96孔板中,测定530nm 处吸光值,空白管、标准管、对照管和测定管吸光值分别记为A1、A2、A3和A4。
若A大于1,需将待测样本用蒸馏水稀释(可稀释10倍或20倍)注意:空白管和标准管只要做一管,每个测定管需设一个对照管。
四、计算公式果胶含量(mg/mg prot)=(C标准×V1)×(A4-A3)÷(A2-A1)÷(V1×Cpr)×稀释倍数=0.05×(A4-A3)÷(A2-A1)÷Cpr×稀释倍数果胶含量(mg/g鲜重)=(C标准×V1)×(A4-A3)÷(A2-A1)÷(W×V1÷V2)×稀释倍数=0.05×(A4-A3)÷(A2-A1)÷W×稀释倍数C标准:标准管浓度,0.05mg/mL;V1:加入样本体积,0.05mL;V2:加入提取液体积,1mL;Cpr:样本蛋白质浓度,mg/mL;W:样本鲜重,g。
离子结合型果胶(ISP )含量检测试剂盒说明书可见分光光度法货号:BC4150规格:50T/24S产品组成:使用前请认真核对试剂体积与瓶内体积是否一致,有疑问请及时联系索莱宝工作人员。
试剂名称规格保存条件提取液一液体100 mL×1瓶(自备)4℃保存提取液二液体30 mL×1瓶4℃保存提取液三液体50 mL×1瓶4℃保存试剂一液体60 mL×1瓶(自备)4℃保存试剂二液体3 mL×1瓶4℃保存试剂三液体5 mL×1瓶4℃保存标准品粉剂×1支4℃保存溶液的配制:1、提取液一:80%乙醇,自备。
即将80 mL 无水乙醇和20 mL 蒸馏水混合。
2、试剂一:浓硫酸60 mL ,自备。
3、标准品:10 mg 半乳糖醛酸。
临用前加入0.943 mL 提取液三,配成50 μmol/mL 的标准液。
产品说明:果胶(Pectin )是构成细胞初生壁和中胶层的主要成分,对细胞起着软化和黏合作用。
果胶间以Ca 2+桥及其他离子键、氢键、糖苷键、酯键和苯环偶联的方式交联,通过不同的抽提方法可以提取各种形式的果胶,如水溶性果胶(WSP )、离子结合型果胶(ISP )和共价结合型果胶(CSP )。
利用带有螯合剂的酸性提取液提取离子结合型果胶(ISP ),其在酸性条件下水解生成半乳糖醛酸,后者在硫酸溶液中与咔唑进行缩合反应形成紫红色的化合物,生成物质在530nm 处有最大吸收峰。
技术指标:最低检出限:0.0212 μmol/mL 线性范围: 0.025-2.5 μmol/mL注意:实验之前建议选择2-3个预期差异大的样本做预实验。
如果样本吸光值不在测量范围内建议稀释或者增加样本量进行检测。
需自备的仪器和用品:可见分光光度计、台式离心机、水浴锅、1mL 玻璃比色皿、可调式移液枪、研钵/匀浆器、丙酮、浓硫酸、无水乙醇和蒸馏水。
操作步骤:一、样本处理(可适当调整待测样本量,具体比例可以参考文献)取约0.1g样本,加入1mL 提取液一,室温快速匀浆,95℃水浴20min,冷却至室温,4000g 25℃离心10min,弃上清。
实验名称:果胶提取与含量测定实验日期:2023年3月15日实验地点:食品科学与工程学院实验室实验目的:1. 掌握果胶提取的基本原理和方法;2. 学习并运用分光光度法测定果胶含量;3. 了解果胶在食品工业中的应用。
实验原理:果胶是一种天然高分子多糖,广泛存在于水果、蔬菜等植物中。
果胶具有增稠、稳定、乳化等特性,在食品、医药、化妆品等领域具有广泛的应用。
本实验采用酶法提取果胶,利用分光光度法测定果胶含量。
实验材料与仪器:1. 材料与试剂:苹果皮、乙醇、盐酸、无水乙醇、苯酚、NaOH、硫酸、95%乙醇、FeCl3、无水乙醇、氯化钠等;2. 仪器:分光光度计、电子天平、烧杯、移液管、滴定管、锥形瓶、研钵、玻璃棒、水浴锅等。
实验步骤:1. 果胶提取(1)称取一定量的苹果皮,用研钵研磨成粉末;(2)将研磨好的苹果皮粉末加入适量乙醇,搅拌均匀,静置过夜;(3)取上层清液,加入适量盐酸,调节pH值为2.5;(4)将混合液加热至80℃,保持30分钟,冷却后用布氏漏斗过滤;(5)将滤液加入适量无水乙醇,静置过夜,滤取沉淀;(6)将沉淀用95%乙醇洗涤三次,干燥后称重,得到果胶粗提物。
2. 果胶含量测定(1)准确称取一定量的果胶粗提物,用蒸馏水溶解;(2)用移液管准确移取一定体积的溶液于锥形瓶中;(3)加入苯酚溶液,振荡均匀;(4)加入NaOH溶液,振荡均匀;(5)加入FeCl3溶液,振荡均匀;(6)加入95%乙醇,振荡均匀;(7)在分光光度计上测定溶液的吸光度;(8)根据标准曲线计算果胶含量。
实验结果与分析:1. 果胶提取结果实验得到果胶粗提物的得率为5.2%。
2. 果胶含量测定结果通过分光光度法测定,得到果胶含量为2.4%。
3. 实验结果分析(1)实验中采用酶法提取果胶,操作简单,提取效果较好;(2)分光光度法测定果胶含量准确可靠,实验结果符合预期;(3)果胶在食品工业中的应用前景广阔,具有很高的研究价值。
实验结论:1. 本实验成功提取了苹果皮中的果胶,提取率为5.2%;2. 通过分光光度法测定,苹果皮中的果胶含量为2.4%;3. 果胶在食品工业中具有广泛的应用前景,具有很高的研究价值。
货号:MS2501 规格:100管/96样植物组织果糖(fructose ,FT)含量试剂盒说明书微量法正式测定前务必取2-3个预期差异较大的样本做预测定测定意义:果糖是一种最为常见的己酮糖,是葡萄糖的同分异构体,以游离状态大量存在于水果的浆汁和蜂蜜中,能与葡萄糖结合生成蔗糖。
果糖是最甜的单糖,广泛应用于食品、医药、保健品生产中。
测定原理:果糖与间苯二酚反应,生成有色物质,在480nm下有特征吸收峰。
自备实验用品及仪器:可见分光光度计/酶标仪、水浴锅、可调式移液器、微量石英比色皿/96孔板、研钵、蒸馏水试剂的组成和配制:提取液:液体100ml×1瓶,4℃保存;试剂一:1mg/mL标准液10mL×1瓶,4℃保存;试剂二:液体 25ml×1瓶,4℃保存;试剂三:液体 8ml×1瓶,4℃保存;试剂四:粉剂0.5g×1瓶,常温保存。
果糖提取:称取0.1~0.2g样本,常温研碎;加入0.5mL提取液,适当研磨后快速转移到有盖离心管中;置于80℃水浴锅中10min(盖紧,以防止水分散失),振荡3~5次,冷却后,4000g,25℃离心10min,取上清;加入少量(约2mg)试剂四,80℃脱色30min(盖紧,以防止水分散失);再加入0.5mL提取液,4000g,25℃离心10min,取上清液测定。
测定步骤:1、分光光度计或酶标仪预热30min以上,调节波长至480nm,蒸馏水调零。
96孔板中测定480nm处光吸收值,空白管、标准管和测定管分别记为A1、A2和A3。
空白管和标准管只要做一管。
果糖含量计算:1、果糖含量(mg/mg prot)=(C标准管×V1)×(A3-A1)÷(A2-A1) ÷(V1×Cpr)= (A3-A1)÷第1页,共2页(A2-A1) ÷Cpr此法需要自行测定蛋白浓度。
共价结合型果胶(CSP)含量试剂盒说明书
分光光度法50管/24样
正式测定前取2-3个预期差异较大的样本做预测定
测定意义:
果胶是构成细胞初生壁和中胶层的主要成分,主要由原果胶、果胶酸甲酯和果胶酸组成。
果胶中含有半乳糖醛酸、乳糖、阿拉伯糖、葡萄糖醛酸等,是许多高等植物细胞壁中含量最丰富的多糖成分,其独特的物理、化学性质影响着植物源食品的口感和品质。
果胶间以Ca2+桥及其他离子键、氢键、糖苷键、酯键和苯环偶联的方式交联,通过不同的抽提方法可以提取各种形式的果胶,如水溶性果胶(WSP)、离子结合型果胶(ISP)和共价结合果胶(CSP)。
测定原理:
利用带有螯合剂的碱溶液提取共价结合型果胶(CSP),采用咔唑比色法测定果胶含量。
果胶水解成半乳糖醛酸,在硫酸溶液中与咔唑试剂进行缩合反应,生成物质在530 nm处有最大吸收峰。
需自备的仪器和用品:
可见分光光度计、水浴锅、可调式移液器、1mL玻璃比色皿、80%乙醇、丙酮、浓硫酸(不允许快递)、研钵和蒸馏水。
试剂的组成和配制:
试剂一:液体50mL× 1瓶,4℃保存。
试剂二:液体50mL× 1瓶,4℃保存。
试剂三:标准液1mL× 1支,4℃保存。
试剂四:液体5 mL× 1瓶,4℃保存;
样品的前处理:
1、细胞壁的提取:取约0.3g样本,加入1mL 80%乙醇,室温快速匀浆,95℃水浴20min,
冷却至室温,4000g 25℃离心10min,弃上清。
沉淀加入1.5mL80%乙醇和丙酮各洗一遍(涡旋振荡2min左右,4000g 25℃离心10min,弃上清即可),沉淀即为粗细胞壁,加入1mL试剂一(去除淀粉)浸泡15小时,4000g 25℃离心10min,弃上清,将沉淀干燥,称重得细胞壁物质(CWM)。
2、CSP的提取:称取烘干的CWM 3mg,加入1mL试剂二,充分匀浆。
8000g 4℃离心10min,
取上清液待测。
测定步骤:
1、分光光度计预热30min以上,调节波长至530nm处,蒸馏水调零;试剂三和试剂四37℃预热10min以上;
别记为A1、A2、A3和A4。
若A大于2,需将待测样本用蒸馏水稀释(可稀释10倍或20
倍)。
空白管和标准管只要做一管,每个测定管需设一个对照管。
CSP含量计算:
CSP含量(mg /g 干重)= (C标准×V1) ×(A4-A3)÷(A2-A1)÷(W×V1÷V2) ×稀释倍数
=0.05×(A4-A3)÷(A2-A1)÷W×稀释倍数
C标准:标准管浓度,0.05mg/mL;V1:加入样本体积,0.1mL;V2:加入提取液体积,1mL;W:样本干重,g。
注意:最低检测限为50μg /g 干重。