2.碱金属和水的反应:
2Li+2H2O==2LiOH+H2
(十分缓慢,因为生成的LiOH微 溶于水,反应慢,且Li不熔化)
【实验2-10】
都易失电子表现强还原性
小结: 碱金属元素的结构和性质
2K + 2H O 2) 与H2O反应越来越剧烈
最外层上都只有一个电子
2
=== 2KOH + 2H2
与O2, S, Cl2等非金属反应越来越剧烈
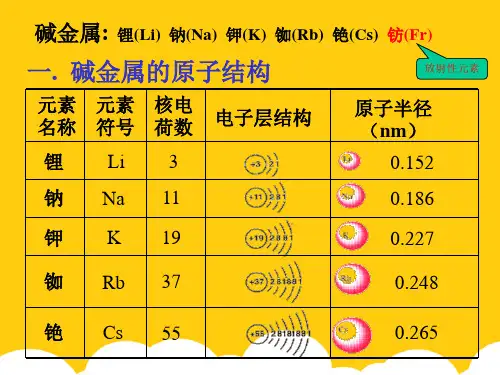
碱金属: 锂(Li) 钠(Na) 钾(K) 铷(Rb) 铯(Cs) 钫(Fr)
一. 碱金属的原子结构
放射性元素
元素 名称
锂
元素 符号
Li
核电 荷数
3
电子层结构
原子半径 (nm)
0.152
钠 Na 11
0.186
钾 K 19
0.227
铷 Rb 37
0.248
铯 Cs 55
0.265
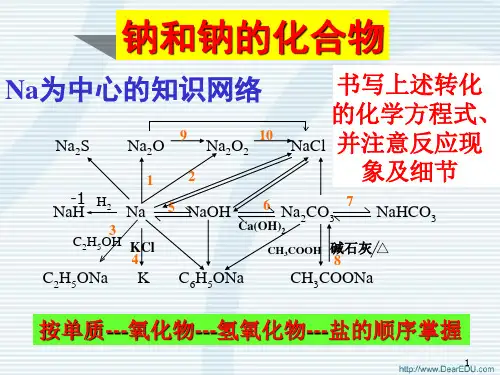
总结:
碱金属的原子结构 Li Na K碱金属与非金属的反应
点燃
2Li+O2===2Li2O(不如钠剧烈,只生成Li2O)
Na+O2
常温 Na2O
点燃 或加热
Na2O2
【实验2-9】
K、Rb、Cs比Na更剧烈,且Rb、Cs遇空气可自燃, 且可生成R2O、R2O2甚至RO2(超氧化物)等更复杂的化 合物。
小结:从Li到Cs,和O2反应越来越剧烈,还 原性越强,金属性越强。
硬度小,都较柔软,有延展性
银白色有金属光泽(铯略带金色) 碱金属元素的物理性质
失2×e-
2R + 2H2O ===2ROH + H2
小结:从Li到Cs,和H2O反应越来越剧烈, 还原性越强,金属性越强。