第六章配合物和簇合物的结构与性质
- 格式:ppt
- 大小:3.42 MB
- 文档页数:83



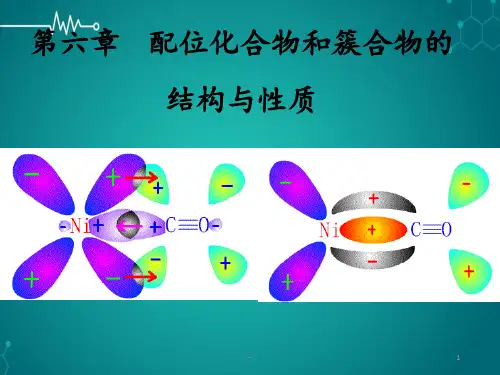







配位键,又称配位共价键,或简称配键,是一种特殊的共价键。
当共价键中共用的电子对是由其中一原子独自供应时,就称配位键。
配位键形成后,就与一般共价键无异。
形成条件配位键的形成需要两个条件:一是中心原子或离子,它必须有能接受电子对的空轨道;二是配位体,组成配位体的原子必须能提供配对的孤对电子。
当一路易斯碱供应电子对给路易斯酸而形成化合物时,配位键就形成了。
例如气态氨NH3和气体三氟化硼BF3形成固体NH3BF3化合价在配位化合物中,由电负性小的元素原子向电负性大的元素原子提供孤对电子形成配位键时,每个有一对孤对电子的前者(电负性小的原子)显示+2价,后者显示-2价。
反之,由电负性大的元素原子提供孤对电子与电负性小的元素原子之间形成配位键时,两种元素都无价态变化。
常见配位键化合物∙一氧化碳CO,其中碳氧间的三对共用电子对有一配位键,两个正常共价键。
∙铵根NH4+,其中N原子与左下右的H原子以极性键结合,与上边的H以配位键结合,由N原子提供孤对电子螯合物(英语:Chelation)是配合物的一种在螯合物的结构中,一定有一个或多个多齿配体提供多对电子与中心体形成配位键。
“螯”指螃蟹的大钳,此名称比喻多齿配体像螃蟹一样用两只大钳紧紧夹住中心体。
金属EDTA螯合物螯合物通常比一般配合物要稳定,其结构中经常具有的五或六元环结构更增强了稳定性。
正因为这样,螯合物的稳定常数都非常高,许多螯合反应都是定量进行的,可以用来滴定。
使用螯合物还可以掩蔽金属离子。
可形成螯合物的配体叫螯合剂。
常见的螯合剂如下:∙乙二胺(en),二齿∙2,2'-联吡啶(bipy),二齿∙1,10-邻二氮杂菲(phen),二齿∙草酸根(ox),二齿∙乙二胺四乙酸(EDTA),六齿值得一提的是EDTA。
它能提供2个氮原子和4个羧基氧原子与金属配合,可以用1个分子把需要6配位的钙离子紧紧包裹起来,生成极稳定的产物。
螯合物在工业中用来除去金属杂质,如水的软化、去除有毒的重金属离子等。
配合物知识点总结讲义一、概念配合物是指由一个或多个中性或带电的配体(通常为有机分子)与一个或多个金属离子(或原子)通过化学键结合而成的化合物。
配位化合物的形成是通过配体中的一个或多个孤对电子与金属中的空轨道形成化学键。
这种电子对与金属形成的键称为配位键,而形成的化合物称为配合物。
二、配位键配位键是指配体与金属中心之间的化学键。
配位键的形成是通过配位体中的孤对电子与金属中的空轨道形成的。
在配合物中,通常会形成多个配位键,形成多个配位键的配合物被称为多核配合物。
配位键的形成不仅是通过配位体中的孤对电子与金属中的空轨道形成的,还包括配体与金属形成的共价键。
共价键的形成主要取决于配体的受体能力和金属中心的给体能力。
受体能力越强的配体,形成的共价键就越强。
而给体能力越强的金属,形成的共价键也越强。
三、配合物的分类1. 根据配体的数量(1)单核配合物单核配合物是指一个金属中心与一个或多个配体通过化学键结合而成的配合物。
单核配合物是最常见的一种配合物。
例如[K4[Fe(CN)6],其中铁原子与6个氰根离子结合而成的配合物就是一个单核配合物。
(2)多核配合物多核配合物是指一个金属中心与两个或多个配体通过化学键结合而成的配合物。
多核配合物通常包含有金属中心与配体之间形成的金属-金属键。
例如[{Fe3(μ3-O)(μ-OH)(H2O)3}(NO3)6],其中三个铁原子通过氧原子形成金属-金属键,同时还与氢氧根离子以及水分子形成金属-配体键。
2. 根据配位键的类型(1)配位化合物配位化合物是指其中心金属原子或离子与一个或多个配体形成的配位键。
典型的配位化合物有氯化物、水合物等。
(2)离子配合物离子配合物是指其中心金属原子或离子与一个或多个离子形成的配位键。
典型的离子配合物有铁离子和硫离子形成的络合物等。
3. 根据配体的性质(1)有机配合物有机配合物是指其中心金属原子或离子与一个或多个有机配体形成的化合物。
例如以乙二胺为配体的金属配合物。