- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
的 SCN-(一般应小于 5×10-3mol/L)只进行 Fe3++CNS-===Fe[CNS]2+的反应,但当
Fe3+、SCN-浓度较大时,就不只是生成一配位的络离子,[FeCNS2+]1,e≠[CNS-],则 E1≠K[CNS-]0 故不能用式④计算。 (2)平衡常数与反应物起始浓度有无关系
平衡常数是与温度有关的常数,与反应物起始浓度并无关系。 (3)测定 Kc 时,为什么要控制酸度和离子强度
洗瓶
1个
实验试剂
1×10-3mol/L KCNS:由级 KCNS 配成,用 AgNO3 容量法准确标定。 L Fe(NH4)(SO4)2:由级 Fe(NH4)(SO4)2·12H2O 配成,并加入 HNO3 使溶液中的 H+ 浓度达到 L,Fe3+的浓度用 EDTA 容量法准确标定。
1mol/L HNO3
始浓度),对 1 号溶液可认为[FeCNS2+]1,e=[CNS-]0。
则 E1=K[CNS-]0
③
对其余组溶液 Ei=K[FeCNS2+]I,e
④
两式相除并整理得
⑤
达到平衡时,在体系中 [Fe3+]i,e=[Fe3+]i,e=[Fe3+]0-[FeCNS2+]
⑥
[CNS-]i,e=[CNS-]0-[FeCNS2+]
1mol/L KNO3
四、实验步骤
(1)取 8 个 50mL 容量瓶,编好号,按表 1 的内容,配制好溶液。在这 4 个容 量瓶中,溶液的氢离子均为 L,用 HNO3 来调节;溶液的离子强度均为,用 KNO3 来调节。
(2)取 4 个标记好的 50mL 容量瓶,按表 1 中计算结果,将除 KSCN 溶液外的三 种溶液分别取所需的体积按编号加入,并用蒸馏水冲制刻度。该溶液为测消光值
除此之外,实验操作也是影响实验结果的一个重要因素。本实验涉及到移液
管、酸碱滴定管、容量瓶等量器的使用,每一步的操作都会引入误差。而且由于 本实验是合作性实验,由 2-3 位同学合作完成。每位同学的操作习惯不相同,由 于个体操作不同从而引入误差。
假若我们忽略原理上的误差,我们只能从实验操作上来保证本实验的准确 性。每一个步骤,如定容,必须要由同一位同学来完成。另外,移液管、滴定管 的使用必须规范,才能在最大程度上保证数据的准确。
华南师范大学实验报告
液相反应平衡常数的测定
一、实验目的
(1)利用分光光度计测定低浓度下铁离子与硫氰酸根离子生成硫氰合铁络离子 液相反应的平衡常数。 (2)通过实验了解热力学平衡常数与反应物的起始浓度无关。
二、实验原理
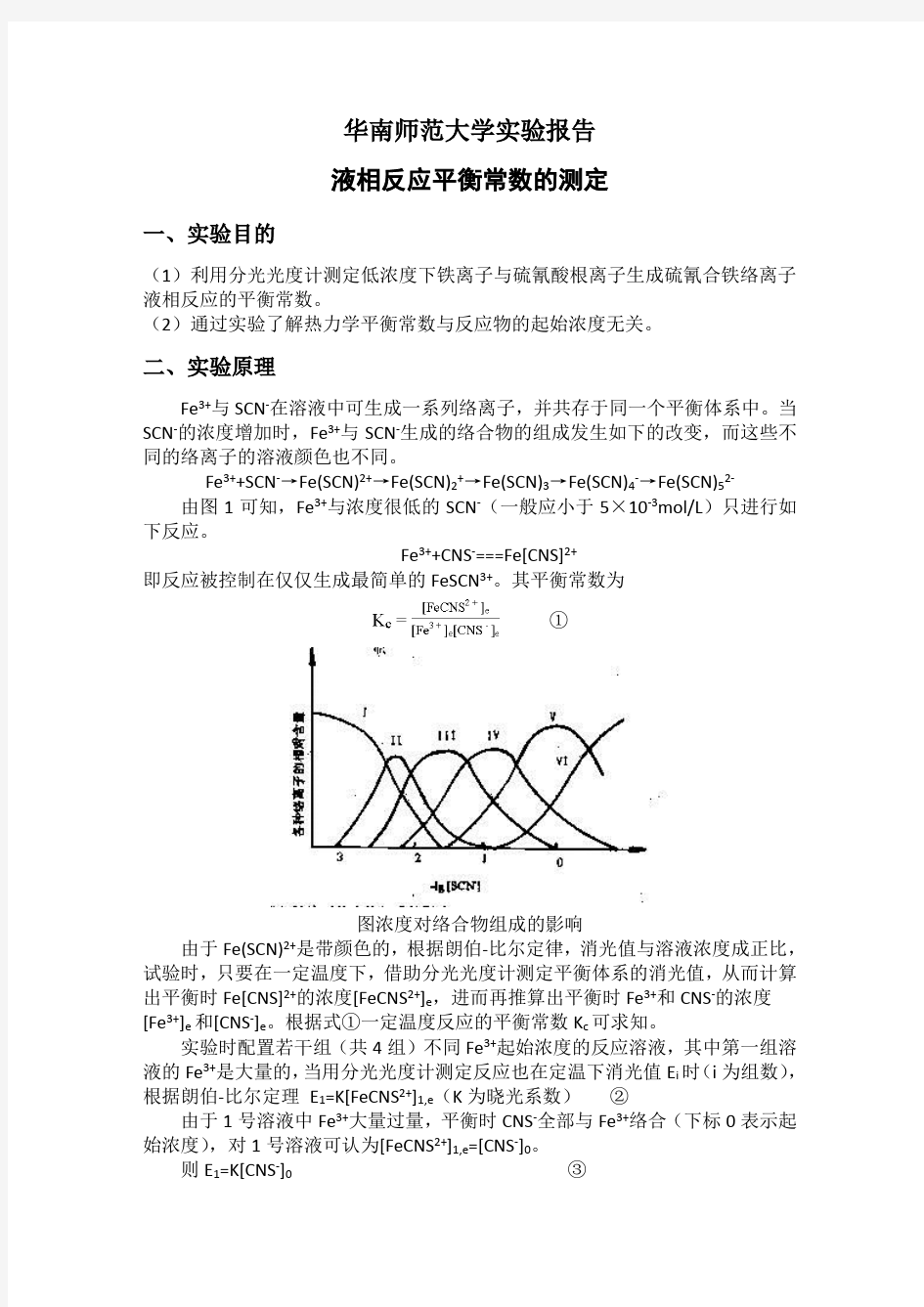
Fe3+与 SCN-在溶液中可生成一系列络离子,并共存于同一个平衡体系中。当 SCN-的浓度增加时,Fe3+与 SCN-生成的络合物的组成发生如下的改变,而这些不 同的络离子的溶液颜色也不同。
表 1.所需用 4 种溶液的用量
项目
容量瓶编号
1
2
3
4
KCNS 溶液(1× 10-3mol/L)
取体积数/mL
实际浓度 /(mol/L)
10
10
10
10
2×10-4 2×10-4 2×10-4 2×10-4
取体积数/mL
Fe(NH4)(SO4)2(L, 其中含 L)
HNO3 溶液 (1mol/L) KNO3 溶液 (1mol/L)
mi
Z
2 i
应保持一致。
由于 Fe3+离子可与多种阴离子发生络合,所以应考虑到对 Fe3+离子试剂的选
择。当溶液中有
Cl
、
PO
3 4
等阴离子存在时,会明显地降低
FeSCN2+络离子浓度,
从而溶液的颜色减弱,甚至完全消失,故实验中要避免 C1—的参与。因而 Fe3+离
子试剂最好选用 Fe(C1O4)3 或 Fe(NH4)(SO4)2。
由于 Fe3++SCN-在水溶液中存在水解平衡,所以 Fe3+与 SCN-的实际反应很复 杂,其机理为
k1
Fe3 SCN FeSCN 2 k1
K2
Fe3 H 2O FeOH 2 H (快)
k3
FeOH 2 SCN FeOHSCN k3
K4
FeOHSCN H FeSCN 2 H 2O(快)
①
图浓度对络合物组成的影响
由于 Fe(SCN)2+是带颜色的,根据朗伯-比尔定律,消光值与溶液浓度成正比,
试验时,只要在一定温度下,借助分光光度计测定平衡体系的消光值,从而计算
出平衡时 Fe[CNS]2+的浓度[FeCNS2+]e,进而再推算出平衡时 Fe3+和 CNS-的浓度 [Fe3+]e 和[CNS-]e。根据式①一定温度反应的平衡常数 Kc 可求知。
当达到平衡时,整理得到 [FeSCN 2 ]平 [Fe3 ]平[SCN ]平
=
k1
K2k3 [H ]平
k 1
k 3 K 4[H ]平
= K平
由上式可见,平衡常数受氢离子的影响。因此,实验只能在同一 pH 值下进 行。本实验为离子平衡反应,离子强度必然对平衡常数有很大影响。所以,在各
被测溶液中离子强度 I = 1 2
实际浓度 /(mol/L) 含 H+量/ (mol/L) 使反应体系
[H+]=
使反应体系 I=
25 5×10-2 ×10-3
5 5
5 1×10-2 5×10-4
7 23
5×10-3 ×10-4
五、数据处理
室温:℃ [H+]=L
大气压:
总离子强度 I=
波长 λ=450nm
表 2.实验数据记录表
项目
溶液编号
此外,可以通过测量两个温度下平衡常数,可计算出 H 。即
H RT2T1 ln K 2 T2 T1 K1
式中 K1 、 K 2 为温度 T1 、T2 时的平衡常数。
八、提问与思考
(1)当 Fe3+、SCN-浓度较大时,能否用式④计算 FeCNS2+络离子生成的平衡常数 不可以。根据图 1 所显示的 SCN-浓度对络合物组成的影响,Fe3+与浓度很低
七、实验评注与拓展
由于 Fe3++SCN-在水溶液中存在水解平衡,所以 Fe3+与 SCN-的实际反应很复 杂,其机理为
k1
Fe3 SCN FeSCN 2 k1 K2
Fe3 H 2O FeOH 2 H (快)
k3
FeOH 2 SCN FeOHSCN k3 K4
FeOHSCN H FeSCN 2 H 2O(快)
九、参考文献
[1]何广平,南俊民等.物理化学实验[M].北京:化学工业出版社,2008,89-92. [2] 陈龙武,陆嘉星等. 教材通讯[J]. 华东师范大学,1990(1):35-36.
分析误差产生的原因,首先从实验原理上分析,实验中[FeSCN]2+标准溶液是 以较浓的 Fe3+和较稀的 SCN-溶液反应而获得,当 Fe3+的浓度为 SCN-的浓度 250 倍 时,则可认为 SCN-全部消耗,反应体系的[FeSCN]2+离子浓度即为反应开始时 SCN的浓度。这种计算方法给实验的数据处理带来了极大的方便,但是这种情况是不 可能存在的,SCN-不可能完全消耗,在该种情况下反应也应该满足平衡常数的理 论值。
当达到平衡时,整理得到
[FeSCN 2 ]平 [Fe3 ]平[SCN ]平
=
k1
K2k3 [H ]平
k 1
k 3 K 4[H ]平
= K平
由上式可见,平衡常数受氢离子的影响。因此,实验只能在同一 pH 值下进 行。本实验为离子平衡反应,离子强度必然对平衡常数有很大影响。所以,在各
被测溶液中离子强度 I = 1 2
实验时配置若干组(共 4 组)不同 Fe3+起始浓度的反应溶液,其中第一组溶
液的 Fe3+是大量的,当用分光光度计测定反应也在定温下消光值 Ei 时(i 为组数), 根据朗伯-比尔定理 E1=K[FeCNS2+]1,e(K 为晓光系数) ②
由于 1 号溶液中 Fe3+大量过量,平衡时 CNS-全部与 Fe3+络合(下标 0 表示起
Fe3++SCN-→Fe(SCN)2+→Fe(SCN)2+→Fe(SCN)3→Fe(SCN)4-→Fe(SCN)52由图 1 可知,Fe3+与浓度很低的 SCN-(一般应小于 5×10-3mol/L)只进行如 下反应。
Fe3++CNS-===Fe[CNS]2+ 即反应被控制在仅仅生成最简单的 FeSCN3+。其平衡常数为
时的对比液。
(3)再取另外 4 个标记好的 50mL 容量瓶,按表 1 的结果,将 4 种溶液分别去 所需的体积按编号加入(KCNS 溶液最后加),并用蒸馏水冲至刻度。该溶液为液 相反应体系。
(4)调整分光光度计,将波长调至 450nm,分别测定 4 组反应溶液的消光值。 每组溶液要重复测 3 次(更换溶液),取其平均值。
1 2×10-3 1×10-4
4
×10-5 mol/L ×10-3 mol/L ×10-4 mol/L
Kc
六、实验结果分析
本次实验测得三个样品溶液的平衡常数分别为、、,可见编号为 3、4 的样品 液所得的数据较为接近,而编号 2 的样品相差较大。在条件许可的情况下,应进 行二次实验以获取较为准确的数据。根据化学数据手册,在 298K 温度下,Fe3+ 与 SCN-反应的平衡常数为 140。本次实验值与其相比较,相对误差高达%。
1
2
3
消光值 Ei
Ei/E1
1
×10-4 mol/L
Fra Baidu bibliotek
×10-4 mol/L
×10-5 mol/L
[Fe3+]i,e=[Fe3+]i,e=[Fe3+]0-[FeCNS2+] [CNS-]i,e=[CNS-]0-[FeCNS2+]
×10-2 mol/L
0
×10-3 mol/L ×10-5 mol/L
×10-3 mol/L ×10-4 mol/L
mi
Z
2 i
应保持一致。
(4)测定消光度时,为什么需空白对比液怎么选择空白对比液
除了 Fe[CNS]2+在溶液中显色具有一定的吸光度外,其他试剂也是具有一定
的吸光度的,因此在没有设置空白对比液的情况下,所得的吸光度会比准确值偏
高。因此必须使用除被测物质外其它组分完全一致的溶液作为空白对比液,在分
光光度计中进行背景校正。
⑦
将式⑥、⑦代入①,可以计算出除第 1 组外各组(不同 Fe3+起始浓度)反应
溶液的在定温下的平衡常数 Ki,e=值。
三、仪器与试剂
实验仪器
721 型分光光度计 1 台
100mL 烧杯
4个
25mL 移液管
1支
洗耳球
1个
50mL 容量瓶 8 个
刻度移液管 10mL(2 支)、5mL(1 支)
50mL 酸式滴定管 1 支