氨基甲酸铵分解压的测定实验报告
- 格式:doc
- 大小:17.28 KB
- 文档页数:2

第1篇一、实验目的1. 掌握氨基甲酸胺的制备方法。
2. 熟悉实验操作技能,如气体的收集、混合、反应等。
3. 了解氨基甲酸胺的性质,如溶解性、分解性等。
4. 分析实验过程中可能出现的问题,提高实验操作能力。
二、实验原理氨基甲酸胺(NH2COONH4)是一种白色固体,易分解、易水解,可用作肥料、灭火剂、洗涤剂等。
本实验采用氨气和二氧化碳在四氧化碳溶液中反应制备氨基甲酸胺。
化学方程式如下:2NH3(g) + CO2(g) → NH2COONH4(s)三、实验仪器与试剂1. 仪器:反应装置、四氧化碳、氨气、二氧化碳、冰水浴、烧杯、漏斗、滤纸、干燥器、分析天平、滴定管、移液管等。
2. 试剂:氨水(25%)、二氧化碳气体、四氧化碳、氢氧化钠标准溶液(0.1mol/L)。
四、实验步骤1. 准备反应装置:将反应装置中的四氧化碳加入烧杯中,用冰水浴冷却。
2. 气体发生:将氨水和二氧化碳气体分别通过液体石蜡瓶鼓泡瓶产生。
3. 气体收集与混合:控制氨气和二氧化碳的流速,使两种气体充分混合。
4. 反应:将混合气体通入四氧化碳溶液中,不断搅拌,使氨基甲酸胺晶体沉淀。
5. 分离:当氨基甲酸胺晶体较多时,停止制备。
用漏斗和滤纸将氨基甲酸胺晶体与四氧化碳溶液分离。
6. 干燥:将氨基甲酸胺晶体放入干燥器中,干燥至恒重。
7. 水解实验:将氨基甲酸胺晶体加入烧杯中,加入适量的水,用滴定管加入氢氧化钠标准溶液,观察水解反应现象。
8. 分析与讨论:分析实验结果,总结氨基甲酸胺的性质。
五、实验结果与分析1. 氨基甲酸胺的制备:实验成功制备了氨基甲酸胺晶体,产物为白色固体。
2. 氨基甲酸胺的溶解性:氨基甲酸胺在四氧化碳中溶解度较小,易析出晶体。
3. 氨基甲酸胺的分解性:氨基甲酸胺易分解,加热时分解速度加快。
4. 氨基甲酸胺的水解性:氨基甲酸胺在水中易水解,产生碳酸氢铵和一种弱碱。
六、实验结论1. 本实验成功制备了氨基甲酸胺晶体,掌握了实验操作技能。


实验十 氨基甲酸铵分解平衡常数的测定一、实验目的1. 掌握氨基甲酸铵的制备方法2. 用等压法测定一定温度下氨基甲酸铵的分解压力,并计算此分解反应的平衡常数3. 根据不同温度下的平衡常数,计算等压反应热效应的有关热力学函数。
二、实验原理干燥的氨和干燥的二氧化碳接触后,只生成氨基甲酸铵。
2 NH 3(g )+ CO 2(g ) NH 2CO 2NH 4(s )在一定温度下氨基甲酸铵的分解可用下式表示:243(2((NH COONH NH 2固)气)+CO 气)设反应中气体为理想气体,则其标准平衡常数K 可表达为22[][]co p K P P =3NH p (1) 式中,3NH p 和2co p 分别表示反应温度下NH 3和CO 2的平衡分压,P 为100kPa 。
设平衡总压为p ,则23p =3NH p ;213co p p =代入式(5-22),得到23214()()()3327P P P K P P P == (2)因此测得一定温度下的平衡总压后,即可按式(2)算出此温度的反应平衡常数K 。
氨基甲酸铵分解是一个热效应很大的吸热反应,温度对平衡常数的影响比较灵敏。
但当温度变化范围不大时,按平衡常数与温度的关系式,可得:ln r m H K C RT -∆=+ (3)式中,r m H ∆为该反应的标准摩尔反应热,R 为摩尔气体常数,C 为积分常数。
根据式(3),只要测出几个不同温度下的,以ln K 对1/T 作图,由所得直线的斜率即可求得实验温度范围内的r m H ∆。
利用如下热力学关系式还可以计算反应的标准摩尔吉氏函数变化r m G ∆和标准摩尔熵变r m S ∆:ln r m G RT K ∆=- (4)r m r m r m G H T S ∆=∆-∆ (5)本实验用静态法测定氨基甲酸铵的分解压力。
参看图10-1所示的实验装置。
样品瓶A 和零压计B 均装在空气恒温箱D 中。
实验时先将系统抽空(零压计两液面相平),然后关闭活塞1,让样品在恒温箱的温度t 下分解,此时零压计右管上方为样品分解得到的气体,通过活塞2、3不断放入适量空气于零压计左管上方,使零压计中的液面始终保持相平。

宁 波 工 程 学 院 物理化学实验报告实验名称 氨基甲酸铵分解反应标准常数的测定一、 实验目的1、 掌握测定平衡常数的一种方法;2、用等压法测定氨基甲酸氨的分解压力并计算分解反应的有关热力学常数。
二、 实验原理氨基甲酸铵(NH 2COONH 4)是白色固体,是合成尿素的中间产物,很不稳定,NH 2COONH 4的分解反应式为:NH 2COONH 4=== 2NH 3↑+CO 2↑该反应为复相反应,该反应正逆向都容易进行,在封闭体系中很容易达到平衡,其标准平衡常数可近似表示为:⎥⎦⎤⎢⎣⎡⎥⎦⎤⎢⎣⎡= p p p p K 2CO 23NH p(1)式中,P NH 3、P CO 2分别表示反应温度下NH 3和CO 2平衡时的分压; p 为标准压。
体系总压: p =p NH 3+p CO从化学反应计量方程式可知:p p p p 31322CO 3NH ==, (2)将式(2)代入式(1)得:32p274332⎪⎪⎭⎫⎝⎛=⎪⎪⎭⎫ ⎝⎛⎪⎪⎭⎫ ⎝⎛=p p p p p p K (3) 因此可知,当体系达平衡后,测定其总压力p ,即可计算出平衡常数K p 温度对平衡常数的影响一般都很明显,其定量关系为:2m pd ln d RT H TK r∆= (4) 式中,T 为热力学温度;Δr H Ө m 为标准反应热效应。
氨基甲酸铵分解反应是一个热效应很大的吸热反应,温度对平衡常数的影响比较灵敏。
当温度在不大的范围内变化时,Δr H Ө m 可视为与温度无关的常数,由(4)式积分得:C RTH Kr +∆-=m pln (C 为积分常数)(5)若以ln K Ө p 对1/T 作图,应为一直线,其斜率为-Δr H Ө m /R 。
由此可求出Δr H Ө m 。
在一个小的温度区间内,也可用此式计算出此温度区间的平均Δr H Ө m 。
并按下式计算T 温度下反应的标准吉布斯自由能变化Δr G Ө m ,Δr G Ө m =-RT ln K Ө p (6)利用实验温度范围内的平均等压热效应Δr H Ө m 及等温下的自由能变Δr G Ө m ,可近似地计算出该温度下的标准熵变Δr S Ө mTG H S r r rmm m∆-∆=∆ (7)综上所述:通过测定一定温度范围内某温度的氨基甲酸铵的分解压(平衡总压),就可以利用上述公式分别求出 K Ө p ,Δr H Ө m ,Δr G Ө m (T ),Δr S Ө m (T )。

氨基甲酸铵分解平衡常数测定一、实验目的1、测定氨基甲酸铵的分解压力,并求得反应的标准平衡常数和有关热力学函数;2、掌握空气恒温箱的结构。
二、实验原理氨基甲酸铵是是合成尿素的中间产物,为白色不稳定固体,受热易分解,其分解反应为2432NH COONH (s)2NH (g)+CO (g)−−→←−−该多相反应是容易达成平衡的可逆反应,体系压强不大时,气体可看作为理想气体,则上述反应式的标准平衡常数可表示为322NH CO θθθp p K p p ⎛⎫⎛⎫= ⎪ ⎪⎝⎭⎝⎭(1)式中3NH p 和2CO p 分别表示在实验温度下3NH 和2CO 的平衡分压。
又因氨基甲酸铵固体的蒸气压可以忽略,设反应体系达平衡时的总压为p ,则有3NH 23p p =, 2CO 13p p = 代入式(1)式可得3θθ427p K p ⎛⎫= ⎪⎝⎭(2)实验测得一定温度下的反应体系的平衡总压p ,即可按式(2)式算出该温度下的标准平衡常数θK 。
由范特霍夫等压方程式可得θθr m2Δd ln d H K T RT = (3) 式中θr m ΔH 为该反应的标准摩尔反应热,R 为摩尔气体常量。
当温度变化范围不大时,可将θr m ΔH 视为常数,对式(3)求积分得θθr mΔln H K C RT=+- (4)通过测定不同温度下分解平衡总压p 则可得对应温度下的θK 值,再以θln K 对1/KT 作图,通过直线关系可求得实验温度范围内的θr m ΔH 。
本实验的关系为:4θ1.89410ln 55.18/KK T -⨯=+由某温度下的θK 可以求算该温度下的标准摩尔吉布斯自由能变θr m ΔGθθr m Δln G RT K =-由θθθr m r m r m ΔΔΔG H T S =-可求算出标准摩尔反应熵变θr m ΔSθθθr m r mr mΔΔΔH G S T-=三、实验装置和药品整套实验装置主要由空气恒温箱(图中虚线框8)、样品瓶、数字式低真空测压仪,等压计,真空泵,样品管、干燥塔等组成,实验装置示意图如图所示。
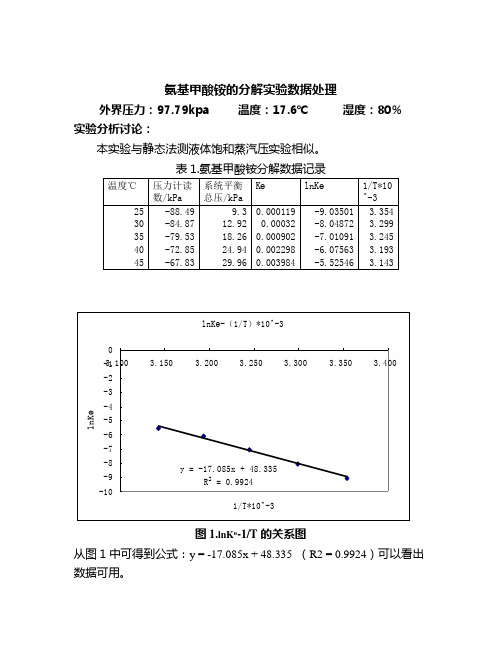
氨基甲酸铵的分解实验数据处理外界压力:97.79kpa 温度:17.6℃湿度:80% 实验分析讨论:本实验与静态法测液体饱和蒸汽压实验相似。
表1.氨基甲酸铵分解数据记录温度℃压力计读数/kPa 系统平衡总压/kPaKөlnKө1/T*10^-325 -88.49 9.3 0.000119 -9.03501 3.354 30 -84.87 12.92 0.00032 -8.04872 3.299 35 -79.53 18.26 0.000902 -7.01091 3.24540 -72.85 24.94 0.002298-6.075633.19345 -67.83 29.96 0.003984 -5.52546 3.143lnKө-(1/T)*10^-3y = -17.085x + 48.335R2 = 0.9924-10-9-8-7-6-5-4-3-2-13.100 3.150 3.200 3.250 3.300 3.350 3.4001/T*10^-3lnKө图1.lnKө-1/T的关系图从图1中可得到公式:y = -17.085x + 48.335 (R2 = 0.9924)可以看出数据可用。
然后结合公式lnKө=-/(RT)+B可知-/R=-17.085 =142.05kJ/mol计算25℃时的Δr G mθ=22.396kJ/molΔr S mθ=0.4013kJ/mol问题回答:1.怎样检查系统是否漏气?装置检查漏气的方法和静态法测液体饱和蒸汽压实验中检查漏气的方法一样,都是在使压力计通过抽气的方式得到一个负压值,然后关闭抽气泵以及各个阀门,观察压力计示数的变化,若是其变化在0.2kpa到0.3kpa的范围内,皆可认为装置气密性较好,能完成实验。
同时在实验步骤(5)中也是对装置实验过程中气密性的一个复查方式。
2.为什么要抽干净氨基甲酸铵小瓶中的空气?如果没有抽干净对测量数据会有什么样的影响?实验是测氨基甲酸铵的分解压力,若是在氨基甲酸铵小瓶中还有未抽干净的空气将使得测得的压力中包含了剩余空气产生的分压,将使结果偏大。
五、实验数据记录和处理 室温:T=(18.0 ℃+18.0 ℃)/2=18.0 ℃大气压:(83.44 Kpa +83.46 Kpa )/2=83.45 Kpa表1 数据记录六、实验结果与分析图1 ln K Θ~ 1/T如图斜率为 -20125,得标准反应摩尔焓变r m H Θ∆= -20125×﹙-8.314﹚= 相对误差=(167.319-155.380)/167.319=7.14%误差分析:1. 由于NH 2COONH 4易吸水,故在制备及保存时使用的容器都应保持干燥。
若NH 2COONH 4吸水,则生成(NH 4)2CO 3和NH 4HCO 3,就会给实验结果带来误差。
2. 系统气密性不是很好,刚开始检漏时,测压仪读数只能在两分钟内基本不变。
3. 系统中有少量空气,得到的蒸汽压数据就会偏大,平衡常数就会偏大。
4.恒温槽温度在微小范围内波动,影响可忽略不计。
3.由于视觉误差,U 型管中液面不能完全保持等高不变。
思考题1.如何检查系统是否漏气?答:关闭真空泵,关闭阀门,10min 后,若数字式低真空测压仪读数基本不变,则表示系统不漏气。
2.为什么一定要排净小球中的空气?答:测定的是纯粹的反应产生的气体的压力,所以空气排除得越干净,得到的数据结果就越准确。
3.如何判断氨基甲酸铵分解已达平衡?答:U 型等压计两臂的液面无论是否等高,在一定的时间内,液面不再变化就表示反应体系已达平衡。
4.在实验装置中安装缓冲瓶的作用是什么?答:防止开泵,关闭泵时体系的真空度上升或下降太猛而损坏设备。
5. 和两者有何不同?答:后者是标准平衡常数,前者是非标准平衡常数。
后者的量纲唯一,前者的量纲取决于平衡常数的表达式。
后者是根据标准热力学函数算得的平衡常数;而前者是用平衡时生成物对反应物的压力熵表示的平衡常数。
322p NH CO K p p=32NH CO p p p K p P ⎡⎤⎡⎤=⎢⎥⎢⎥⎣⎦⎣⎦。
氨基甲酸铵分解宁波工程学院物理化学实验报告专业班级姓名序号实验日期同组姓名指导老师实验名称氨基甲酸铵分解反应标准平衡常数测定一、实验目的1. 掌握测定平衡常数的一种方法;2. 用等压法测定氨基甲酸铵的分解压力并计算分解反应的有关热力学常数。
二、实验原理氨基甲酸胺是合成尿素的中间产物,为白色固体,很不稳定,其分解反应式为:NH 2COONH 4 == 2NH 3 + CO 2该反应为复相反应,在封闭体系中很容易达到平衡,在常压下其平衡常数可近似表示为:Kp (标准)= 【P(NH 3)/P(标准)】2【P(CO 2)/P(标准)】式中,P NH3、P CO2分别表示反应温度下NH 3和CO 2平衡时的分压;P (标准)为标准压。
在压力不大时,气体的逸度近似为1,且纯固态物质的活度为1,体系总压P=P NH3+P CO2。
从化学反应计量方程式可知:P NH3 = 2P/3 , P CO2 = P/3 将下式代入上面的式子中,得:K P (标准)= (4/27) (p/p (标准))3因此,当体系达到平衡后,测量其总压P ,即可计算出平衡常数K P (标准),温度对平衡常数的影响可用下式表示:dlnK P(标准)/dT = △rHm (标准)/RT 2利用实验温度范围内反应的平均等压热效应△rHm (标准)和T 温度下的标准吉布斯自由能变化△rGm (标准),可近似计算出该温度下的熵变△rSm (标准)△ rSm (标准) = (△rHm (标准)- △rGm (标准))/T因此通过测定一定温度范围内某温度的氨基甲酸铵的分解压,就可以利用上述公式分别求出K P (标准),△rHm (标准),△rGm (标准),△rSm (标准)。
三、实验仪器、试剂仪器:循环水泵,低真空数字测压仪,等压计,恒温槽一套,样品管。
试剂:氨基甲酸铵,液体石蜡。
四、实验步骤1打开恒温水浴开关,按回差键使之变为0.12装样:打开氨基甲酸銨分解反应平衡常数测定仪上端的加样口盖,加入一定量的氨基甲酸銨(平衡器中已装好)。
实验五 氨基甲酸铵分解压的测定 (多相化学反应平衡常数和热力学函数的测定)一、实验目的1.测定氨基甲酸铵的分解压力,并求得反应的标准平衡常数和有关热力学函数。
2.了解真空泵的构造原理和使用方法以及获得低真空度的方法。
3.掌握大气压力计的构造原理,使用方法以及气压计读数的校正方法。
二、基本原理氨基甲酸铵的分解可用下式表示:NH 2COONH 4(固)=2NH 3(气)+CO 2(气)设反应中气体为理想气体,则其标准平衡常数K 可表示为:K =P P P P K CO NH p 232)((1)式中3NH P 和2CO P 分别表示某温度下NH 3和CO 2的平衡分压,P 为标准压力。
设平衡总压为P ,则3NH P =P32(2)2CO P =P 31(3)代入式(1),得到p K =322743132P P P P P P (4)因此测得一定温度下的平衡总压后,即可按式(4)算出此温度的反应平衡常数。
氨基甲酸铵分解是一个热效应很大的吸热反应,温度对平衡常数的影响比较灵敏。
但当温度变化范围不大时,按平衡常数与温度的关系式,可得C RTH Kmln (5)式中m 为该反应的标准摩尔反应热,R 为摩尔气体常数,C 为积分常数。
根据式(5),只要测出几个不同温度下的 P K ,以 P K ln 对1/T 作图,由所得直线的斜率即可求得实验温度范围内的m 。
利用如下的热力学关系式:K RT G m ln (6)mm m S T G (7) 还可计算反应的标准摩尔吉氏函数变化m G 和标准摩尔熵变m S 等。
本实验用静态法测定氨基甲酸铵的分解压力。
三、仪器及试剂恒温槽一套、等压计、大气压力计、DPC—2B 型数字式低真空测压仪、三通活塞、二通活塞、真空泵、氨基甲酸铵,实验装置如图6-1。
四、实验步骤1.从气压计上读出大气压和室温,将大气压进行仪器误差和温度误差校正。
2.恒温槽及数字式低真空测压仪的调节使用。
氨基甲酸铵分解压的测定实验报告
实验目的:1、测定氨基甲酸铵的分解压2、测定氨基甲酸铵的溶解度,用质量分数表示其百分含量。
3、探讨铵盐与盐酸反应的机理4、确定盐酸在氨基甲酸铵溶液中的解离常数。
实验原理及方法:(1)热重分析法测定混合液浓度和温度。
用称量瓶分别取等质量的两份试样倒入干燥洁净的干燥器中。
用小烧杯分别取两份试样约3.5毫升放于干燥洁净的锥形瓶内并加以溶化。
向其中一支试管滴加等体积的1%盐酸溶液(作为参比),另一只试管中加入等体积的蒸馏水或去离子水(作为对照),然后再用滴管将此两种溶液各自沿试管壁缓慢注入,至整个试管底部充满了水时停止滴加。
同时记下滴数。
混合液经烘干后称重,根据滴数即可计算出混合液在25℃条件下的相对密度和氨基甲酸铵的含量。
(2)冷却法测定混合液中NH4HCO3的浓度。
将混合液放置在盛有冰水的大烧杯中冷却。
将已知质量的冷却后的混合液倒入一容量瓶中,用少量水冲洗烧杯并洗涤烧杯。
然后将冲洗过的烧杯和洗涤后的烧杯放回原来位置,加入等体积的蒸馏水使之达到刻度线。
然后摇匀,立即用0.05 mol/ L 硫酸标准溶液滴定,至溶液呈无色为终点。
实验原理及方法:(1)热重分析法测定混合液浓度和温度。
用称量瓶分别取等质量的两份试样倒入干燥洁净的干燥器中。
用小烧杯分别取两份试样约3.5毫升放于干燥洁净的锥形瓶内并加以溶化。
向其中一支试管滴加等体积的1%盐酸溶液(作为参比),另一只试管中加入等体积的蒸馏水或去离子水(作为对照),然后再用滴
管将此两种溶液各自沿试管壁缓慢注入,至整个试管底部充满了水时停止滴加。
同时记下滴数。
混合液经烘干后称重,根据滴数即可计算出混合液在25℃条件下的相对密度和氨基甲酸铵的含量。
(2)冷却法测定混合液中 NH4HCO3的浓度。
将混合液放置在盛有冰水的大烧杯中冷却。