金属与酸反应的图像及天平专题
- 格式:ppt
- 大小:811.00 KB
- 文档页数:15


专题1 金属的置换反应课程标准 课标解读 金属是初中常见且非常重要的知识。
涉及金属与酸、盐的置换,该类题目考察知识面广、综合性强,是考查学生逻辑思维的一类题目。
考察的知识较多,结合金属与酸、盐的基本属性,以选择填空和简答、计算题为主,探究题也涉及,难度较大。
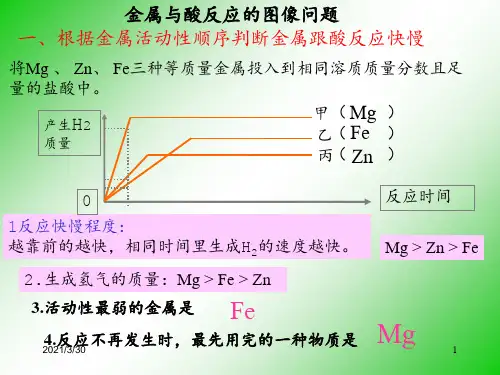
知识点01 金属与酸反应的图像分析金属与酸反应的图像要看清楚横坐标和纵坐标所表示的量。
(1)当横坐标表示时间、纵坐标表示产生氢气的量时,直线的“坡度”能够反映 ,坡度越陡,表示生成氢气越 ,金属活动性越 。
(2)当横坐标表示加入的酸的质量时,则图像的“坡度”不能用来表示产生气体的速率,在金属未反应完之前,横坐标相同时,产生的氢气质量 。
【即学即练1】(2020九上·柯桥月考)向等质量的锌粉和铁粉中加入过量的稀硫酸,下列图像能正确反映其对应关系的是( )A. B. C. D.【即学即练2】(2018九上·绍兴期中)以下是兴趣小组研究的课题——“金属和酸反应的快慢与什么因素有关”。
知识精讲目标导航(1)其他条件相同,同种金属与不同质量分数的盐酸反应,反应的快慢不同。
取质量相等的铝片,分别放入 5%、20%的足量稀盐酸中。
实验表明盐酸浓度越大,反应速率越快。
下图 I、II、Ш是三位同学记录的实验生成氢气的质量(m)与反应时间(t)的关系曲线,其中正确的是________。
(2)其他条件相同,不同金属与相同质量分数的盐酸反应,反应的快慢不同。
取质量相等的镁片、锌片、铁片中的两种金属,分别放入溶质质量分数相同的足量稀盐酸中,生成氢气的质量(m)与反应时间(t)的关系曲线如右图所示。
则曲线 A 对应的金属是________。
(3)请再提出一个影响金属与盐酸反应快慢的合理因素________。
知识点02 金属与盐反应的先后问题当活动性较强的金属与多种活动性较弱的金属的盐溶液发生置换反应时,金属按照活动性由到的顺序从它的盐溶液中被置换出来;当几种活动性较强的金属与一种活动性较弱的金属的盐溶液发生置换反应时,金属按照活动性由到的顺序与盐溶液发生置换反应。

一、中考初中化学金属与酸反应的图像1.在两只烧杯中分别放入相同质量的镁、锌两种金属,然后向两只烧杯中分别倒入相同质量、相同质量分数的稀硫酸,反应产生氢气的质量与消耗硫酸的质量关系如图。
综合以上信息得到以下结论,合理的是A .从图象可以看出,金属镁比金属锌的活动性强B .若两种金属都有剩余,二者得到的氢气质量相同C .若硫酸有剩余,二者得到氢气的质量相同D .若两种金属完全溶解,二者消耗硫酸的质量相同【答案】B【解析】【分析】【详解】A 、图像体现的是产生氢气质量与消耗硫酸质量之间的关系,没有体现时间关系,无法比较镁、锌反应的速率,无法得出镁和锌的活动性强弱,说法错误;B 、若两种金属都有剩余,则消耗的硫酸质量相等,根据氢元素质量守恒,产生的氢气均来自硫酸中的氢元素,故二者得到的氢气质量相同,说法正确;C 、若硫酸有剩余,根据2442Mg H SO MgSO H 242+=+↑,2442Zn H SO ZnSO H 652+=+↑可知,相同质量的镁、锌产生氢气的质量为:镁>锌,说法错误;D 、若两种金属完全溶解,根据2442Mg H SO MgSO H 2498+=+↑,2442Zn H SO ZnSO H 6598+=+↑可知,相同质量的镁、锌与硫酸反应,消耗硫酸的质量为:镁>锌,说法错误。
故选:B 。
2.如图表所示4个图象中,能正确反映变化关系的是A .足量镁和铝分别放入等质量、等浓度的稀盐酸中B .镁在空气中加热C .加热一定质量的高锰酸钾固体D .向一定质量的二氧化锰中加入过氧化氢溶液【答案】B【解析】【分析】【详解】A 、根据反应的化学方程式及其质量关系:22Mg+2HCl=24MgCl +3H 72↑,325421961872Al +6HCl =2AlCl +3H 32↑可知 ,足量的镁和铝分别放入等质量、等浓度的稀盐酸中,酸能完全反应,因此反应生成的氢气质量相同,产生相同质量的氢气,消耗镁的质量大于 铝的质量,图像不能正确反映变化关系,不符合题意;B 、镁与空气中的氧气反应生成氧化镁,根据质量守恒定律,反应物质量应该等于生成物质量,因此固体的质量不断增加,图像能正确反映变化关系,符合题意;C 、高锰酸钾受热分解生成了锰酸钾、二氧化锰和氧气,固体的质量减小,锰元素的质量不变,因此固体中锰元素的质量分数应当增加,图像不能正确反映变化关系,不符合题意;D 、向一定质量的二氧化锰中加入过氧化氢溶液,二氧化锰是该反应的催化剂,质量不变,图像不能正确反映变化关系,不符合题意。


一、中考初中化学金属与酸反应的图像1.在两只烧杯中分别放入相同质量的镁、锌两种金属,然后向两只烧杯中分别倒入相同质量、相同质量分数的稀硫酸,反应产生氢气的质量与消耗硫酸的质量关系如图。
综合以上信息得到以下结论,合理的是A .从图象可以看出,金属镁比金属锌的活动性强B .若两种金属都有剩余,二者得到的氢气质量相同C .若硫酸有剩余,二者得到氢气的质量相同D .若两种金属完全溶解,二者消耗硫酸的质量相同【答案】B【解析】【分析】【详解】A 、图像体现的是产生氢气质量与消耗硫酸质量之间的关系,没有体现时间关系,无法比较镁、锌反应的速率,无法得出镁和锌的活动性强弱,说法错误;B 、若两种金属都有剩余,则消耗的硫酸质量相等,根据氢元素质量守恒,产生的氢气均来自硫酸中的氢元素,故二者得到的氢气质量相同,说法正确;C 、若硫酸有剩余,根据2442Mg H SO MgSO H 242+=+↑,2442Zn H SO ZnSO H 652+=+↑可知,相同质量的镁、锌产生氢气的质量为:镁>锌,说法错误;D 、若两种金属完全溶解,根据2442Mg H SO MgSO H 2498+=+↑,2442Zn H SO ZnSO H 6598+=+↑可知,相同质量的镁、锌与硫酸反应,消耗硫酸的质量为:镁>锌,说法错误。
故选:B 。
2.下列图像能正确反映对应变化关系的是A.两份等质量的氯酸钾在有、无 MnO2的情况下加热产生氧气B.加水稀释盐酸C.向稀盐酸和氯化钙的混合溶液中加入碳酸钠溶液D.将足量粉末状的铁和镁分别与等质量、等质量分数的稀盐酸反应【答案】C【解析】【分析】【详解】A、两份等质量的氯酸钾在有、无MnO2的情况下加热产生氧气,催化剂只能影响反应速率,产生氧气的质量相等,故选项图象不能正确反映对应变化关系;B、向浓盐酸中不断加水稀释,溶液始终显酸性,pH不可能大于7,故选项图象不能正确反映对应变化关系;C、向稀盐酸和氯化钙的混合溶液中加入碳酸钠溶液,碳酸钠先与稀盐酸反应生成氯化钠、水和二氧化碳气体,开始不生成沉淀。

金属与酸反应(讲义)➢知识点睛1.图象题(1)氢气质量与反应时间的关系a.等质量的镁、铝、锌、铁和足量的酸反应(图1),金属反应完,酸有剩余,生成氢气的质量不等,产生氢气的质量由多到少为:____、____、____、____,产生氢气由快到慢为____、____、____、____。
b.足量的镁、铝、锌、铁和等量的酸反应(图2),酸反应完,金属有剩余,生成氢气的质量相等,消耗金属的质量由少到多为:____、____、____、____,产生氢气由快到慢为____、____、____、____。
注:四种金属的产氢能力由强到弱为:___、___、___、___。
(2)氢气质量与反应物质量的关系a.向等质量的镁、铝、锌、铁中加入足量酸(图3),最初酸不足,产生氢气的质量相等,最终酸过量,金属不足,产生的氢气质量不等,产生氢气的质量由多到少为:____、____、____、____。
b.向等质量的酸中加入足量的镁、铝、锌、铁(图4),最初金属不足,等质量的金属参与反应产生氢气的质量不等,产生氢气的质量由多到少为:____、____、____、____,最终酸不足,产生的氢气质量相等。
注:此类图象中斜率的大小不再表示产生氢气的快慢。
2.天平问题天平两边加入金属和酸的量均相等,天平偏转情况:(1)天平首先偏向放出氢气较慢的一侧,即金属活动性较弱的一侧。
(2)天平最终偏向放出氢气的量较少的一侧,即产氢能力弱的一侧。
若两边放出氢气的质量相等,则天平最终平衡。
注:天平最终不可能偏向产氢能力强的一侧。
3.根据金属混合物与酸反应判断金属混合物的成分(1)平均值法计算出金属混合物的平均相对原子质量Ar,利用平均值法,推测金属混合物的成分(将Al的相对原子质量折算成18,氢后金属的相对原子质量折算成无穷大)。
A r(A)<Ar< A r(B)(2)极端假设法假设金属混合物中只含已知的该金属,计算此时应产生的氢气质量,比较其与实际产生的氢气质量的大小关系,根据金属产氢能力,推测金属混合物的成分。




一、中考初中化学金属与酸反应的图像1.在两只烧杯中分别放入相同质量的镁、锌两种金属,然后向两只烧杯中分别倒入相同质量、相同质量分数的稀硫酸,反应产生氢气的质量与消耗硫酸的质量关系如图。
综合以上信息得到以下结论,合理的是A .从图象可以看出,金属镁比金属锌的活动性强B .若两种金属都有剩余,二者得到的氢气质量相同C .若硫酸有剩余,二者得到氢气的质量相同D .若两种金属完全溶解,二者消耗硫酸的质量相同【答案】B【解析】【分析】【详解】A 、图像体现的是产生氢气质量与消耗硫酸质量之间的关系,没有体现时间关系,无法比较镁、锌反应的速率,无法得出镁和锌的活动性强弱,说法错误;B 、若两种金属都有剩余,则消耗的硫酸质量相等,根据氢元素质量守恒,产生的氢气均来自硫酸中的氢元素,故二者得到的氢气质量相同,说法正确;C 、若硫酸有剩余,根据2442Mg H SO MgSO H 242+=+↑,2442Zn H SO ZnSO H 652+=+↑可知,相同质量的镁、锌产生氢气的质量为:镁>锌,说法错误;D 、若两种金属完全溶解,根据2442Mg H SO MgSO H 2498+=+↑,2442Zn H SO ZnSO H 6598+=+↑可知,相同质量的镁、锌与硫酸反应,消耗硫酸的质量为:镁>锌,说法错误。
故选:B 。
2.下列图像与对应的说法正确的是A.向NaOH溶液中加水稀释B.等质量的Al、Zn与足量的稀硫酸反应C.向稀硫酸中加入Ba(OH)2溶液D.在恒温的条件下,适量蒸发饱和NaCl溶液的水分【答案】C【解析】【分析】【详解】A.向氢氧化钠溶液加水稀释,溶液一开始呈碱性,pH>7,加水稀释后,碱性减弱,pH逐渐减小,但也不会呈酸性,故A错误;B.金属活动顺序中,Al比Zn活泼,与酸反应速率Al比Zn快,在图像中表现应为Al的斜线倾斜率大于Zn的斜线倾斜率,故B错误;C. H2SO4+Ba(NO3)2=2HNO3+BaSO4↓,二者完全反应后,Ba(NO3)2溶液过量后,就不会产生BaSO4沉淀,故C正确;D.在恒温下,饱和溶液溶质质量分数不变,故D错误。