大容量注射剂生产工艺流程图
- 格式:docx
- 大小:139.63 KB
- 文档页数:11

批号外观质量数量灭菌温度、时间可见异物检查包装质量检查成品质量检验装量、外观质量检查原料安瓿清洁除尘拆外包装称量配制清洁除尘拆外包装灭菌、检漏灯检包装注射用水清洗可见异物检查外包装材料进厂质量检验质量检验检查流程物料库房一般生产区D级中间产品检验药液检查干燥灭菌温度、时间安瓿清洁度加 工QC检验过程控制供应商审计进厂验收质量检查工序监控点监控内容监控频次监控标准配液备料物料物料信息、外观、异物每次1、所领物料与生产所用物料一致;2、外观无破损;3、物料无异物称量衡具,量具校验合格证、校准每批1、有检验合格证并在有效期内2、经过校准且有记录原辅料环境、数量、复核每次1、环境:温度:18℃-26℃,湿度:45%-65%;2、称量数量与批生产指令一致;3、双人独立复核配制原辅料标识每批1、标识与生产所需一致除菌过滤器规格、起泡点每批1、除菌过滤器所用规格与生产要求一致;2、起泡点合格药液澄明度、数量、pH值、含量每批1、澄明度:无浑浊;2、药液数量与批生产指令一致;3、pH值:3.2-3.8;4、含量:4.85mg/ml~5.50mg/ml 过滤过滤器压力每次1、过滤压力0.1-11 质量监控0.2Mpa洗瓶安瓶物料信息、外观每批1、所领物料与生产所用物料一致;2、外观无破损注射用水超声频率、注射用水澄明度、水温、水压、清洁度每小时1、超声波频率:70Hz;2、注射用水澄明度:无浑浊;3、水压:0.35-0.45Mpa;4、清洁度:无颗粒物压缩空气清洁度、压力每小时1、清洁度:无颗粒物,无油;2、压力:0.30-0.60Mpa洗后安瓶清洁度随时/批1、清洁度:无颗粒物,无浑浊;2、瓶内无积水灭菌干燥隧道烘箱温度、网带频率每小时1、温度:290±10℃;2、网带频率:≤25Hz灌封药液装量、中间体检验报告单每批1、装量:2.10ml ~2.30ml/支;2、有中间体检验合格报告熔封封口长度、封口质量、装量、灌封时间随时/班1、封口高度:6.5cm;2、封口质量:不合格品(无尖头、泡头、凹头等)≤5‰;3、灌封时间≤8h灭菌检漏灭菌柜温度,时间每柜1、温度:100℃;2、时间:20min半成品标识、存放区、无菌检查每柜1、每批灭菌半成品存放按柜次存放并有状态标识;2、无菌检查:合格灯检待检品装量、可见异物、外观随时/班1、装量:2.10ml ~2.30ml/支;2、可见异物:抽检20支不得有可见异物;3、外观:抽检20支不得有外观不合格品(无尖头、泡头、凹头等)不合格品数量,标识,处理每批1、不合格品统计数量,每批分区存放并有状态标识;2、在QA监督下每批销毁工序监控点监控内容监控频次监控标准纸盒内容、字迹、位置、数量随时/班1、内容、数量与批包装指令一致;2、字迹清晰,与样张相符;1、内容、数量与包装标签内容、字迹、位置、数量随时/班批包装指令一致;2、字迹清晰,与样张相符;装盒包装内容物、装盒数量、装盒质量随时/批1、包装内容物与批包装指令一致;2、装盒数量:2ml*5支/盒;3、装盒质量:无少装内容物,无多装或少装说明书装箱装箱内容物、装盒数量、装盒质量随时/批1、装箱内容物与批包装指令一致;2、装箱数量:2ml*100盒/件;3、装箱质量:无少装内容物入(寄)库成品标识、存放区、无菌检查每批1、成品统计数量,每批分区存放并有状态标识;。

药品生产典型工艺流
程框图
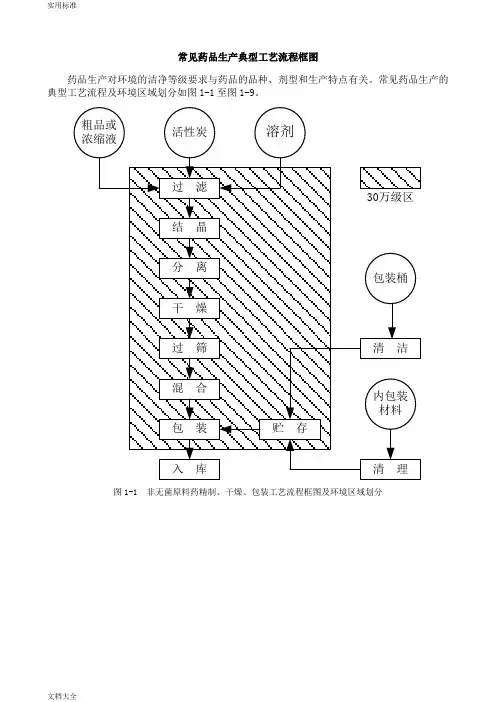
常见药品生产典型工艺流程框图
药品生产对环境的洁净等级要求与药品的品种、剂型和生产特点有关。
常见药品生产的典型工艺流程及环境区域划分如图1-1至图1-9。
图1-1 非无菌原料药精制、干燥、包装工艺流程框图及环境区域划分
图1-2 无菌原料药精制、干燥、包装工艺流程框图及环境区域划分
图1-3 片剂生产工艺流程框图及环境区域划分
图1-4 硬胶囊剂生产工艺流程框图及环境区域划分
图1-5 压制法软胶囊剂生产工艺流程框图及环境区域划分
图1-6 可灭菌小容量注射剂生产工艺流程框图及环境区域划分
图1-7 可灭菌大容量注射剂生产工艺流程框图及环境区域划分
图1-8 注射用无菌分装产品生产工艺流程框图及环境区域划分
图1-9 注射用冷冻干燥制品生产工艺流程框图及环境区域划分。

大容量注射剂的生产工艺流程英文回答:Large Volume Parenteral (LVP) Manufacturing Process Flow.1. Raw Material Receiving and Storage.Initial incoming raw materials, including active pharmaceutical ingredients (APIs), excipients, and packaging components, are inspected and quarantined until approved for use. Proper storage conditions are maintained to ensure product integrity.2. API and Excipient Preparation.The API is weighed and dissolved or suspended in an appropriate solvent. Excipients, such as buffers, stabilizers, and preservatives, are added to the solution to enhance stability and functionality.3. Filtration.The solution is filtered to remove any particles or impurities that could compromise product quality. Sterile filtration is employed to eliminate microorganisms.4. Filling.The solution is filled into sterile containers, typically glass or plastic vials or bags. Fill volumes are precisely controlled to ensure accurate dosing.5. Capping and Sealing.Vials or bags are capped or sealed using sterile techniques to maintain product integrity and prevent contamination.6. Inspection.Filled containers undergo visual and automatedinspections to detect any defects or anomalies in appearance, fill volume, or sealing.7. Labeling.Product labels are applied to containers, providing essential information such as product name, manufacturer, dosage, and expiration date.8. Packaging.Filled and labeled containers are packaged in cartons or boxes for protection and distribution.9. Sterilization.Terminal sterilization is performed to eliminate any remaining microorganisms. Heat sterilization, gamma irradiation, or ethylene oxide sterilization methods may be used.10. Storage and Distribution.Finished LVP products are stored and distributed under controlled conditions to ensure their stability and potency throughout their shelf life.中文回答:大容量注射剂生产工艺流程。

制药有限公司大容量注射液生产工艺规程颁发单位:GMP办公室工艺规程批准程序目录1. 剂型、规格 (3)2. 生产工艺流程 (3)3. 操作过程及工艺条件 (4)4.质量控制要点 (6)5.设备一览表、主要设备生产能力 (7)6.工艺过程中的SOP (7)7.中间产品的控制 (8)8.验证工作要点 (8)9.工艺卫生和环境卫生 (10)10.劳动组织及岗位定员 (10)一、制剂类型:最终灭菌大容量注射液,100ml规格,西林瓶包装。
二、流程图:大容量注射剂工艺流程图三、操作过程及工艺条件1 生产前的检查与确认1.1 是否还留有前批生产的产品或物料,是否已清洁并取得“清场合格证”。
1.2 检查确认生产现场的机器设备和器具是否已清洁并准备完毕挂上“合格”标示。
1.3 所使用原辅料是否准备齐全。
是否有质量检验报告单,合格品才能使用。
1.4 检查工艺用水是否新鲜制备,贮存不得超过24小时。
1.5 检查确认与生产品种相适应的批生产指令、配套文件及有关记录是否已准备齐全。
1.6 检查确认生产场所的温度是否在规定范围内(18-26℃,相对湿度在30%-65%)。
2 洗瓶、塞、铝盖2.1理瓶:根据“批生产指令”准备所需的清洁盘、领取必须的西林瓶。
在理瓶室将西林瓶的合格品摆满瓶盘。
2.2清洗:把西林瓶放在不锈钢传送链条上,开动洗瓶机,定时检查安瓿的清洁度:目检1000ml注射用水无可见异物,抽50支,毛、块≤2%。
洗瓶岗位按清场SOP进行清场,并填写生产记录。
2.3 理塞、铝盖:根据《生产指令》准备所需的丁基胶塞和铝盖,分别、依次放入多功能胶塞漂洗机。
2.4清洗:将丁基胶塞放入多功能漂洗机后,加入纯化水,开动机器进行清洗,清洗后捞出、沥干。
排除纯化水后再加入注射用水清洗,捞出、沥干。
将铝盖放入多功能漂洗机后,加入纯化水,开动机器清洗,清洗后捞出、沥干。
排除纯化水后再加入注射用水清洗,捞出、沥干。
清洗过后,按岗位清场操作规程进行清场,填写清场合格证,并填写生产记录。


磺胺间甲氧嘧啶钠注射液生产工艺规程(大容量)目录1 产品概述2 处方和依据3 工艺流程图4 制剂工艺过程及工艺条件5 原辅材料质量标准和检查方法6 中间产品质量标准和检查方法7 成品质量标准和检查方法8 包装规格、包装材料质量标准9 说明书、产品文字说明和标志10 工艺要求11 设备一览表和主要设备生产能力12 技术安全与劳动保护13 劳动组织14 技术经济指标计算15 原辅料消耗定额16 包装材料消耗定额17 动力消耗定额18 综合利用与环境保护目的:制定本标准的目的是规范磺胺间甲氧嘧啶钠注射液生产过程,对一定数量的成品所需的起始原辅料和包装材料,以及工艺、加工说明、技术参数、注意事项等进一步标准化。
适用范围:适用于磺胺间甲氧嘧啶钠注射液生产全过程。
责任人:质量部部长、生产部部长、车间主任。
内容:1产品概述:本品为磺胺间甲氧嘧啶钠的灭菌水溶液。
含磺胺间甲氧嘧啶钠(C11H11N4NaO3S)应为标示量的96.0%~104.0%1.1产品特点:1.1.1性状:本品为无色至微黄色的澄明液体。
1.1.2作用与用途:磺胺类药。
用于各种敏感菌引起的呼吸道、消化道、泌尿道感染及球虫病、猪弓形虫病等。
局部灌注可治疗乳腺炎和子宫内膜炎。
1.1.3用法用量:静脉注射一次量每1Kg体重家畜0.5ml,一日1~2次,连用2-3日。
1.1.4规格:100ml:10g(磺胺间甲氧嘧啶钠)1.1.5贮藏:遮光、密闭保存。
1.1.6停药期:28日1.1.7有效期:二年1.1.8批准文号:2 处方和依据:2.1处方:(1000ml)磺胺间甲氧嘧啶钠100g 硫代硫酸钠 1 g注射用水 至1000ml10000级区100000级区4 制剂工艺过程及工艺条件: 4.1总述:4.1.1按生产指令单领取磺胺间甲氧嘧啶钠原料,在浓配灌中加入计算量70%的注射用水, 再加入计算量的硫代硫酸钠搅拌使溶解;然后加磺胺间甲氧嘧啶钠原料搅拌至完全溶解,粗滤至稀配灌中,加注射用水近全量,调节PH在规定范围内(9.7-10.8),补加注射用水至足量;用孔径为0.45um、0.22um的过滤器(使用前后经过完整性测试合格)精滤,检查澄明度、含量合格后,将药液输送到至灌封岗位,灌装压盖,100℃30分钟灭菌,灯检、贴签包装成规定规格即可。


大容量注射剂工艺流程英文回答:The process of manufacturing large volume injections (LVIs) involves several steps to ensure the quality and safety of the final product. I have experience working in a pharmaceutical company where we produced LVIs, so I can provide insights into the process.Firstly, the raw materials used in the formulation of LVIs need to be thoroughly tested and validated. This includes testing the purity, potency, and stability of the active pharmaceutical ingredients (APIs) as well as ensuring the quality of excipients and other additives. These tests are crucial to maintain the efficacy and safety of the final product.Once the raw materials are approved, the next step is the formulation of the injection. This involves mixing the APIs with excipients and additives to achieve the desiredconcentration and stability. The formulation process requires precise measurements and careful handling to prevent contamination and ensure uniformity.After the formulation, the injection is subjected to sterilization. Sterilization is a critical step to eliminate any microorganisms that may be present in the product. The most common method of sterilization for LVIsis autoclaving, where the product is exposed to high temperature and pressure to kill any bacteria or fungi. Other methods such as filtration or irradiation may also be used depending on the specific requirements of the product.Once the injection is sterilized, it is filled into vials or ampoules. This step requires specialized equipment to ensure accurate filling and prevent any air bubbles or contamination. The filled vials or ampoules are then sealed to maintain the sterility of the product.Finally, the filled and sealed vials or ampoules undergo quality control tests to ensure that they meet the required specifications. These tests include visualinspection for any defects, measurement of volume and pH, and testing for sterility and endotoxin levels. Only the vials or ampoules that pass these tests are considered suitable for distribution and use.中文回答:制造大容量注射剂(LVIs)的工艺流程涉及多个步骤,以确保最终产品的质量和安全性。
常见药品生产典型工艺流程框图
药品生产对环境的洁净等级要求与药品的品种、剂型和生产特点有关。
常见药品生产的典型工艺流程及环境区域划分如图1-1至图1-9。
图1-1 非无菌原料药精制、干燥、包装工艺流程框图及环境区域划分
图1-2 无菌原料药精制、干燥、包装工艺流程框图及环境区域划分
图1-3 片剂生产工艺流程框图及环境区域划分
图1-4 硬胶囊剂生产工艺流程框图及环境区域划分
图1-5 压制法软胶囊剂生产工艺流程框图及环境区域划分
图1-6 可灭菌小容量注射剂生产工艺流程框图及环境区域划分
图1-7 可灭菌大容量注射剂生产工艺流程框图及环境区域划分
图1-8 注射用无菌分装产品生产工艺流程框图及环境区域划分
图1-9 注射用冷冻干燥制品生产工艺流程框图及环境区域划分。

大输液生产工艺规程大输液生产工艺规程大输液生产工艺规程部门:生产部题目:大输液生产工艺规程1/15文件编号:STP-PC-99000(01)新订:替代:起草:部门审阅:审核:批准:执行日:变更记录:修订人:批准执行日:变更原因及目的:目的:建立一个大容量注射液(大输液)生产的通用工艺规程,为车间提供一个通用技术标准适用范围:大输液的生产工艺责任者:生产部经理、输液车间主任、工艺技术员、质监员及操作员内容:一、生产工艺流程图(见下页)。
二、操作过程及工艺条件。
1、制水将饮用水(来自青城山)经石英砂过滤和活性碳过滤去除水中有机质及微粒,经电渗析初步脱盐(脱盐率75±5%后,再经过“阳—阴—阴—混”离子交换柱去离子化制得去离子水,再经过切割分子量为10000(相当于0.001μm)中空纤维滤材组成的超滤系统过滤后制得超纯水(纯化水),再经五效蒸馏水机制造蒸馏水,经微孔滤膜(孔径0.45μm)过滤后制得注射用水。
2、洗瓶将检验合格的输液瓶在车间外脱去外包装(麻袋或纸箱),在玻瓶进入口处转入周转箱中,运至理瓶室理瓶机旁,逐一上瓶于转盘上,开动外洗瓶机,淋水下对玻瓶进行外刷洗,同时灌入约100ml自来水,传送至内洗瓶(粗洗)机,先用0.5%NaOH 洗刷,再用自来水洗刷,再用自来水洗刷,最后用纯化水大输液生产工艺规程部门:生产部题目:大输液生产工艺规程2/15文件编号:STP-PC-99000(01)新订:替代:起草:部门审阅:审核:批准:执行日:变更记录:修订人:批准执行日:变更原因及目的:胶塞隔离膜输液瓶原辅料饮用水↓瓶外清洗碱酸处理乙醇浸泡↓称量离子交换清洁剂处理↓饮用水初洗蒸馏水清洗刷洗内壁浓配去离子水↓饮用水清洗蒸馏水煮沸蒸馏水清洗↓过滤蒸馏水去离子水清洗↓蒸馏水清洗注射用水清洗注射用水清洗稀配注射用水↓注射用水清洗粗滤精滤灌装放膜注射用水清洗上胶塞翻塞盖铝盖铝盖轧口出厂入库包装贴签灯检灭菌注:洁净级别100级1万级10万级大输液生产工艺规程部门:生产部题目:大输液生产工艺规程3/15文件编号:STP-PC-99000(01)新订:替代:起草:部门审阅:质量审核:批准:执行日:变更记录:修订人:批准执行日:变更原因及目的:药液经中间检验各项指标合格后输送至灌装机,开机灌装入洁净的输液瓶中,立即盖薄膜,膜必须放正,然后对准膜中心,垂直塞入胶塞,经翻塞机翻塞后传送到轧盖。
大容量注射剂生产实用工艺流程图目录1.大容量注射剂生产区概况2.需要验证的关键工序及工艺验证3.工艺流程的实施4.操作过程及工艺条件5.技术安全、工艺卫生及劳动保护6.物料平衡及技经指标7.设备一览表8.岗位定员9.附件(含设备操作、清洁规程)10.变更记录1.大容量注射剂生产区概况本生产区面积904㎡,其中1万级净化区域167㎡,10万级净化区域174㎡。
大容量注射剂车间采用10万级和1万级(局部百级)空气净化洁净级别,10万级区域设置缓冲、更衣、洗涤、洁具、称量、配碳、浓配、洗瓶等,1万级区域设置缓冲、更衣更鞋、稀配、化验、灌装、加塞、轧盖、洗涤、存放、洁具等功能间,所有隔断采用无粉尘产生的静电喷涂彩钢板,结合处采用圆角处理,不易产生积灰;人员经过三次更衣和二次更鞋后进入洁净区操作,物料进入洁净区均采用传递窗或气闸进行传递,人流、物流的进入相对分开,保证了洁净区空气洁净度要求;生产设备均采用优质不锈钢材料制造,采用洗瓶、灌装、压塞、轧盖联动线生产,其中洗瓶出口、灌装、加塞采用百级层流保护,灭菌器采用水浴式灭菌器。
1.1 大容量注射剂生产工艺流程图(见后页)1.2 大容量注射剂生产区工艺布局布置图(见后页)1.3 大容量注射剂生产区工艺设备布置图(见后页)1.4 大容量注射剂生产区送回风口平面布置图(见后页)以上项目按验证文件规定,均已在规定周期内进行相关的验证,验证方案及报告见相应文件。
大容量注射剂生产工艺流程图3.1 批生产指令的签发3.1.1 批生产指令由车间技术负责人根据生产计划表起草,并依据产品工艺规程于生产前一个工作日制定。
3.1.2 批生产指令应经QA质监员审核并签字,由车间主任签字批准后生效。
3.2 生产批记录的发放3.2.1 除配制工序和包装工序外,工序相应的生产批记录于生产当日由车间工艺质监员发放给各工序负责人,并于工序结束当日填写完整返回车间工艺质监员处汇总。
3.2.2 配制工序和包装工序的生产批记录于生产前一天由车间工艺质监员随同批生产指令或批包装指令一同发放,并于工序结束当日填写完整返回车间工艺质监员处汇总。
简述大容量注射剂生产的工艺流程下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor.I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classic articles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!大容量注射剂生产的关键工艺流程概述大容量注射剂,通常指的是装量在100毫升以上的液体药品,主要用于医院的静脉输液。