硫酸安普霉素内控质量标准
- 格式:doc
- 大小:35.00 KB
- 文档页数:2

硫酸安普霉素及其制剂的研究进展摘要:硫酸安普霉素是新一代氨基糖苷类抗生素,具有抗菌活性高、抗菌谱广、对细菌内酰胺酶稳定性好等特点,在临床上被广泛用于治疗敏感菌引起的感染性疾病。
但由于其存在吸收差、半衰期短等问题,限制了其在临床上的应用。
近年来,随着药物制剂技术的不断发展,硫酸安普霉素的生物利用度得到了较大提高。
本文对硫酸安普霉素及其制剂研究进展进行综述,包括硫酸安普霉素的药代动力学研究及用药剂量的选定、硫酸安普霉素的抗菌活性及其作用机制、硫酸安普霉素的稳定性进行了研究,为进一步提高硫酸安普霉素的生物利用度及更好地发挥其临床价值提供参考。
关键词:硫酸安普霉素;制剂;研究进展引言:安普霉素是美国开发的畜禽专用抗菌药物,又名“阿泊拉霉素”,是一种由暗黑链霉菌族菌产生的氨基环醇类抗菌药物,主要通过影响原核生物的核蛋白合成来抑制细菌增殖,对革兰氏阴性菌(如大肠埃希菌、沙门氏菌)有很强的抗菌活性,而且不容易发生耐药,市场前景广阔,目前国内已有多个厂家开发成功。
一、硫酸安普霉素的药代动力学研究及用药剂量的选定药代动力学研究表明,硫酸安普霉素主要经胆汁、尿液、粪便和胎盘吸收,口服给药后,药物很快分布到血浆和组织中,在血液中浓度迅速增加。
因此,硫酸安普霉素的给药方法和剂量的选定应根据其药代动力学特性和临床特点而定。
硫酸安普霉素主要经肝脏代谢,肝脏是其主要的代谢器官,药物主要经肝脏代谢为半合成状态。
有研究表明,硫酸安普霉素在口服后约有90%可由肾脏清除。
因此,从药物排泄和消除的角度看,口服硫酸安普霉素的最大生物利用度为仅为10%。
在相同给药剂量下,口服给药硫酸安普霉素的生物利用度仅为静脉注射的60%左右。
因此,硫酸安普霉素静脉给药应为其最常用的给药方式。
临床实践表明,在静脉注射硫酸安普霉素时,由于药物快速清除使疗效迅速提高并保持较长时间。
临床上使用硫酸安普霉素静脉注射治疗慢性淋巴细胞白血病时,一次给药后可维持数周至数月以上的疗效。
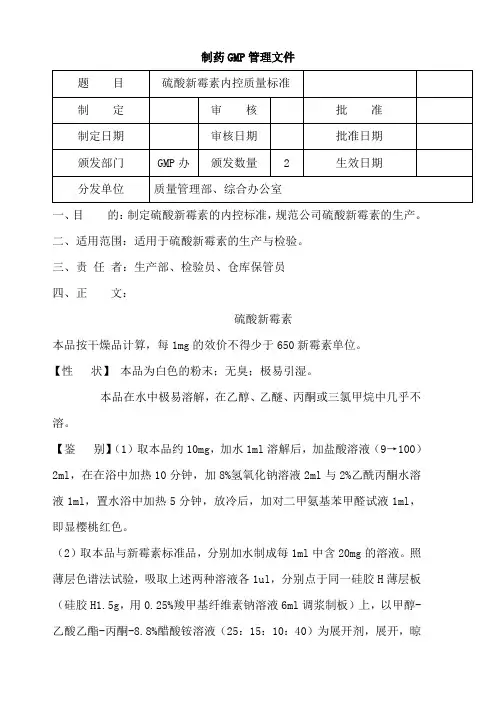
制药GMP管理文件一、目的:制定硫酸新霉素的内控标准,规范公司硫酸新霉素的生产。
二、适用范围:适用于硫酸新霉素的生产与检验。
三、责任者:生产部、检验员、仓库保管员四、正文:硫酸新霉素本品按干燥品计算,每1mg的效价不得少于650新霉素单位。
【性状】本品为白色的粉末;无臭;极易引湿。
本品在水中极易溶解,在乙醇、乙醚、丙酮或三氯甲烷中几乎不溶。
【鉴别】(1)取本品约10mg,加水1ml溶解后,加盐酸溶液(9→100)2ml,在在浴中加热10分钟,加8%氢氧化钠溶液2ml与2%乙酰丙酮水溶液1ml,置水浴中加热5分钟,放冷后,加对二甲氨基苯甲醛试液1ml,即显樱桃红色。
(2)取本品与新霉素标准品,分别加水制成每1ml中含20mg的溶液。
照薄层色谱法试验,吸取上述两种溶液各1ul,分别点于同一硅胶H薄层板(硅胶H1.5g,用0.25%羧甲基纤维素钠溶液6ml调浆制板)上,以甲醇-乙酸乙酯-丙酮-8.8%醋酸铵溶液(25:15:10:40)为展开剂,展开,晾干,在110℃干燥20分钟,趁热喷以10%次氯酸钠溶液,将薄层板于通风处冷却片刻,再喷碘化钾淀粉溶液(0.5%淀粉溶液100ml中含碘化钾0.5g),立即检视。
供试品溶液所显主斑点的颜色和位置应与标准品溶液的主斑点相同。
(3)本品的红外光吸收图谱应与对照的图谱一致。
(4)本品的水溶液显硫酸盐鉴别反应。
【检查】酸度取本品,加水制成每1ml中含0.1g的溶液,依法测定,PH值应为5.0~7.0。
硫酸盐取本品0.16g,精密称定,置碘量瓶中,加水100ml使溶解,用氨试液调节PH值至11后,精密加入氯化钡滴定液(0.1mol/l)10ml、酞紫指示液5滴,用乙二胺四醋酸二钠滴定液(0.05mol/l)滴定,注意保持滴定的结果用空白试验校正。
每1ml氯化钡滴定液(0.1mol/l)相当于9.606mg的硫酸盐(SO4)。
本品含硫酸盐按干燥品计算应为27.0%~31.0%。

1、安普霉素概况安普霉素(Apramycin)亦称阿泊拉霉素,由黑暗链霉菌族菌产生的一种氨基环醇类抗生素,通过干扰原核生物核蛋白质的合成而抑制细菌的繁殖。
安普霉素在活体内外,可有力阻止蛋白质合成的易位阶段,该化合物以硫酸盐在兽医上应用。
具有广谱抗菌活性的畜禽专用安普霉素是美国于60年代研制出的一类抗生素,对畜禽感染的革兰氏阴性菌有较强抗菌活性,特别是对其他抗生素耐药的大肠杆菌和沙门氏菌等有强抗菌作用,且不易产生耐药性,有广泛的市场前景和需求,国内先后有多家进行了研制。
我国学者近年来对国产安普霉素进行了试验研究。
报道显示了对仔猪黄白痢的治疗效果良好,可以预混剂或粉针形式应用。
以中国科学院武汉植物研究所王有为研究员为首的科研人员针对国家畜牧养殖业的需求,着重解决畜禽的肠道感染和耐药性问题,在安普霉素单组分高产菌种筛选认证、免疫屏障促生长机制、安全应用技术等方面作出了创新性贡献,通过诱变筛选出了稳定高产的单组分安普霉素生产菌种,研究出成熟的生产工艺,对安普霉素的药理学、毒理学、动物临床、对猪与鸡生产性能的影响及饲用安全性等进行了全面、系统的研究,取得了创新性成果,并获得了二类新兽药证书[1]。
据《中国农村科技》2001年8期报道,中国农业科学院兰州畜牧与兽药研究所与沈阳药科大学合作开发研制的硫酸安普霉素,对畜禽多种致病菌均有很强的抑杀作用。
主要用于治疗由大肠杆菌、沙门氏菌、巴氏杆菌、链球菌引起的多种畜禽传染病,尤对猪、鸡白痢病有良好的治疗效果,据数千例病例的疗效统计,对仔猪白痢的治愈率在94%以上。
徐忠赞等以一定浓度添加于饲料中。
应用表明,以0.01%浓度饲料添加硫酸安普霉素预混剂,治疗仔猪白痢用量少,治愈率高,此外还可促进增重,提高饲料转化率;另据其介绍,以含量40%的硫酸安普霉素治疗时,配成20mg/ml的水溶液,患猪每天口服3ml,每日l次,连用7天,在第5天时患猪停止腹泻,精神好转,食欲恢复,治愈率为93.3%。
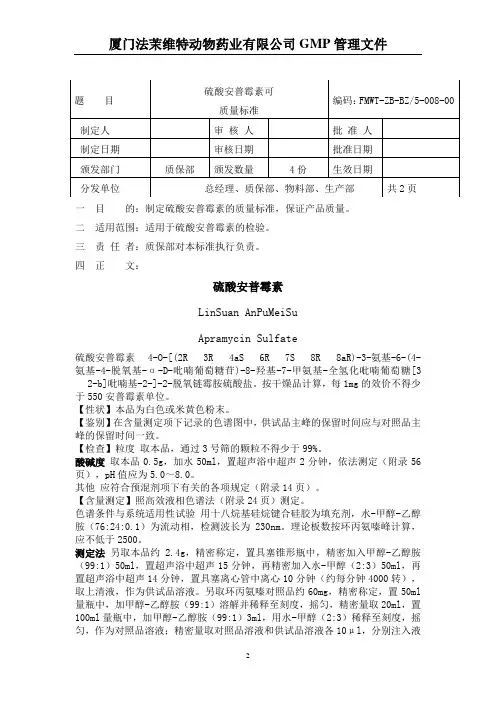
一 目 的:制定硫酸安普霉素的质量标准,保证产品质量。
二 适用范围:适用于硫酸安普霉素的检验。
三 责 任 者:质保部对本标准执行负责。
四 正 文:硫酸安普霉素LinSuan AnPuMeiSu Apramycin Sulfate 4-O-[(2R 3R 4aS 6R 7S 8R 8aR)-3-氨基-6-(4-氨基-4-脱氧基-α-D-吡喃葡萄糖苷)-8-羟基-7-甲氨基-全氢化吡喃葡萄糖[32-b]吡喃基-2-]-2-脱氧链霉胺硫酸盐。
按干燥品计算,每1mg 的效价不得少于550安普霉素单位。
【性状】本品为白色或米黄色粉末。
【鉴别】在含量测定项下记录的色谱图中,供试品主峰的保留时间应与对照品主峰的保留时间一致。
【检查】粒度 取本品,通过3号筛的颗粒不得少于99%。
酸碱度 取本品0.5g ,加水50ml ,置超声浴中超声2分钟,依法测定(附录56页),pH 值应为5.0~8.0。
其他 应符合预混剂项下有关的各项规定(附录14页)。
【含量测定】照高效液相色谱法(附录24页)测定。
色谱条件与系统适用性试验 用十八烷基硅烷键合硅胶为填充剂,水-甲醇-乙醇胺(76:24:0.1)为流动相,检测波长为230nm 。
理论板数按环丙氨嗪峰计算,应不低于2500。
测定法 另取本品约 2.4g ,精密称定,置具塞锥形瓶中,精密加入甲醇-乙醇胺(99:1)50ml ,置超声浴中超声15分钟,再精密加入水-甲醇(2:3)50ml ,再置超声浴中超声14分钟,置具塞离心管中离心10分钟(约每分钟4000转),取上清液,作为供试品溶液。
另取环丙氨嗪对照品约60mg ,精密称定,置50ml 量瓶中,加甲醇-乙醇胺(99:1)溶解并稀释至刻度,摇匀,精密量取20ml ,置100ml 量瓶中,加甲醇-乙醇胺(99:1)3ml ,用水-甲醇(2:3)稀释至刻度,摇匀,作为对照品溶液;精密量取对照品溶液和供试品溶液各10μl ,分别注入液题 目硫酸安普霉素可 质量标准 编码:FMWT-ZB-BZ/5-008-00 制定人审 核 人 批 准 人 制定日期审核日期 批准日期 颁发部门质保部 颁发数量 4份 生效日期 分发单位 总经理、质保部、物料部、生产部共2页相色谱仪,记录色谱图。
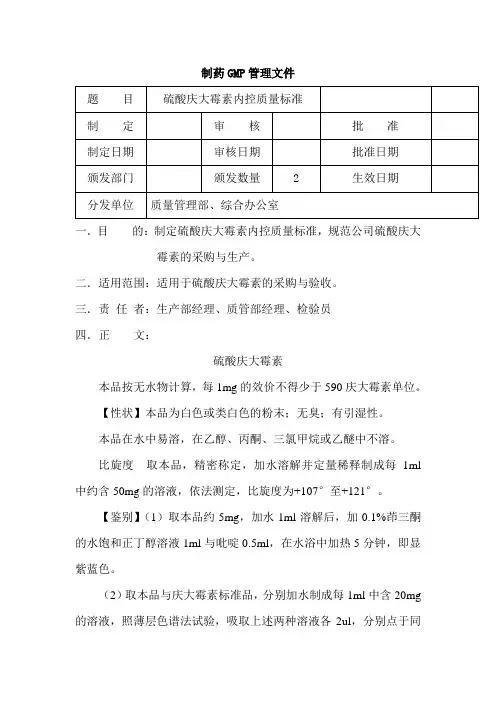
制药GMP管理文件一.目的:制定硫酸庆大霉素内控质量标准,规范公司硫酸庆大霉素的采购与生产。
二.适用范围:适用于硫酸庆大霉素的采购与验收。
三.责任者:生产部经理、质管部经理、检验员四.正文:硫酸庆大霉素本品按无水物计算,每1mg的效价不得少于590庆大霉素单位。
【性状】本品为白色或类白色的粉末;无臭;有引湿性。
本品在水中易溶,在乙醇、丙酮、三氯甲烷或乙醚中不溶。
比旋度取本品,精密称定,加水溶解并定量稀释制成每1ml 中约含50mg的溶液,依法测定,比旋度为+107°至+121°。
【鉴别】(1)取本品约5mg,加水1ml溶解后,加0.1%茚三酮的水饱和正丁醇溶液1ml与吡啶0.5ml,在水浴中加热5分钟,即显紫蓝色。
(2)取本品与庆大霉素标准品,分别加水制成每1ml中含20mg 的溶液,照薄层色谱法试验,吸取上述两种溶液各2ul,分别点于同一硅胶G薄层板(临用前于105℃活化2小时)上;另取三氯甲烷-甲醇-浓氨溶液(1:1:1)混合振摇,放置1小时,分取下层混合液为展开剂,展开,取出于20~25℃晾干,置碘蒸气中显色,供试品溶液所显主斑点数、位置和颜色应与标准品溶液斑点数、位置和颜色相同。
(3)本品的红外吸收图谱应与对照的图谱一致。
(4)本品的水溶液显硫酸盐的鉴别反应。
【检查】酸度取本品,加水制成每1ml中含40mg的溶液,依法测定,PH值应为4.0~6.0。
溶液的澄清度与颜色取本品5份,各0.4g,分别加水5ml使溶解,溶液应澄清无色;如显浑浊,与1号浊度标准液比较,均不得更浓;如显色,与黄色或黄绿色2号标准比色液比较,均不得更深。
硫酸盐取本品约0.125g,精密称定,加水100ml使溶解,用浓氨溶液调节PH值至11,精密加氯化钡滴定液(0.1mol/L)10ml及酞紫指示液5滴,用乙二胺四醋酸二钠滴定液(0.05mol/L)滴定,注意保持滴定过程中的PH值保持为11,滴定至紫色开始消褪,加乙醇50ml,继续滴定至紫蓝色消失,并将滴定的结果用空白试验校正。

硫酸安普霉素可溶性粉生产工艺规程目录1 产品概述2 处方和依据3 工艺流程图4 制剂工艺过程及工艺条件5 原辅材料的预处理6 原辅材料质量标准和检查方法7 中间产品质量标准和检查方法8 成品质量标准和检查方法9 包装规格、包装材料质量标准10 说明书、产品文字说明和标志11 工艺要求12 设备一览表和主要设备生产能力13 技术安全与劳动保护14 劳动组织15 原辅料消耗定额16 包装材料消耗定额17 动力消耗定额18 综合利用与环境保护目的:制定本标准的目的是规范硫酸安普霉素可溶性粉生产过程,对一定数量的成品所需的起始原辅料和包装材料,以及工艺、加工说明、技术参数、注意事项等进一步标准化。
适用范围:适用于硫酸安普霉素可溶性粉生产全过程。
责任人:质量部部长、生产部部长、车间主任。
内容:1 产品概述:本品为硫酸安普霉素可溶性粉。
1.1 产品特点:1.1.1性状:本品为黄褐色粉末。
1.1.2 规格:50g:安普霉素5g1.1.3 贮藏:遮光,密闭,在干燥处保存。
1.1.4有效期:二年1.1.5批准文号:2.处方和依据2.1处方:50g硫酸安普霉素: 5g(以安普霉素计)无水葡萄糖:加至50g2.2处方依据:3生产工艺流程图及环境区域划分示意图4 制剂工艺过程及工艺条件4.1总述:按生产指令领取硫酸安普霉素原料药和预处理过的无水葡萄糖,将硫酸普霉素与无水葡萄糖用等量递增法混合均匀,定量分装即可。
4.2分述:4.2.1投料量:为处方量的整数倍。
5 原辅材料的预处理5.1 按生产指令单领取无水葡萄糖粉的预处理按粉碎机操作规程操作,粉碎,使完全通过80目筛。
过筛结束后,检查合格将粉碎好的药粉装入洁净容器,称量、记录,挂上标签,注明品名、批号、数量、日期等,填写中间产品交接单,转入下工序。
进行物料平衡计算,收率97.0%~99.9%。
5.2 称量配料:按生产指令单称取硫酸安普霉素和无水葡萄糖5.3混合:将上述称量好的药粉置V型混合机中,按等量递增法充分混合,每次预混10分钟,总混30分钟,检验含量均匀度合格后,装入洁净不锈钢桶密封并标明名称、规格、批量(或数量)等,填写中间产品交接单,转入中间站。

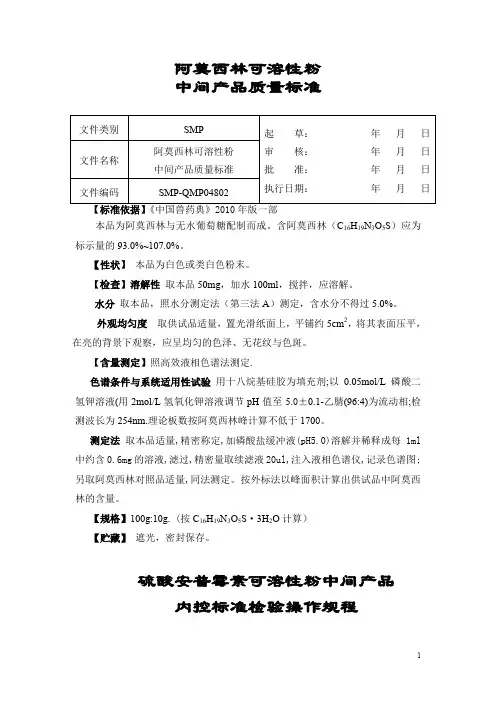
阿莫西林可溶性粉中间产品质量标准本品为阿莫西林与无水葡萄糖配制而成。
含阿莫西林(C16H19N3O5S)应为标示量的93.0%~107.0%。
【性状】本品为白色或类白色粉末。
【检查】溶解性取本品50mg,加水100ml,搅拌,应溶解。
水分取本品,照水分测定法(第三法A)测定,含水分不得过5.0%。
外观均匀度取供试品适量,置光滑纸面上,平铺约5cm2,将其表面压平,在亮的背景下观察,应呈均匀的色泽、无花纹与色斑。
【含量测定】照高效液相色谱法测定.色谱条件与系统适用性试验用十八烷基硅胶为填充剂;以0.05mol/L磷酸二氢钾溶液(用2mol/L氢氧化钾溶液调节pH值至5.0±0.1-乙腈(96:4)为流动相;检测波长为254nm.理论板数按阿莫西林峰计算不低于1700。
测定法取本品适量,精密称定,加磷酸盐缓冲液(pH5.0)溶解并稀释成每1ml 中约含0.6mg的溶液,滤过,精密量取续滤液20ul,注入液相色谱仪,记录色谱图;另取阿莫西林对照品适量,同法测定。
按外标法以峰面积计算出供试品中阿莫西林的含量。
【规格】100g:10g. (按C16H19N3O5S·3H2O计算)【贮藏】遮光,密封保存。
硫酸安普霉素可溶性粉中间产品内控标准检验操作规程【标准依据】《中国兽药典》2010版一部本品为硫酸安普霉素与枸橼酸钠配置而成。
含安普霉素(C21H14N5O11)应为标示量的93.0%~107.0%。
【性状】本品为微黄色至黄褐色粉末。
【检查】酸碱度仪器与试剂天平、PH计、烧杯、移液管、标准缓冲溶液取本品0.5g,加水10ml溶解后,依法测定,pH值应为5.0~8.0。
干燥失重仪器与用具天平、快速水分测定仪、毛刷。
取本品,用快速水分测定仪测定,减失重量不得过8.0%。
溶解性仪器及试剂天平、烧杯、玻璃棒、水取本品1.0g,加水50ml,搅拌,应全部溶解。
【效价测定】仪器及试剂双碟、陶瓦盖、钢管、恒温培养箱、移液管、刻度吸管、容量瓶、称量瓶、毛细滴管、电子分析天平、镊子、游标卡尺、灭菌水精密称取本品适量,加灭菌水定量制成每1ml中约含10000单位的溶液,照抗生素检定法测定。

GMP管理文件
一.目的:制定硫酸新霉素可溶性粉内控质量标准,规范公司硫酸新霉素可溶性粉的生产。
二.适用范围:适用于硫酸新霉素可溶性粉生产和质检。
三.责任者:生产部经理、质管部经理、检验员
四.正文:
【物料名称】硫酸新霉素可溶性粉
【质量标准】本品为硫酸新霉素与蔗糖、维生素C配置而成。
含硫酸新霉素应为标示量的92.0%--108.0%。
性状本品为白色或类白色粉末。
检查酸度取本品,加水制成每1ml中含10mg的溶液,依法测定,pH值应为4.0~7.5。
干燥失重取本品,在60℃减压干燥至恒重,减失重量不得过6.0%。
含量测定精密称取本品适量,照硫酸新霉素项下的方法测定。
即得。
第 1 页共1 页。

恩诺沙星钠盐(速溶型)恩诺沙星是新一代喹诺酮类抗菌药物的代表,是畜禽水产疾病防治的专用新药,它不仅保留了喹诺酮类药物广谱、高效、低毒以及吸收良好,给药方便的特点,而且对多种细菌引起的各种感染有显著疗效,特别是对各种霉形体的杀伤力显著高于喹诺酮类其它药物和各种已使用多年泰乐菌素、泰牧霉素等药物物理特性本品在水中溶解,在甲醇、乙醇中极微溶解,在氢氧化钠溶液中略溶,无挥发刺激性气味。
在水中溶解度(25℃):0.1g/ml水本品的水溶液颜色为无色或微黄色;水溶液的pH值9.0~11.0干燥失重:≤10%含量:≥98.0%含氟量:≥4.7%容重mg/ml:松密度 0.5~0.55 紧密度 0.6~0.65化学特性1、本品吸水能力强,很容易受潮结块。
2、本品遇光色泽加深。
3、水溶液呈碱性。
4、水溶液与酸性物质混合,溶液中有析出。
药理作用与特点:1.一般抗菌药物的作用原理是干扰病原体代谢,破坏细胞膜或影响病原体的合成,而恩诺沙星是直接作用于病原体的细胞核,阻断DNA(脱氧核糖核酸)复制“回旋酶”,从而在核心处抑制了细菌的代谢和繁殖,迅速而有效地杀灭病原菌,包括顽固的霉形体。
2.具有极广的抗菌谱,对革兰氏阳性菌及革兰氏阴性菌有强大的杀灭作用,尤其对固定的霉形体效果更为显著。
3.吸收效果好,口服0.5—1小时内在血清中达到治疗浓度。
4.组织穿透力强,在肺、肝、肾等组织药物浓度是血清水平的1.5~3倍。
5.治疗量的恩诺沙星无任何毒副作用,对蛋、种禽的产蛋率和孵化率无任何影响。
对畜禽免疫系统无损害,不会降低机体的免疫力和抗病力。
适应症:1.禽类:鸡的支原体病,慢性呼吸道病,禽大肠杆菌病,鸡白痢、禽沙门氏菌病,禽巴氏杆菌病等。
2.猪:仔猪白痢、黄痢,中大猪水肿型大肠杆菌病,猪的支原体肿性支气管肺炎,胸膜炎,仔猪副伤寒等。
产品检验报告产品名称硫酸安普霉素可溶性粉检验日期2012年04月25日规格100g/袋报告日期2012年05月02日检品来源仓库待验区检验项目全检批号20120425 数量100kg检验依据《兽药质量标准》2005年版检验项目标准规定检验结果项目结论【性状】本品应为类白色至淡黄色结晶性粉末本品为淡黄色结晶性粉末符合规定无臭,味微苦,有引湿性无臭,味微苦,有引湿性【鉴别】(1)应符合规定符合规定符合规定(2)在274、323、334nm的波长处在274、323、334nm的波长应有最大吸收处有最大吸收符合规定(3)本品的红外吸收图谱应与对照图谱一致符合规定符合规定(4)应显氯化物的鉴别反应符合规定符合规定【检查】酸度应为1.5~3.0 2.0 符合规定澄清度与颜色应符合规定符合规定符合规定氟应符合规定符合规定符合规定有关物质应符合规定符合规定符合规定干燥失重减失重量不得过0.05% 减失重量为0.02% 符合规定炽灼残渣不得过0.5% 测得的结果为0.2% 符合规定重金属应符合规定符合规定符合规定检验结论:依据《兽药质量标准》2005年版检验,结果符合规定。
备注:/检验人复核人负责人产品检验报告产品名称氟苯尼考可溶性粉检验日期2012年04月25日规格 100g/袋报告日期 2012年05月02日检品来源仓库待验区检验项目全检生产批号20120425 数量100kg检验依据《兽药质量标准》2005年版检验项目标准规定检验结果项目结论【性状】本品应为白色或类白色粉末本品为白色粉末符合规定【鉴别】(1)在266nm的波长处在266nm的波长处吸收最大符合规定应有最大吸收(2)沉淀的红外吸收图谱应与对照品的图谱一致。
符合规定符合规定【检查】粒度本品应全部通过二号筛符合规定符合规定干燥失重取本品,在105℃干燥至恒重,减失重量不得过9.7%。
减失重量为0.3% 符合规定其他应符合预混剂项下有关的各项规定符合规定符合规定装量平均装量不少于100g,每袋装量应为99g~102g。
广西康普动物保健品股份有限公司技术标准文件文件名称硫酸安普霉素可溶性粉生产工艺规程文件编号页数 1 / 10修订人GMP办修订日期版号01审核人审核日期颁发部门质保部批准人批准日期生效日期分发部门生产部、质保部、散、粉、预混剂车间_______________________________________________________________________________________________1 目的制订硫酸安普霉素可溶性粉生产工艺规程,以便于指导每个工序操作。
2 适用范围本规程适用于硫酸安普霉素可溶性粉生产的全过程。
3 责任人生产部、质保部、车间。
4 内容为了严格按规范进行生产,确保产品质量的一致性,符合企业内控标准。
特制订硫酸安普霉素可溶性粉工艺规程。
由质保部、生产部对本规程的实施负责。
4.1产品概述:4.1.1 产品名称:硫酸安普霉素可溶性粉汉语拼音:Liusuan Anpumeisu Kerongxingfen4.1.2剂型:粉剂。
4.1.3主要成份:硫酸安普霉素、枸橼酸钠。
4.1.4性状:本品为微黄色至黄褐色粉末。
4.1.5适应症:抗微生物药。
主用于畜禽肠道革兰氏阴性菌引起的感染。
4.1.6用法与用量:以硫酸安普霉素计。
混饮:每1L水鸡 250mg-500mg 连用5日;每1kg体重,猪12.5mg,连用7日。
4.1.7规格:100g:安普霉素50g(5000万单位)4.1.8包装:铝箔袋,100g/包。
4.1.9贮藏:遮光,在密闭、干燥处保存。
4.1.10批准文号:兽药字(2009)200101500。
4.1.11执行标准:《中华人民共和国兽药典》二〇一〇年版一部298页。
4.2处方和处方依据:4.2.1处方:硫酸安普霉素50kg、枸橼酸钠0.1kg、加无水葡萄糖至100kg。
计算方法硫酸安普霉素:根据原料所含安普霉素单位数换算出100g:0.1g:50g所需用量计算公式:5000万安普霉素单位原料所含安普霉素单位 x 1000无水葡萄糖:=100kg — 硫酸安普霉素用量-枸橼酸钠用量 总 计 100.00㎏4.2.2制法:分别取硫酸安普霉素、枸橼酸钠无水葡萄糖,过 80目筛,混合均匀,分装即得。
方案名称:硫酸安普霉素可溶性粉生产工艺验证方案目的:制定硫酸安普霉素可溶性粉生产过程验证的一系列文件,用以验证硫酸安普霉素可溶性粉生产过程的可靠性和重现性。
适用范围:硫酸安普霉素可溶性粉生产过程的关键工序。
责任人:验证小组成员、生产操作人员、化验员。
1 验证的目的及要求。
硫酸安普霉素可溶性粉工艺规程是我公司根据《中国兽药典》2010版硫酸安普霉素可溶性粉项下有关内容制订的,在此验证之前已对生产设备设施、计量器具等进行了验证;所用原辅材料、包装材料经检验合格,本验证方案对硫酸安普霉素可溶性粉生产工艺中有可能影响产品质量的关键工序进行验证,也是对以上各系统联合起来的复验证,以证明在规定的工艺条件下,能始终如一生产出合格的产品。
2 生产过程和各部分生产过程的说明,流程图,关键工序可能存在的危险。
2.1 生产过程和各部分生产过程的说明:硫酸安普霉素可溶性粉是由硫酸安普霉素与无水葡萄糖组成,硫酸安普霉素、无水葡萄糖水分均符合质量标准要求。
其制法是:按生产指令单领取硫酸安普霉素原料药和无水葡萄糖。
分别过80目筛后(剩余少量不合格同批原辅料汇总粉碎处理过80目筛),按处方量将硫酸安普霉素与无水葡萄糖粉按等量递增法混合均匀,定量分装即可。
2.2硫酸安普霉素可溶性粉生产工艺流程图2.3 关键工序可能存在的危险。
2.3.1过筛:因无水葡萄糖易结块、原料粒度大不符合要求影响产品质量,因此通过过80目筛验证原辅料需不需要过筛。
2.3.2 混合:混合为硫酸安普霉素可溶性粉生产中的一道重要工序,混匀与否直接影响着成品的质量,为防止有效成分含量有偏差,因此应对混合搅拌工序进行验证。
2.3.3 分装:此工序为硫酸安普霉素可溶性粉的成型工序,因为装量差异在生产时不可能一直测定,只能每隔20分钟测定一次,装量可能在两次测定之间发生较大偏差。
因此应对分装工序进行验证。
2.3.4 包装:包装为硫酸安普霉素可溶性粉最后一道生产工序,包装的好坏直接影响产品的质量,因此应对包装的过程全面验证,用以证明现行的工艺条件能始终如一生产出合格的产品。
硫酸安普霉素可溶性粉工艺规程制订人审核人批准人制订日期批准日期执行日期烟台金海药业有限公司目录2、处方和依据3、粉剂生产工艺流程及环境区域划分示意图4、工艺过程及条件4.1生产前准备:a.专人检查确认该品种的批生产指令及相应的配套文件,如批记录等是否准备齐全,并是现行文件b.设备器具和现场是否有“清场合格证”c。
对设备状况进行检查,挂有“合格”、“已清洁”、“已消毒”标志的设备方可使用。
4。
2粉碎工序4.2.1工艺过程4。
2。
1。
1认真核对硫酸安普霉素和枸橼酸钠品名、批号等是否与生产指令相符,并有检验合格报告单,确认无误后经清洁或脱去外包装提入暂存室。
将内容物连同内包装一起取出放在干净的容器内,并正确填写盛装单放在该容器内(可扎在袋口上).4.2.1.2对硫酸安普霉素和枸橼酸钠进行检查,用五号筛试筛,应全部通过五号筛,如不符合要求,则按生产工艺要求,粉碎至规定细度,并用振荡筛进行过筛。
如符合要求,则可不粉碎。
4。
2。
1.3粉碎后的物料装入洁净容器中,贴上标志,注明名称、规格、批号、数量、日期、操作者等。
4.2.1。
4.每批物料粉碎结束后,须对粉碎机进行清洗,以防止改变品种时相互污染. 4。
2。
2工艺条件及质量控制点4.2.2。
1粉碎岗位应有除尘设施,并控制尾气排放中粉尘不得超标。
4。
2.2.2当水分过高时,要先干燥后再粉碎4.2.2.3.粉碎后药粉应全部通过五号筛.4.3干燥4.3。
1因硫酸安普霉素和枸橼酸钠水分含量低,无需烘干.4.4称量、配料工序4.4。
1工艺过程4。
4。
1.1直接使用的硫酸安普霉素和枸橼酸钠须清洁或除去外包装.4。
4.1.2.称量人认真校对物料名称、批号、数量等,确认无误后按规定的方法和生产指令定额称量,记录并签名。
需要进行计算后称量的物料,计算结果先经复核无误后再称量。
4.4。
1.3称量必须复核,复核人校对称量后的物料的名称、重量,确认无误后记录、签名.4.4.1.4称好的硫酸安普霉素和枸橼酸钠分别装于洁净容器中,备用。
制药GMP管理文件
一、目的:本标准适用于硫酸安普霉素的内控质量标准,规范公司
硫酸安普霉素的采购与使用。
二、适用范围:适用于硫酸安普霉素的采购与使用。
三、责任者:质检员。
四、正文:
硫酸安普霉素
本品按干燥品计算,每1ml的效价不得少于550安普霉素单位。
【性状】本品为微黄色至黄褐色粉末;有引湿性。
本品在水中易溶,在甲醇,丙酮,氯仿,或乙醚中几乎不溶。
【鉴别】(1)取本品与安普霉素标准品,分别加水制成每1ml中含1mg的溶液,照薄层色谱法试验,吸取上述两种溶液各5ul,分别点于同一硅胶G薄层板上,以甲醇-三氯甲烷-浓氨溶液(6:2:4)为展开剂,展开,晾干,在105℃烘烤5分钟,置碘蒸气中显色。
供试品溶液所显主斑点的颜色和位置应与标准品溶液的主斑点相同。
(2)本品的水溶液显硫酸盐的鉴别反应。
【检查】干燥失重取本品,在60℃减压干燥至恒重,减失重量不得过10.0%。
炽灼残渣,不得过1.0%。
重金属取炽灼残渣项下的残渣,依法测定,含重金属不得过百万分之二十。
【含量测定】取本品适量,精密称定,加灭菌水制成每1ml中约含1000单位的溶液照抗生素微生物检定法测定。
1000新霉素单位相当于1mg 的安普霉素。