抗血小板药物的应用共40页文档
- 格式:ppt
- 大小:3.93 MB
- 文档页数:40


抗⾎⼩板药的临床应⽤抗⾎⼩板药的临床应⽤⼀、动脉⾎栓形成的危害性动脉⾎栓形成主要发⽣在动脉粥样硬化的基础上,动脉⾎管⾎栓形成在临床上可导致⼼绞痛、⼼肌梗死、缺⾎性脑卒中和周围⾎管闭塞症等常见多发病。
⼼脑⾎管栓塞是常见的病死原因,在我国⼈⼝的死因中约占半数。
⼆、⾎⼩板激活和动脉⾎栓形成⾎⼩板是由巨核细胞⽣成的⾎液中3种有形成分之⼀。
⾎⼩板在初期⽌⾎作⽤中占有重要地位。
正常⾎管内⽪细胞有抗⾎栓形成作⽤,⾎管受损破裂后⾎⼩板可黏附聚集于⾎管裂⼝处,形成⽌⾎栓⼦⽽达到初期⽌⾎。
在动脉粥样硬化时,由于斑块破溃从⽽激活⾎⼩板,⾎⼩板在破溃处黏附、聚集,并可黏附⽩细胞形成⽩⾊⾎栓。
因此,⽩⾊⾎栓和⽌⾎栓⼦的形成机制是相似的,不同之处是⽩⾊⾎栓发⽣于内⽪受损但⾎管未破裂,⽽⽌⾎栓⼦是形成于⾎管裂⼝处。
⾎⼩板黏附是通过其膜糖蛋⽩Ⅰb与⾎管性⾎友病因⼦(vWF)结合,进⽽与内⽪下组织结合⽽发⽣的。
激活的⾎⼩板膜糖蛋⽩IIb和IIIa形成复合体,通过纤维蛋⽩原与另⼀⾎⼩板的膜糖蛋⽩IIb/IIIa 复合体结合⽽出现⾎⼩板聚集体。
激活的⾎⼩板还释放多种活性物质,如ADP,TXA2,PF3等,可促进聚集体进⼀步发展,增⼤并且为凝⾎过程提供反应平台。
粥样硬化斑块和⽩⾊⾎栓使⾎管腔狭窄并影响⾎流,从⽽在局部可使⽣成的凝⾎酶积蓄达到有效浓度,使纤维蛋⽩原转变为纤维蛋⽩,并⽹络红细胞等形成红⾊⾎栓。
因此,动脉⾎栓的结构特点是⽩⾊⾎栓的头部和红⾊⾎栓的尾部。
从动脉⾎栓的形成过程可见,⾎⼩板的激活是动脉⾎栓形成的始动物,若能控制⾎⼩板不被激活即可阻⽌或延缓动脉⾎栓的形成。
三、抗⾎⼩板药的作⽤机制60年代初发现⼆磷酸腺苷(ADP)可以引起⾎⼩板聚集,因此建⽴了⽐浊法测定⾎⼩板聚集性,为体外分析⾎⼩板功能开辟了新途径。
当时,发现了不少可以促进⾎⼩板聚集的物质,如肾上腺素、凝⾎酶、⾎清素(5羟⾊胺)和胶原等。
随后,由于分⼦⽣物学、分⼦免疫学的发展,对⾎⼩板黏附聚集机制有了深⼊的了解。
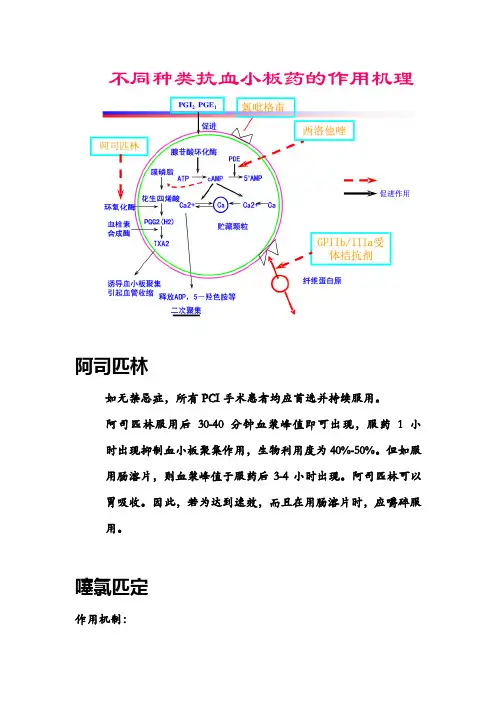
阿司匹林如无禁忌症,所有PCI手术患者均应首选并持续服用。
阿司匹林服用后30-40分钟血浆峰值即可出现,服药1小时出现抑制血小板聚集作用,生物利用度为40%-50%。
但如服用肠溶片,则血浆峰值于服药后3-4小时出现。
阿司匹林可以胃吸收。
因此,若为达到速效,而且在用肠溶片时,应嚼碎服用。
噻氯匹定作用机制:1、选择性地与血小板表面ADP受体P2Y12结合,而不可逆地抑制由胶原和凝血酶诱导的血小板聚集。
2、抑制由胶原和凝血酶诱导的血小板聚集。
临床评价:A 抗血小板作用等于或略大于阿司匹林;B 起效慢, 偶可引起粒细胞减少和血栓性血小板减少性紫癜(TIP)等严重不良反应。
其适应证和阿司匹林相似。
噻氯匹啶剂量为250mg,每日1次或2次。
由于它可抑制骨髓,引起中性粒细胞减少等,因此逐渐被氯吡格雷代替。
后者一般先采用300-600mg负荷剂量,然后每日75mg。
氯吡格雷的抗血小板作用呈现量效关系,在不同个体中有明显差异。
氯吡格雷300mg vs 600mg vs 900mg氯吡格雷对ADP诱导的最大血小板聚集率的影响:600mg优于300mg,但900mg与600mg相似。
目前不支持对稳定型心绞痛患者联合应用氯吡格雷和阿司匹林,通常在冠状动脉支架术后或急性冠脉综合征初期内联合应用。
血小板GPⅡb/Ⅲa受体拮抗剂单克隆抗体:ReoPro (abciximab 阿昔单抗)肽类:KGD环肽Integrelin(eptifibatide,依替非巴肽)非肽类衍生物:Tirofiban(替罗非班)作用机制阻断或妨碍血小板GPⅡb/Ⅲa受体与纤维蛋白原等配体的特异性结合,有效的抑制各种血小板激活剂诱导的血小板聚集,防止血栓形成,从而达到抗血栓的目的。
临床评价:直接抑制血栓形成的关键和唯一通路,作用最强,最直接[糖蛋白Ⅱb /Ⅲa是血小板聚集的最后的共同途径,因此糖蛋白Ⅱb / Ⅲa拮抗剂是最强的抗血小板药]。
GPⅡb/Ⅲa受体拮抗剂共识1.能使PCI术后急性缺血事件的发生率下降15%-50%,急性事件包括急性心梗,死亡,紧急血管重建术等。



抗血小板药物的临床应用抗血小板治疗是指通过药物抑制血小板活化从而阻止血小板参与血栓形成。
理想的抗血小板药物应具有:(1)在体外及体内均有抑制血小扳黏附、聚集和释放的作用;(2)能抑制血小板血栓形成;(3)能延长病理状态下寿命缩短的血小板的生存时间;(4)能延长出血时间但不引起过度出血;(5)口服有效,无明显副作用。
抗血小板药物可以从多步骤干扰血小板的激活,抑制血小板聚集的过程,包括附着、释放和/或聚集,在治疗和预防动脉栓塞方面的作用已很明确。
抗血小板药物种类较多,但有些药物因为其安全性、有效性和可行性等问题限止了它们的临床应用。
抗血小板药物在应用过程中的预防动脉栓塞的作用与增加出血的风险是密不可分的。
1 抗血小板药物1.1 抑制血小板A-A而阻止血小板聚集药物阿司匹林(Aspirin)又名乙酰水杨酸(acetylsalicacid,ASA)是应用和研究最多的抗血小板药物,它的抗血小扳机制包括3个方面: (1)抑制PG合成酶,从而减少PGI 2 与TXA 2 的合成;(2)抑制环氧化酶1(COX-1);(3)抗炎作用。
ASA的抑制作用是不可逆的,由于每日均有新的血小板产生,而当新的血小板占到整体的 10%时,血小板功能即可恢复正常,所以ASA需每日持续服用。
口服单剂量ASA其抗血小板作用可持续7天,接近血小板平均生存期(7~10)天。
ASA 口服生物利用度为70%左右,1~2h内血浆浓度达高峰,半衰期随剂量增加而延长。
有学者研究发现,早晨服药组的PGI 2 水平夜间高于白天,晚间服药则低于白天。
夜间为心脑血管事件高发时段,为保证夜间PGI 2 处于较高水平,ASA早晨服较晚间服有助于预防心脑血管事件的发生。
由于ASA主要是抑制COX-1而发挥作用,所以较大剂量的ASA虽然能抑制血小板的TXA 2 生成而降低血小板聚集,但同时也使血浆中PGI 2 浓度下降,然而内皮细胞的COX-1对ASA的敏感度较血小板弱50~200倍,采用小剂量ASA(50~75mg/d)就能充分抑制TXA 2 的生成,而对PGI 2 几乎无影响。



