乙烯的结构与性质练习题(附答案)
- 格式:docx
- 大小:70.64 KB
- 文档页数:6

2017-2018学年度人教版化学高一暑假作业乙烯、苯的结构与性质一、单选题1.甲烷中混有乙烯,欲除去乙烯得到纯净的甲烷,最好依次通过的洗气瓶应分别盛有的试剂为( )A.澄清石灰水,浓H2SO4B.KMnO4酸性溶液,浓H2SO4C.溴水,浓H2SO4D.浓硫酸,KMnO4酸性溶液2.关于乙烯的分子结构描述错误的是( )A.乙烯的结构简式为CH2=CH2B.乙烯是最简单的烯烃C.乙烯分子中所有的原子都在同一平面上D.乙烯分子中所有的原子都在一条直线上3.能证明乙烯分子里含有一个碳碳双键的事实是( )A.乙烯分子里碳氢原子个数比为1:2B.乙烯完全燃烧生成的CO和2H O的物质的量相等2C.乙烯容易与溴水发生加成反应,且1mol乙烯完全加成消耗1mol溴单质D.乙烯能使酸性KMnO溶液褪色44.苏轼的《格物粗谈》有这样的记载:“红柿摘下未熟,每篮用木瓜三枚放入,得气即发,并无涩味。
”按照现代科技观点,该文中的“气”是指( )A.脱落酸B.乙烯C.生长素D.甲烷5.下列有关乙烯的说法,其中错误的是( )A.乙烯分子的双键中有一键较易断裂B.乙烯分子里所有原子都在同一个平面上,且碳氢键之间的键角约为120°C.乙烯的化学性质比乙烷活泼C H,因此它们属D.乙烯和环丙烷的分子组成符合通式n n2于同系物6.乙烯是重要的工业原料,下列有关乙烯叙述不正确的是( )A.常温常压下是气体B.能使溴的四氯化碳溶液褪色C.可使酸性高锰酸钾溶液发生加成反应而褪色D.在氧气中燃烧有明亮的火焰7.通常用于衡量一个国家石油化工发展水平的标志是( )A.石油的产量B.乙烯的产量C.天然气的产量D.硫酸的产量8.下列对甲烷和乙烯的描述正确的是( )A.乙烯比甲烷的碳的质量分数低B.燃烧时,乙烯与甲烷现象一样C.它们都能使溴水褪色D.充分燃烧时,产物都是二氧化碳和水9.除去乙烷中乙烯的办法是( )A.点燃B.通过溴水C.通过浓硫酸D.通过酸性高锰酸钾溶液10.下列关于乙烯的化学性质的叙述中,不正确的是( )A.能使溴水褪色B.不能发生加成反应C.能使酸性KMnO4溶液褪色D.能发生氧化反应11.对比饱和链烃、不饱和链烃的结构和性质,苯的独特性质具体来说是( )A.难氧化,易加成,难取代B.易取代,能加成,难氧化C.易氧化,易加成,难取代D.因其是单双键交替结构,故易加成为环己烷12.以苯为原料,不能通过一步反应而制得的有机物是( )A. B.C. D.13.下列关于苯的性质的叙述中,不正确的是( )A.苯是无色带有特殊气味的液体B.常温下苯是一种不溶于水且密度小于水的液体C.苯在一定条件下能与溴发生取代反应D.苯不具有典型的双键所具有的加成反应的性能,故不可能发生加成反应14.下列关于苯的叙述中正确的是( )A.苯分子的结构中六个碳原子的连接方式是单双建交替组成的环状B.苯中含有碳碳双键,所以苯属于烯烃C.苯分子中6个碳碳化学键完全相同D.苯可以与溴水、高锰酸钾溶液反应而使它们褪色15.下列关于乙烯和苯的叙述中,错误的是( )A.乙烯能发生加聚反应B.乙烯可以燃烧C.苯能使酸性高锰酸钾溶液褪色D.苯分子中6个碳碳化学键完全相同16.下列关于甲烷、乙烯和苯的说法正确的是( )A.乙烯和苯均能在空气中燃烧B.甲烷和乙烯都能使溴水褪色C.甲烷和乙烯互为同分异构体D.乙烯和苯分子中均含碳碳双键17.如图所示为有关苯的转化关系图,下列说法中不正确的是( )A.反应①、③均为取代反应B.反应②的现象是火焰明亮并带有浓烟C.反应④的产物中所有原子在同一平面上D.甲苯()与苯互为同系物18.下列有关苯、乙烯的说法正确的是( )A.都易溶于水B.都能与溴水发生加成反应C.都具有可燃性D.两者互为同分异构体19.苯是一种重要的有机化工原料,广泛用于合成橡胶、塑料和医药等方面。

第七章有机化合物第二节乙烯与有机高分子材料第1课时乙烯(知识点考试试题)知识点一乙烯的组成和结构1.正确掌握化学用语是学好化学的基础,下列有关化学用语表示正确的是( )A.甲烷的球棍模型:B.乙烯的结构简式:CH2CH2C.丙烷的空间填充模型:D.乙烯的电子式:2.下列有关乙烯的组成和结构的叙述不正确的是( )A.乙烯是由两个碳原子和四个氢原子组成的化合物B.乙烯分子中的6个原子处于同一平面内C.乙烯的结构式为CH2CH2D.乙烯分子中含有极性键和非极性键3.与乙烯所含碳、氢元素的百分含量相同,但与乙烯既不互为同系物又不互为同分异构体的是( )A.环丙烷()B.乙烷C.甲烷D.CH3CH CH2知识点二乙烯的化学性质4.下列物质:①Cl2、②HBr、③H2O、④H2。
其中在一定条件下能与乙烯发生加成反应的有( )A.①②B.③④C.①③④D.全部5.下列反应中属于加成反应的是( )A.甲烷与氯气的混合气体在光照条件下反应B.CH3CH CH2和氯气在一定条件下反应生成ClCH2CH CH2的反应C.乙烯使酸性高锰酸钾溶液褪色D.乙烯与HCl气体反应生成一氯乙烷6.使1 mol乙烯与氯气发生完全加成反应,然后使该加成反应的产物与氯气在光照条件下发生取代反应,则两个过程中消耗的氯气的总的物质的量是( )A.3 molB.4 molC.5 molD.6 mol7.将CH4和C2H4的混合气体15 g通入盛有足量溴水的容器中,溴水的质量增加了7 g,则混合气体中CH4和C2H4的体积比为( )A.1∶2B.2∶1C.3∶2D.2∶38.甲烷中混有乙烯,欲除去乙烯得到纯净的甲烷,可依次将其通过下列哪组试剂的洗气瓶( )A.澄清石灰水,浓H2SO4B.溴水,浓H2SO4C.酸性高锰酸钾溶液,浓H2SO4D.浓H2SO4,酸性高锰酸钾溶液9.聚乙烯(PE)可用于制作食品包装袋,在一定条件下可通过乙烯生成聚乙烯,下列说法中正确的是( )A.燃烧等质量的乙烯和聚乙烯时,聚乙烯消耗的氧气多B.乙烯比乙烷的含碳量高,等物质的量燃烧时,乙烯耗氧量小,容易产生浓烟C.乙烯和聚乙烯都能使溴的四氯化碳溶液褪色D.乙烯和聚乙烯都能使酸性KMnO4溶液褪色10.乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平。

乙烯烯烃乙烯一、乙烯的分子结构化学式:电子式:结构式:结构简式:分子构型:键角:分子极性:不饱和烃:___________________________________________________________。
实验表明,C=C的键能为615kJ/mol,C-C的键能为348kJ/mol,即双键的键能并非单键键能的两倍,而是比两倍略小。
因此只要较少的能量就能使双键里的一个键断裂。
二、乙烯的物理性质通常状况下,乙烯是一种_____色__________味的气体,_____溶于水,密度比空气_______。
三、乙烯的实验室制法:1.药品:和{比例()约为}2.装置:3.反应原理:反应方程式:用结构式表示断键方式:反应类型:4.注意事项:⑴实验中温度计的水银球应位于_________________。
⑵实验中碎瓷片的作用是_____________________。
⑶实验中浓硫酸的作用是_____________________。
⑷实验中加热的方式应使溶液温度_____________(填迅速或缓慢)升高至________℃。
⑸实验完成后,应该先撤____________,后撤____________。
四、乙烯的化学性质1.氧化反应(1)可燃性现象:_______________________________________,解释__________________________。
化学方程式:(2)与酸性高锰酸钾反应现象:_____________________________。
用途:鉴别乙烯(烯烃)和烷烃。
2.加成反应乙烯通过溴的四氯化碳溶液或者溴水,能使溶液褪色。
化学方程式:加成反应:一定条件下,乙烯还能与氢气、氯气、卤化氢、水等发生加成反应。
OH CH CH O H CH CH ClCH CH HCl CH CH Cl CH Cl CH Cl CH CH CH CH H CH CH 2322223222222233222--−−→−+=-−→−+=-−→−+=-−−→−+=∆加热加压催化剂催化剂 3.聚合反应化学方程式:聚合反应:加聚反应:高分子化合物:单体:五、乙烯的用途乙烯是石油化工最重要的基础原料,乙烯工业的发展水平是衡量一个国家石油化工水平的重要标志之一。

乙烯的性质练习题一、单选题1.关于乙烯的分子结构描述错误的是( )A.乙烯的结构简式为CH2=CH2B.乙烯是最简单的烯烃C.乙烯分子中所有的原子都在同一平面上D.乙烯分子中所有的原子都在一条直线上2.能证明乙烯分子里含有一个碳碳双键的事实是( )A.乙烯分子中碳、氢原子个数比为1:2B.乙烯完全燃烧生成的CO2和H2O的物质的量相等C.1mol乙烯与溴的四氯化碳溶液发生加成反应,完全加成时消耗1mol Br2D.乙烯能使酸性高锰酸钾溶液褪色3.从南方往北方长途运输水果时,常常将浸泡有高锰酸钾溶液的硅藻土放置在盛放水果的容器中,其目的是( )A.利用高锰酸钾溶液吸收水果产生的乙烯,防止水果早熟B.利用高锰酸钾溶液吸收水果周围的氧气,防止水果腐烂C.利用高锰酸钾溶液的氧化性,催熟水果D.利用高锰酸钾溶液杀死水果周围的细菌,防止水果霉变4.将CH4和C2H4的混合气体15g通入盛有足量溴水的容器中,溴水的质量增加了7g,则混合气体中CH4与C2H4的体积比为( )A.1:2B.2:1C.3:2D.2:35.将乙烯分别通过如图所示的装置,下列叙述正确的是( )A.二者都褪色且原理相同B.二者都能证明乙烯中有碳碳双键C.二者都可用于除去乙烷中混有的乙烯D.二者都可用于鉴別乙烷和乙烯6.既可以用来鉴别乙烯和乙烷,又可以用来除去乙烷中混有的少量乙烯的最佳方法是( )A.混合气体通过盛有水的洗气瓶B.通过装有过量浓溴水的洗气瓶C.将混合气体通过酸性高锰酸钾溶液中D.混合气体与过量氢气混合7.实现下列变化的有机反应的类型,不正确的是( )A.CH3CH3→CH3CH2Cl 取代反应B.CH2=CH2→CH2BrCH2Br 加成反应C.CH2=CH2→CH3CH2OH 取代反应D.CH≡CH→CHBr=CHBr 加成反应8.甲烷分子中的四个氢原子都可以被取代。
甲烷分子的四个氢原子都被乙烯基(CH2=CH-)取代得到的产物的结构简式如下:下列对所得分子的描述中不正确的是( )A.分子式为C 9H 12B.1mol 该物质在一定条件下最多能与4mol H 2发生反应C.所有碳原子都在同一平面上D.此物质属于烯烃类物质 9.关于实验室制取乙烯的实验,下列说法正确的是( )A.反应容器(烧瓶)注入酒精和浓硫酸的体积比为3:1B.反应物是乙醇和过量的3mol/L H 2SO 4混合液C.温度计应插入反应溶液液面下,以便控制温度D.为检验生成的乙烯,可将生成的气体直接通入酸性KMnO 4溶液10.乙烯(CH 2=CH 2)、丙稀(CH 3CH=CH 2)、丁烯(CH 3CH 2CH=CH 2)等都属于烯烃,下列关于烯烃的说法不正确的是( )A.分子中都含有碳碳双键B.通式为C n H 2n ,n≥2C.碳、氢元素的质量比为6:1D.它们都是饱和链烃11.乙烯直接水合法制乙醇因污染小而应用于工业合成,下列有关说法错误的是( )A.该反应属于加成反应B.乙烯能使酸性4KMnO 溶液褪色C.乙烷中含有少量乙烯,可用2H 除去D.等物质的量的乙烯与乙醇充分燃烧,耗氧量相同二、填空题12.乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平。

7.2.1 乙烯练习(解析版)1.下列说法错误的是()A.无论是乙烯与Br2的加成反应,还是乙烯使酸性KMnO4溶液褪色,都与分子内含有的碳碳双键有关B.溴的四氯化碳溶液和酸性KMnO4溶液都可以鉴别乙烯和甲烷C.相同质量的乙烯和甲烷完全燃烧后生成水的质量相同D.乙烯的化学性质比乙烷的化学性质活泼[答案]C[详解]A.乙烯中含C=C,与Br2加成时,碳碳双键打开两端的碳原子与Br相连,与碳碳双键有关;由于碳碳双键能被高锰酸钾溶液氧化使之褪色,与碳碳双键有关,正确,A不选;B.乙烯能与溴的四氯化碳发生加成,或被高锰酸钾溶液氧化,使溶液褪色,而乙烷不能,现象不同,能鉴别,正确,B不选;C.乙烯和甲烷中氢的质量分数不同,所以相同质量的乙烯和甲烷完全燃烧生成的水的质量不同,错误,C选;D.乙烯中含碳碳双键,乙烷中均为饱和键,碳碳双键易发生加成,也易被高锰酸钾等氧化,则乙烯的化学性质比乙烷的化学性质活泼,正确,D不选。
答案选C。
2.下列叙述错误的是()A.1molCH2=CH2先与HCl发生加成反应,再与Cl2发生取代反应,最多消耗Cl22.5molB.实验室中可用如图所示方法除去CH3CH3气体中的CH2=CH2气体C.实验室中可用酸性的KMnO4溶液鉴别CH3CH3气体和CH2=CH2气体D.工业上可利用CH2=CH2与HCl的加成反应制得纯净的CH3CH2Cl[答案]A[详解]A.CH2=CH2与HCl发生加成生成CH3CH2Cl,根据取代反应原理,取代1molH需要1molCl2,则CH3CH2Cl再与Cl2发生取代反应,最多消耗5molCl2,错误,A选;B.CH2=CH2能与Br2发生加成,生成油状液体,而乙烷不溶于溴水,可以除去乙烯,正确,B不选; C.乙烷不与酸性KMnO4溶液反应,而乙烯能使酸性KMnO4溶液褪色,可以鉴别,正确,C不选; D.乙烯与HCl发生加成只生成一种产物CH3CH2Cl,因此可以制得纯净的CH3CH2Cl,正确,D不选。

乙烯和烯烃一、乙烯的分子结构乙烯是一个平面型分子,即“六点共面”:二个C原子和四个H原子均在同一平面内,有一个C=C双键和四个C-H单键,它们彼此之间的键角约为120º。
乙烯乙烷键长(m) 1.33×10-10 1.54×10-10键角约120º109º28'键能(kJ/mol)615 348)键长小于碳碳单键(C-C);键能大于单键键能,但小于单键键能的两倍,结合乙烯的性质可认为双键中,两个键并不等同,其中一个键较稳定,另一个键较不稳定。
从而说明乙烯的双键中有一个键容易断裂,这是乙烯化学性质比乙烷活泼的理论根据,这就在本质上加深了烯烃重要性质—加成反应和加聚反应的认识,进一步理解分子结构与性质的辩证关系。
另外由于乙烯中存在碳碳双键结构,双键不能扭曲、旋转,这一点与乙烷有很大差异。
二、乙烯的重要化学性质1.乙烯能使溴水和酸性KMnO4溶液褪色,这是检验饱和烃与不饱和烃的方法。
但两者的反应类型是不同的,前者是加成反应,后者是氧化反应。
加成反应有二个特点:①反应发生在不饱和的C=C 键上,双键中的不稳定的共价键断裂,不饱和的C原子与其它原子或原子团以共价键结合。
乙烯可以与多种物质发生加成反应,例如卤素单质、卤化氢、水、氢气等。
②加成反应后生成物只有一种(不同于烷烃的取代反应)。
乙烯通过溴水,现象:溴水褪色1,2-二溴乙烷(液态)乙烯与氢气加成2.可燃性:C2H4+3O22CO2+2H2O现象:火焰较明亮,略带黑烟(与甲烷燃烧相比较)3.加聚反应,C=C双键里的一个键断裂,然后,分子里的C原子互相结合成为高分子长链。
这种聚合反应是通过加成而聚合,所以习惯上也称为加聚反应,其实质是加成反应,断的是C=C 双键中的一个键。
三、实验室制乙烯的原理、装置及注意事项: 1.药品:乙醇和浓硫酸(体积比:1∶3)2.装置:根据反应特点属于液、液加热制备气体,所以选用反应容器圆底烧瓶。
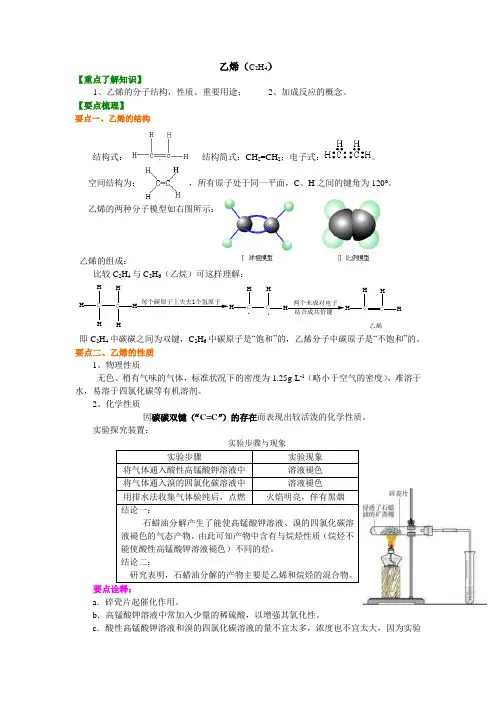
乙烯(C 2H 4)【重点了解知识】1、乙烯的分子结构,性质、重要用途;2、加成反应的概念。
【要点梳理】要点一、乙烯的结构结构式: , 结构简式:CH 2=CH 2;电子式:。
空间结构为: ,所有原子处于同一平面,C 、H 之间的键角为120°。
乙烯的两种分子模型如右图所示:乙烯的组成:比较C 2H 4与C 2H 6(乙烷)可这样理解:C HH HC HH H每个碳原子上失去1个氢原子HH CH .两个未成对电子CHHC HH 乙烯.即C 2H 4中碳碳之间为双键,C 2H 6中碳原子是“饱和”的,乙烯分子中碳原子是“不饱和”的。
要点二、乙烯的性质 1、物理性质无色、稍有气味的气体,标准状况下的密度为1.25g·L -1(略小于空气的密度),难溶于水,易溶于四氯化碳等有机溶剂。
2、化学性质因碳碳双键(“C=C ”)的存在而表现出较活泼的化学性质。
实验探究装置:实验步骤与现象要点诠释:a .碎瓷片起催化作用。
b .高锰酸钾溶液中常加入少量的稀硫酸,以增强其氧化性。
c .酸性高锰酸钾溶液和溴的四氯化碳溶液的量不宜太多,浓度也不宜太大,因为实验中乙烯量不大。
d .酸性高锰酸钾、溴的四氯化碳溶液能检验乙烯等不饱和烃。
(1)氧化反应①乙烯被酸性高锰酸钾溶液氧化——使酸性高锰酸钾溶液褪色启示:利用此性质可鉴别CH 4和C 2H 4,但不能除去CH 4中的C 2H 4,原因是:5CH 2=CH 2+12KMnO 4+18H 2SO 410CO 2↑+6K 2SO 4+12MnSO 4+28H 2O 产物中有CO 2↑,仍混在甲烷中,达不到除杂的目的。
②乙烯的燃烧在空气中燃烧,现象:火焰明亮并伴有黑烟,同时放出大量的热。
C 2H 4 + 3O22CO 2 +2H 2O重点提示:a . 产生黑烟:乙烯分子中含碳量较高,燃烧时部分碳并没有完全被氧化,而导致多余的碳析出。
以黑烟的形式冒出。
碳粒本身被烧成炽热的状态,所以乙烯的火焰很明亮,没有被氧化的碳呈游离态 b .乙烯属于易燃易爆的气体,点燃前一定要先验纯。

乙烯练习题带解析乙烯(Ethylene)是一种简单的烯烃化合物,化学式为C2H4。
它是一种无色气体,在化工领域中应用广泛。
下面是一些乙烯相关的练习题,带有详细的解析,可以帮助读者更好地理解乙烯的性质和应用。
练习题一:1. 乙烯的分子式是什么?2. 乙烯的化学式是什么?3. 乙烯在常温常压下是什么状态?解析:1. 乙烯的分子式是C2H4,表示它由2个碳原子和4个氢原子组成。
2. 乙烯的化学式也是C2H4,即乙烯分子由2个碳原子和4个氢原子所组成。
3. 乙烯在常温常压下是一种气体状态。
练习题二:1. 乙烯的结构式中,碳原子之间是什么键?2. 乙烯的分子形状是什么?3. 乙烯可以通过哪种常见的工业方法制取?解析:1. 在乙烯的结构中,碳原子之间是双键。
2. 乙烯的分子形状是线性,即两个碳原子之间的双键形成直线。
3. 乙烯可以通过蒸汽裂解石油、煤等烃类化合物制取。
练习题三:1. 乙烯的燃烧方程式是什么?2. 乙烯在燃烧时会产生什么物质?3. 乙烯的燃烧产物有哪些特点?解析:1. 乙烯的燃烧方程式为C2H4 + 3O2 → 2CO2 + 2H2O。
2. 乙烯在燃烧时会产生二氧化碳(CO2)和水(H2O)。
3. 乙烯的燃烧产物是无色、无味、无毒的气体,二氧化碳是温室气体,会对环境产生一定的影响。
练习题四:1. 乙烯的主要用途是什么?2. 乙烯可以用来制造哪些化学品?3. 乙烯在医药领域中有什么应用?解析:1. 乙烯的主要用途是作为化工原料,广泛用于合成其他有机化学品。
2. 乙烯可以用来制造聚乙烯、乙烯薄膜、聚丙烯等塑料,以及乙醇、醋酸等化学品。
3. 乙烯在医药领域中可以用于合成药物、医用高分子材料等。
练习题五:1. 乙烯是一种什么类型的烃?2. 乙烯的密度是多少?3. 乙烯在温度较低时会变成什么状态?解析:1. 乙烯是一种烯烃。
2. 乙烯的密度为0.97 g/cm³。
3. 在温度较低时,乙烯会变成液体状态。

乙烯专题练习及答案1.下列关于乙烯的结构与性质的叙述,错误的是A.乙烯分子中6个原子在同一平面内B.乙烯与酸性4KMnO 溶液发生加成反应能使其褪色C.乙烯分子没有同分异构体D.乙烯分子的一氯代物只有一种结构解析:乙烯与酸性4KMnO 溶液反应是被酸性4KMnO 溶液氧化,而不是发生加成反应;答案:B2.甲烷是最简单的烷烃,乙烯是最简单的烯烃,下列物质中,不能用来鉴别二者的是A.水B.溴水C.溴的四氯化碳溶液D.酸性高锰酸钾溶液解析:乙烯分子中含有碳碳双键,能与溴水、溴的四氯化碳溶液发生加成反应,与酸性高锰酸钾溶液发生氧化还原反应而使它们褪色,甲烷不能;答案:A3.下列物质属于不饱和烃的是解析:A 项中物质属于环烷烃;B 项中物质含有氧元素,不是烃;D 项中物质是链状烷烃;答案:C4.乙烯能与许多物质在适当条件下发生加成反应;下列物质:①氯气 ②溴化氢 ③水 ④氢气,其中能与乙烯发生加成反应的是A.①②④B.④C.①④D.①②③④解析:乙烯与卤素、卤化氢、水、氢气在一定条件下都能发生加成反应;答案:D5.下列说法中错误的是A.无论乙烯与2Br 的加成,还是乙烯使酸性4KMnO 溶液褪色,都与分子内含有碳碳双键有关B.用溴的四氯化碳溶液或酸性4KMnO 溶液都可以鉴别乙烯和乙烷C.相同质量的乙烯和甲烷完全燃烧后产生的水的质量相同D.利用燃烧的方法可以鉴别乙烯和甲烷解析:乙烯分子中含有碳碳双键,决定了它的性质与甲烷、乙烷等烷烃的性质有所不同;乙烯的加成反应和氧化反应过程中碳碳双键断裂,A 项正确;乙烯能与溴水和酸性4KMnO 溶液反应,但是乙烷不能,故能用溴的四氯化碳溶液或酸性4KMnO 溶液鉴别乙烯和乙烷,B 项正确;乙烯和甲烷中氢的质量分数不同,故相同质量的乙烯和甲烷完全燃烧生成的水的质量不同,C 项错误;甲烷燃烧产生淡蓝色火焰,乙烯燃烧,火焰明亮有黑烟,D 项正确;答案:C6.下列各组物质在一定条件下反应,可以制得较纯净的氯乙烷的是A.乙烷与氯气混合光照B.乙烯与氯气混合C.乙烯与氯化氢气体混合D.乙烯通入浓盐酸中答案:C7.将15 g 甲烷和乙烯的混合气体通入足量的溴水中,充分反应后,溴水的质量增加了7 g,则混合气体中甲烷和乙烯的体积比为∶2 ∶1 ∶2 ∶3解析:溴水增重的质量是乙烯的质量,故4CH 的质量为15 g-7 g=8 g;V 4()CH ∶V 24()C H =n 4()CH ∶n 24()C H = 1816g g mol -⋅∶17282g g mol -⋅=∶1; 答案:B8.若1 mol 某气态烃C x H y 完全燃烧,需用3 mol 2O ,则 ……=2,y=2 =2,y=4 =3,y=6 =3,y=8解析:根据C x H y 燃烧的方程式:C x H y ()y 24x O ++x y 222CO H O + 1 mol 气态烃C x H y 消耗的2O 为()y 4x + mol,将各选项中x 、y 的数值分别代入,其中B项消耗2O 的物质的量为 3 mol;答案:B9.将a L 乙烯、b L 丙烯、c L 丁烯三者混合,它们所形成的混合物中碳氢两元素的质量比是∶5 ∶5∶6 ∶1解析:烯烃的通式为C n H 2n ,无论何种烯烃,碳元素与氢元素的质量比均为16212=n n ; 答案:D10.下列化合物中,既能使溴水褪色又能在光照下与溴发生取代反应的是A.甲烷B.2SOC.丙烯D.乙烯解析:甲烷不能使溴水褪色,A 错误;2SO 能和溴水发生氧化还原反应而褪色;丙烯和乙烯都能和溴水发生加成反应而褪色,在光照条件下与溴发生取代反应应是烷烃的性质,丙烯中甲基具有此性质,故应选C;答案:C11.当运动员肌肉受伤时,队医会随即对准运动员的受伤部位喷射药剂氯乙烷化学式为25C H Cl ,沸点为 ℃,进行局部冷冻麻醉处理;1制取氯乙烷32()CH CH Cl 的最好的方法是 ; A.乙烷与氯气发生取代反应 B.乙烯与氯气发生加成反应C.乙烷与氯化氢反应D.乙烯与氯化氢发生加成反应2写出所选反应的化学方程式: ;3决定氯乙烷能用于冷冻麻醉应急处理的理由是;答案:1D3氯乙烷的沸点较低 ℃易汽化,汽化时吸收热量使人体局部冷冻麻醉12.现有4CH 、24C H 、26C H 三种有机物:1等质量的以上三种物质完全燃烧时耗去2O 的量最多的是 ;生成2CO 的量最多的是 ;2同状况、同体积的以上三种物质完全燃烧时耗去2O 的量最多的是 ;3在120 ℃、1.50110 Pa 条件下,上述有机物中的两种和足量的氧气混合点燃,相同条件下测得反应前后气体体积没有发生变化,这两种气体是 ;解析:1等质量的氢和碳消耗2O 的量的比为3∶1,故氢的质量分数越大,碳的质量分数越小,消耗2O 的量越大,生成2CO 的量越小;2等物质的量时,烃分子中碳原子数越多,氢原子数越多,其耗2O 量越大;3产物2H O 为气态时,C x H 4的烃完全燃烧前后气体总体积不变; 答案:4(1)CH 24C H 26(2)C H 4(3)CH 、24C H 13.实验室用乙醇和浓硫酸加热反应制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量二氧化硫;有人设计下列实验以确认上述混合气体中有乙烯和二氧化硫;试回答下列问题;1下图中①②③④装置可盛放的试剂是:① ;② ;③ ;④ ;将下列有关试剂的代号填入空格内A.品红溶液 溶液 C.浓硫酸 D.酸性4KMnO 溶液2能说明二氧化硫气体存在的现象是 ;3使用装置②的目的是 ;4使用装置③的目的是 ;5确证含有乙烯的现象是 ;解析:从解答本题的角度来说,乙烯和二氧化硫的性质的相同点是都能使酸性高锰酸钾溶液褪色,不同点是二氧化硫能使品红溶液褪色而乙烯不能;二氧化硫能溶于烧碱溶液而乙烯不能;所以应该先确定二氧化硫的存在,再确定乙烯的存在;二氧化硫使品红溶液褪色的灵敏度很高,品红溶液对二氧化硫的吸收量很小,所以在确定了二氧化硫的存在以后,还要除去二氧化硫并检验二氧化硫是否除尽;答案:1①A ②B ③A ④D2装置①中的品红溶液褪色3除去SO以免干扰乙烯的性质实验24检验SO是否除尽25③中品红溶液不褪色,④中酸性KMnO溶液褪色4。


乙烯烯烃乙烯一、乙烯的分子结构化学式:电子式:结构式:结构简式:分子构型:键角:分子极性:不饱和烃:___________________________________________________________。
实验表明,C=C的键能为615kJ/mol,C-C的键能为348kJ/mol,即双键的键能并非单键键能的两倍,而是比两倍略小。
因此只要较少的能量就能使双键里的一个键断裂。
二、乙烯的物理性质通常状况下,乙烯是一种_____色__________味的气体,_____溶于水,密度比空气_______。
三、乙烯的实验室制法:1.药品:和{比例()约为}2.装置:3.反应原理:反应方程式:用结构式表示断键方式:反应类型:4.注意事项:⑴实验中温度计的水银球应位于_________________。
⑵实验中碎瓷片的作用是_____________________。
⑶实验中浓硫酸的作用是_____________________。
⑷实验中加热的方式应使溶液温度_____________(填迅速或缓慢)升高至________℃。
⑸实验完成后,应该先撤____________,后撤____________。
四、乙烯的化学性质1.氧化反应(1)可燃性现象:_______________________________________,解释__________________________。
化学方程式:(2)与酸性高锰酸钾反应现象:_____________________________。
用途:鉴别乙烯(烯烃)和烷烃。
2.加成反应乙烯通过溴的四氯化碳溶液或者溴水,能使溶液褪色。
化学方程式:加成反应:一定条件下,乙烯还能与氢气、氯气、卤化氢、水等发生加成反应。
OH CH CH O H CH CH ClCH CH HCl CH CH Cl CH Cl CH Cl CH CH CH CH H CH CH 2322223222222233222--−−→−+=-−→−+=-−→−+=-−−→−+=∆加热加压催化剂催化剂 3.聚合反应化学方程式:聚合反应:加聚反应:高分子化合物:单体:五、乙烯的用途乙烯是石油化工最重要的基础原料,乙烯工业的发展水平是衡量一个国家石油化工水平的重要标志之一。
课后作业(十五)[基础巩固]一、乙烯的结构1.下列说法正确的是()A.乙烯的电子式为B.乙烯的球棍模型为C.乙烯分子的碳碳双键中有一个键易断裂D.乙烯的分子式可表示为(CH2)2[解析]乙烯分子中碳原子间是双键,有两对共用电子对,A错误;碳原子半径应比氢原子大,B错误;乙烯分子中含有碳碳双键,其中有一个键容易断裂,而使乙烯的化学性质较为活泼,故C正确;分子式表示分子的组成即分子中原子的种类和个数,乙烯的分子式为C2H4,故D错误。
[答案] C2.能证明乙烯分子里含有一个碳碳双键的事实是()A.乙烯分子里碳氢个数比为1∶2B.乙烯完全燃烧生成的CO2和水的物质的量相等C.乙烯容易与溴的四氯化碳溶液发生加成反应,且1 mol乙烯完全加成需要消耗1 mol溴D.乙烯能使酸性高锰酸钾溶液褪色[解析]碳氢原子个数比为1∶2,是对乙烯的组成分析,而不是证明碳碳双键存在的事实;B与A的实质是一样的,根据生成的CO2和水的物质的量相等,也只能推断出碳、氢原子个数比为1∶2,A、B错误;加成反应是不饱和烃的特征性质,1 mol乙烯完全加成需要消耗1 mol溴,说明乙烯分子中含有一个碳碳双键,C正确;能够使酸性高锰酸钾溶褪色是不饱和烃的特征,并不能说明一定含有碳碳双键,也不能定量地说明乙烯分子的结构中只含有一个碳碳双键,D错误。
[答案] C3.下列说法不正确的是()A.乙烯属于不饱和链烃,乙烷属于饱和链烃B.乙烯分子中所有原子处于同一平面上,乙烷分子中所有原子不都在同一平面上C.1 mol乙烯所含C—H单键的数目与0.5 mol乙烷所含C—H 单键的数目相同D.根据乙烯的结构可知,乙烯也可能发生取代反应[解析]C2H4中含有碳碳双键,属于不饱和链烃,A项正确;乙烯为平面结构,所有原子共面,乙烷相当于2个—CH3结合而成,所有原子不可能共面,B项正确;1 mol C2H4含有4 mol C—H键,0.5 mol C2H6含有3 mol C—H键,C项错误;乙烯分子中的H原子在一定条件下也能被其他原子取代,D项正确。
第七章有机化合物第二节乙烯与有机高分子材料第1课时乙烯1.下列物质属于不饱和烃的是()A.B.正丁烷C.CH2===CH—CH3D.C8H18【答案】C2.关于乙烯分子结构的描述错误的是()A.乙烯的结构简式为CH2===CH2B.乙烯是最简单的烯烃C.乙烯分子中所有原子都在同一平面上D.乙烯分子中所有原子都在一条直线上【答案】D3.下列说法中,错误的是()A.无论乙烯与Br2的加成,还是乙烯使酸性KMnO4溶液褪色,都与分子内含有碳碳双键有关B.用溴的四氯化碳溶液或酸性KMnO4溶液都可以鉴别乙烯和乙烷C.相同质量的乙烯和甲烷完全燃烧后产生的水的质量相同D.利用燃烧的方法可以鉴别乙烯和甲烷【答案】C【解析】本题考查乙烯的性质。
乙烯分子中含有碳碳双键,决定了它的性质与甲烷、乙烷等烷烃的性质有所不同。
乙烯的加成反应和氧化反应过程中碳碳双键断裂,A对;乙烯能与溴水和酸性KMnO4溶液反应,但是乙烷不能,故能用溴的四氯化碳溶液或酸性KMnO4溶液鉴别乙烯和乙烷,B 对;乙烯和甲烷中氢的质量分数不同,故相同质量的乙烯和甲烷完全燃烧后产生的水的质量不同,C 错;甲烷燃烧产生淡蓝色火焰,乙烯燃烧火焰明亮有黑烟,D对。
4.区别CH4和C2H4的方法最好是()A.比较它们在水中的溶解度大小B.嗅闻它们的气味C.通入溴水中观察溶液颜色的变化D.点燃它们后,观察火焰【答案】C【解析】甲烷不能使溴水褪色,而乙烯可以,因此答案选C。
5.下列关于乙烯和乙烷的说法中错误的是()A.乙烯是不饱和烃,乙烷是饱和烃B.乙烯分子中的两个碳原子在同一条直线上,乙烷分子中的两个碳原子也在同一条直线上C.乙烯分子中碳碳双键的键能是乙烷分子中碳碳单键键能的两倍,因此乙烯比乙烷稳定D.乙烯分子为平面结构,乙烷分子为立体结构【答案】C【解析】A项,乙烯含有碳碳双键,属于不饱和烃,乙烷属于饱和烃,正确;B项,两点决定一条直线,所以分子中的两个碳原子一定在同一条直线上,正确;C项,乙烯分子中碳碳双键键能小于乙烷分子中碳碳单键键能的两倍,因此乙烯结构不稳定,导致乙烯能和溴水发生加成反应,错误;D项,甲烷是正四面体结构,所以乙烷中所有原子不可能在同一平面上;乙烯为平面结构,所有原子都处在同一平面上,正确。
第二节 乙烯与有机高分子材料第1课时 乙烯 烃基础过关练题组一 乙烯的结构与性质1.(2019广西桂林十八中高一下期中)为了防止番茄在长途运输过程中发生腐烂,常常运输尚未完全成熟的果实,运到目的地后再用一种植物生长调节剂将其催熟。
这种植物生长调节剂是( )A.乙烷B.苯C.乙烯D.酒精2.(2020四川绵阳高一月考)由乙烯推测丙烯的结构,正确的是( )A.分子中3个碳原子在同一直线上B.分子中所有原子都在同一平面上C.分子中共价键的夹角均为120°D.1个分子中共价键数为8,其中有一个碳碳双键3.下列说法正确的是( 易错 )A.乙烯的电子式为H ··C H ····C H····H B.乙烯的球棍模型为C.乙烯分子是平面结构D.乙烯的结构简式为CH 2CH 24.下列关于乙烯和环丙烷()的说法中,正确的是( )A.二者都为不饱和烃B.二者互为同分异构体C.二者互为同系物D.二者碳、氢元素的质量比相同5.(2020湖北武汉高一月考)下列有关乙烯和乙烷的说法中错误的是( )A.乙烯分子中所有原子一定共平面,而乙烷分子中所有原子不可能在同一平面内B.乙烯的化学性质比乙烷的化学性质活泼,乙烯中组成碳碳双键的两个键活性完全相同C.乙烷中混有乙烯,不能用酸性KMnO 4溶液除杂D.酸性KMnO 4溶液可以鉴别乙烯和乙烷6.下列各反应中属于加成反应的是( )①CH2CH2+H—OH CH3CH2OH②H2+Cl22HCl③+H2CH3—CH2—OH④CH3—CH3+2Cl2CH2Cl—CH2Cl+2HClA.①②B.②③C.①③D.②④题组二烃7.下列关于烃的说法,错误的是()A.根据碳原子成键情况的不同,可将烃分为饱和烃与不饱和烃B.根据碳骨架的不同,可将烃分为链状烃和环状烃C.烯烃、炔烃和芳香烃都属于不饱和烃D.烷烃的通式为C n H2n8.(2020浙江杭州高一期中)下列说法正确的是()A.实验室除去乙烷中的少量乙烯,可加入氢气B.光照下1mol CH4最多和4mol氯气发生取代反应,产物中可能CH3Cl最多C.甲烷、乙烯可用燃烧法区分D.苯分子中含有碳碳双键,可以与氢气在一定条件下发生加成反应9.丙烯是重要的化工原料。
7.2.1 乙烯【合格性测试】1.关于乙烯分子结构的描述错误的是()A.乙烯的结构简式为CH2===CH2B.乙烯是最简单的烯烃C.乙烯分子中所有原子都在同一平面上D.乙烯分子中所有原子都在一条直线上2.除去乙烷中混有的少量乙烯,应采取的简便方法是()A.将混合气体通入氢氧化钠溶液B.将混合气体通入溴水C.将混合气体在催化剂条件下与氢气反应D.使混合气体中的乙烯气体发生加聚反应3.下列分子中的各原子均在同一平面上的是()A.C2H3Cl B.CHCl3C.CH3CH===CH2D.CH3—CH34.下列各组物质在一定条件下反应,可以制得较纯净的1,2二氯乙烷的是()A.乙烷与氯气光照反应B.乙烯与氯化氢气体混合C.乙烯与氯气加成D.乙烯通入浓盐酸5.下列说法错误的是()A.乙烯可被酸性高锰酸钾溶液和溴水氧化B.通过加成反应、取代反应都可以生成CH3CH2ClC.乙烯具有可燃性,在点燃前要验纯D.乙烷中混有的乙烯可用溴水除去6.能证明乙烯分子里含有一个碳碳双键的事实是()A.乙烯分子里碳氢个数比为1∶2B.乙烯完全燃烧生成的CO2和水的物质的量相等C.乙烯容易与溴的四氯化碳溶液发生加成反应,且1 mol乙烯完全加成需要消耗1 mol溴D .乙烯能使酸性高锰酸钾溶液褪色7.下列物质中不可能是乙烯加成产物的是( )A .CH 3CH 3B .CH 3CHCl 2C .CH 3CH 2OHD .CH 3CH 2Br8.如图是某种有机物分子的球棍模型图。
图中的“棍”代表单键或双键,不同大小的“球”代表三种不同的短周期元素的原子。
对该有机物的叙述不正确的是( )A .该有机物可能的分子式为C 2HCl 3B .该有机物的分子中一定有C .该有机物分子中的所有原子在同一平面上D .该有机物可以由乙烯和氯化氢加成反应得到9.甲烷中混有乙烯,欲除去乙烯得到纯净的甲烷,最好将混合气依次通过盛有下列哪种试剂的洗气瓶( )A .澄清石灰水、浓硫酸B .KMnO 4酸性溶液、浓硫酸C .溴水、浓硫酸D .浓硫酸、KMnO 4酸性溶液10.乙烯性质较活泼,能与多种物质反应,是重要的化工原料。
7.2.1 乙烯考点1 乙烯的结构、物理性质及用途乙烯的来源:石油裂解获得乙烯是目前工业生产乙烯的主要途径。
一、乙烯分子的组成与结构分子式电子式结构式结构简式球棍模型空间充填模型C2H4CH2==CH2结构特点乙烯的结构是平面形结构,2个C原子和4个H原子在同一个平面上,键角120°注意:①乙烯分子中的碳原子价键没有全部被氢原子“饱和”,为不饱和碳原子②分子共线、共面问题类型结构式结构特点共线、共面情况甲烷型正四面体结构5个原子最多有3个原子共平面,中的原子不可能共平面规律:凡是碳原子与其他4个原子形成共价单键时,与碳原子相连的4个原子组成四面体结构。
有机物分子结构中只要出现一个饱和碳原子,则分子中的所有原子不可能共面乙烯型平面形结构所有原子共平面,与碳碳双键直接相连的4个原子与2个碳原子共平面规律:有机物分子结构中每出现1个碳碳双键,则整个分子中至少有6个原子共面分析丙烯(CH3CH=CH2)原子共面情况情况分析三个氢原子(①②③)和三个碳原子(④⑤⑥)六原子一定共面。
根据三角形规则(⑤C,⑥C,⑦H构成三角形),⑦H也可能在这个平面上即:丙烯分子最多7个原子共平面,至少有6个原子共平面二、物理性质:乙烯为无色、稍有气味的气体,密度比空气的略小,难溶于水,易溶于四氯化碳等有机溶剂故:乙烯用排水集气法手机乙烯。
三、应用(1)乙烯是石油化工重要的基本原料,通过一系列反应,乙烯可以合成有机高分子材料、药物等。
乙烯产量可以用来衡量一个国家石油化学工业的发展水平(2)乙烯还是一种植物生长调节剂,果实催熟剂考点2 乙烯的化学性质一、乙烯的化学性质:乙烯分子中含有碳碳双键,其中一个不稳定发生化学反应时容易断裂,使乙烯表现出较活泼的化学性质1、乙烯的氧化反应(1)与氧气的燃烧反应:C2H4+3O2−−→−2CO2+2H2O (乙烯中的碳碳键、碳氢键全部破坏)①实验现象:火焰明亮且伴有黑烟(比甲烷要明亮),同时放出大量的热②原因:产生黑烟是因为乙烯中碳的质量分数(85.7%)比较大,燃烧不完全产生的碳的小颗粒造成的;火焰明亮是由于碳微粒受灼热成炽热状态而发光所致③乙烯具有可燃性,点燃乙烯之前一定要检验乙烯纯度注意:A、在点燃乙烯前一定要检验乙烯的纯度B、乙烯完全燃烧时,生成的CO和HO的物质的量之比为1:1C、当温度高于100℃时,生成的H2O为气态,乙烯完全燃烧前后气体的总体积不变(2)乙烯可使酸性高锰酸钾溶液褪色①反应方程式:5CH2=CH2+12KMnO4+18H2SO4―→10CO2+12MnSO4+6K2SO4+28H2O②反应现象:酸性高锰酸钾溶液紫色褪去③反应机理:碳碳双键易被酸性高锰酸钾溶液氧化,乙烯被氧化为CO2,高锰酸钾溶液被还原为无色的Mn2+④应用:高锰酸钾溶液可用于鉴别乙烷和乙烯,但不能用于除去乙烷中的乙烯2、乙烯的加成反应(1)2222CH2Br (1,2—二溴乙烷)①反应的实质:乙烯分子双键中的一个键易于断裂,两个溴原子分别加在两个价键不饱和碳原子上,生成了1,2—二溴乙烷②乙烯与溴加成的机理③加成反应a.定义:有机物分子里不饱和的碳原子(碳碳双键或碳碳三键)跟其他原子或原子团直接结合生成新的化合物的反应,叫做加成反应 (有进无出)b.特点:断一(断双键中的一个键),加二(加两个原子或原子团),只上不下。
乙烯的性质练习题一、单选题1.关于乙烯的分子结构描述错误的是( )A.乙烯的结构简式为CH2=CH2B.乙烯是最简单的烯烃C.乙烯分子中所有的原子都在同一平面上D.乙烯分子中所有的原子都在一条直线上2.能证明乙烯分子里含有一个碳碳双键的事实是( )A.乙烯分子中碳、氢原子个数比为1:2B.乙烯完全燃烧生成的CO2和H2O的物质的量相等C.1mol乙烯与溴的四氯化碳溶液发生加成反应,完全加成时消耗1mol Br2D.乙烯能使酸性高锰酸钾溶液褪色3.从南方往北方长途运输水果时,常常将浸泡有高锰酸钾溶液的硅藻土放置在盛放水果的容器中,其目的是( )A.利用高锰酸钾溶液吸收水果产生的乙烯,防止水果早熟B.利用高锰酸钾溶液吸收水果周围的氧气,防止水果腐烂C.利用高锰酸钾溶液的氧化性,催熟水果D.利用高锰酸钾溶液杀死水果周围的细菌,防止水果霉变4.将CH4和C2H4的混合气体15g通入盛有足量溴水的容器中,溴水的质量增加了7g,则混合气体中CH4与C2H4的体积比为( )A.1:2B.2:1C.3:2D.2:35.将乙烯分别通过如图所示的装置,下列叙述正确的是( )A.二者都褪色且原理相同B.二者都能证明乙烯中有碳碳双键C.二者都可用于除去乙烷中混有的乙烯D.二者都可用于鉴別乙烷和乙烯6.既可以用来鉴别乙烯和乙烷,又可以用来除去乙烷中混有的少量乙烯的最佳方法是( )A.混合气体通过盛有水的洗气瓶B.通过装有过量浓溴水的洗气瓶C.将混合气体通过酸性高锰酸钾溶液中D.混合气体与过量氢气混合7.实现下列变化的有机反应的类型,不正确的是( )A.CH3CH3→CH3CH2Cl 取代反应B.CH2=CH2→CH2BrCH2Br 加成反应C.CH2=CH2→CH3CH2OH 取代反应D.CH≡CH→CHBr=CHBr 加成反应8.甲烷分子中的四个氢原子都可以被取代。
甲烷分子的四个氢原子都被乙烯基(CH2=CH-)取代得到的产物的结构简式如下:下列对所得分子的描述中不正确的是( )A.分子式为C 9H 12B.1mol 该物质在一定条件下最多能与4mol H 2发生反应C.所有碳原子都在同一平面上D.此物质属于烯烃类物质 9.关于实验室制取乙烯的实验,下列说法正确的是( )A.反应容器(烧瓶)注入酒精和浓硫酸的体积比为3:1B.反应物是乙醇和过量的3mol/L H 2SO 4混合液C.温度计应插入反应溶液液面下,以便控制温度D.为检验生成的乙烯,可将生成的气体直接通入酸性KMnO 4溶液10.乙烯(CH 2=CH 2)、丙稀(CH 3CH=CH 2)、丁烯(CH 3CH 2CH=CH 2)等都属于烯烃,下列关于烯烃的说法不正确的是( )A.分子中都含有碳碳双键B.通式为C n H 2n ,n≥2C.碳、氢元素的质量比为6:1D.它们都是饱和链烃11.乙烯直接水合法制乙醇因污染小而应用于工业合成,下列有关说法错误的是( )A.该反应属于加成反应B.乙烯能使酸性4KMnO 溶液褪色C.乙烷中含有少量乙烯,可用2H 除去D.等物质的量的乙烯与乙醇充分燃烧,耗氧量相同二、填空题12.乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平。
请回答下列问题。
1.乙烯的电子式____________,结构简式是 。
2.鉴别甲烷和乙烯的试剂是__________(填序号)。
A. 稀硫酸B. 溴的四氯化碳溶液C. 水D. 酸性高锰酸钾溶液3.下列物质中,可以通过乙烯加成反应得到的是__________(填序号)。
A. 33CH CHB. 32CH CHClC. 32CH CH OHD. 32CH CH Br4.乙烯__________(填“能”或“不能”)使溴的四氯化碳溶液褪色若能,写出化学方程式为__________。
反应类型是__________。
13.乙烯的产量可以用来衡量一个国家的石油化工发展水平.请回答:1.乙烯的结构式是__________。
2.若将乙烯气体通入溴的四氯化碳溶液中,反应的化学方程式为__________。
3.可以用来除去乙烷中混有的乙烯的试剂是__________。
(填序号)①水 ②氢气 ③溴水 ④酸性高锰酸钾溶液4.在一定条件下,乙烯能与水反应生成有机物A,其反应方程式为__________,其反应类型是__________反应(填“取代”或“加成”) 。
参考答案1.答案:D解析:A、乙烯的结构简式为:CH2=CH2,故A正确;B、乙烯是最简单的烯烃,故B正确;C、乙烯分子中2个C碳原子和4个氢原子即所有原子都在同一平面上,故C正确;D、乙烯是平面型分子,并不是所有的原子不在一条直线上,故D错误;故选:D.2.答案:C解析:A项,碳、氢原子个数比为1:2,是对乙烯的组成分析,而不是证明碳碳双键存在的事实,所以错误;B项,只能证明乙烯分子碳、氢原子个数比为1:2,无法证明其结构,所以错误;C项,加成反应是不饱和烃的特征性质,1mol乙烯完全加成需要消耗1mol溴,说明乙烯分子中含有一个碳碳双键,所以正确;D项,能够使酸性高锰酸钾溶液褪色是不饱和烃的特征,并不能说明一定含有碳碳双键,也不能定量地说明乙烯分子的结构中只含有一个碳碳双键,所以错误。
3.答案:A解析:水果在成熟过程中会产生乙烯,乙烯又是水果的催熟剂,利用乙烯能被酸性KMnO4溶液氧化的性质,浸泡有高锰酸钾溶液的硅藻土可以吸收乙烯,延长水果成熟期,达到保鲜目的。
4.答案:B解析:乙烯和甲烷的混合气体通入溴水中,溴水增加的质量即为乙烯的质量,7g乙烯的物质的量为0.25mol;甲烷的质量为8g,其物质的量为0.5mol,因此CH4与C2H4的体积比为2:1,所以B项正确。
5.答案:D解析:A项,乙烯分子中含有碳碳双键,能与溴的四氯化碳溶液发生加成反应,能与高锰酸钾溶液发生氯化反应,因此二者褪色的原理不同,所以错误;B项,与溴的四氯化碳溶液发生加成反应能证明乙烯中含有双键,而与高锰酸钾溶液发生氧化反应不能证明乙烯中含有双键,所以错误;C项,高锰酸钾溶液能将乙烯氧化生成二氧化碳,在除去乙烯的同时又引入新的杂质,因此不能用酸性高锰酸钾溶液除去乙烷中的乙烯,所以错误;D项,溴的四氯化碳溶液和酸性高锰酸钾溶液都能用来鉴别乙烷和乙烯,所以正确。
6.答案:B解析:常温常压下乙烯与乙烷均难溶于水,也不能与水发生加成反应,因此不能用水鉴别二者,也不能洗气除杂,A项错误;常温常压下乙烯能使溴水褪色,二者发生加成反应,生成无色油状液体1,2-二溴乙烷,而乙烷不溶于溴水,也不能与溴水发生化学反应,因此能用溴水鉴别乙烷和乙烯并除去乙烯,B项正确;乙烯能使酸性高锰酸钾溶液褪色,乙烷与酸性高锰酸钾溶液不反应,故可以鉴别二者,但乙烯会被氧化为CO2气体,除去杂质的同时引入新杂质,C项错误;通入氢气不能鉴别乙烷和乙烯,且会引入新杂质(氢气),D项错误。
7.答案:C解析:A项,该反应为乙烷与氯气发生的取代反应,生成CH3CH2Cl和HCl,所以正确,不符合题意;B项,乙烯与Br2发生加成反应生成1,2-二溴乙烷,所以正确,不符合题意;C项,乙烯与水发生加成反应生成乙醇,所以错误,符合题意;D 项,CH ≡CH 与Br 2发生加成反应生成CHBr=CHBr,所以正确,不符合题意。
8.答案:C解析:A 项,根据结构简式可直接数出碳、氢原子的数目,从而得出分子式为C 9H 12,所以正确,不符合题意;B 项,1mol 该物质含4mol 碳碳双键,故最多可与4mol H 2发生加成反应,所以正确,不符合题意;C 项,甲烷分子中四个氢原子被四个-CH=CH 2取代后,其正四面体的基本结构不变,因此所有碳原子不可能处在同一平面上,所以错误,符合题意;D 项,因含碳碳双键,且只含有C 、H 两种元素,因此属于烯烃,所以正确,不符合题意。
9.答案:C解析:所用的药品比例应为1体积酒楮和3体积浓硫酸.故A 错误;所用的是浓硫酸而不是稀硫酸,故B 错误;温度计要插入反应溶液中以便控制反应温度,故C 正确;浓硫酸具有强氧化性,与乙醇发生副反应生成二氧化硫,二氧化硫也能使酸性卨锰酸钾溶液褪色,对乙烯的检验产生干扰,闪此检验生成的乙烯时不能将生成的气体直接通人酸性KMnO 4溶液中10.答案:D解析:A 项,三种物质中均含有碳碳双键,所以正确,不符合题意;B 项,分子中碳、氢原子个数比均为1:2,因此通式为C n H 2n ,且n ≥2,所以正确,不符合题意;C 项,碳、氢原子个数比为1:2,质量比为6:1,所以正确,不符合题意;D 项,都含有不饱和碳原子,因此都属于不饱和烃,所以错误,符合题意。
11.答案:C解析:A 项,乙烯水合法制乙醇的方程式为24232C H +H O CH CH OH ,该反应属于加成反应,正确;B 项,24C H 中含碳碳双键,能使酸性4KMnO 溶液褪色,正确;C 项,乙烷中含有少量24C H ,难以完成2H 与24C H 的加成反应,且不能确定24C H 的含量,易引入新杂志,可使用溴水,将乙烯转化为1,2-二溴乙烷除去,错误;D 项,1mol 24C H 和32CH CH OH 完全燃烧均消耗3mol 2O ,则等物质的量24C H 和32CH CH OH 在氧气中充分燃烧耗氧量相同,正确。
12.答案:1.2.BD;3.ACD;4.能 CH 2=CH 2+Br 2→CH 2Br-CH 2Br 加成反应解析:1.本题综合考查乙烯的性质。
其中乙烯与氯气加成只能得到22CH ClCH Cl 而非32CH CHCl 。
4.A 为32CH CH OH ,B 为3CH CHO 。
13.答案:1.2.CH 2=CH 2+Br 2→CH 2Br-CH 2Br3.③;4.CH 2=CH 2+H 2O CH 3CH 2OH 加成解析:1.乙烯的结构式为。
2.乙烯通入溴的四氯化碳溶液中,乙烯与溴发生加成反应,反应的化学方程式为CH2=CH2+Br2→CH2Br-CH2Br。
3.①乙烷、乙烯都难溶于水,不能用水除去乙烷中混有的乙烯;②虽然乙烯可以与H2在一定条件下转化为乙烷,但过量H2为新杂质,不能用H2除去乙烷中混有的乙烯;③乙烯与溴水发生加成反应而被吸收,乙烷不能被溴水吸收,能用溴水除去乙烷中混有的乙烯;④乙烯能被酸性KMnO4溶液氧化成CO2,引入新杂质,不能用酸性KMnO4溶液除去乙烷中混有的乙烯;答案选③。
4.乙烯与水在一定条件发生加成反应生成乙醇,反应的化学方程式为CH2=CH2+H2O CH3CH2OH,反应类型为加成反应。