氯气实验室制备装置图
- 格式:doc
- 大小:72.00 KB
- 文档页数:1



一、氯气的性质1、物理性质通常情况下为有强烈刺激性气味的黄绿色的有毒气体,氯气密度是空气密度的2.5倍,标况下ρ=3.21kg/m³。
熔沸点较低,常温常压下,熔点为-101.00℃,沸点-34.05℃,常温下把氯气加压至600~700kPa或在常压下冷却到-34℃都可以使其变成液氯,液氯即Cl₂,液氯是一种油状的液体,其与氯气物理性质不同,但化学性质基本相同。
可溶于水,且易溶于有机溶剂氯原子结构示意图(例如:四氯化碳),难溶于饱和食盐水。
1体积水在常温下可溶解2体积氯气,形成黄绿色氯水,密度为3.170g/L,比空气密度大。
2、化学性质氯气是一种有毒气体,它主要通过呼吸道侵入人体并溶解在黏膜所含的水分里,生成次氯酸和盐酸,对上呼吸道黏膜造成损伤:次氯酸使组织受到强烈的氧化;盐酸刺激黏膜发生炎性肿胀,使呼吸道黏膜浮肿,大量分泌黏液,造成呼吸困难,所以氯气中毒的明显症状是发生剧烈的咳嗽。
症状重时,会发生肺水肿,使循环作用困难而致死亡。
由食道进入人体的氯气会使人恶心、呕吐、胸口疼痛和腹泻。
1L空气中最多可允许含氯气0.001mg,超过这个量就会引起人体中毒。
二、实验室制氯气1、反应原理: 2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2OMnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O;KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O;2、实验装置:铁架台、分液漏斗、石棉网、导气管、广口瓶、烧杯、烧瓶、酒精灯3、净化方法(1)用饱和食盐水出去HCl气体:2NaCl + 2H2SO4(浓)+MnO2= MnSO4 + Na2SO4 + 2H2O+ Cl2↑(2)用浓硫酸除去水蒸气4、收集装置⑴向上排空气法(如图)⑵排饱和食盐水法5、尾气吸收用强碱溶液(如NaOH溶液)吸收6、验满:⑴将湿润的淀粉-KI试纸靠近盛Cl2瓶口,观察到试纸立即变蓝,则证明已集满⑵将湿润的蓝色石蕊试纸靠近盛Cl2瓶口,观察到试纸先变红后褪色,则……⑶实验室制备氯气时,根据氯气的颜色判断是否收集满7、注意事项⑴必须用浓盐酸,MnO2与稀盐酸不反应⑵为了减少制得的Cl2中HCl的含量,所以加热温度不宜过高,减少HCl的挥发⑶实验结束后,先使反应停止并排出残留的Cl2,再拆缷装置,避免污染空气⑷尾气吸收时,不能用澄清石灰水吸收Cl2,因为溶液中Ca(OH)2浓度小,吸收不完(5)两个洗气瓶中气体入口导管应插入液面以下,而出口导管应靠近瓶塞。

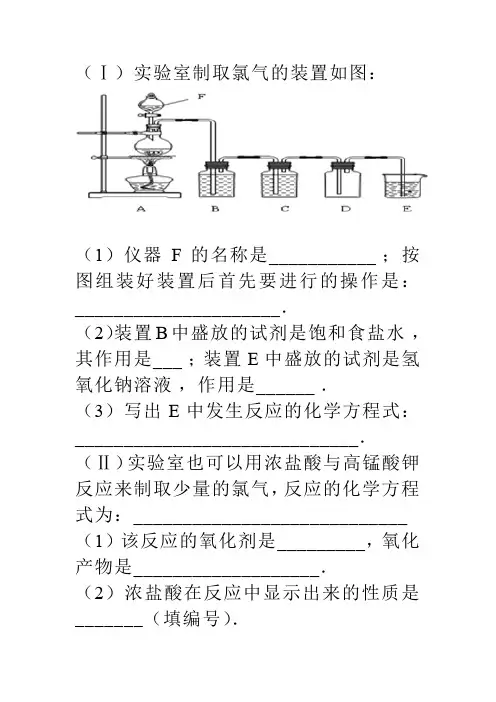
(Ⅰ)实验室制取氯气的装置如图:
(1)仪器F的名称是___________ ;按图组装好装置后首先要进行的操作是:_____________________.
(2)装置B中盛放的试剂是饱和食盐水,其作用是___ ;装置E中盛放的试剂是氢氧化钠溶液,作用是______ .
(3)写出E中发生反应的化学方程式:_____________________________.(Ⅱ)实验室也可以用浓盐酸与高锰酸钾反应来制取少量的氯气,反应的化学方程式为:____________________________ (1)该反应的氧化剂是_________,氧化产物是___________________.
(2)浓盐酸在反应中显示出来的性质是_______(填编号).
①只有还原性②还原性和酸性
③只有氧化性④氧化性和酸性
(3)若用足量的浓盐酸与一定量的二氧化锰反应,产生的氯气在标准状况下的体积为11.2L,则反应中被氧化的HCl的质量为多少?(要求计算过程)。




以下是实验室制取氯气的装置,在图中饱和食盐水的作用是吸收氯化氢
吸收氯化氢
,浓硫酸的作用是干燥
干燥
,F中盛放的溶液是氢氧化钠溶液
氢氧化钠溶液
,起的作用是吸收尾气
吸收尾气
.
考点:气体的净化(除杂);气体的干燥(除水);碱的化学性质.专题:实验性简答题.分析:实验室可以采用加热二氧化锰固体和浓盐酸的方法制取氯气,产生的氯气中混有氯化氢、水蒸气,氯气有毒,必须进行尾气处理,可以使用氢氧化钠溶液吸收.解答:解:加热二氧化锰固体和浓盐酸的方法制取氯气时,产生的氯气中容易混有氯化氢气体,要除去氯化氢气体,所选的除杂试剂只能吸收氯化氢而不能吸收氯气,故可以使用饱和食盐水将其除去,浓硫酸具有吸水性,可以除去氯气中混有的水蒸气,氯气有毒,必须进行尾气处理,防止其造成空气污染.
所以本题答案为:吸收氯化氢,干燥,氢氧化钠溶液,吸收尾气.。
考点37 氯气的实验室及工业制法聚焦与凝萃1.掌握氯气的实验室制法; 2.了解氯气的工业制法。
解读与打通常规考点1.氯气的实验室制法(1)反应原理:MnO 2+4HCl(浓)=====△MnCl 2+Cl 2↑+2H 2O①盐酸是浓盐酸,一般为12mol·L -1、1.9g·mL -1,稀溶液中的HCl 不能被MnO 2氧化;HCl 是还原剂,但还表现出酸性。
②必须加热,在常温下,MnO 2与浓盐酸是不反应的。
(2)实验装置图:图中:A 是分液漏斗,加浓盐酸;B 是圆底烧瓶,用于反应,液体不超过容积的2/3,加热时必须垫石棉网;C 是洗气瓶,瓶中装饱和食盐水,除去Cl 2中混有的HCl(氯气在饱和食盐水中比在水中溶解度小,可减少氯气的损耗);D 是洗气瓶,瓶中装浓H 2SO 4,干燥Cl 2;E 为收集装置,用向上排空气法收集Cl 2,进气管伸入集气瓶的底部;F 是尾气吸收装置,因氯气有毒,多余氯气要用NaOH 的溶液将其吸收(用水和石灰水吸收效果都不好。
) (3)氯气的检验:氯气可用湿润的KI 淀粉试纸检验,试纸变蓝,其原理是:Cl 2+2KI=2KCl +I 2,置换出的碘与淀粉反应生成蓝色物质。
隐性考点2.工业制法——电解饱和食盐水法 2NaCl +2H 2O=====通电2NaOH +H 2↑+Cl 2↑融合与应用例1.实验室用如下图所示装置制备Cl 2,并进行Cl 2的性质实验。
(1)A中加入KMnO4固体(反应后产物是MnCl2),B中盛有浓盐酸,烧瓶中发生反应的化学方程式为。
(2)C中盛有紫色石蕊试液,C中的现象是;D中有白色沉淀生成,D中盛放的试剂可能是;E 中溶液由无色变为蓝色,E中盛放的试剂可能是。
(3)F中一般盛放,其作用是。
【答案】(1)2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O(2)先变红后褪色AgNO3溶液KI淀粉溶液(3)NaOH溶液吸收多余的Cl2(2)产生的Cl2通入紫色石蕊试液中,Cl2与水反应产生的盐酸使石蕊由紫色变为红色,产生的HClO又可将红色漂白。